서 언
재료 및 방법
실험 재료
기기 및 시약
추출 및 분리
HPLC 분석
LC/MS 분석
Oregonin
DPPH 프리 래디칼 소거작용의 측정
ABTS 프리 래디칼 소거작용의 측정
HFDPC 세포배양
Western blotting
결과 및 고찰
Oregonin의 구조 동정
DPPH, ABTS 프리라디컬 소거능 활성
Oregonin의 처리에 의한 oxidative stress-induced apoptosis 유발 분자의 감소효능
Oregonin의 처리에 의한 oxidative stress-induced apoptosis에 대한 억제분자의 증가효능
Oregonin의 처리에 의한 oxidative stress-induced apoptosis에 의해 유도된 PARP-1 단백질의 발현 억제효과
Oregonin의 처리에 의한 oxidative stress-induced apoptosis에 의해 유도된 caspase-3 단백질의 발현억제효과
적 요
서 언
국내 자생하는 오리나무 (Alnus japonica)의 가지를 한방에서는 적양(赤楊)이라 부르며 청열(淸熱), 강화(降火) 작용이 있는 것으로 알려져 있다. 민간에서는 고열, 육혈(衄血), 설사, 치통, 숙취해소, 암 등에 쓰여 온 것으로 알려져 있다(Lee, 1966). Alnus속 식물들은 동양과 서양에서 예로부터 다양한 질환 중 특히 피부질환들에 대해서 공통적으로 사용되어 왔으며, red alder라고 불리는 같은 속 식물인 Alnus rubra는 북아메리카에서는 만성 헤르페스질환, 습진, 소양증 등 다양한 만성 난치성 피부질환에 사용되어 왔다(Boericke, 1927).
최근까지 Alnus속 식물로부터 diarylheptanoid 계열의 화합물을 분리하고, 항산화활성, 항염증활성, 항아토피활성 등에 대한 Alnus 속 식물의 자원의 활용성에 대한 연구가 다수 발표되고 있다(Choi et al., 2010; Choi et al., 2012). 이렇게 강력하고 효과적인 생리활성의 주효 효능 물질로서는 Alnus 속 식물에서 높은 함량으로 존재하는 주된 diarylheptanoid 계열 화합물로 알려진 oregonin이 핵심적인 역할을 하는 것으로 판단된다. 이는 Alnus 속 식물의 화학적 계통 분류 연구에 있어서 지표 물질로서 oregonin을 중점적으로 연구하는 국내외 연구동향을 살펴보면 알 수 있다(Choi, 2013; Lim et al., 2004).
다양한 생리활성 연구가 활발히 보고된 oregonin을 포함한 Alnus속 식물들이지만 최근 대두되고 있는 탈모 질환과 관련된 생리활성 연구는 아직 보고되지 않고 있다. 따라서 본 연구자들은 Alnus속 식물로부터 분리한 oregonin을 대상으로 탈모질환과의 연관성을 밝혀내기 위하여 인체 모유두 세포로부터 산화적 스트레스를 유발하여 세포사멸(apoptosis)을 유도한 후 oregonin이 세포사멸과 관련된 바이오 마커들을 효율적으로 조절하는지에 대한 활성 연구를 수행하고자 하였다.
또한, 본 연구에서 주로 수행한 연구내용인 세포사멸과 웨스턴 블랏팅 실험에서 측정한 바이오 마커는 Bcl-2, Bax, caspase-3, PARP 등이며, 이들에 대한 과학적 근거는 다음과 같다. 세포가 내외부의 요인으로 인해 죽음에 이르는 것을 크게 세포사멸(apoptosis)와 세포괴사(necrosis)로 구분할 수 있다. 이 가운데 세포사멸은 세포 내부의 신호에 따른 여러 단백질 활성의 조절과 유전자의 발현을 통하여 프로그램화 된 세포 사멸의 과정으로 일어나는 능동적으로 진행되는 세포의 죽음으로 알려져 있다(Clarke et al., 1995). 외부 요소로서 대표적인 것은 방사선, 고열 충격, 독소, 박테리아나 바이러스에 의한 감염 등에 의한 세포의 손상이나 심한 스트레스로 세포사멸 반응이 나타나며, 그 이상은 다양한 질병을 초래하는데 정상적인 세포의 사멸을 유도하는 것은 장기의 손상과 연관될 수 있다. 세포사멸과 관련된 유전자중 대표적인 것은 세포사멸을 억제하는 유전자인 Bcl-2와 이를 유도하는 유전자인 Bax가 존재하여 길항적으로 조절되는 것으로 보고되고 있다(Alnermri et al., 1997). 또한 세포사멸을 유도하는 경로에서 활성화되는 단백질 분해효소 중, caspase들은 세포가 사멸하는 과정에서 각 소기관별로 다양하게 활성화되는 가장 중요한 실행자로 알려져 있으며, 이 효소의 활성을 통하여 세포사멸의 정도 및 경로를 파악할 수 있다(Zhap et al., 2001). Caspase 계열의 효소가 활성화되면 다양한 표적 단백질들을 분해하여 세포사멸을 비가역적으로 진행시키게 되는데, 특히 caspase-3 단백질은 DNA repair, DNA stability 및 전사조절에 관여하는 PARP 단백질 등의 발현을 증대시키고, PARP 단백질의 절단을 유도하고(Muller et al., 1994) 최종적인 세포 사멸 단계로 접어들게 된다.
따라서 정상세포에서 세포사멸을 유도하는 외부 자극, 예를 들면 약물 또는 산화적 스트레스 등으로 인해 세포 사멸에 이르게 되는 것을 차단하기 위해서 상기에 기술된 요소 등의 발현을 조절하는 것은 매우 중요하다. 따라서 본 연구자들은 국내 자생식물인 오리나무(A. japonica)로부터 고성능액체크로마토그래피(high perpformance liquid chromatography, HPLC)를 이용하여 oregonin을 단일하게 분리한 후 핵자기공명(nuclear magnetic resonance, NMR)과 액체크로마토그래피/질량분석(Liquid chromatography-mass spectrometry, LC/MS) 데이터를 확보하여 기존 선행 문헌과 비교하여 최종 oregonin으로 구조동정 후 DPPH ․ ABTS 라디컬 소거능과 인체 모유두 세포를 대상으로 세포사멸 조절 효능에 대한 연구를 수행하였다.
재료 및 방법
실험 재료
오리나무(A. japonica)는 2017년 9월 경기도 포천시에 위치한 국립수목원에서 진혜영 연구관(국립수목원)으로부터 식물학적 감정한 후 제공받아 실험에 사용하였으며, 표준품은 남부대학교 천연 기능성 소재 연구실에 보관하고 있다(AJ2017-09).
기기 및 시약
1H 및 13C-NMR 분석은 JEOL-JNM-AL300(300MHz, 75MHz)로 실시하였다. High performance liquid chromatography (HPLC)는 Waters 2695 system (USA)과 2487 Dual rhamda Absorbance Detector, Guard column : Phenomenex KJ0- 4282 Guard column, Column : Sky Pak C18 column (120Å, 4.6*250 ㎜, 5 ㎛), Column oven temperature : 25℃, Mobile phase : Water (A), Acetonitrile (B), Data system : Empower 2 Software (Waters Co., USA)의 조합을 통해 구성하였다.
LC/MS는 Shimadzu prominence UFLC-MS system, Pump A: LC-30AD, Pump B: LC-30AD, Detector: SPD-20A, Auto sampler: SIL-20A XR, Column Oven: CTO-20A, Communications Bus Module: CBM-20A, MS: ESI-IT-TOF MS를 이용하였으며, 사용조건은 Column: Waters ACQUITY UPLCⓇ BEH C18 2.1 x 150 ㎜, 1.7 ㎛, Column Oven Temperature: 35℃, UV detector: 280 ㎚, injection volume: 1 ㎕, flow: 0.21 ㎖/ min, Solvent A: Water in 0.1% formic acid, Solvent B: Acetonitrile, solvent condition이며, MS condition은 Nebulizing gas flow: 1.5 L/min, Curved desolvation line (CDL) Temperature : 200℃, Heat Block Temperature : 200℃를 각각 설정하여 실험에 활용하였다.
박막크로마토그래피(Thin layer chromatography, TLC) plate는 pre-coated silica gel 60 F254 plate (Merck, Darmstadt, Germany)를 사용하였다. 항산화활성 측정용 시약인 DPPH (1,1-diphenyl-2-picrylhydrazyl), ABTS (2,2'-azino-bis (3- ethylbenzothiazoline-6-sulphonic acid)), L-ascorbic acid, potassium persulfate, 무수에탄올은 Sigma-Aldrich (MO, USA)에서 구입하여 사용하였다. 흡광도는 ELISA reader (TECAN, Salzburg, Austria)를 사용하여 측정하였다.
추출 및 분리
오리나무 가지 200 g을 절단한 후 70% 에탄올로 실온에서 1회 추출하여 여과하였다. 그 추출액을 감압 농축과 동결건조를 통해 최종 23.01 g을 확보 하였고, HPLC 분석용으로 정량하여 실험에 사용하였다.
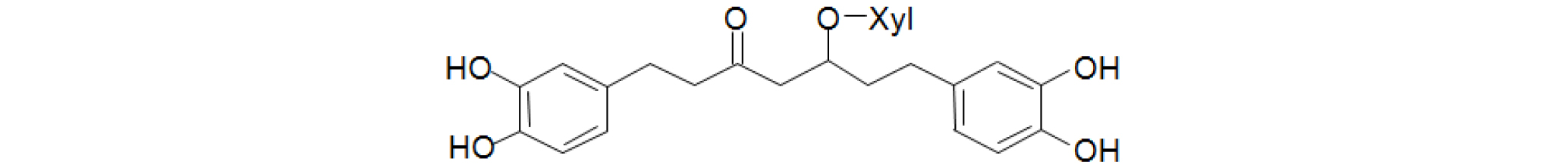
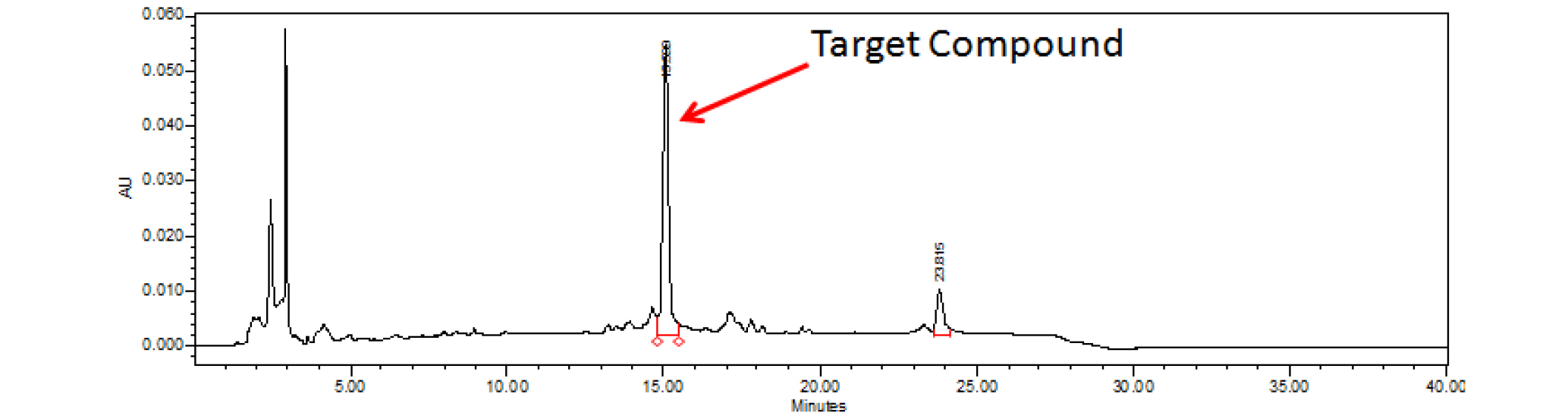
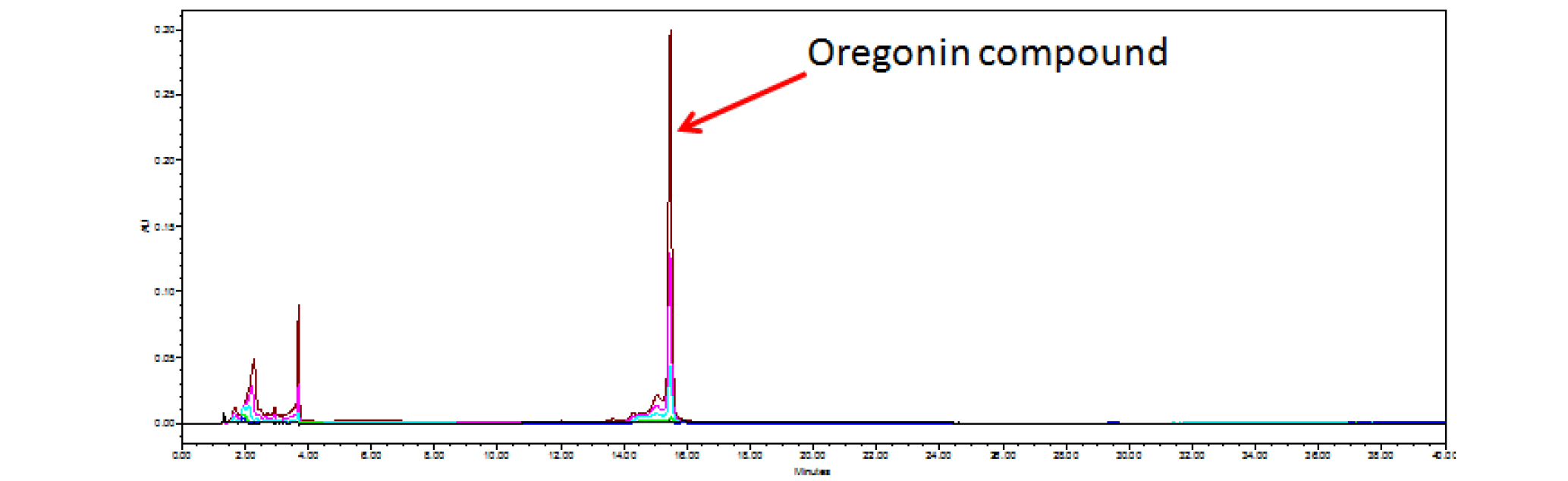
기존에 실험실에서 보유중인 오리나무 가지로부터 분리, 정제한 표품인 oregonin (1) (Fig. 1) 1 ㎎을 정확히 취해 80% MeOH를 가하여 전체량이 1 ㎖가 되도록 하여 고농도원액(1,000 ppm)을 조제하였다. 이 고농도 원액을 희석하여 125, 250, 500, 1,000 ppm 농도의 표준용액을 조제하였다. 표준용액을 20 ㎕씩 취하여 HPLC 분석을 실시하여 대표적인 분석곡선을 획득하였다(Fig. 2, 3). 또한 실험의 재현성을 위해 반복실험을 통해서 표준용액과 신나무 가지 추출물 미지검액의 체류시간(retention time, RT)의 평균과 표준오차를 구하였다(Table 1).
Table 1. Retention time of oregonin and A. japonica extracts
| Samples | Retention Time (min) |
| Oregonin | 15.561 ± 0.019z |
| A. japonica extract | 15.107 ± 0.021 |
표품의 분석조건을 아래와 같이 설정한 다음, 반복정제를 통해서 oregonin 표준품과 동일한 RT값을 나타내는 분석곡선의 분획을 획득하여 구조 및 구성을 동정하기 위해 NMR과 LC/MS 분석을 시행하였다.
HPLC 분석
이동상의 조건은 Table 2와 같이 구성을 하였으며, 유량은 1 ㎖/min, wavelength는 280 ㎚, inject volumn은 20 ㎕, total run time은 40 min, column oven 온도는 25℃로 분석조건을 적용하였으며, Phenomenex KJ0-4282 Guard 칼럼, VDSpher 100 C18-E 칼럼(5 ㎛, 250 X 4.6 ㎜)의 조합을 사용하여 분석을 실시하였다.
Table 2. HPLC method of solvent system
| 0 min | 12 min | 24 min | 25 min | |
| Solvent A (H2O) | 100 | 90 | 75 | 60 |
| Solvent B (CH3CN) | 0 | 10 | 25 | 40 |
LC/MS 분석
LC 조건은 각각 다음과 같이 설정하여 수행하였다. 즉, 칼럼은 Waters ACQUITY UPLCⓇ BEH C18 2.1 x 150 ㎜, 1.7 ㎛, column oven의 온도는 35℃, UV detector는 254 ㎚, injection volume은 1 ㎕, 유량은 0.21 ㎖/min으로 각각 설정하여 분석을 시행하였으며, 이동상의 조건은 Table 3과 같이 설정하였다.
Table 3. LC/MS method of solvent system
| 0 min | 20 min | 24 min | 25 min | 30 min | |
| Solvent A (0.1% Acetic acid-H2O) | 95 | 40 | 40 | 95 | 95 |
| Solvent B Acetonitrile | 5 | 60 | 60 | 5 | 5 |
질량 분석 시험 조건에서 nebulize gas flow는 1.5 L/min, CDL 온도는 200℃, heat block 온도는 200℃로 각각 설정하여 분석에 적용하였다.
Oregonin
무정형 갈색 분말
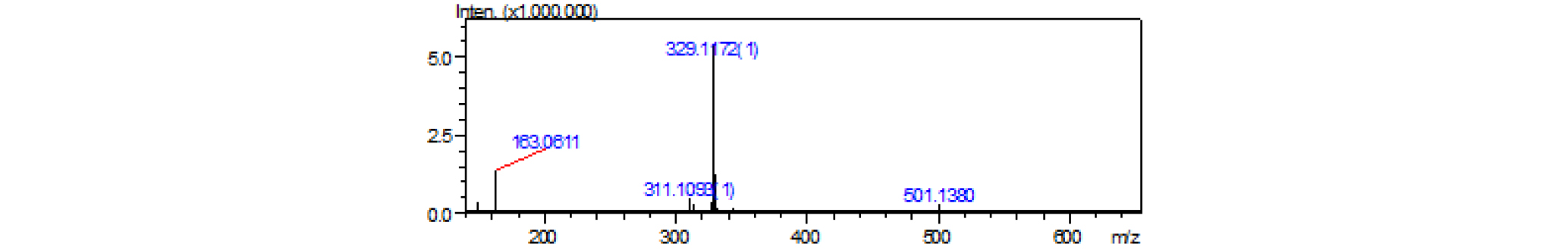
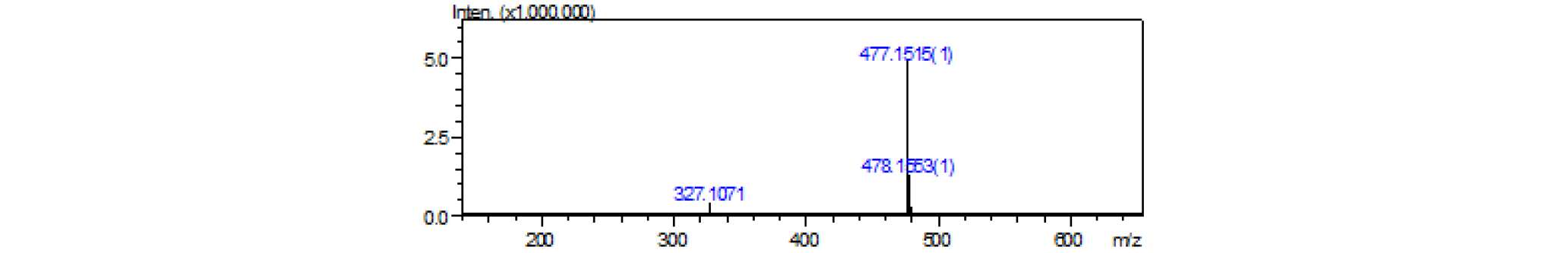
파지티브 LC/MS m/z : 501 [M+Na]+(Fig. 4), 네거티브 LC/MS m/z: 477 [M-H]-(Fig. 5).
1H-NMR (300MHz, DMSO-d6+D2O): δ6.61-6.53(4H in total, H-2', 2'', 5', 5''), 6.42-6.37 (2H in total, H-6'', 6'), 4.25 (1H, brd, J=7.8Hz, xyl-1), 4.13 (1H, m, H-5), 3.72 (1H, dd, J=11.4, 6Hz xyl-5e), 3.27 (1H, m, xyl-4), 3.07-2.50 (8H in total, H-1,2,4,7), 1.66-1.59 (2H in total, m, H-6) (Fig. 1).
13C-NMR (75 MHz, DMSO-d6+D2O): Table 4 (Fig. 1).
Table 4. 13C-NMR spectra of oregonin
DPPH 프리 래디칼 소거작용의 측정
DPPH 프리 래디칼 소거작용의 측정은 Hatano et al. (1989)의 방법에 의하여 실시하였다. 즉 시료를 각 농도별로 조제한 용액 100 ㎕ (control : 99.5% ethanol)에 0.1 mM DPPH 용액(99.5% ethanol) 1.9 ㎖를 가한다. 각 시료는 5가지 농도로 조제하였다. Vortex mixer로 10초간 진탕한 후 37℃에서 30분 동안 반응시키고 492 ㎚에서 흡광도를 측정하였다. 양성 대조약물로는 L-ascorbic acid (vitamin C) (Xie et al., 2018)를 5가지 농도로 조제하여 측정하였다. 각 시료의 항산화작용은 IC50치(DPPH 래디칼 형성을 50%로 억제하는 데 필요한 농도)로 나타내었다.
ABTS 프리 래디칼 소거작용의 측정
ABTS 라디칼 소거 활성은 Re et al. (1999)의 방법을 수정하여 측정하였다. ABTS (Sigma-Aldrich, USA) 시약을 증류수에 용해하여 7.0 mM의 농도로 준비하고, potassium persulfate (Sigma-Aldrich, USA)를 증류수에 용해하여 2.45 mM 농도로 준비하여 두 용액을 1:1 비율로 섞어서 12~16시간 동안 암실상태로 방치하여 시험을 위한 라디칼 고농도원액(radical stock solution)을 제조하였다. 이를 인산완충용액(phosphate-buffered saline, PBS) (pH 7.4)으로 희석하여 750 ㎜에서 흡광도를 측정하여 0.7~1.0 사이의 흡광값이 나오도록 희석하여 준비하였다.흡광도는 농도별로 시료를 준비하여 96 well plate (NUNC, USA)에 시료와 ABTS 반응 비율을 1:9 (v/v)로 맞춰서 실온에서 30분 동안 빛을 차단한 조건에서 반응을 시키고, 반응이 끝난 후 750 ㎚ 파장에서 측정하였다.
HFDPC 세포배양
인모유두세포주(human fibroblastic dermal papilla cells, HFDPC)는 PromoCell (Heidelberg, Germany)로부터 구입하여 사용하였고, 배지의 선택 및 배양은 공급자의 지침에 준하여 실시하였다. 온도 37℃와 5%의 CO2를 유지하는 배양기를 사용하였다. 배지는 매 2일마다 교환하였으며, 세포의 밀도가 80∼90%에 도달하기 이전에 계대 배양하였다. 냉동보관 한 세포를 해동한 후 내지 2∼3 세대까지만 사용하였으며, 사용 후 세포는 고압멸균 후 폐기하였다(Boivin et al., 2006).
Western blotting
세포를 인산완충용액(phosphate-buffered saline, pH 7.4) (PBS)로 두 번 세척하고, lysis buffer (50 mM Tris-HCl [pH 7.4], 1% NP-40, 0.25% sodium deoxycholate, 150 mM NaCl, 1 mM EDTA, 1 mM PMSF, 1 mM sodium orthovanadate, 1 mM NaF, 1 ㎍/㎖ aprotinin, 1 ㎍/㎖ leupeptin, 1 ㎍/㎖ pepstatin)를 넣고 약 5분간 얼음에 정치시킨 후 14,000 rpm에서 15분 동안 원심분리하고, 상등액을 취해서 electrosample buffer (Bio- Rad, USA)를 넣은 후 100℃에서 5분 동안 끓여서 단백질의 변성을 유도하였다. 그 후 10% SDS PAGE를 이용하여 단백질을 분리한 후 Polyvinylidene fluoride (PVDF) 막에 옮긴 후 웨스턴블롯팅 분석을 각각의 항체를 이용하여 실시하였다. 사용된 항체는 공급처에서 제시하는 희석비율을 사용하였고, SantaCruz (UT, USA) 및 Sigma-Aldrich Korea를 통해 구입하여 사용하였다(Burnette et al., 1981).
결과 및 고찰
Oregonin의 구조 동정
TLC plate상에서 10%-H2SO4 및 FeCl3 용액에 의한 발색과 1H, 13C-NMR, MS spectrum data를 기존 문헌(Kim et al., 2005)과 비교하여 각각 일치함을 확인하여 oregonin으로 최종 동정하였다(Fig. 1).
DPPH, ABTS 프리라디컬 소거능 활성
오리나무 가지 추출물과 이로부터 분리한 oregonin의 항산화 활성을 검정하기 위해서 두 가지 실험 방법인 DPPH 라디컬 소거능과 ABTS 라디컬 소거능 측정법을 통해서 항산화 활성을 양성대조군으로 잘 알려진 강력한 항산화제인 Vitamin C (Xie et al., 2018)와 비교하여 실험을 수행한 결과 IC50를 각각 비교하였을 때, 오리나무 가지 주정 추출물은 DPPH 라디컬 소거능은 57.64±0.62 ㎍/㎖, ABTS 소거능은 13.18±0.11 ㎍/㎖로 각각 측정되었으며, oregonin은 DPPH 라디컬 소거능은 14.46± 0.08 ㎍/㎖, ABTS 소거능은 4.05±0.04 ㎍/㎖로 각각 측정되었고, 양성대조군인 Vitamin C의 DPPH 라디컬 소거능은 18.18± 0.10 ㎍/㎖, ABTS 소거능은 14.96±0.29 ㎍/㎖로 각각 측정된 결과값이 나옴에 따라서 오리나무 가지 추출물과 그로부터 분리한 oregonin은 양성대조군과 비교하였을 때 두 가지 실험에서 모두 매우 강력한 항산화 활성을 나타내었음을 알 수 있었다(Fig. 6, Fig. 7).
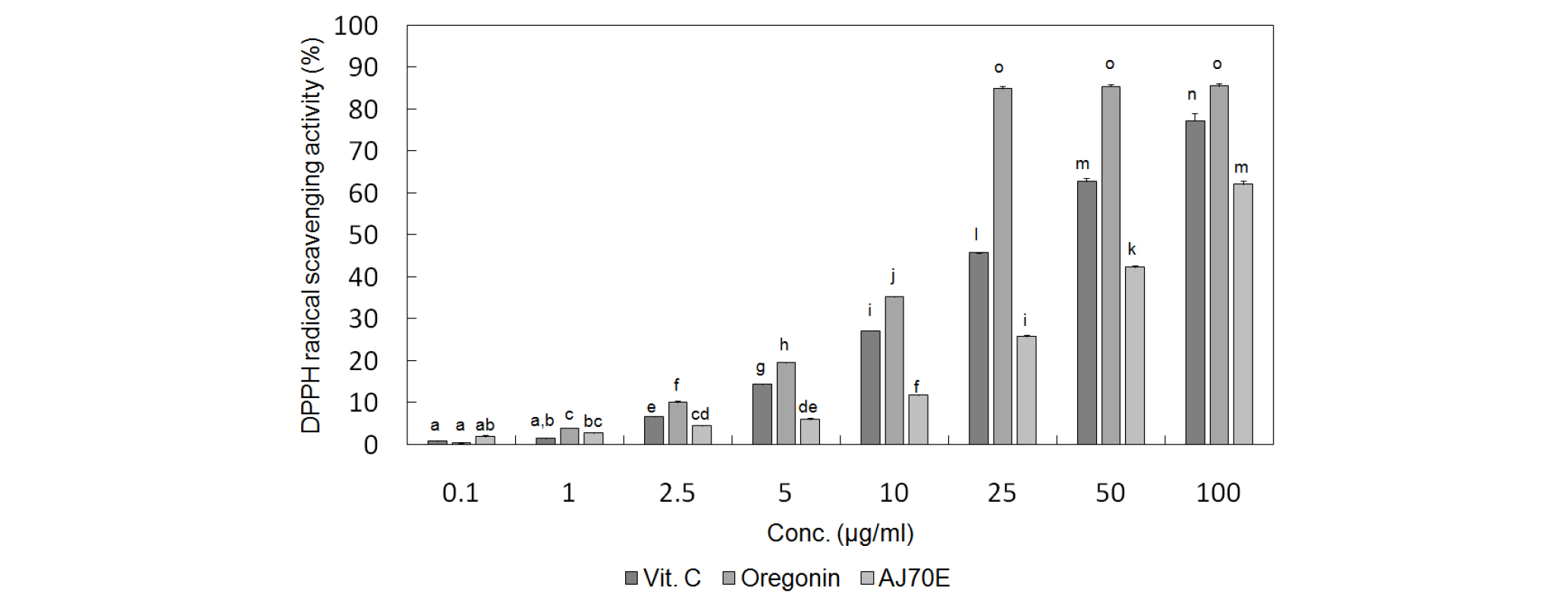
Fig. 6.
DPPH radical scavenging activities of oregonin and extract of A. japonica. Values were expressed as mean±S.D. of three determinations. Values were expressed as mean ± S.D. of at least three determinations. Values bearing different superscripts in the same column are significantly different at p <0.05 by Tukey’s test.
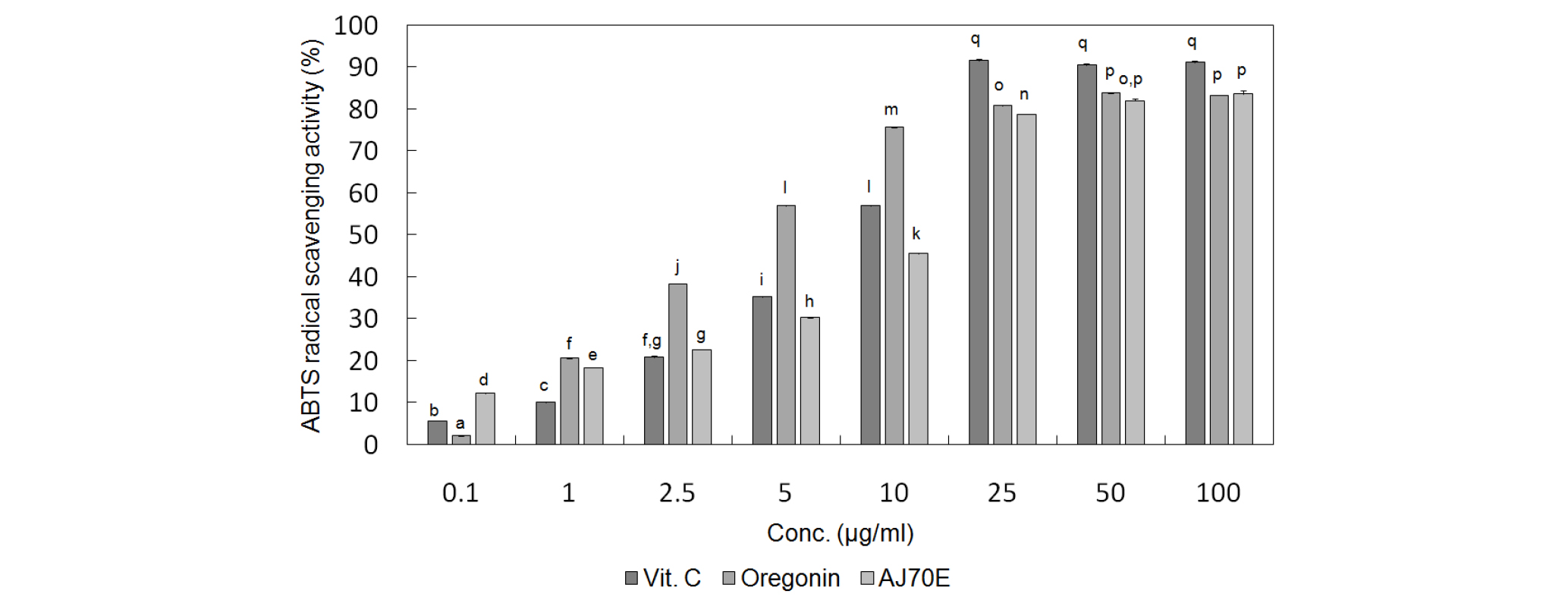
Fig. 7.
ABTS radical scavenging activities of oregonin and extract of A. japonica. Values were expressed as mean±S.D. of three determinations. Values were expressed as mean ± S.D. of at least three determinations. Values bearing different superscripts in the same column are significantly different at p <0.05 by Tukey’s test.
Oregonin의 처리에 의한 oxidative stress-induced apoptosis 유발 분자의 감소효능
HDFDC의 세포독성을 유발하기 위해 처리한 hydrogen peroxide에 의해 유도된 세포사멸을 측정하기 위하여 600 μM의 H2O2를 세포에 처리하였다. Bax (Bcl-2-associated X protein)는 대표적인 세포사멸 유발단백질 분자로서(Oltvai et al., 1993; Sedlak et al., 1995), H2O2의 처리는 Bax 분자의 발현을 유의하게 증가시키는 것을 알 수 있었다. 이에 반해 농도별로 처리한 oregonin은 농도의존적으로 Bax의 발현을 유의하게 감소시키는 것을 알 수 있었다. 이러한 결과는 oregonin은 세포내 활성산소에 의한 스트레스 (oxidative stress) 및 세포사멸을 효과적으로 억제함을 증명하고 있다(Fig. 8).
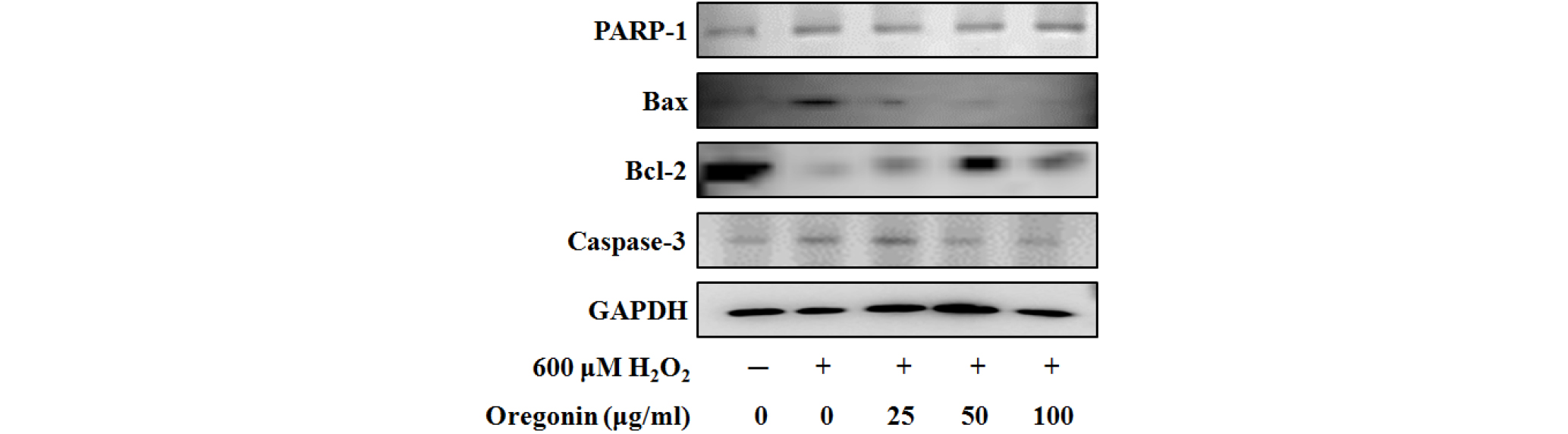
Fig. 8.
Inhibitory effects of oregonin on H2O2-induced PARP-1, Bax, Bcl-2, and caspase-3 protein expression in HDFDC. Cells (1× 105 cells) were pre-incubated with oregonin in various dosage or control medium for 10 min at 37℃, in CO2 incubator. Then, cells were treated H2O2 (final concentration 600 μM) and further incubated for 12 hrs. Harvested cells were solubilized with protease inhibitors-contained RIPA buffer and analyzed by western blotting by using PARP-1, Bax, Bcl-2, and caspase-3 specific antibody.
Oregonin의 처리에 의한 oxidative stress-induced apoptosis에 대한 억제분자의 증가효능
상기와 동일한 방법으로 HDFDC의 세포독성을 유발하기 위해 처리한 hydrogen peroxide에 의해 유도된 세포사멸을 측정하기 위하여 600 μM의 H2O2를 세포에 처리하였다. Bcl-2는 대표적인 세포사멸 억제에 관여하는 단백질 분자로서(Tsujimoto et al., 1984; Cleary et al., 1986), H2O2의 처리는 Bcl-2 분자의 발현을 유의하게 감소시키는 것을 알 수 있었다. 이에 반해 농도별로 처리한 oregonin은 농도의존적으로 Bcl-2의 발현을 유의하게 증가시키는 것을 알 수 있었다. 이러한 결과는 oregonin은 세포내 활성산소에 의한 스트레스(oxidative stress) 및 세포사멸을 효과적으로 억제함을 증명하고 있다(Fig. 8).
Oregonin의 처리에 의한 oxidative stress-induced apoptosis에 의해 유도된 PARP-1 단백질의 발현 억제효과
PARP-1은 세포의 핵에 존재하여 대량의 NAD를 사용하여 표적단백질을 poly-ADP ribosylation을 유도하고 이를 통해 하위 세포사멸에 관여하는 신호전달을 활성화시킨다. 이로 인해 PARP-1의 활성화는 세포사멸의 진행에 대한 지표로 사용되고 있다(Godon et al., 2008; Schultz et al., 2003). HDFDC에 처리된 600 μM의 H2O2는 유의하게 세포내 PARP-1의 발현을 증가시켰고, 이러한 결과는 세포의 세포사멸이 진행되고 있음을 증명하고 있다. 이에 반해 oregonin의 처리는 농도의존적으로 PARP-1의 단백질발현을 유의하게 억제시키는 것을 확인하였다. 이러한 결과는 oregonin은 세포내 활성산소에 의한 스트레스 (oxidative stress) 및 세포사멸을 효과적으로 억제함을 증명하고 있다(Fig. 8).
Oregonin의 처리에 의한 oxidative stress-induced apoptosis에 의해 유도된 caspase-3 단백질의 발현억제효과
Caspase-3는 세포의 세포사멸의 최종단계를 담당하는 분자로서 상기의 다양한 분자들의 발현과 세포신호전달기전을 통해 비가역적인 세포 사멸을 담당하는 단백질이다. 따라서 caspase- 3의 활성화 또는 단백질 발현량 증가의 확인은 세포사멸의 진행에 대한 중요한 최종지표로 사용되고 있다(Alnemri et al., 1996; Harrington et al., 2008). HDFDC에 처리된 600 μM의 H2O2는 유의하게 세포내 caspase-3의 단백질 발현을 증가시켰고, 이러한 결과는 세포의 세포사멸이 최종적으로 진행되고 있음을 증명하고 있다. 이에 반해 oregonin의 처리는 농도의존적으로 caspase-3 단백질 발현을 유의하게 억제시키는 것을 확인하였다. 이러한 결과는 oregonin은 세포내 활성산소에 의한 스트레스 (oxidative stress) 및 세포사멸을 효과적으로 억제함을 증명하고 있다(Fig. 8).
적 요
최근 식품의약품안전처에서 그동안 의약외품으로 분류되었던 '탈모 증상 완화' 관련 제품이 기능성 화장품의 범주에 포함됨에 따라서 관련 산업계에 큰 관심 중 하나라고 할 수 있다. 본 연구에서는 기존 의약품들의 한계점인 부작용의 위험률이 적으면서 탈모를 과학적으로 조절시켜 줄 수 있는 객관적인 근거를 제시할 수 있는 천연물 유래 신소재를 발굴하고자, 오리나무 가지로부터 분리한 oregonin은 강력한 활성산소종 소거능을 가지며 탈모와 연관성이 높은 모유두 세포의 사멸을 명확하게 조절함을 확인하였다. 결론적으로 oregonin을 포함한 오리나무 추출물은 두피에서 발생한 활성산소를 강력하게 제거하는 효능을 기반으로 하여, 산화적 스트레스에 의한 모유두세포의 사멸 억제 및 조절을 통하여 탈모방지 효과를 기대할 수 있는 천연 탈모 방지 및 양모 신소재로서의 개발가능성이 있는 것으로 확인하였다.