서 언
재료 및 방법
실험재료
추출물 제조
생물검정
용매 극성별 추출
Silica gel column chromatography
Semi-prep. HPLC purification
Analytical HPLC analysis
GC/MS analysis
통계분석
결과 및 고찰
Methanol 농도가 추출물의 양과 부정근 형성 유도율에 미치는 영향
80% methanol 추출물 처리가 녹두의 부정근 형성률에 미치는 영향
용매 극성에 따른 추출물이 녹두의 부정근 형성에 미치는 영향
Silica gel column chromatography 분획물이 녹두의 부정근 형성에 미치는 영향
Silica gel flash column chtomatography 분획물이 녹두의 부정근 형성에 미치는 영향
HPLC 분획물이 녹두부정근 형성에 미치는 영향
Analytical HPLC analysis
GC/MS analysis
Cinnamyl alcohol 표준품이 녹두 부정근 형성에 미치는 영향
열수 추출물과 추출 후 잔류물의 80% methanol 재추출물이 녹두 부정근 형성에 미치는 영향
적 요
서 언
19세기 초부터 현재까지 농업에서 유기합성 농약은 농산물의 생산과 품질 향상에 큰 기여를 했지만, 무분별한 사용으로 환경오염의 원인 및 인축에 대한 위해성까지 문제가 되어왔다(Choi, 1982). 식물 호르몬의 종류는 auxin, gibberellin, cytokinin, abscisic acid과 ethylene 등이 있으며, 최초로 발견된 indole acetic acid (IAA)의 생리적 기능과 유사한 작용을 하거나 줄기의 세포 생장을 촉진하는 호르몬을 옥신(auxin)으로 명명해 왔다(Lebuhn et al., 1997). 옥신은 일반적으로 줄기 절편의 길이 생장을 촉진하고 줄기와 뿌리의 발달, 꽃과 과실의 발달, 굴성 반응 등을 유도하는 식물호르몬으로서 식물의 뿌리 형성에 있어 낮은 농도에서는 세포분열의 촉진을 유도하지만 고농도에서는 억제하는 역할을 한다(Evans et al., 1994; Guilfoyle and Key, 1986). 합성 옥신의 유기화합물 중 하나인 2, 4-D (2, 4-dichlorophenoxyacetic acid)는 가격이 저렴할 뿐만 아니라 효과도 뛰어나 전 세계적으로 널리 사용되었지만, 잔류성이 높아 토양이 축적되며 지하수나 하천으로 유출되는 둥 환경오염을 유발하는 것으로 알려졌다(Hyun et al., 2021; Jaafarzadeh et al., 2018). 또한 WHO (World Health Organization)에서는 2, 4-D를 발암 가능성 물질로 분류하였으며, 환경뿐만 아니라 건강 문제의 원인으로 주목받고 있다(Loomis et al., 2015). 식물에서 기관 분화의 생리적 과정들은 온도, 수분, 빛과 같은 외부적 요인과 식물체 내부에서 합성된 다양한 화학물질과 식물 호르몬과 같은 내부적 요인에 의해 조절된다(Bagni et al., 1980). 또한 식물의 뿌리에서 부정근은 줄기나 잎에서 파생된 세포로부터 형성된 뿌리로서 경제적으로 중요한 원예와 목본 종의 식물번식에 필수적이며, 물과 양분흡수, 식물체의 지지력 강화 및 양분 저장 증대 등의 중요한 역할을 하는 것으로 알려져 있다(Geiss et al., 2009; Lee et al., 2022).
계피나무(Cinnamomum cassia J.Presl)는 녹나무과(Lauraceae) 녹나무속(Cinnamomum)에 속하는 식물로 나무의 주피를 제거한 줄기 껍질을 주로 사용한다. 계피나무는 특유의 향과 맛 때문에 조미료나 향신료 및 생약으로 사용되어 왔으며, 육계(계피나무의 줄기껍질)의 대표적 성분인 cinnamic acid (C9H8O2)를 0.03% 이상 함유한다. 계피나무에서 알려진 성분으로 나무껍질에는 정유 성분으로 cinnamaldehyde, cinnamyl acetate, 2-hydroxycinnamaldehyde (Choi et al., 2001), cinnamyl alcohol, cinnamic acid (Sagara et al., 1987), eugenol (Lockwood, 1979)이 함유되어 있고, 배당체 성분으로 cassioside, cinnamoside, kelampayoside A (Shiraga et al., 1988), 응축된 탄닌 성분으로 procyanidin A2, B1, B2, B5, B7 (Morimoto et al., 1986a), C1, cinnamtanin A2, A3, A4 (Morimoto et al., 1986b), 디테르페노이드 성분으로 cinncassiol A (Yagi et al., 1980), B (Nohara et al., 1980b), C1 (Nohara et al., 1980a), C2, C3 (Kashiwada et al., 1981), D1, D2, D3 (Nohara et al., 1981), D4 (Nohara et al., 1982), E (Nohara et al., 1985), cinnzeylanin, cinnzeylanol, anhydrocinnzeylanin, anhydrocinnzeylanol (Yagi et al., 1980)이 함유되어 있다. 그 중 Cinnamyl alcohol은 유전적 독성을 나타내지 않으며(Api et al., 2020), 화장품 향료 및 식품첨가물로 많이 사용되고 있다(Letizia et al., 2005). 또한, 육계를 이용한 연구에는 항균 활성(Ooi et al., 2006), 항산화 활성(Lin et al., 2003), 항당뇨 효과(Verspohl et al., 2005), 항염증 효과(Lee, 2015) 등 선행연구가 진행되어 있다.
본 연구는 식물자원에 함유된 식물생장조절 물질을 활용한 천연 유래 식물생장조절제를 개발하기 위해 수행되었으며, 부정근 형성 유도 활성이 확인된 육계 methanol 추출물로부터 활성 본체를 분리, 정제 및 동정을 하였다.
재료 및 방법
실험재료
본 연구의 시료인 육계(Cinnamon Bark: cortex of Cinnamomum cassia J.Presl)는 베트남에서 재배한 약재로 식품의약품안전처의 허가 규격품으로써 GMP인증을 받은 한의약품 제조업회사인 한약인(주)를 통해 구매하여 분쇄 후 시료로 사용되었다.
추출물 제조
효율적인 추출법을 수립하기 위해 methanol (20%, 40%, 60%, 80%) 및 증류수로 추출하였다. 육계 2 g과 용매 40 mL를 첨가하여 shaking incubator에서 상온, 150 rpm으로 7일간 추출하였다. 열수 추출은 육계 150 g에 D.W 1 L를 첨가하여 약탕기(DAEWOONG BIO, DW-80, Korea)를 사용하여 100℃, 5시간 추출 후 동결건조기(EYELA, FD-5N, Japan)를 사용하여 건조하였다. 이후 육계 잔류물을 건조하였으며, 육계 잔류물 2 kg에 80% methanol 15 L를 첨가하여 재추출하였다. 모든 추출물을 추출 후 ADVANTEC No. 2 여지로 여과하여 식물체의 잔류 이물질을 제거하였다. 추출 여액을 37℃ 하에서 rotary evaporator로 감압·농축하여 methanol을 제거 후 동결건조 했으며 –80℃ 냉동고에 보관하였다.
생물검정
생물검정은 Hess (1961)의 mung bean adventitious roots induction test에 따라 실시되었다. 녹두를 0.3%의 sodium hypochlorite에 5분간 살균을 한 후 흐르는 물에 24시간 세척하였다. 녹두종자는 배수공이 있는 육묘상자(50 ㎝ × 60 ㎝ × 15 ㎝)에 실험용 vermiculite를 약 7 ㎝로 채워 파종한 다음 약 1.5 ㎝로 복토하였다. 파종된 육묘상자를 24℃, 464.5 fc하의 growth chamber에 치상하고 주·야 12시간 광주기의 환경을 조성하여 7일∼10일간 3소엽의 엽아가 부풀어 있는 상태까지 녹두를 생육시켰다. 균일하게 자란 유묘를 선별하여 scalpel로 자엽 3 ㎝ 아래를 절단하였으며, 3 반복으로 vial (26 ㎜ × 60 ㎜) 당 5개의 절단된 녹두 유묘를 넣고 10 mL의 피검액을 채워 24℃, 464.5 fc의 growth chamber에 치상하여 주·야 12시간 광주기에서 7일간 생육 후 1 ㎜ 이상 발근된 유묘에 대해 발근 수를 측정하였고, 대조군에 대한 발근율을 산출하였다.
용매 극성별 추출
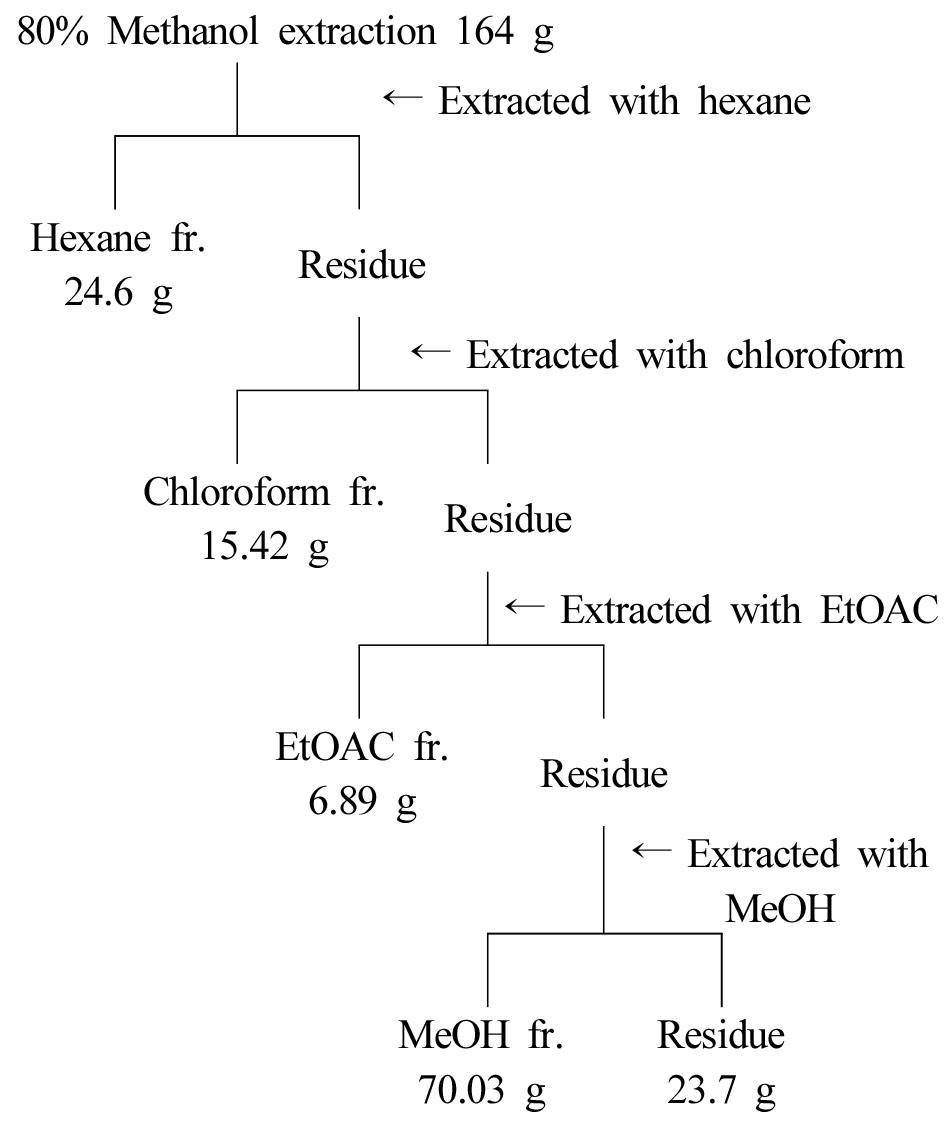
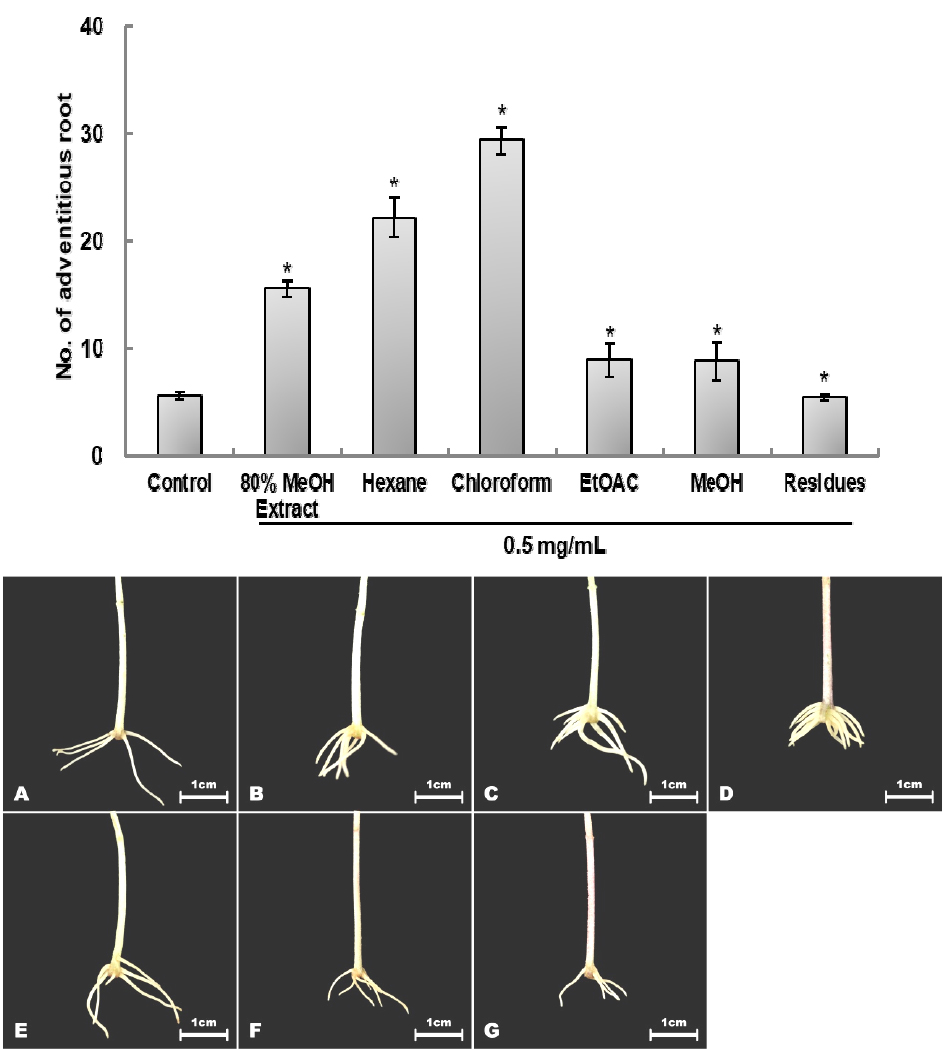
80% methanol 추출물 164 g을 막자사발로 미세하게 분쇄하여 용매의 극성에 따른 용해도를 이용하여 hexane, chloroform, ethyl acetate, methanol의 순서로 순차적으로 추출하였으며, 추출물 10 g당 용매 500 mL로 3회 추출 후 37℃하에서 rotary evaporator로 감압 농축하였다(Fig. 1).
Silica gel column chromatography
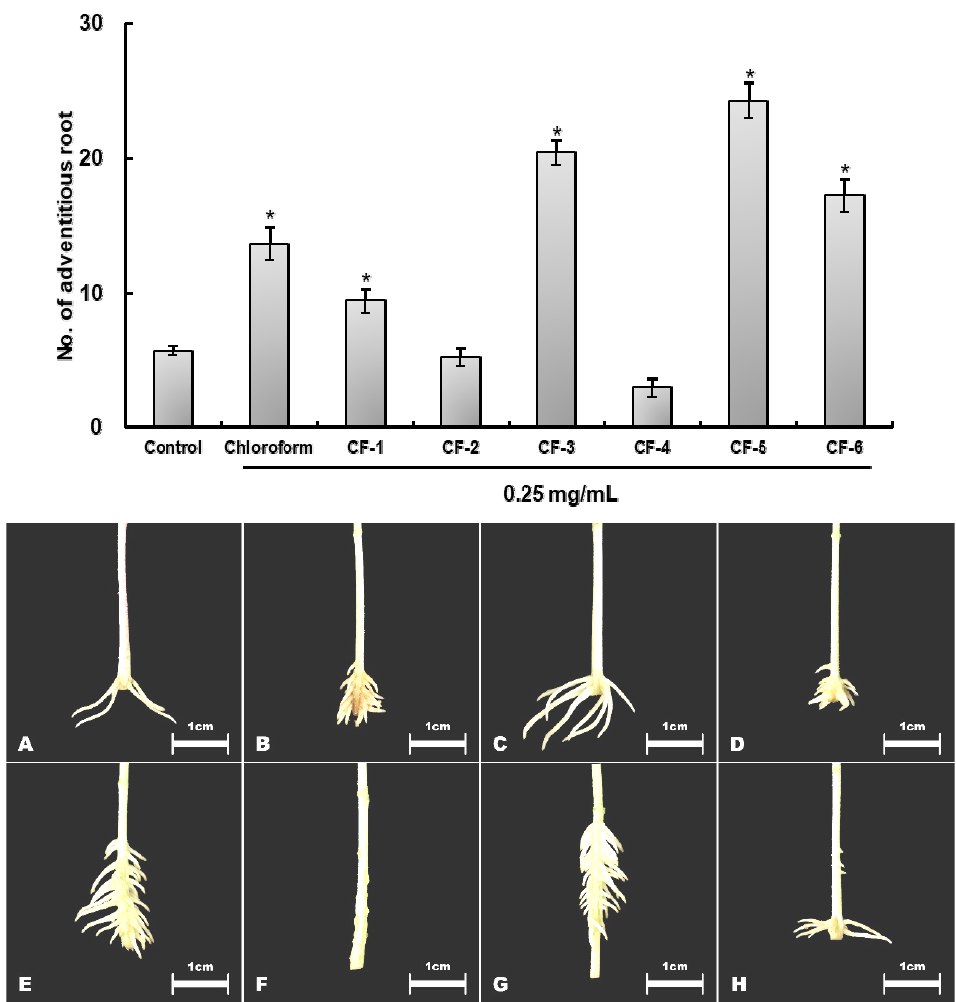
Silica gel column chromatography법을 사용하여 활성을 나타낸 분획 CHCl3 분획 추출물을 3 g씩 나누어 분리 및 정제하였다. 분리조건은 silica gel (70~230 mesh, Merck) 60 g을 column (32 ㎜ × 60 ㎝)에 충진한 후, 전개용매를 hexane-EtOAC (19 : 1 v/v; 0.25 L)에서 (14 : 1 v/v; 0.25 L), (9 : 1 v/v; 0.25 L), (4 : 1 v/v; 0.25 L), (3 : 1 v/v; 0.25 L), (2 : 1 v/v; 0.25 L), (1 : 1 v/v; 0.25 L), 그리고 MeOH을 0.3 L의 순서로 용출하였다. 각분획물을 thin layer chromatgraphy (TLC, silica gel 60 F254, aluminium sheets 20 ㎝ × 20 ㎝, Merck)을 사용하여 동일한 Rf 값을 가진 분획들을 모아 농축 후 생물검정에 사용하였다(Fig. 2). 또한 silica gel column chromatography 분획물들 중 활성을 나타내는 CF-5 분획물을 silica gel (230~400 mesh, Merck) 50 g을 column (27 ㎜ × 20 ㎝)에 충진하였으며, 전개용매는 chloroform-hexane (2 : 1, v/v; 2 L) 및 MeOH로 용출하였으며, 분리능을 향상하기 위해 N2 gas를 0.2 MPa의 압력을 가하여 분리하였다. 시험관에 15 mL씩 분취하였으며, TLC를 사용하여 동일한 Rf 가진 분획물을 모아 생물검정을 실시하였다(Fig. 2).
Semi-prep. HPLC purification
활성을 나타내는 CS-4 분획물을 high performance liquid chromatograpgy를 사용하여 분리 및 정제하였다. HPLC pump는 Waters 1525 Binary HPLC pump, Detector는 Waters 2487 Dual Absorbance λ Detector, Column은 분취용 YMC Pack pro C18 RS (5 ㎛, 10 ㎜ × 250 ㎜)를 사용하였다. Injection volume은 20 μL, 전개용매는 methanol, water를 사용하였으며, gradient elution 기법으로 20분간 methanol 60%, water 40%로 유지하였고, 20~25분에서 methanol 100%로 증가하였다. Runtime은 40분으로 2 mL/min으로 흘려주었으며, peak의 검출은 254 nm에서 확인하였다. 분획물은 tR 값을 기준으로 4구간으로 분취하였다(Fig. 2).
Analytical HPLC analysis
Semi-prep. HPLC에 의해 분취한 분획물 중 높은 활성을 가진 H3 분획물을 HPLC를 이용하여 분석을 실시했다. Column은 분석용 Sunfire C18 (5 ㎛, 4.6 ㎜ × 250 ㎜), 유속은 1 mL/min로 설정하였고, 기타조건은 동일하게 적용하였다(Fig. 2).
GC/MS analysis
분석에 사용된 GC/MS model은 Agilent사의 5977A Series GC/MSD system을 사용하였다. 분석에 사용된 column은 Agilent사의 DB-5MS (30 m × 0.25 ㎜, 0.25 ㎛)이며, GC/MS chemstation platform은 Agilent Mass Hunter software를 사용하였다. 분석조건은 60℃에서 5분간 유지 후 분당 10℃씩 280℃까지 승온시켜 280℃에서 5분간 유지하였다. Injecttion mode는 split mode로 1 : 5 비율, injector temp는 250℃로 설정하였다(Table 1).
Table 1.
The condition of GC/MS for the identification of adventitious roots formation inducing substances.
통계분석
모든 실험은 3회 반복 측정으로 이루어졌으며, 평균 ± 표준편차(SD)로 나타내었다. 처리간 유의성은 Student’s t-test로 검증하여 p-value값이 0.05 미만일 때 통계적으로 유의하다고 판정하였다(Micro-soft Excel 2010, microsoft, Redmond, WA, USA).
결과 및 고찰
Methanol 농도가 추출물의 양과 부정근 형성 유도율에 미치는 영향
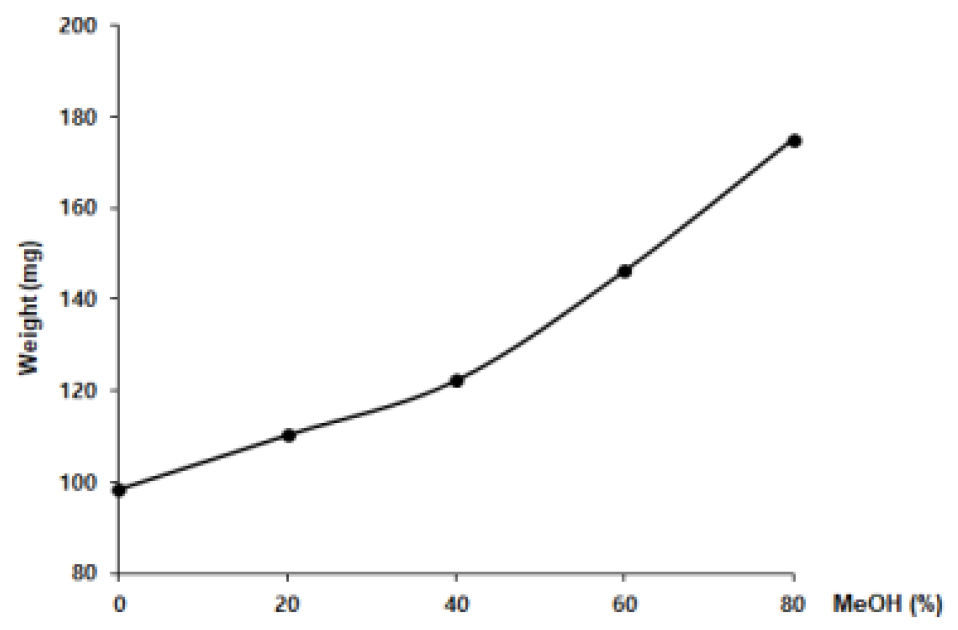
육계를 methanol 농도별 추출 결과 methanol 농도와 추출물의 양은 정의 상관관계에 있는 것으로 확인되었다(Fig. 3). 또한 부정근 형성율도 methanol 추출농도 순으로 증가하였으며, 80% methanol 추출물의 경우 434.8%의 높은 형성율을 나타내었다(Fig. 4). 따라서 분리 및 정제에 사용하기 위한 추출조건으로 80% methanol을 택하게 되었다.
80% methanol 추출물 처리가 녹두의 부정근 형성률에 미치는 영향
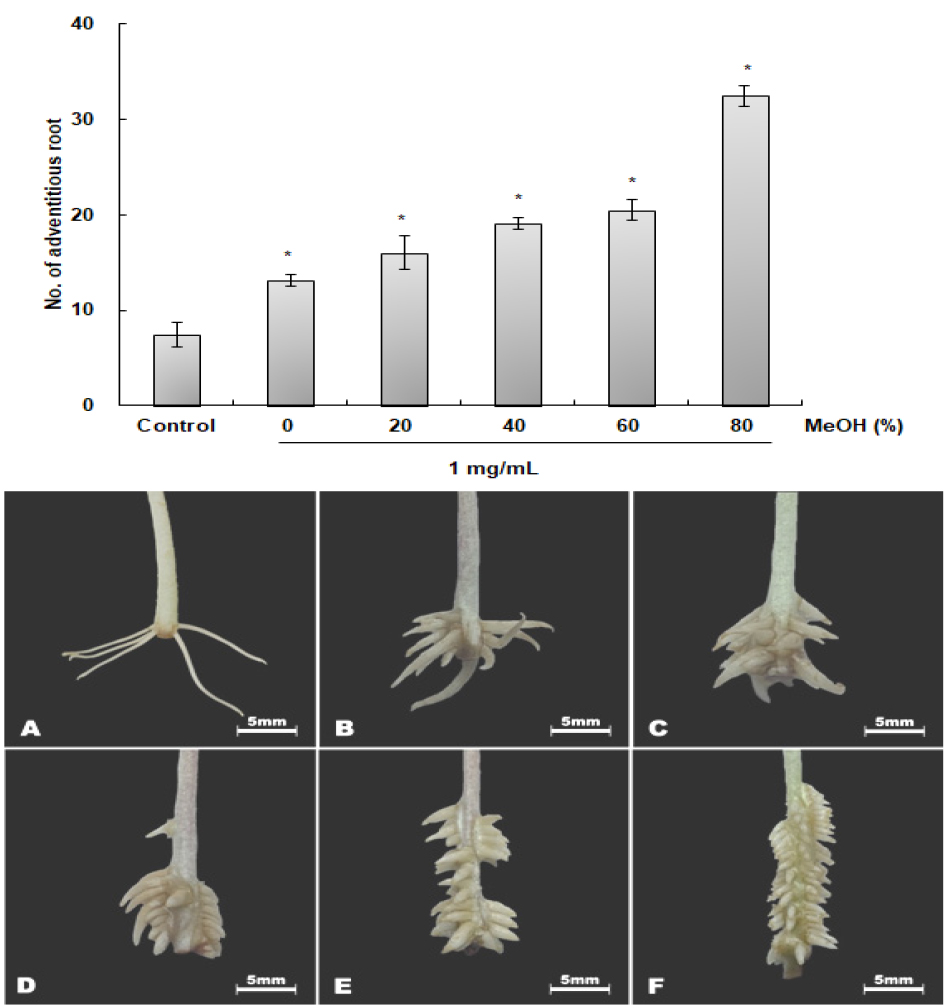
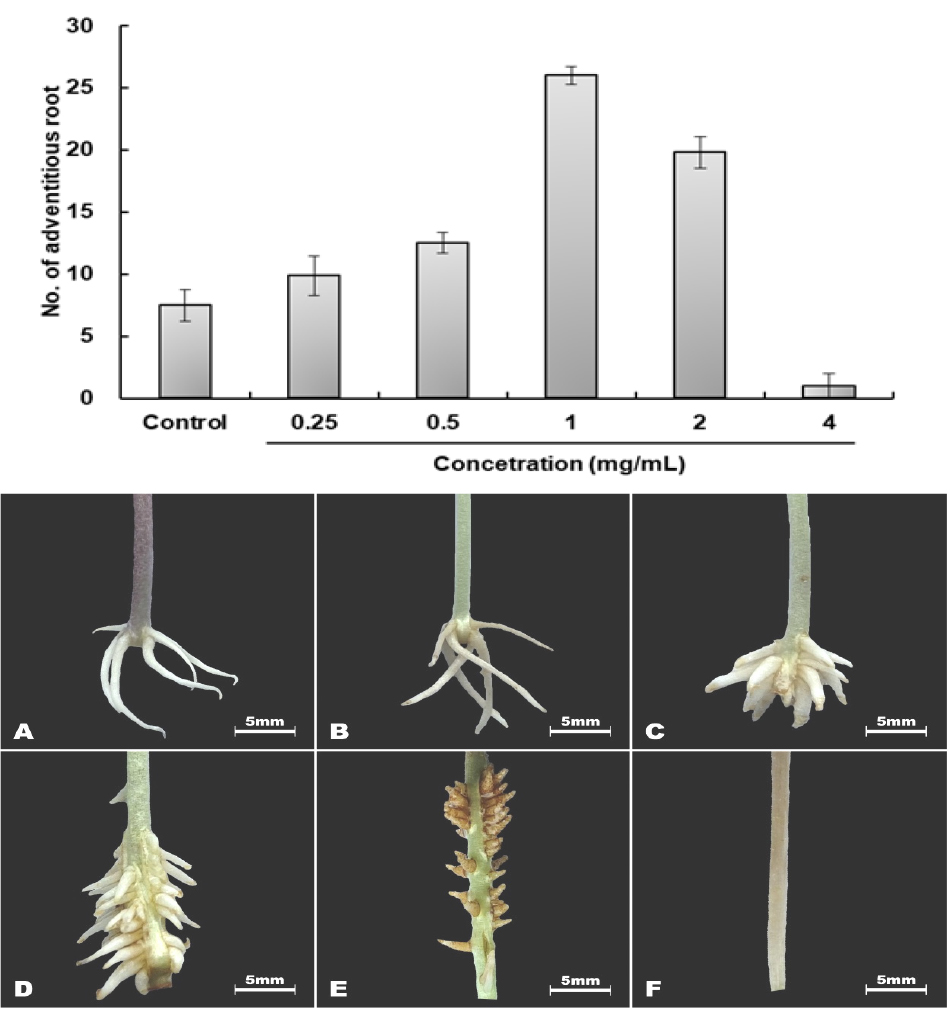
육계 2 kg을 80% methanol 15 L로 7일간 추출 후 감압·농축하여 164 g의 추출물이 추출되었다. Methanol 추출물을 농도별 처리한 결과 1 ㎎/mL에서 가장 높은 348.2%의 부정근 형성율을 나타내었지만 4 mg/mL의 고농도에서는 녹두 유묘의 생장을 억제시키는 것으로 나타났다(Fig. 5).
용매 극성에 따른 추출물이 녹두의 부정근 형성에 미치는 영향
육계 methanol 추출물을 용매의 극성에 따른 추출을 실시한 결과, hexane 24.60 g, chloroform 15.42 g, EtOAC 6.89 g, MeOH 70.03 g이 획득되었다. 각 용매의 부정근 발근율을 확인한 결과, chloroform 분획에서 525%의 높은 활성을 나타내었다(Fig. 6).
Silica gel column chromatography 분획물이 녹두의 부정근 형성에 미치는 영향
Silica gel Column chromatograpgy을 사용하여 chloroform층을 분획한 결과 CF-1 ~ CF-6의 분획물을 획득하였으며, 활성을 나타내는 CF-3, CF-5, CF-6 중 424.2%의 가장 높은 부정근 형성율을 나타내는 CF-5를 분리·정제에 사용하였다(Fig. 7).
Silica gel flash column chtomatography 분획물이 녹두의 부정근 형성에 미치는 영향
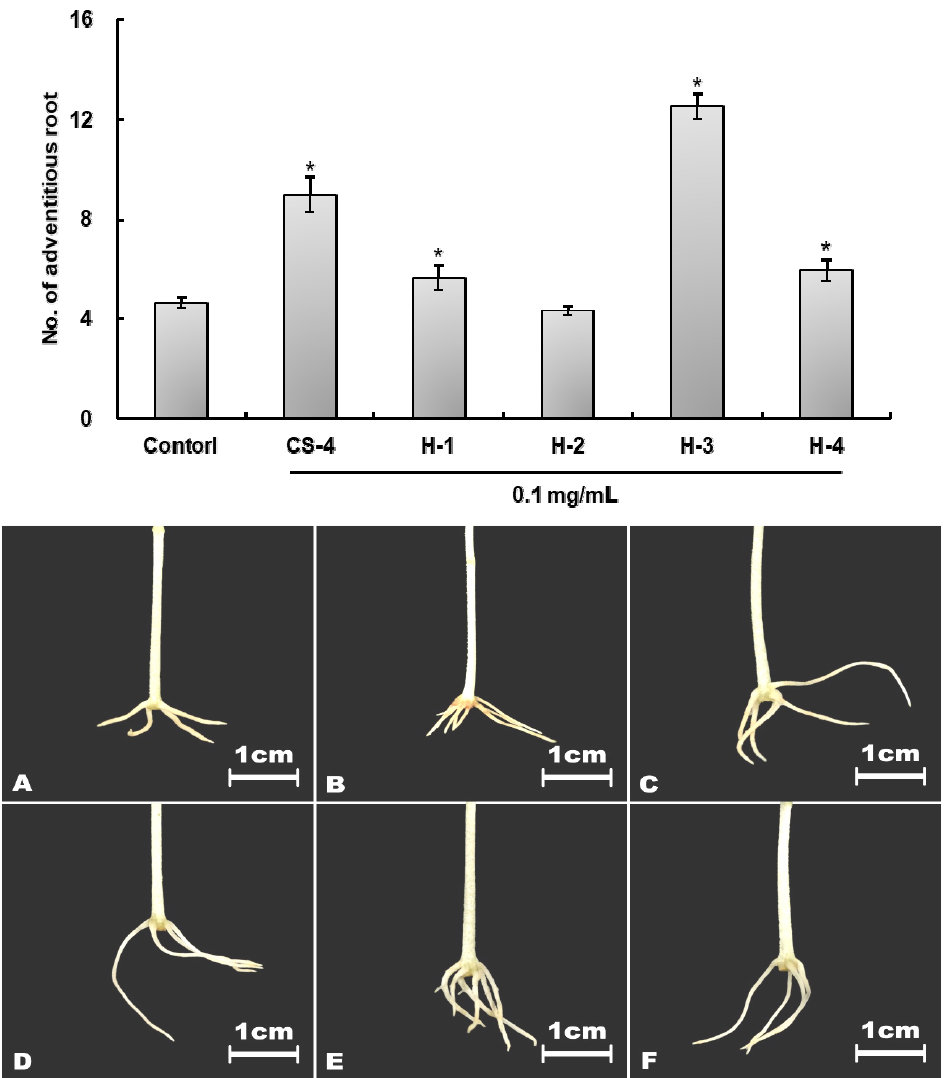
높은 활성을 나타내는 CF-5의 분획에 대한 silica gel flash column chromatograpgy를 실시했으며, 분획한 결과 CS-1 ~ CS-5의 분획물을 획득하였다. 각 분획물의 생물검정 결과는 CS-4 및 CS-5에서 각각 302.6% 및 293.6%로 부정근 형성율을 나타내었다(Fig. 8). 이중 CS-5는 methanol로 용출된 분획물로서 활성본체 이외의 다른 극성물질이 다수 함유되어있을 것으로 추정되어 CS-4를 사용하여 추가적인 분리 및 정제를 실시하였다.
HPLC 분획물이 녹두부정근 형성에 미치는 영향
활성 분획물 CS-4를 semi-prep. HPLC로 정제하였으며, H1 분획물은 8.5분 ~ 10.5분, H2 분획물은 10.5 ~ 17.8분, H3 분획물은 17.8분 ~ 22분, H4 분획물은 22분 ~ 40분으로 분취하였으며(Fig. 9), 분취 후 획득된 분획물은 0.1 ㎎/mL의 농도로 처리하였고 H3분획이 268.6%의 활성으로 가장 높은 것으로 조사되었다(Fig. 10).
Analytical HPLC analysis
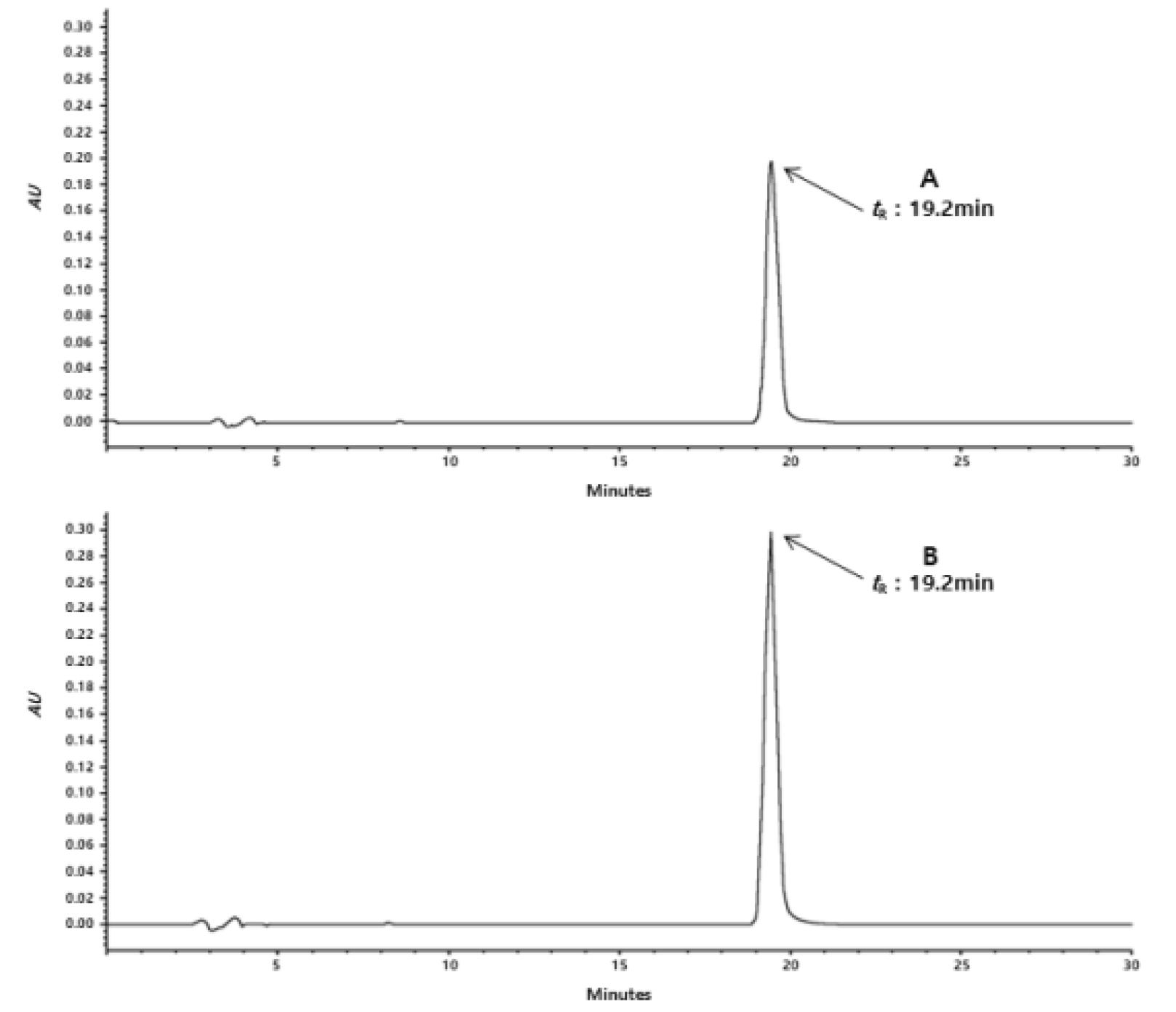
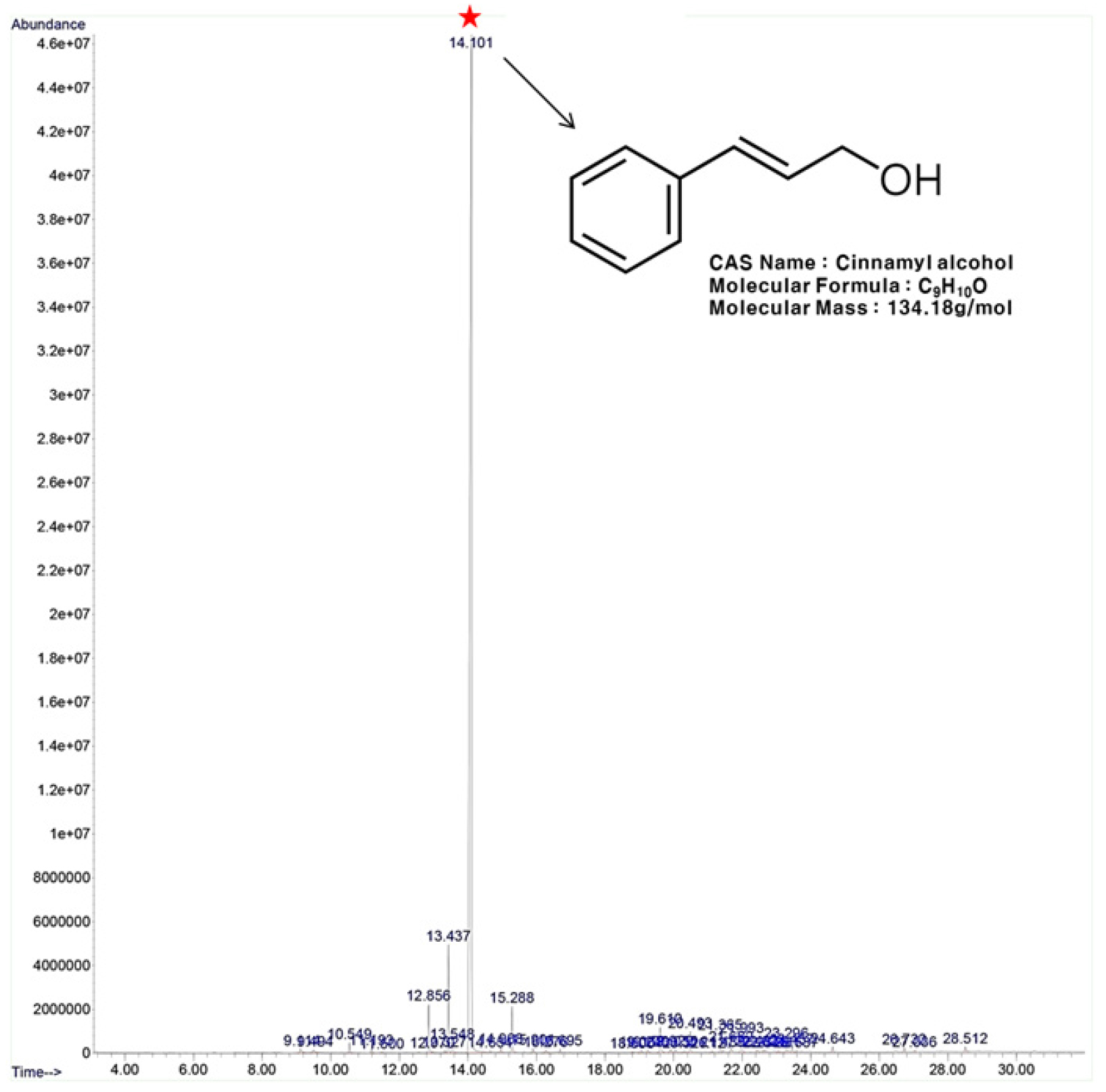
H3 분획 및 cinnamyl alcohol 표준품에 대해 HPLC로 분석을 실시하였다. 그 결과, cinnamyl alcohol 표준품과 H3 분획물에서 동일한 tR값 19.2분에서 단일 피크가 확인되었다(Fig. 11).
GC/MS analysis
H3 분획에 대한 GC/MS 분석 결과, 14.101분에서 활성본체로 추정되는 peak가 검출되었다(Fig. 12). MassHunter software상의 mass spectrum을 확인한 결과 순도 84.38%의 2-propen-1-ol, 3-phenyl-로 동정되었다(Fig. 13). 이는 동의어로 cinnayl alcohol, IUPAC명(E)-3-phenylprop-2-en-l-ol이며, 현재 FAO (Food and Agriculture Organization of the United Nations)에 식품 첨가제로 등록되어있으며, 향료로 사용되고 있다(Mattia and Sipes, 2001).
Cinnamyl alcohol 표준품이 녹두 부정근 형성에 미치는 영향
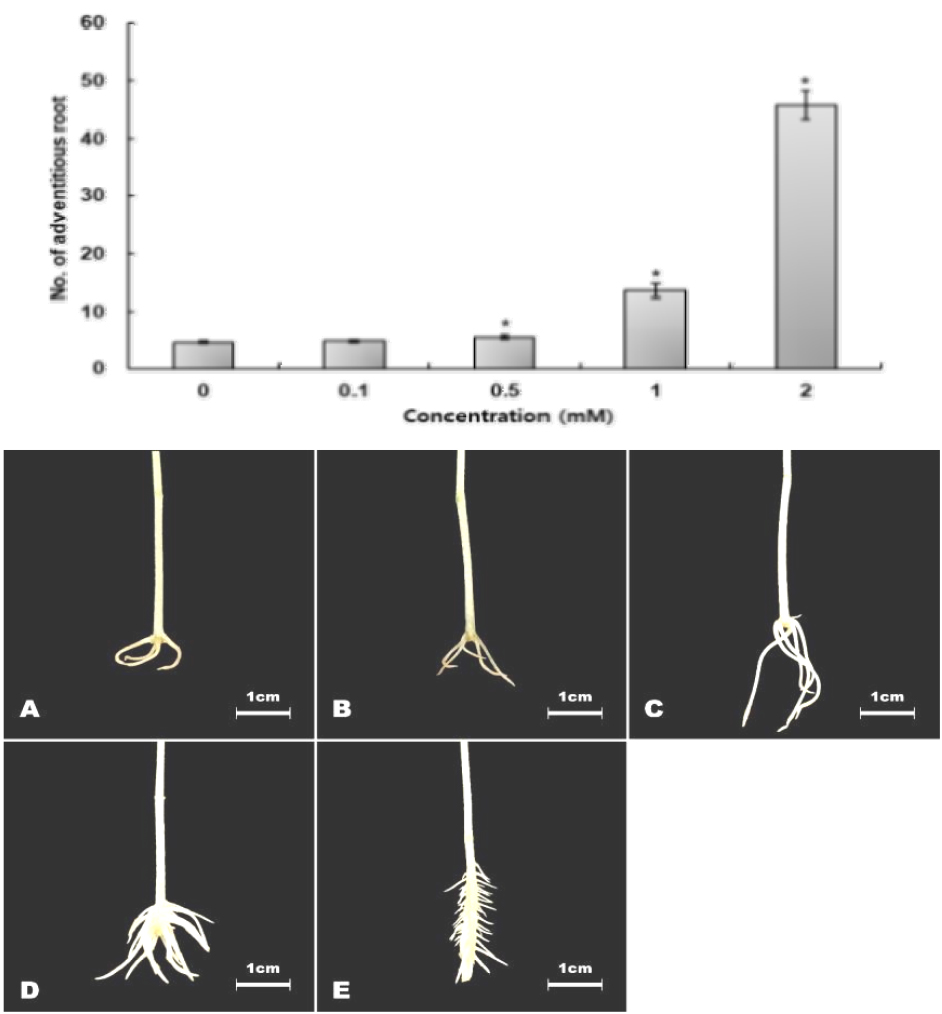
Cinnamyl alcohol을 농도별(0.1 mM, 0.5 mM, 1 mM, 2 mM)로 처리하였으며, 생물검정 결과 녹두 유묘 부정근 형성률은 농도에 비례하여 증가되었으며, 1 mM의 농도인 134.2 ㎍/mL에서 290%로 나타났다(Fig. 14).
열수 추출물과 추출 후 잔류물의 80% methanol 재추출물이 녹두 부정근 형성에 미치는 영향
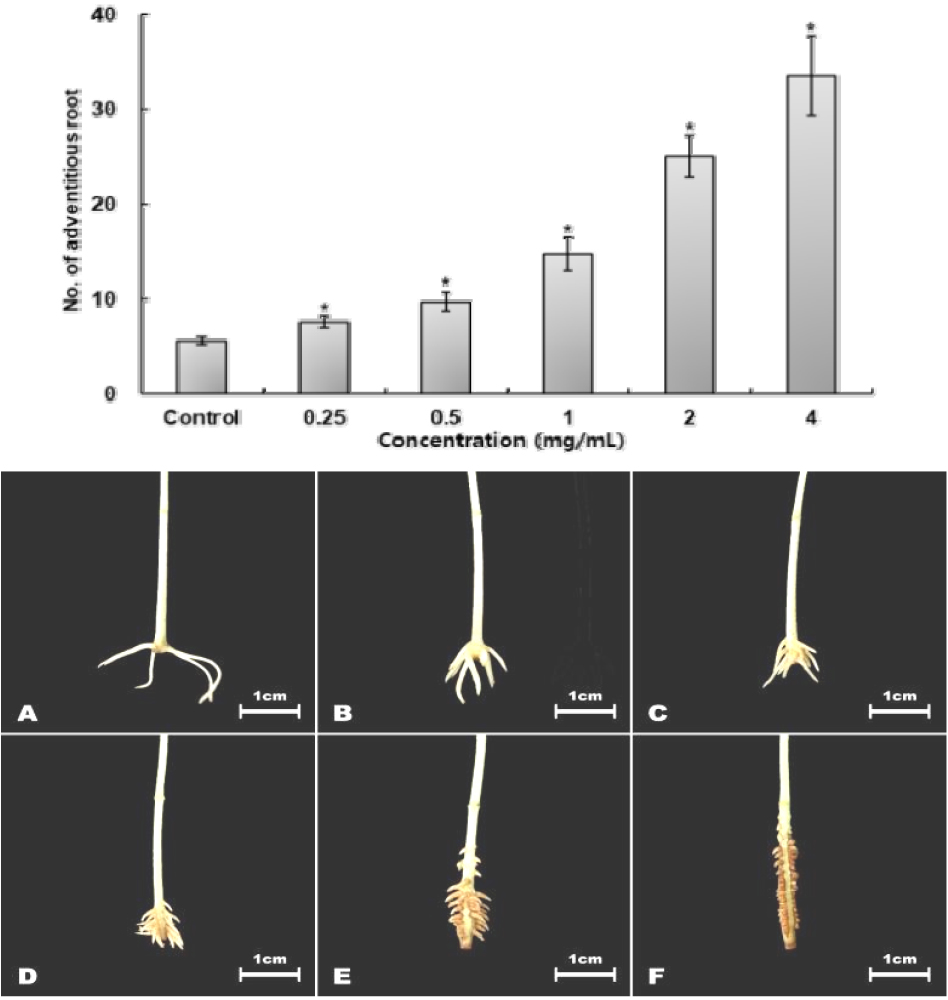
열수 추출물과 열수 추출 후 잔류물의 80% methanol 재추출한 추출물을 처리한 결과, 모든 추출물에서 농도에 비례하여 부정근의 수가 증가하였지만 열수추출물의 경우 1 ㎎/mL에서 263%로 나타났으나 앞선 연구에서 80% methanol추출물의 발근율에 비해 약 60% 내외의 낮은 활성을 나타내었다(Fig. 15).
반면 열수 추출물에 대한 결과에 비해 열수추출 후 80% methanol로 재추출한 추출물의 경우 1 ㎎/mL에서 부정근 형성 수가 45.7개, 816.7%의 발근율을 나타내었고, 앞선 연구결과와 같이 2 ㎎/mL의 고농도에서는 녹두의 유묘에 괴사를 유발하는 것을 확인하였다(Fig. 16).
전체적인 실험 결과 육계 추출물 함유된 cinnamyl alcohol이 부정근 형성 유도물질로 확인되었다. 본 실험에서 사용된 육계 추출물은 식품이나 화장품이 아닌 농업용 자재가 목적이므로 에탄올 보다 비용이 저렴한 메탄올을 사용하였다. Cinnamyl alcohol은 열수 추출에서 추출되지 않으며, 식품, 천연염색 및 한약재로 이용 할 때 열수 추출법을 주로 사용하므로 버려지는 육계 잔류물을 재활용 할 수 있을 것으로 확인되었다. 현재 cinnamyl alcohol은 시중에 저렴하게 구입할 수 있으나 합성원료이기 때문에 천연소재로 사용할 수 없으므로 육계 잔류물을 추출해 사용하는 것이 친환경 재배 방법에 이용 할 수 있을 것으로 사료된다.
적 요
본 연구에서 육계 추출물로부터 cinnamyl alcohol을 분리·정제하였다. 연구 결과, H3 분획 100 ㎍/mL에서 부정근 형성율이 286.6%였으며, 표준품 cinnamyl alcohol 1 mM (134.2 ㎍/mL)의 형성율이 290%로 유사한 결과를 나타내었다. 따라서 육계 methanol 추출물에 함유되어있는 cinnamyl alcohol이 녹두의 부정근 형성을 유도하는 주된 화합물일 것으로 판단된다. 육계에서 동정한 cinnamyl alcohol은 현재 식품첨가제 및 향료로써 사용되고 있으므로 안전성이 이미 보장되어 있으며, 한약재로써 사용된 육계 잔류물을 활용하여 부정근 형성 유도물질을 추출한다면 비용적인 측면에서 또한 긍정적인 요인으로 작용할 것으로 판단된다. 따라서 육계는 유기농 농자재로써 충분히 사용 가능할 뿐만 아니라 신규 천연 식물생장조절제의 개발용 소재로서도 활용 가능할 것으로 사료된다.