서 언
재료 및 방법
산양삼 추출물의 제조
MC3T3-E1 조골세포의 배양 및 분화
세포생존률 및 세포증식 유도 측정
Alkaline phosphatease (ALP) 활성 측정
Alizarin-Red 염색법에 의한 골 석회화 형성도 측정
정량 Real-time PCR 분석
통계분석
결과 및 고찰
산양삼 추출물이 조골세포의 증식에 미치는 영향
산양삼 추출물이 조골세포의 활성에 미치는 영향
산양삼 추출물이 조골세포의 골 석회화 형성에 미치는 영향
산양삼 추출물이 조골세포에서 골 형성 관련 유전자 발현에 미치는 영향
적요
서 언
골조직의 항상성(skeletal homeostasis)은 끊임없는 골형성과 골흡수에 의해 유지된다. 골의 재형성(bone remodeling)에는 조골세포와 파골세포가 관여하는데, 조골세포는 골기질을 합성하는 반면 파골세포는 골을 흡수하는 역할을 한다. 골재형성(bone remodeling)은 조골세포와 파골세포의 작용에 의해 일정한 주기로 골격계의 구조를 유지하는데 이러한 골격계의 구조와 기능은 전신적인 호르몬과 국소적 인자들의 상호작용에 의해 조절된다(Canalis et al., 1988; Raisz, 1988). 조골세포와 파골세포 작용간의 불균형은 전체적인 골감소(osteoporosis)나 증가(osteosclerosis)로 인한 골격의 이상으로 나타난다(Jeong et al., 2008).
우리나라 고령인구가 전체 인구의 7%를 넘어선 2000년 이후 사회 각 분야에서 고령인구에 대한 관심이 증가하고 있다. 특히, 한국여성의 경우 2013년 기준 평균수명이 85.06세로 OECD 회원국의 평균 수명보다 4.86세 높은 수준을 나타내고 있다(Yoon and Han, 2013). 고령사회에서 노년기 건강의 큰 문제로 대두되고 있는 골다공증은 골의 석회 성분 감소로 밀도가 떨어져서 경미한 충격에도 쉽게 골절을 일으킬 수 있는 질환으로, 2008- 2009년 국민건강영양조사에 따르면 50세 이상 성인의 골다공증 유병률은 여성에서 35.5%, 남성에서 7.5%로 여성이 남성에 비해 4배 이상 높았으며 , 노인 특히 폐경 후 여성들에게서 가장 그 발생빈도가 높게 나타났으며, 폐경 후 여성들에게서 나타나는 골다공증은 estrogen의 분비부족에 기인하는 것으로 알려져 있다(Choi et al., 2012; Jilka, 1998). 현재 폐경성 골다공증의 치료에는 천연 식물 유래의 phytoestrogen이 유효하다는 보고가 있고(Davis et al., 1998; Ha and Lee, 2003; Jeon et al., 2013; Keum et al., 2001; Lee et al., 2004), 비 폐경성 골다공증 치료에는 칼슘보충제, vitamin D 대사산물, calcitonin 요법, bisphosphonates 및 불소요법, 성장인자 등이 보고되었다(Kim, 2013; Min, 2016; Orcel and Krane, 2000; Prestwood et al., 1995). 현재 골다공증 예방 및 치료에 사용되고 있는 약제는 대부분 골흡수 억제제이며, 이는 이미 진행된 골소실을 회복 시킬 수는 없기 때문에 골다공증에 대한 예방 및 치료가 어려운 실정이다(Choi and Koo, 2002; Jeon and Kim, 2011; Kim, 2011). 이에 골형성 증가를 통한 골다공증 예방과 치료에 관한 연구가 활발히 이루어졌으며(Jeong et al., 2008; Kim et al., 2014; Kim et al., 2017; Yun et al., 2012), 특히 한의학에서 골관련질환에 처방되었던 약용식물등에 대한 효능 연구들과(Choi et al., 2001; Lee, 2001), 산화 억제 및 유리기(free radical) 소거능과 골다공증 예방에 대한 논문도 보고되고 있다(Boskey et al., 1992; Choi and Koo, 2002; Kenney et al., 1994).
인삼(人蔘: Panax ginseng C.A. Mayer)은 오갈피나무과(Araliaceae) 인삼속(Panax)에 속하는 다년생 초본이다. 현재 인삼, 산삼(wild Panax ginseng), 산양삼(cultivated wild Panax ginseng)의 정의를 보면, 인삼은 밭삼을 의미하고, 산삼은 산에서 인공적인 요소가 전혀 없이 자라는 삼을 가리키며, 산양삼은 산지관리법에 따라 국내 산지에서 재배하는 삼으로 정의된다(Kim et al., 2019). 인삼은 과거로부터 효능이 인정된 약용식물로 인삼의 구성 성분인 사포닌(saponin) 성분과 비사포닌 성분인 페놀, 플라보노이드, 산성다당체 등의 효과가 널리 알려져 있다(Kim and Kim 2005a; Lee et al., 2000; Yoo et al., 2000). 인삼의 생리활성은 체계적인 약리학적 접근으로 심혈관계, 면역계, 신경계에 대한 효능과 해독작용, 항암 작용 그리고 항당뇨작용 등이 알려져 있고(Kang et al., 2008; Kim et al., 2007), 최근 인삼열수추출물의 조골세포 골화 촉진효과(Kim et al., 2015)와 발효홍삼추출물의 ALP 활성 증가 효과와 TypeⅠ콜라겐의 mRNA 발현 수준 증가 효과가 보고되었다(Siddiqi et al., 2015). 산양삼은 일반적인 인삼과는 다르게 약리적인 활성이 높고 향이 강한 특징을 갖는다고 알려져 있으며(Bae et al., 2009), 간 기능 활성, 혈당 강하, 암세포 성장억제, 혈압 강하 및 동맥경화 예방, 면역 기능 활성, 빈혈예방, 신진대사 촉진, 피부장벽 강화, 중추 신경 자극 및 진전을 통한 학습능력과 기억력 촉진, 스트레스와 피로 해소 효과 등으로 매우 다양한 효능을 가지고 있는 것으로 보고되고 있다(Joo, 1995; Kim et al., 1999; Kimura and Suzuki, 1985; Nam, 1996).
산양삼에 대한 연구는 다수가 원기회복, 자양강장 및 면역증강 효과 등에 대한 것이며(Kim and Kim, 2006; Kim, 2009; Park et al., 2003; Sohn et al., 2012), 인삼과 산삼 및 산양삼 등의 효능을 비교 연구하였거나(Jang et al., 2008; Joo, 1995; Kim et al., 1999; Kim et al., 2004; Kim and Kim, 2006; Kimura and Suzuki, 1985; Lee, 2000; Lee et al., 2000; Nam, 1996; Pan et al., 2013; Yoo et al., 2000) 산양삼 감별법(Seo et al., 2004)과 제품품질 특성(Kim and Kim, 2005b)과 관련된 논문 등은 있으나 골대사에 미치는 영향에 대한 연구는 거의 없는 실정이다. 이에 본 연구에서는 산양삼의 다양한 생리활성 효능 등이 조골세포에 미치는 영향에 대해 알아보고 선행된 연구(Kim et al., 2015; Siddiqi et al., 2015)에서 열수추출물의 효능이 검증된 바 산양삼 열수추출물이 골관련 유전자 발현에 미치는 영향을 확인함으로써 골다공증 예방 및 치료 효과를 갖는 천연 소재로의 활용 가능성을 검토하고자 하였다.
재료 및 방법
산양삼 추출물의 제조
본 실험에 사용된 산양삼(cultivated wild Panax ginseng)은 산림약용자원연구소로부터 제공받았으며, 산양삼 분말시료에 20배량(w/v)의 증류수를 첨가한 후, 25℃에서 72시간 동안 추출을 수행하였으며, 추출액을 여과지(Whatman, Maidstone, UK)를 이용하여 2회 여과하여 rotary vacuum evaporator (EYELA, Tokyo, Japan)로 감압 농축한 후 동결건조장치(Ilshin BioBase, Gwangju, Korea)를 사용하여 동결건조하였다.
MC3T3-E1 조골세포의 배양 및 분화
Mouse calvaria osteoblast 세포인 MC3T3-E1 세포는 American Type Culture Collection (Manassas, VA, USA)에서 구입하였고 10% FBS (Gibco BRL, Grand island, NY, USA)와 1% antibiotics (Gibco BRL, Grand island, NY, USA)가 포함된 α-MEM (Gibco BRL, Grand island, NY, USA) 배지를 사용하여 37℃, 5% CO2 incubator에서 배양하면서 실험에 사용하였다. 분화유도를 위해 α-MEM배지에 10 mM β-glycerol Phosphate (Sigma-Aldrich, St. Louis, USA), 50 ㎍/mL의 vitamin C (Sigma-Aldrich, St. Louis, USA)를 첨가하였다. 3일마다 배지를 교환하였고 증식, 분화 및 무기질화에 미치는 영향을 확인하기 위하여 1일에서 21일까지 배양하며 실험을 진행하였다.
세포생존률 및 세포증식 유도 측정
산양삼 추출물이 조골세포 생존 및 증식에 미치는 영향을 알아보기 위해 Green 등(Green et al., 1984)의 방법에 따라 3- (3,4-dimethylthiazoly-2)-2,5-diphenyltetrazolium bromide (MTT, Sigma-Aldrich, St. Louis, MO, USA) 시약의 환원정도를 측정하는 MTT assay를 실시하였다. 먼저 MC3T3- E1 세포를 24 well plate에 분주한 후 24시간 동안 37℃, 5% CO2 incubator에서 배양 후, 세포생존률을 확인하기 위하여 배지를 제거하고 FBS가 첨가되지 않은 배지에 산양삼 추출물을 농도별(25, 50, 100 ㎍/mL) 첨가하여 만든 새로운 배양액을 분주하여 48시간 배양하였다. 산양삼 추출물의 세포증식률 확인을 위해 MC3T3-E1 세포를 24 well plate에 분주한 후 24시간 동안 37℃, 5% CO2 incubator에서 배양 후, 배지를 제거하고 FBS가 첨가된 배지에 산양삼 추출물을 농도별(25, 50, 100 ㎍/mL) 첨가하여 만든 새로운 배양액을 분주하여 7일간 배양하였다. 실험 종료 후 배지를 제거하고 5 ㎎/mL 농도의 MTT시약 100 μL를 각 well에 첨가하여 3시간 더 배양한 후 배지를 제거하고 DMSO (dimethyl sulfoxide)를 500 μL를 첨가하여 생성된 불용성의 formazan 결정을 용해시켜 UV/Visible spectrophotometer (Xma-3000PC, Human Corporation Co., Seoul, Korea)로 570 ㎚에서 흡광도를 측정하였다.
Alkaline phosphatease (ALP) 활성 측정
산양삼 추출물이 조골세포 활성에 미치는 영향을 알아보기 위하여 염기성 인산분해효소(alkalline phosphatase, ALP) 활성을 측정하였다. 염기성 인산분해효소는 조골세포 분화에 발현되는 표식인자이므로 산양삼 추출물의 조골세포 분화 촉진 효과를 알아볼 수 있다. 포화 배양된 MC3T3-E1 cell를 6 welll plate에 분주하고 37℃, 5% CO2 incubator에서 24시간 배양 후, 배지를 제거하고 10% FBS, 1% 항생제가 첨가된 배지에 산양삼 추출물을 농도 별로 배분시켜 만든 새로운 배양액을 분주하였다. 7일간 배양 후 배양액을 제거하고 0.1% Triton X-100/0.9% NaCl 용액을 첨가하여 세포를 분리하였다. 세포 현탁액을 14,000 rpm에서 10분간 원심분리한 후 상등액만 취하여 ALP 효소 활성과 단백질 정량에 사용하였다. 상등액에 1 M Tris-HCl 500 μL와 5 mM MgCl2 100 μL와 Lysis buffer 250 μL와 5 mM p- nitrophenolphospate (p-NPP)를 첨가한 후 37℃에서 30 분간 반응시킨 후 1 N NaOH 250 μL로 반응을 중지하고, 405 ㎚에서 흡광도를 측정하였다. ALP activity는 p-NPP로부터 생성된 p-nitrophenol (PNP)를 측정하여 p-NP에 대한 표준그래프를 작성한 후 활성도를 도출하였고, 단백질은 bovine serum albumin을 표준물질로 사용하여 Brad-ford (Bio-Rad Laboratories, Inc, USA)법으로 정량하였다. 측정된 ALP activity를 단백질량으로 나누어 단위 단백질량 당 효소활성도(U activity/㎎ protein)를 산출하였다.
Alizarin-Red 염색법에 의한 골 석회화 형성도 측정
조골세포 분화의 주요 표식인자인 골석회화 형성도를 측정하기 위해 Alizarin-red 염색법을 실시하였다. 24-well plate에 조골세포(MC3T3-E1 cell)를 분주한 후, 37℃, 5% CO2 incubator에서 24시간 배양 후, 배지를 제거하고 PBS로 세척한 뒤, 석회화 유도를 위해 50 ㎍/ml ascorbic acid, 10 mM β- glycerol phosphate가 포함된 농도별 산양삼 추출물 배양액을 분주하고 21일까지 incubator에서 배양하였다. 배양 후, 배지를 제거하고 PBS로 세척한 뒤 80% EtOH로 4℃에서 1시간 동안 고정시켰다. 증류수에 alizarin red (Sigma-Aldrich, St. Louis, USA)를 녹여 40 mM Alizarin Red Solution (pH 4.2) 제조한 후, 고정이 끝나면 준비한 AR solution으로 shaker위에서 속도 120 rpm으로 30분간 염색하였다. 염색이 끝난 뒤 증류수로 5번 세척한 후 현미경으로 nodule 정도를 관찰하였다. 석회화 형성 확인 후 10% cetylpyridinium chloride를 첨가한 10 mM sodium phosphate (pH 7.0) 용액을 첨가하여 15분간 용출 후, 염색된 정도를 UV/Visible spectrophotometer (Xma-3000PC, Human Corporation Co., Seoul, Korea)를 이용하여 570 ㎚에서 흡광도를 측정하였다.
정량 Real-time PCR 분석
세포분화와 석회화가 유도된 각 실험군의 MC3T3-E1 세포주에서 mRNA 발현을 정량 PCR 분석으로 확인하였다. RNeasy Mini Kit (Qiagen, Valencia, CA, USA)를 이용하여 total RNA를 추출하였고 cDNA를 합성하기 위하여 Verso cDNA Kit (Thermo Scientific, Pittsburgh, PA, USA)를 이용하였다. Brilliant Ⅲ Ultra-Fast SYBR Green qRT-PCR master mix (Agilent Technologies, Santa Clara, CA, USA)를 이용하여 cDNA 1 ㎍, 2x SYBR Green master mix 10 μL, 각 primer 1 μL, 100 mM DTT 0.2 μL RT/RNase block 1 μL를 혼합한 후, 전체 부피가 20 μL가 되도록 DEPC를 처리한 물로 적정하였다. ExicyclerTM 96 (Bioneer co., Daejeon, Korea)을 이용하여 95℃에서 3분간 반응시킨 후, 94℃에서 15초, 60℃에서 25초, 70℃에서 15초를 40회 반복하여 반응시켰다. 정량 PCR 결과를 qcalculator 1.0 program (Institute of Pharmacology & Toxicology, University of Bonn, Bonn, Germany)을 이용하여 Ct값에 따른 mRNA양을 정량적으로 계산하여 분석하였다. 정량을 위한 내부 대조군(internal control)으로는 GAPDH를 이용하였으며, 정량 PCR 분석에 사용한 primer sequence는 Table 1에 나타내었다.
Table 1.
Sequence of oligonucleotide primers used for qRT-PCR
통계분석
실험결과는 평균과 표준오차로 나타내었으며, 통계분석은 SPSS program을 이용한 one-way ANOVA (p < 0.05)을 실시하여 Duncan’s multiple range test에 의해 시료간의 유의적 차이를 검정하였다.
결과 및 고찰
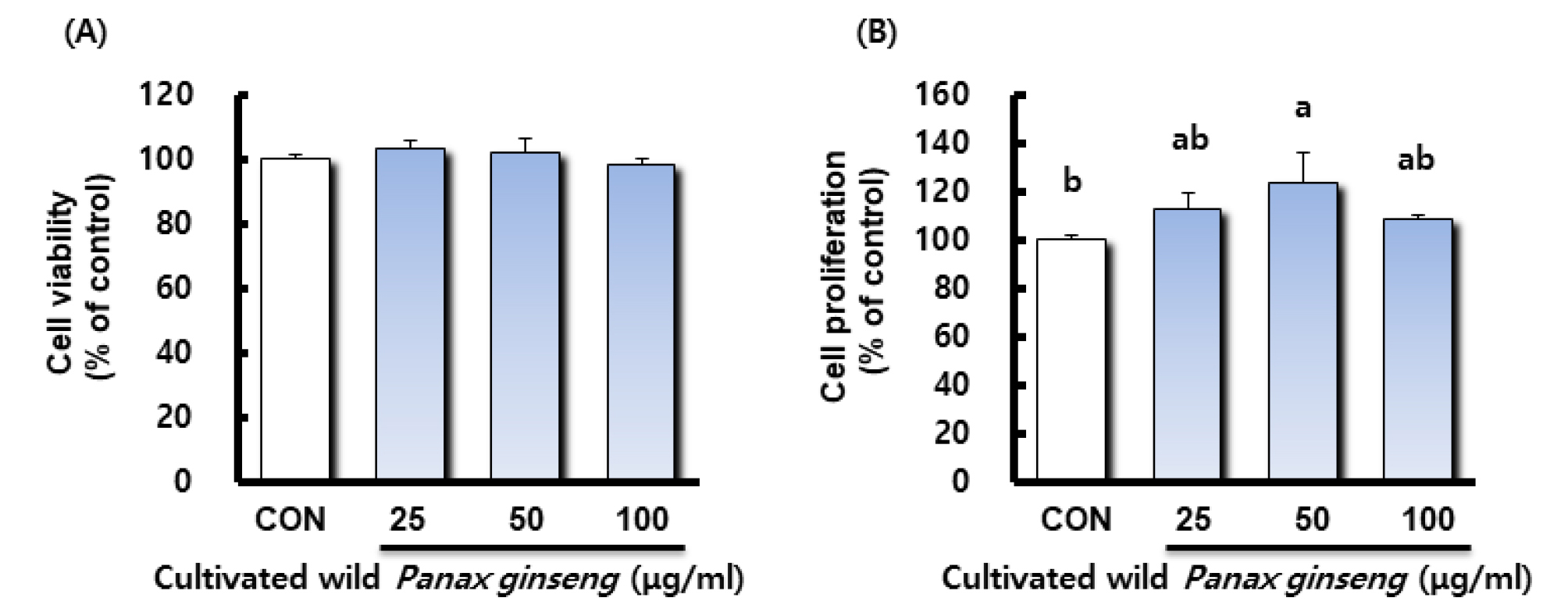
산양삼 추출물이 조골세포의 증식에 미치는 영향
미분화간엽세포로부터 유래하는 조골세포는 골기질 성분을 주로 합성하여 석회화과정을 촉진하며(Martin and Matthews, 1970; Owen, 1985), 세포막에 당단백 효소인 염기성인산분해효소를 갖고 있다(Jeong et al., 2008). 확립된 골조직유래 여러 가지 세포주 중 골세포의 세포활성과 관련된 연구에서 유용하게 이용되고 있는 mouse calvaria 유래의 MC3T3-E1 osteoblastic cell은 적절한 자극 하에 골수의 stromal cell이나 결합조직의 mesenchymal stem cell이 분화되어 생긴 것으로, in vivo 골형성 과정 중 세포의 증식, 분화, 석회화 등 골아세포와 유사한 대사적 특징을 가지고 있으며, 조골세포 전구체(osteoprogenitor)로부터 전조골세포(pre-osteoblast)와 조골세포, 그리고 골내막 세포(bone lining cell) 또는 골세포(osteocyte)로 분화되는 과정에 속하는 세포이다(Ernst et al., 1989; Jeong et al., 2008; Sudo et al., 1983). 특히 세포외기질에 무기질을 형성(mineralization of matrix)하는 성질도 가지고 있으므로(Kim et al., 1991) 본 연구에서는 MC3T3-E1 세포주를 이용하였다. 산양삼 추출물 처리가 조골 세포의 증식에 미치는 영향을 알아보기 위해 MTT assay를 실시하였고, MC3T3-E1 세포생존률은 대조군과 산양삼 추출물을 처리한 실험군 모두에서 동일한 수준으로 나타났으며 이로써 산양삼 추출물의 안전성을 확인할 수 있었다(Fig. 1A). 또한 산양삼 추출물을 처리한 실험군과 대조군과의 세포증식률을 비교하였을 때 산양삼 추출물 50 ㎍/mL 농도 처리군에서 유의적으로 세포증식이 촉진되었으며 25 ㎍/mL과 100 ㎍/mL 농도 처리군에서도 대조군보다 높은 경향을 나타내었다(Fig. 1B).
산양삼 추출물이 조골세포의 활성에 미치는 영향
산양삼 추출물이 조골 세포의 활성에 미치는 영향을 알아보기 위해 조골세포의 분화초기에 나타나는 표지인자인 Alkaline phosphatease (ALP) 활성을 측정하였다(Kim et al., 2001; Min, 2016). 전 조골세포(pre-osteoblast)에서 성숙 조골세포(mature osteoblast)로 가는 초기 과정의 분화 인자인 ALP는 당단백 효소이며(Delany and Canalis, 1998; Ju, 2008; Kim, 2014), 이 효소는 기질 특이성과 염기성 pH에서 최적의 활성을 나타내며 세포외막과 석회화조직에서 높은 농도로 발견된다. 특히 석회화 과정 동안 무기인산을 운반하고 인산칼슘의 침착을 도와주며 세포분열이나 분화의 조절자 역할을 담당하므로 다수의 논문이 조골세포의 활성을 측정하기 위한 도구로 ALP 활성도를 사용하였다(Choi et al., 2001; Choi and Koo, 2002; Park and Shin, 2001; Stein et al., 1990; Sudo et al., 1983). 산양삼 추출물을 처리한 MC3T3-E1 세포의 ALP 활성 결과는 Fig. 2와 같다. 모든 산양삼 추출물 처리군이 대조군과 비교하여 유의적으로 높은 활성을 나타내었으며 특히 산양삼 추출물 50 ㎍/mL 농도 처리군에서 가장 높은 활성을 나타내었다. 이는 Siddiqi et al. (2015)의 연구에서 홍삼 및 발효홍삼 추출물이 조골세포의 ALP 활성을 증가시켰다는 결과와 일치한다. ALP가 조골세포의 분화초기에 나타나는 표지인자이므로 이 결과로 산양삼 추출물이 조골세포의 분화를 촉진한 것으로 사료되며, 향후 분화 촉진과 관련된 산양삼의 유효성분에 대한 후속 연구를 통해 분화 촉진 기전과 유효성분 규명이 필요할 것으로 보인다.
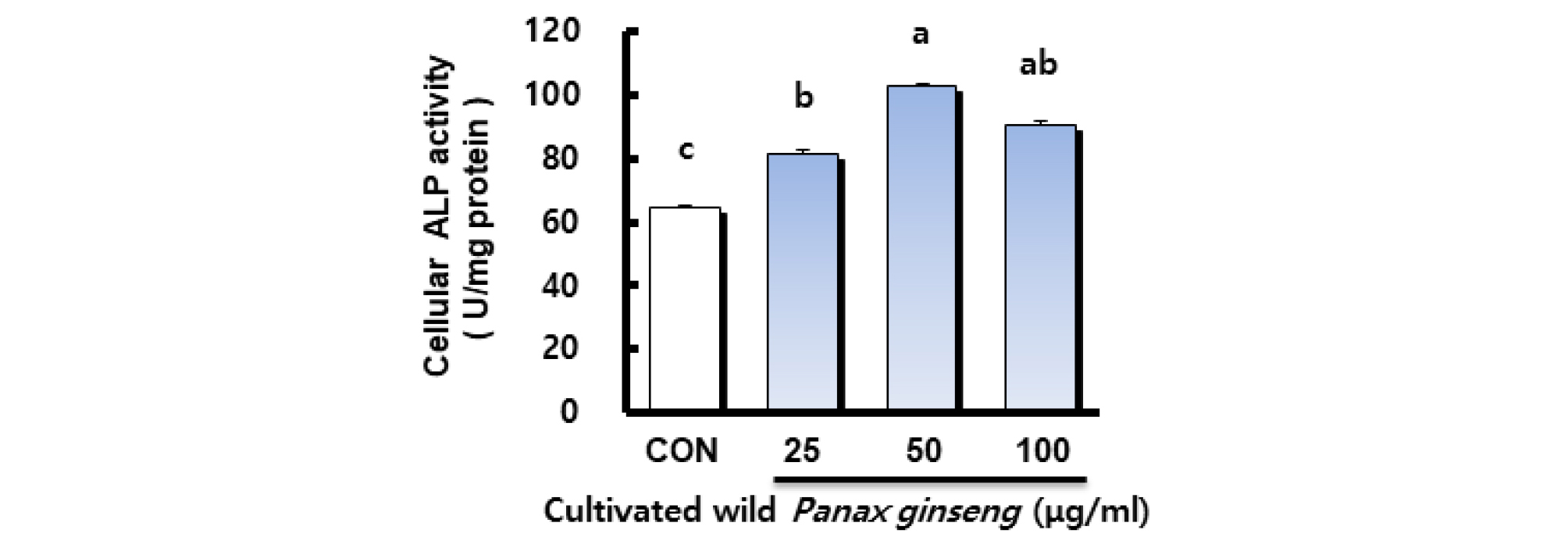
Fig. 2.
Effect of cultivated wild Panax ginseng on intracellular alkaline phosphatase (ALP) activity in osteoblastic-like MC3T3- E1 cells. Data presented as Mean ± SEM (n=3). Different letter superscripts mean significantly different CWP concentration as analyzed by one-way ANOVA, Tukey test (p < 0.05). Cellular ALP 1 unit(U)(1 nmole p-nitrophenyl phosphate/mg protein/ min).
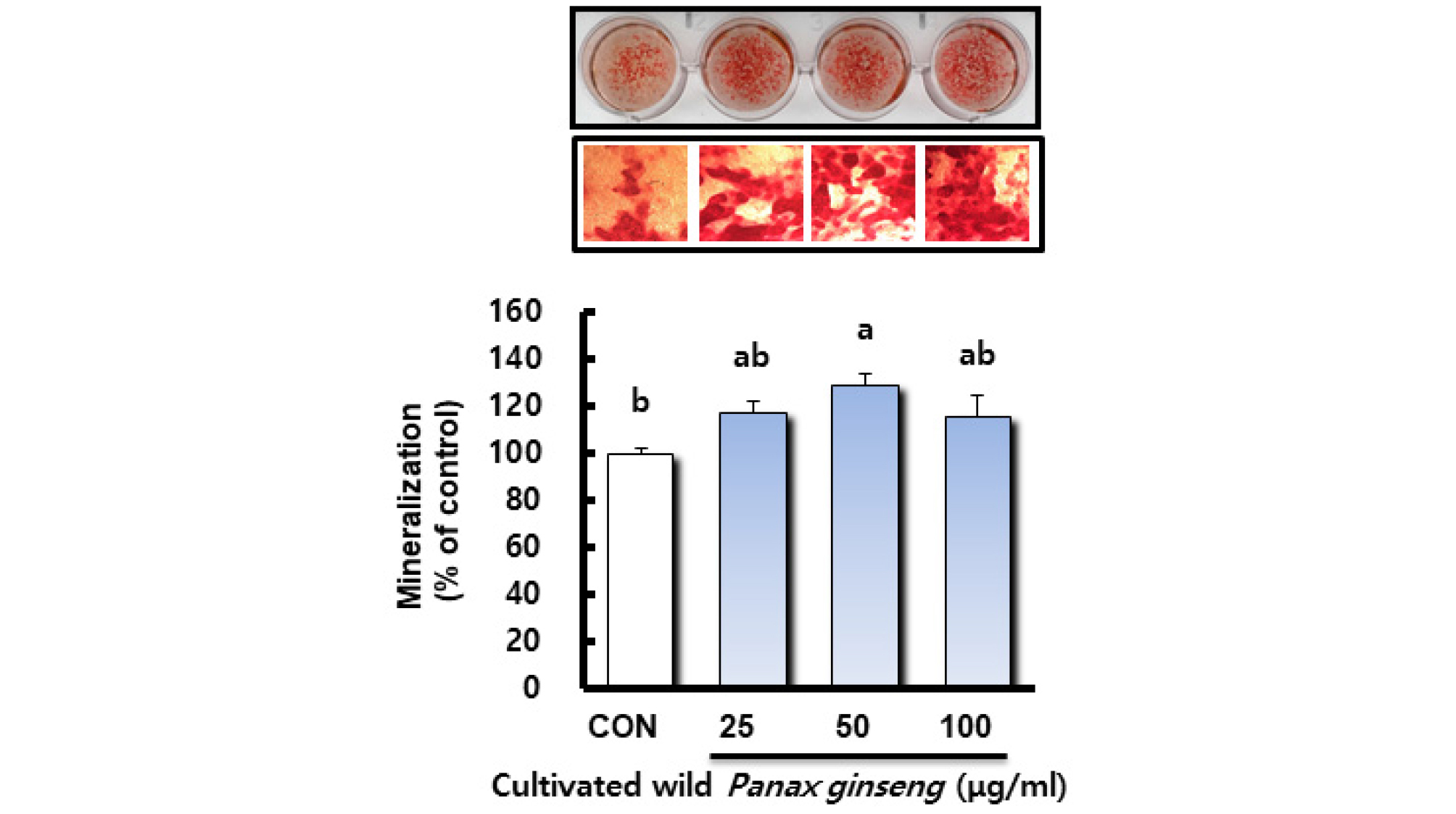
산양삼 추출물이 조골세포의 골 석회화 형성에 미치는 영향
골의 발생은 간엽줄기세포로부터 골모세포로의 분화가 연골내골화와 막내골화라는 두 과정을 거쳐 일어나면서 골모세포에서 만들어진 기질에 무기질이 침착되어 생성된다. 일반적으로 증식기, 기질 성숙기, 석회화의 3단계 과정을 거쳐 골을 형성하는데 조골세포는 5일 정도부터 분화되기 시작하여 15일 이후로 골석회화가 진행된다(Jeong et al., 2008; Kim et al., 2001; Min, 2016). 조골세포의 표지인자에는 ALP, collagen 및 osteocalcin 등이 사용되고 있으나 이러한 지표는 조골세포에 한정된 지표가 아니기 때문에 전조골세포(pre-osteoblast)에서 조골세포의 분화 및 골형성(bone formation)의 지표로 세포외기질의 석회화 형성능을 검토하고 있다(Declercq et al., 2005). 본 연구에서는 산양삼 추출물의 농도에 따른 석회화 형성도를 확인하기 위해 무기질화된 세포의 기질을 alizarin red로 염색하였고, 염색된 석회화물은 10% cetylpyridinium chloride로 녹여 흡광도 값을 측정하여 상대활성을 Fig. 3에 나타내었다. 산양삼 추출물을 처리한 실험군과 대조군과의 석회화 형성도를 비교하였을 때 산양삼 추출물 50 ㎍/mL 농도 처리군에서 유의적으로 석회화 형성이 촉진되었으며 25 ㎍/mL와 100 ㎍/mL 농도 처리군에서도 대조군보다 높은 경향을 나타내었다. Kim et al. (2015)은 인삼열수추출물이 조골세포의 칼슘 축적 형성을 유도하여 골화를 촉진한다고 보고하였고, Kim et al. (2012)은 진세노사이드 Rd가 AMPK와 BMP-2 신호전달 경로의 활성을 통하여 조골세포 분화를 유도한다고 보고하였다. 따라서 본 연구결과 산양삼 추출물이 MC3T3-E1 조골세포의 분화를 촉진하고, 석회화 형성능이 있음을 확인하였으나 산양삼 추출물의 분화 촉진과 석회화 형성능이 산양삼의 사포닌계 진세노사이드 성분의 영향인지에 대한 후속 연구가 필요할 것으로 사료된다.
산양삼 추출물이 조골세포에서 골 형성 관련 유전자 발현에 미치는 영향
전 조골세포(pre-osteoblast)에서 성숙 조골세포(mature osteoblast)로 가는 초기 과정의 분화 인자로는 당단백 효소인 ALP가 있으며, 조골세포 분화 조절 인자인 osterix, Runx2 및 collagen I 등은 골 형성을 촉진시키며, 성숙 조골세포(mature osteoblast)에서 골세포(osteocyte)화 되는 과정에서는 골 형성 단백질인 Bone morphogenetic proteins (BMP), osteopontin (OPN), osteocalcin (OCN) 등의 세포 외 기질 단백질을 생성하여 골세포의 기질을 석회화 하는 것으로 알려져 있다(Delany and Canalis, 1998; Ju, 2008; Kim, 2014). Runx2와 osterix의 발현은 세포 분화 조절에 관련하며(Komori, 2006), collagen I (Tognarini et al., 2008)는 초기 분화 마커이고 OPN과 OCN은 후기 분화 마커이다(Ducy and Karsenty, 1998). 본 연구에서는 산양삼 추출물이 MC3T3-E1 조골세포에서 골 형성 관련 유전자 발현에 미치는 영향을 확인하기 위해 Runx2, ALP, OPN, OCN 등의 유전자를 정량 real-time PCR을 통해 분석하였고 그 결과는 Fig. 4에 나타내었다. 먼저 골형성 전사인자인 Runx2 유전자 발현에서는 대조군과 비교하여 모든 산양삼 추출물 처리군에서 농도 의존적이고 유의적으로 발현이 증가되었다. 더불어 조골세포는 세포막에 당단백효소인 ALP를 가지고 있는데, 이는 무기 인산을 운반하고 인산 칼슘의 침착을 도와주며 세포외 기질이 석회화할 수 있는 조건을 만들어주어 조골세포의 분화에 관여하는 것으로 알려져 있다(BeIIow et al., 1991; de Bernard et al., 1986). ALP 유전자 발현에서는 모든 산양삼 추출물 처리군이 대조군과 비교하여 유의적으로 높은 발현 양상을 보였으며, 특히 산양삼 추출물 50 ㎍/mL 농도 처리군에서 가장 높은 발현량을 나타내었다. 후기 분화 마커인 OPN과 OCN은 골세포의 분화가 이루어짐에 따라 발현이 증가하여 조골세포의 석회화를 촉진하고 골의 세포외 기질 안에 축적되거나 합성된 일부가 혈중으로 방출되기도 한다(Ganss et al., 1999). OPN 유전자 발현은 ALP 유전자 발현의 양상과 유사하며 대조군과 비교하여 산양삼 추출물 50 ㎍/mL 농도 처리군에서 유의적으로 발현이 증가되었다. OCN은 골이나 상아질 및 석회화된 연골에서 발현되는 특이적인 유전자(Zheng, 2014)로 본 실험결과에서는 대조군과 비교하여 모든 산양삼 추출물 처리군에서 농도 의존적이고 유의적으로 발현이 증가되었다. 따라서 본 연구에서는 산양삼 추출물이 조골세포의 골 형성 관련 유전자인 Runx2, ALP, OPN, OCN 발현을 증가시켜 조골세포의 분화를 촉진하고, 골 석회화 형성 촉진에 기여하였을 것으로 사료된다. 그러나 산양삼 추출물이 골형성과 관련하여 어떠한 기전으로 유전자의 발현을 조절하였는지에 대한 유전자 및 단백질 수준의 추가적인 연구가 필요할 것으로 사료된다.
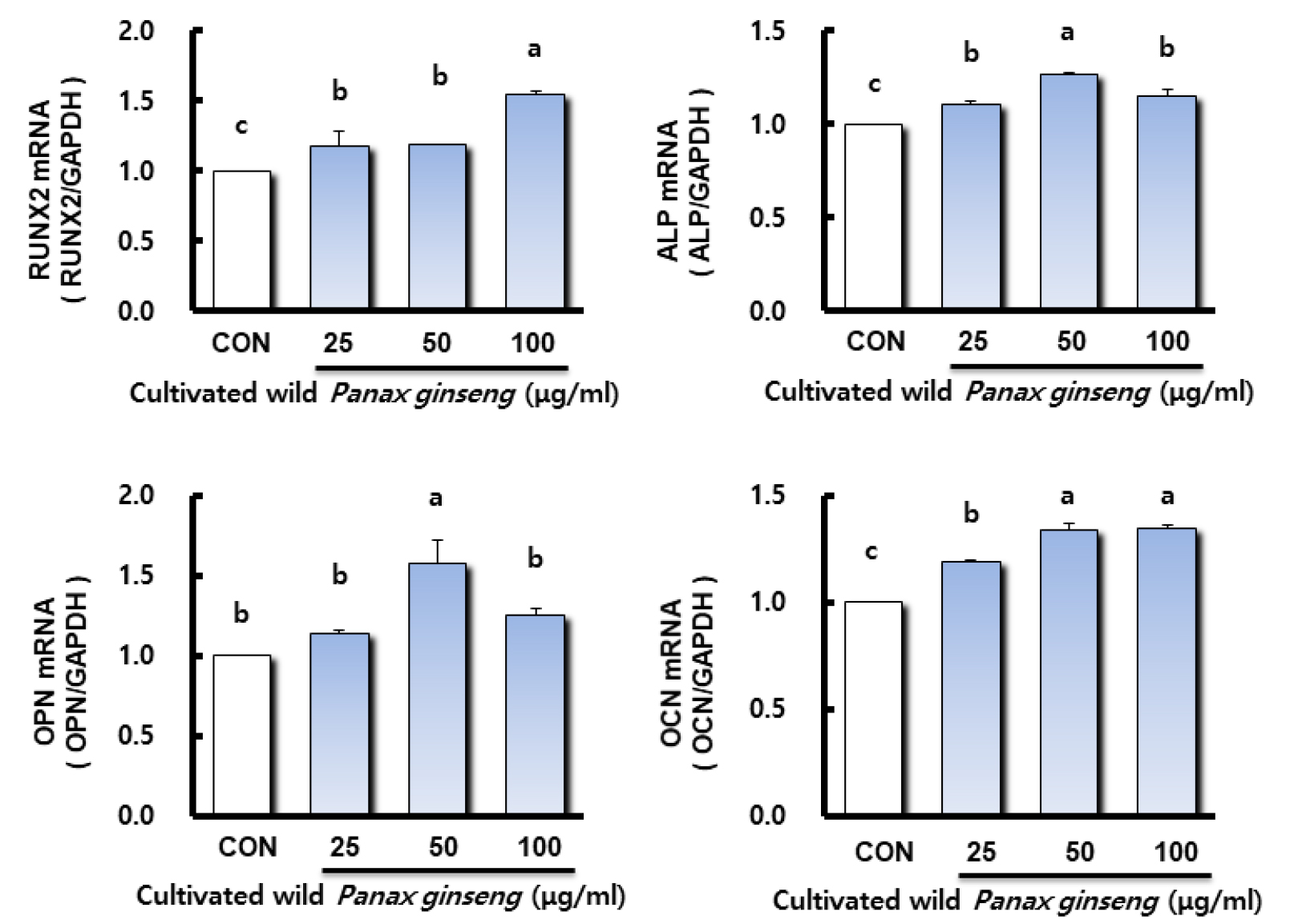
Fig. 4.
Effect of cultivated wild Panax ginseng on the expression of bone-related genes in osteoblastic-like MC3T3-E1 cells. Results are reported as fold change or relative quantification of target mRNA expression, normalized to an endogenous control (GAPDH). Different letter superscripts mean significantly different CWP concentration as analyzed by one-way ANOVA, Tukey test (p < 0.05).
적요
고령사회에서 노년기 건강의 큰 문제로 대두되고 있는 골다공증은 특히 폐경 후 여성들에게서 가장 그 발생빈도가 높게 나타났으며, 현재 골다공증 예방 및 치료에 사용되고 있는 약제는 대부분 골흡수 억제제로써 진행된 골소실을 회복 시킬 수는 없기 때문에 골형성 증가를 통한 골다공증 예방과 치료에 관한 연구가 활발히 이루어지고 있다. 산양삼(cultivated wild Panax ginseng, CWP)에 대한 연구는 다수가 원기회복, 자양강장 및 면역증강 효과 등에 대한 것이나 골대사에 미치는 영향에 대한 연구는 거의 없는 실정이다. 이에 본 연구에서는 산양삼 추출물이 조골세포에서 골관련 유전자 발현에 미치는 영향을 확인함으로써 골다공증 예방 및 치료 효과를 갖는 천연 소재로의 활용 가능성을 검토하고자 하였다. 산양삼 추출물 처리가 조골 세포의 증식에 미치는 영향을 알아보기 위해 MTT assay를 실시하였고, MC3T3-E1 세포생존률은 FBS가 첨가되지 않은 배양액만 처리한 대조군과 산양삼 추출물을 처리한 실험군 모두에서 동일한 수준으로 나타났으며 이로써 산양삼 추출물의 안전성을 확인할 수 있었다. 또한 산양삼 추출물을 처리한 실험군과 대조군과의 세포증식률을 비교하였을 때 산양삼 추출물 50 ㎍/mL 농도 처리군에서 유의적으로 세포증식이 촉진되었으며 25 ㎍/mL과 100 ㎍/mL 농도 처리군에서도 대조군보다 높은 경향을 나타내었다. 산양삼 추출물이 조골 세포의 활성에 미치는 영향을 알아보기 위해 조골세포의 분화초기 표지인자인 ALP 활성을 측정하였으며 그 결과 모든 산양삼 추출물 처리군이 대조군과 비교하여 유의적으로 높은 활성을 나타내었으며 특히 산양삼 추출물 50 ㎍/mL 농도 처리군에서 가장 높은 활성을 나타내었다. 산양삼 추출물의 농도에 따른 석회화 형성도를 확인하기 위해 무기질화된 세포의 기질을 alizarin red로 염색하였고 산양삼 추출물을 처리한 실험군과 대조군과의 석회화 형성도를 비교하였을 때 산양삼 추출물 50 ㎍/mL 농도 처리군에서 유의적으로 석회화 형성이 촉진되었으며 25 ㎍/mL과 100 ㎍/mL 농도 처리군에서도 대조군보다 높은 경향을 나타내었다. 산양삼 추출물이 MC3T3-E1 조골세포에서 골 형성 관련 유전자 발현에 미치는 영향을 확인하기 위해 Runx2, ALP, OPN, OCN 등의 유전자를 정량 real-time PCR을 통해 분석하였으며 대조군과 비교하여 모든 산양삼 추출물 처리군에서 농도 의존적이고 유의적으로 골 형성 관련 유전자발현이 증가되었다. 따라서 산양삼 추출물이 골 형성 관련 유전자인 Runx2, ALP, OPN, OCN 발현을 증가시켜 MC3T3-E1 조골세포의 분화를 촉진하고, 골 석회화 형성 촉진에 기여하였을 것으로 사료된다. 그러나 산양삼 추출물이 골형성과 관련하여 어떠한 기전으로 유전자의 발현을 조절하였는지에 대한 유전자 및 단백질 수준의 추가적인 연구와 산양삼 추출물의 분화 촉진과 석회화 형성능이 산양삼의 사포닌계 진세노사이드 성분의 영향인지에 대한 후속 연구가 필요할 것으로 사료된다.