서 언
재료 및 방법
실험재료 및 추출물 조제
Ultra-performance liquid chromatography (UPLC-Q-TOF-MS) 분석
세포배양 및 MTT assay
DNA flow cytometry 분석
환원력과 DPPH 라디칼 소거 활성 측정
Reactive oxygen species (ROS) 생성 측정
Malondialdehyde (MDA) 함량 측정
Glutathione (GSH) 함량 측정
간 기능 지표효소 AST 및 ALT 활성 측정
통계 처리
결과 및 고찰
추출물 조제 및 UPLC-Q-TOF-MS 분석
세포생존에 미치는 AJL 및 EtOH의 영향
AJL의 DPPH radical 및 ABTS radical 소거활성
AJL에 대한 ROS 생성 억제 효과
MDA 및 GSH 조절에 미치는 영향
AST 및 ALT 활성에 미치는 영향
적 요
서 언
과도한 알코올 섭취는 간염, 간경변, 지방간 및 간암과 같은 간질환과 연관성이 있다고 보고되어져 있다. 알코올은 주로 간세포에서 대사되므로 간은 체내 알코올 대사의 주요한 장소이며, 체내에서 알코올은 알코올 탈수소효소인 alcohol dehydrogenase (ADH)에 의해 간에서 산화되어 아세트알데히드가 되고 다시 aldehyde dehydrogenase (ALDH)에 의해 산화되어 acetic acid로 되며 일부는 뇨나 CO2로 배설된다(Hwang et al., 2004; Lin and Li, 1998; Williams and Ding, 2020). 알코올의 간에서의 대사과정은 주로 ADH, cytochrome P450-2E1 (CYP2E1), catalase (CAT) 3가지 효소계에 의한 산화경로를 통해 이루어진다(Cederbaum, 2012; Contreras-Zentella et al., 2022). 이런 알코올 대사는 CYP2E1, aldehyde oxidase 등을 유도하며 생체 내 활성산소종(reactive oxygen species, ROS)을 생성함으로써 생체 내 산화적 스트레스를 유발한다(Cederbaum, 2013; Lu and Cederbaum, 2008; Wu et al., 2006). 유발된 산화적 스트레스는 면역반응을 유도하거나 간 내 여러 세포에서 염증반응을 유발하여 간 손상을 초래하며 항산화 방어 시스템의 균형이 깨져 다양산 메커니즘을 통해 세포손상을 유발하고 각종 질환이 발생하게 된다(Li et al. 2015; Park et al., 2015).
항산화 방어 시스템은 세포보호에 필수적이며, 활성산소를 제거하기 위해 세포 내에서는 catalase (CAT), glutathione peroxidase (GPx), superoxide dismutase (SOD), glutathione reductase (GR) 등 항산화 효소와 glutathione (GSH) 등과 같은 비효소적 항산화 물질들이 작용한다. 또한 세포내 산화-환원 균형을 위한 핵심 전사조절인자 중 하나인 Nuclear factor E2-related factor 2 (Nrf2)는 phase II 해독, 항산화효소를 암호화하는 세포 보호 유전자의 발현을 조절하고 산화적 스트레스가 발생할 경우 활성 친전자체(reactiv electrophiles)를 중화시킴으로써 항산화의 역할을 담당하며, antioxidant response element (ARE)에 결합하여 NAD(P)H: quinine oxidoreductase 1 (NQO1), hemeoxygenase 1 (HO-1), glutathione reductase 등 항산화 효소들의 발현을 증가시킨다(Alharbi et al., 2022; Haque et al., 2020; Jaganjac et al., 2020).
오리나무(Alnus japonica)는 자작나무과(Betulaceae)에 속하는 낙엽 교목으로 우리나라 중부 이북의 해발 200-900 m 지역에 주로 분포하고 있으며 꽃은 취산화서이다. 한방에서는 오리나무 수피를 적양(赤楊)이라고 부르며, 해열, 지혈, 수렴 등의 효능이 있어 오래전부터 장염, 설사, 외상출혈, 혈변 등의 치료에 사용해왔고 민간에서는 숙취해소에 사용하였다(An et al., 1999; Lee et al., 2018). 오리나무에는 lupenon, β-amylin, glutenol, taraxerol, betulinic acid 등 여러 종류의 triterpenoid 외에 β-sitosterol, heptacosane, 지방족 alcohol, pyrocatechol 계열 tannin과 pillioin, salvigenin 및 5-hydroxy-4', 7-dimethoxyflavone 등의 flavonoids 화합물이 포함되어 있으며(Buitelaar et al., 1991; Kim et al., 2005; Kuroyanagi et al., 2005; Lee et al., 1992; Na et al., 2012; Wada et al., 1998), 오리나무 수피 및 목본류에서 항암 효과(Stevic et al., 2010), 항산화효과(Kim et al., 2004; Lee et al., 2000b) 항염효과(Lee et al., 2000a) 등에 관한 생리활성 연구가 보고되었지만 오리나무 잎 추출물에 대한 알콜성 간 질환 예방에 관한 연구는 미비한 실정이다.
따라서 본 연구에서는 오리나무 잎(Alnus japonica leaf, AJL) 추출물이 알코올로 유발된 간손상 모델 HepG2/2E1 세포에서 항산화 및 간보호 효과를 조사하여 유의적인 결과를 얻었기에 이를 보고하는 바 이다.
재료 및 방법
실험재료 및 추출물 조제
본 실험에 사용한 오리나무 잎(Alnus japonica Leaf, AJL) 시료는 ㈜청명약초(충북 충주시 양성면)에서 파쇄된 상태로 구입하였다. 오리나무 잎 열수추출물(water extracts of Alnus japonica leaf)을 얻기 위하여 시료 무게의 10배에 해당하는 증류수로 100℃에서 3시간 동안 추출하였다. 열수 추출물을 여과지(Whatman No. 3 filter paper, Whatman International Ltd., Maidstone, England)로 여과한 후 용매를 Rotary evaporator (Eyela, A-1000, Tokyo Rikakikai Co., Tokyo, Japan)를 이용하여 농축하고, 각 농축물은 동결 건조하여 분말화시켰으며, AJL 추출물의 수율은 13.6%였다. 이후 열수추출물은 멸균 증류수에 100 mg/mL의 농도로 녹이고, MinisartⓇ Syringe filter (0.2 ㎛, Sartorius AG, Weender Landstr. Germany)로 거른 후 -20℃에서 보관하며 실험에 따라 적절하게 희석하여 사용하였다.
Ultra-performance liquid chromatography (UPLC-Q-TOF-MS) 분석
AJL 분석을 위하여 메탄올로 용해시켜 10 ㎎/mL로 샘플을 제조하였다. UPLC 분석 장비는 Waters ACQUIY UPLC system (Waters, Corporation, Milford, MA, USA)이며 BEH C18 컬럼(2.1 × 50 ㎜ ; 1.7 ㎛)을 사용하였다. 시료 주입량은 1 μL로 설정하였고, 0.1% 포름산을 첨가한 물(A)과 아세토니트릴(B)의 두 용매에 기울기를 주어(B용액:5-30%, in 25 min) 0.3 mL/min의 유속으로 실험하였다. Mass 분석 장비는 waters Xevo G2-XS Q-TOF-MS이며, 컬럼에서 분리되어 나온 대사 물질들은 ESI Negative 모드로 분석하였다. Capillary 및 sampling cone의 전압은 3 kV 및 40 V로 설정하였으며, 이온 소스와 desolvation 온도는 각각 100℃ 와 350℃로 설정하였다. MS 데이터는 0.5 s의 scan으로 m/z 50-1500 범위에서 수집되었다.
세포배양 및 MTT assay
본 실험에 이용한 HepG2/2E1 세포는 인간 간암세포주 HepG2 세포에 CYP2E1 (origin: human)을 transfection시켜 만들었다. 세포배양은 10% fetal bovine serum (FBS, Gibco BRL, Gaithersburg, MD, USA)과 0.5% (V/V)의 antibiotics (100 U/mL of penicillin A and 100 U/mL of streptomycin)를 첨가한 MEM 배지를 사용하여 37℃, 5% CO2 조건에서 배양하였다. AJL 처리에 따른 세포생존율 정도를 측정하기 위하여 6-well plate에 HepG2/2E1 세포를 well당 3 × 105개를 분주하고 AJL을 적정 농도로 처리하여 배양하였다. 그 후 후 3-[4,5-dimethylthiazol-2-yl]-2,5 diphenyl tetrazolium bromide (MTT) 시약을 0.5 mg/mL 농도가 되게 처리하여 3시간 동안 배양하고, 배지를 제거한 후 DMSO를 2 mL 씩 분주하여 생성된 formazan을 모두 녹인 후 ELISA reader (Molecular Devices, Sunnyvale, CA, USA)로 540 nm에서 흡광도를 측정하였다.
DNA flow cytometry 분석
AJL이 유발하는 세포사멸 정도를 정량적으로 분석하기 위하여 정상 및 AJL이 24시간 동안 처리된 세포들을 모은 다음 원심분리하여 상층액을 제거한 후 PBS를 이용하여 세척하였다. 준비된 세포를 10 mM HEPES/NaOH, pH 7.4, 140 mM NaCl and 2.5 mM CaCl2가 포함된 annexin V binding buffer (Becton Dickinson, San Jose, CA, USA)에 부유시킨 다음 annexin V-FITC 및 propidium iodide (PI, Becton Dickinson)를 처리하여 암실에서 20분 동안 반응을 시켰다. 반응시킨 세포를 35-㎜ mesh를 이용하여 단일세포로 분리한 후 DNA flow cytometer (FACSCalibur, Becton Dickinson, San Jose, CA, USA)에 적용시켜 세포사멸이 유발된 세포(V+/PI-)를 형광반응에 따라 측정한 후 CellQuest software 및 ModiFit LT 프로그램을 이용하여 분석하였다.
환원력과 DPPH 라디칼 소거 활성 측정
2,2-diphenyl-1-picrylhydrazyl (DPPH) 라디칼 소거 활성은(Cheel et al., 2005)의 방법을 응용하여 측정하였다. 농도별로 희석된 AJL (20, 40, 80 ㎍/mL)을 각각 100 μL씩취하여 DPPH radical (in MeOH, 0.2 mM) solution (100 μL)과 1:1 비율로 혼합하였다. 혼합물을 잘 섞어준 다음 암실에서 실온으로 30분 동안 방치하였다. 이후 Cytation-3 microplate reader로 517 ㎚에서 흡광도를 측정하였다.
AJL의 환원력(reducing power)은 Yen and Chen (1995)의 방법을 응용하여 측정하였다. AJL (20, 40, 80 ㎍/mL)을 phosphate buffer (0.1 M, pH 6.6)에 용해시키고, 1% potassium ferricyanide (50 mL, 0.5 g)에 첨가하였다. 50℃에서 30분 동안 incubation 한 후, 10% trichloroacetic acid (50 mL, 5 g)를 첨가하였다. 이후 100 μL 상층액을 증류수(100 μL) 및 0.1% ferric chloride (10 mL, 0.01 g)와 혼합하여 Cytation-3 microplate reader (Biotek, Shoreline, WA, USA)로 700 ㎚에서 흡광도를 측정하였다.
환원력과 DPPH 라디칼 소거 활성 측정의 실험에서 positive control은 ascorbic acid (1000 ㎍/mL)를 사용하였다.
Reactive oxygen species (ROS) 생성 측정
세포 내 ROS 생성의 정도를 확인하기 위하여 준비된 세포들을 PBS에 수세 후 fluorescent probe인 2',7'-dichlorodihydrofluorescein diacetate (DCF-DA, Molecular Probes, Leiden, Netherlands) 10 μM로 20분간 염색 후 flow cytometry를 사용하여 ROS 생성의 정도를 평가하였으며, positive control은 silymarin (100 μM)을 사용하였다.
Malondialdehyde (MDA) 함량 측정
HepG2/2E1 세포 내 MDA 생성량은 가장 널리 알려진 thiobarbituric acid (TBA) 방법으로 측정하였다(Bueqe and Aust, 1978). 세포를 6-well plate에 3 × 105 cells/well 농도로 분주하고 24시간 배양 후 AJL 및 positive control로 silymarin (100 μM)을 FBS가 없는 배지에 일정 농도로 희석한 후 1시간 동안 배양하였다. 이후 EtOH를 3% 농도로 첨가하여 1시간 배양하였다. 세포를 PBS로 세척하고 0.1 M의 potassium phosphate buffer (pH 7)를 증류수에 2배 희석한 용액에 세포를 모은 후 Vibra-Cell VCX 750 sonicator (Sonic & Materials, Inc., Newtown, CT, USA)를 사용하여 세포를 10초간 방치하여 용해시켰다. 세포 용해물은 4℃, 10,000 × g 조건에서 5분간 원심분리하고 상등액은 즉시 MDA 함량 분석에 사용하였다. 세포용해물 200 μL에 TBA solution (TBA 0.375%, trichloroacetic acid 15%, HCl 0.25 N) 200 μL를 첨가한 후 15분간 수욕상에서 가열하였다. 가열한 세포용해물은 다시 13,000 × g에서 5분간 원심분리한 후 535 nm에서 상등액의 흡광도를 측정하여 MDA 검량 표준 곡선에 의거하여 계산하였다. 각 농도는 nmol/mg protein으로 나타내었다.
Glutathione (GSH) 함량 측정
GSH 함량은 Microtiter plate assay의 변형된 방법에 따라 측정하였다(Baker et al., 1990). Malondialdehyde (MDA) 함량 측정에서 제시한 방법으로 세포 용해물을 확보하였으며, 4℃, 10,000 × g 조건에서 5분간 원심분리하고 상등액은 즉시 GSH 함량 분석에 사용하였다. 단백질을 침전시키기 위해 5% sulfosalicylic acid 20 μL와 세포용해물 180 μL를 첨가한 후 4℃, 10,000 × g 조건에서 5분간 원심분리하였다. 원심분리 후 상등액 20 μL와 3 mM 5,5'-dithiobis (2-nitrobenzoic acid) (DTNB), 400 units/mL glutathione reductase가 포함된 반응 혼합물 150 μL를 10분간 37℃에서 반응시킨 다음 2.5 mM NADPH 50 μL를 첨가하여 microplate reader를 사용하여 412 nm에서 10분 동안 20초 간격으로 흡광도를 측정하였다. GSH의 농도는 표준곡선을 이용하여 계산하였으며, 각 농도는 nmol/mg protein으로 나타내었다.
간 기능 지표효소 AST 및 ALT 활성 측정
Aspartate aminotransaminase (AST) 및 alanine aminotransferase (ALT)의 수준은 제조업체(Biovision, CA, USA)의 지침에 따라 시판되는 분석 키트를 사용하여 측정하였다.
통계 처리
본 연구의 모든 실험결과는 3회 실시한 독립적인 실험을 통해 얻은 값을 평균 ± 표준편차로 나타내었으며, Graph Pad Prism 6 (Graph Pad Software Inc., San Diego, CA, USA)을 이용하여 one-way analysis of variance (ANOVA) test 실시한 후 Tukey test로 사후 검증하여 유의적 차이를 판단하였다.
결과 및 고찰
추출물 조제 및 UPLC-Q-TOF-MS 분석
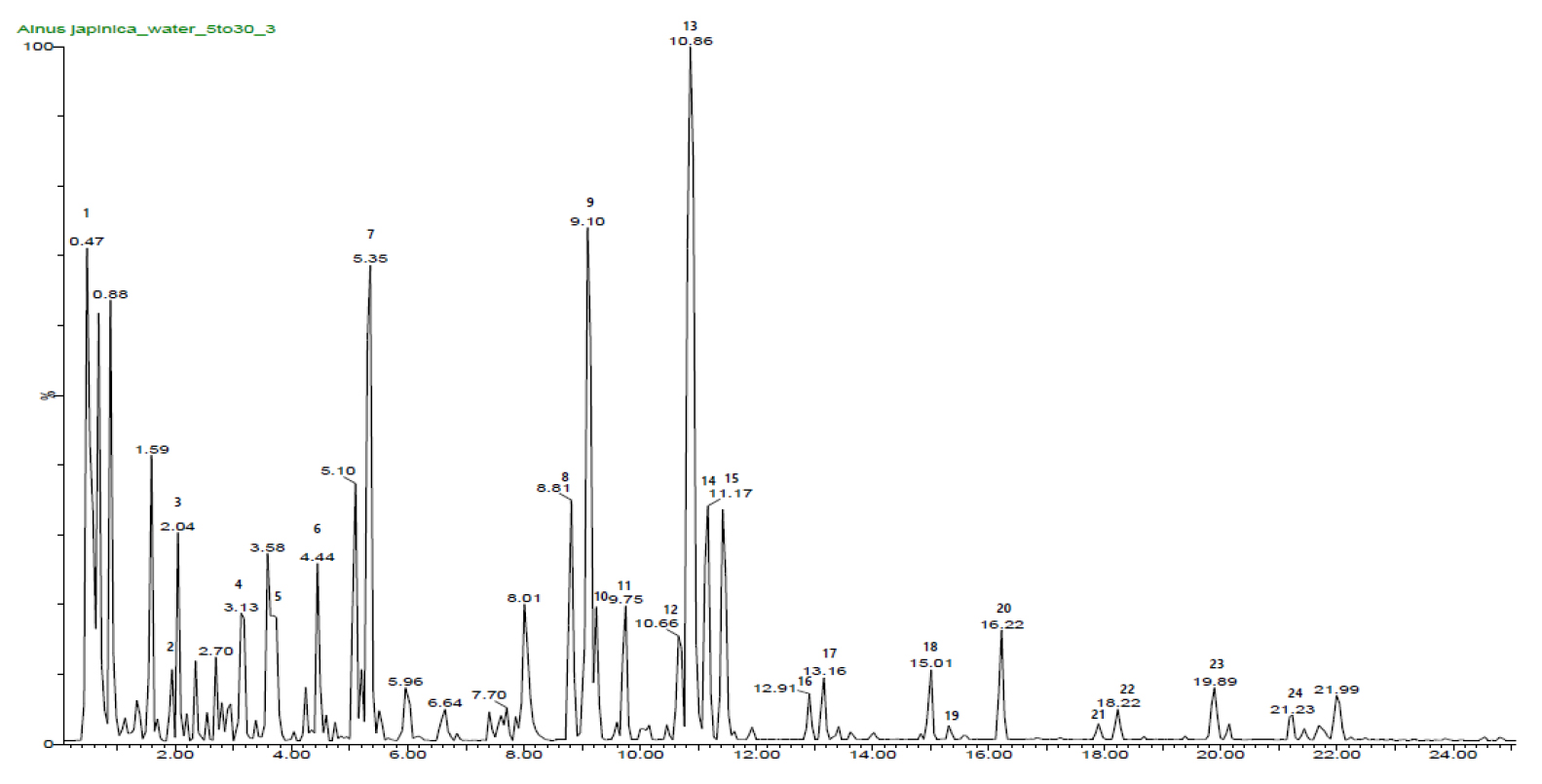
AJL을 얻기 위하여 시료 무게(50 g)의 10배에 해당하는 증류수로 100℃에서 3시간 동안 추출하였다. 열수추출물을 여과지로 여과한 후 용매를 Rotary evaporator를 이용하여 농축하고, 농축물은 동결 건조하여 분말화하였다. 열수추출 및 동결건조 결과 13.6%의 추출 수율로 본 실험에서 사용할 시료를 확보하였다. LC-MS 음이온 모드로 분석한 크로마토그램을 통하여 AJL의 성분을 확인하였다(Fig. 1 and Table 1). 데이터베이스와 고유 표준물질을 이용하여 24개의 성분을 분석하였다. 이들이 종류로는 quercetin 유도체(hyperoside, isoquercetin 등), qunic acid 유도체(chlorogenic acid, neochlorogenic acid 등), diarylheptanoids (oregonin, rubranol, alnuside A, B, C 등) 화합물이 포함되어 있는 것을 알 수 있었다. 오리나무 수피 및 목본류에서 항암, 항산화, 항염효과 등에 관한 생리활성 연구가 보고되었지만 오리나무 잎 추출물에 대한 알콜성 간 질환 예방에 관한 연구는 미비한 실정이다. 이에 본 연구에서는 오리나무 잎 추출물이 알코올로 유발된 간손상 모델 HepG2/2E1 세포에서 항산화 및 간보호 효과에 대한 분자생물학적 기전에 대해 연구를 수행하였다.
Table 1.
UPLC-Q-TOF-MS analysis of the major compounds in AJL.
세포생존에 미치는 AJL 및 EtOH의 영향
AJL 및 EtOH 처리에 따른 HepG2/2E1 세포의 생존에 영향을 미치는지를 확인하기 위하여 20, 40, 80 ㎍/mL 농도의 AJL 및 positive control로 silymarin (100 μM)을 1시간 동안 처리한 후 3% EtOH를 24시간 동안 처리하였다. 그리고 MTT assay로 세포 생존율 을 분석한 결과 본 실험에 사용한 농도의 범위에서는 세포 독성이 나타나지 않는 것을 확인할 수 있었다(Fig. 2A). 아울러 각각의 AJL (80 ㎍/mL), silymarin (100 μM) 및 EtOH (3%) 처리에 의한 정량적인 세포생존율을 확인하기 위하여 annexin V-FITC/PI 염색을 통하여 DNA flow cytometry 분석을 실시하였다. Fig. 2B에 나타난 바와 같이 정상배지에서 자란 세포의 사멸 빈도는 약 10.6% 정도였지만 EtOH 처리에 따라 세포사멸 빈도가 약 60.8% 증가하였으며, AJL 80 ㎍/mL및 silymarin 100 μM 처리군에서는 각각 약 21.6% 및 약 12.5%로 정상군과 유사하게 세포사멸이 회복되는 것을 확인할 수 있었다. 따라서 EtOH로 유발된 간 세포 사멸이 AJL 처리로 간 세포 보호 효과가 있음을 알 수 있었으며, 이후 실험조건으로 설정하여 진행하였다(Fig. 2B).
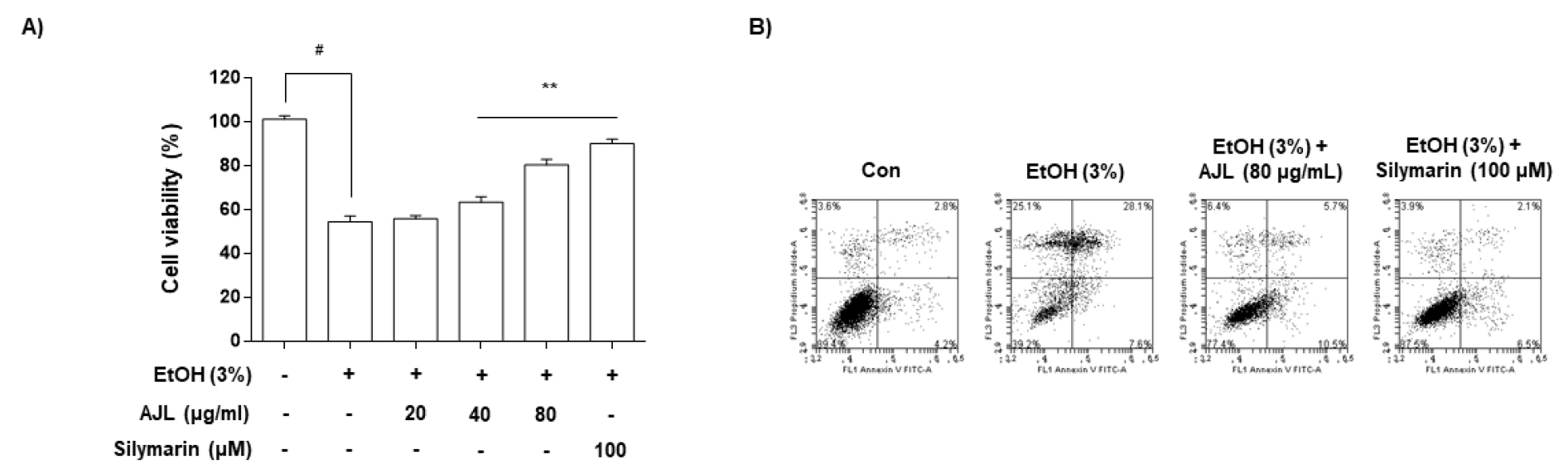
Fig. 2.
Effects of AJL and EtOH on the cell viability of HepG2/2E1 cells. (A) The cells were treated with the indicated concentrations of AJL alone or pretreated with AJE for 1 h before EtOH (3%) treatment. After 24 h, cell viability was assessed using an MTT assay. Each value is presented as the mean ± SD and is representative of the results obtained from three independent experiments. The significance was determined by the Student’s t-test (#p < 0.05, compared with control group; **p < 0.01, compared with EtOH); (B) To quantify the degree of apoptotic cells, the cells were collected and stained with FITC-conjugated Annexin V and PI for DNA flow cytometry analysis. Silymarin (100 μM) was used as a positive control.
AJL의 DPPH radical 및 ABTS radical 소거활성
AJL의 항산화 기능을 검증하기 위하여 AJL의 농도별 DPPH radical 및 ABTS radical 소거활성을 측정하였다. 본 실험에서 positive control로 사용된 ascorbic acid는 1000 ㎍/mL 농도에서 각각 DPPH 81.64% 및 ABTS 90.82%로 라디칼 소거능이 보였으며, AJL의 농도가 증가함에 따라 DPPH radical 소거능이 증가함을 관찰하였고, 최고 농도인 80 ㎍/mL에서 부터 ascorbic aicd와 유사하게 약 70.62% DPPH radical 소거능이 확인되었다(Fig. 3A). ABTS radical 소거능은 Fe3+/ferric cyanide 복합체가 ferrous 형태로 환원시키며, 700 ㎚에서 Perl의 Prussian blue 형성을 측정하여 그 농도를 확인할 수 있다. Fe3+를 Fe2+로 환원시키는 AJL의 ABTS radical 소거능을 이전과 동일하게 ascorbic acid를 positive control로 사용하여 평가하였다. ABTS radical 소거능은 AJL의 다양한 농도에 걸쳐 용량 의존적으로 증가함을 나타내었으며, 80 ㎍/mL의 AJL은 ascorbic aicd 대비 약 67.46%의 소거능을 나타내었다(Fig. 3B). 이상의 AJL 처리에 따른 항산화 효능은 기존에 보고된 오리나무 출출물의 항산화 효능(Kim et al., 2004; Lee et al., 2000b)과 비교하였을때 IC50에서 각각의 DPPH 및 ABTS의 결과와 유사한 농도에서 효능이 관찰되었다.
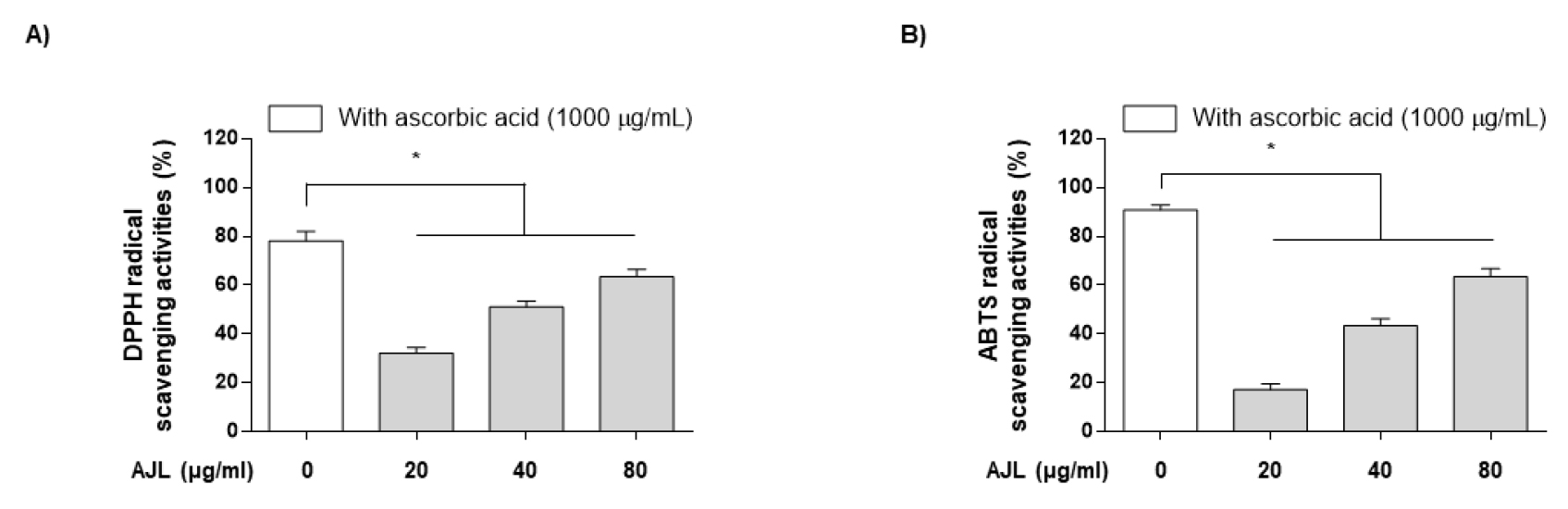
Fig. 3.
Antioxidant (DPPH and ABTS) activities of Alnus japonica leaf (AJL). (A) DPPH free radical-scavenging activity and (B) ABTS of AJL obtained with bioprotease in an in vitro cell-free experiments. Each value is presented as the mean ± SD and is representative of the results obtained from three independent experiments. The significance was determined by the Student’s t-test (*p < 0.05, compared with control).
AJL에 대한 ROS 생성 억제 효과
산화적 스트레스에 의해 발생하는 ROS 생성에 AJL의 효과를 알아보기 위해 HepG2/2E1 세포에 3% EtOH로 산화적 스트레스를 유도한 뒤 DCFH-DA를 이용하여 ROS의 생성량을 측정하였다. Fig. 4에서 나타낸 것처럼 3% 에탄올을 처리하여 산화적 스트레스가 유도된 세포는 정상세포에 비해 ROS의 생성이 약 26.6% 빠르게 증가되었으며, AJL 전처리한 세포는 ROS 생성이 농도 의존적으로 억제되는 결과를 보여주었으며, positive control로 사용된 silymarin에서도 약 3.8%로 정상군과 유사하게 억제됨을 확인할 수 있었다(Fig. 4A). 이러한 ROS 생성 억제 결과는 HepG2/2E1 세포에서 알코올이 대사되는 동안 생성된 자유라디칼이 AJL에 의해 제거되는 것으로 사료되어진다.
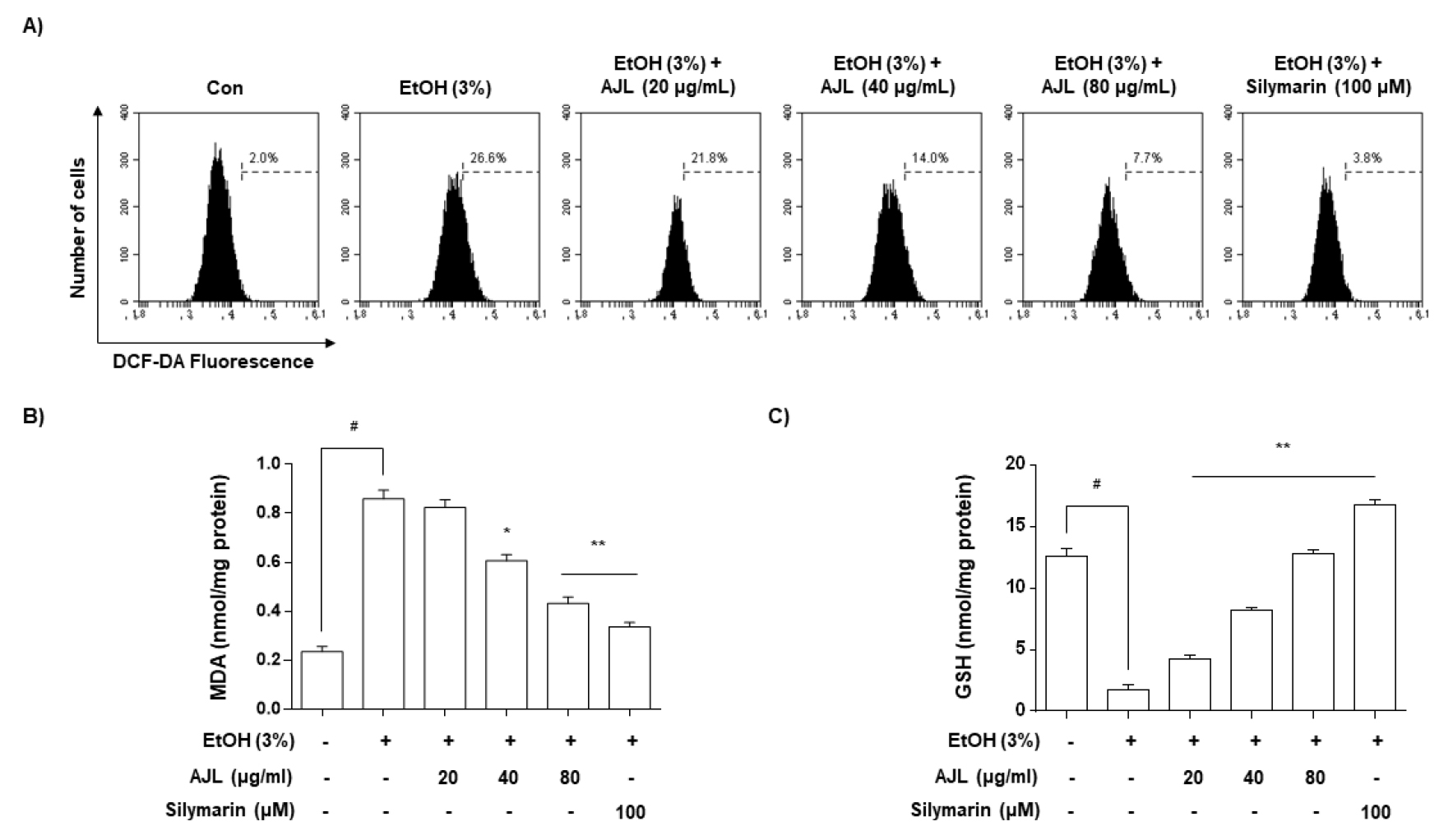
Fig. 4.
Inhibitory effects of AJL on EtOH-induced ROS generation in HepG2/2E1 cells. (A) ROS generation was detected using a DCF-DA probe and quantified by flow cytometry; (B) Cellular lipid peroxidation was determined by the levels of MDA; (C) Cellular GSH levels were determined by DTNB-GSSG reductase recycling assay; Each value is presented as the mean ± SD and is representative of the results obtained from three independent experiments. The significance was determined by the Student’s t-test (#p < 0.05, compared with control group; *p < 0.05 and **p < 0.01, compared with EtOH). Silymarin (100 μM) was used as a positive control.
MDA 및 GSH 조절에 미치는 영향
MDA는 지질과산화물의 대표적인 성분의 하나로 지질산화의 지표로 사용된다(Janero, 1990). AJL 처리에 따른 지질과산화 억제 활성을 알아보기 위해 HepG2/2E1 세포의 MDA 농도를 측정한 결과, 정상군 세포에서는 0.24 nmol/mg protein으로 나타났으며, 3% EtOH 처리시 0.89 nmol/mg protein으로 증가되는 것을 확인할수 있었다(Fig. 4B). 이에 AJL 20, 40, 80 ㎍/mL의 농도로 처리한 결과 지질과산화 반응이 농도 의존적으로 억제되어 세포의 MDA 농도가 감소하는 경향이 나타났다. 특히 AJL은 최고 농도인 80 ㎍/mL 농도에서 positive control인 silymarin과 유사한 정도의 MDA 생성 억제 효과를 확인할 수 있었다(Fig. 4B).
GSH는 간에서 만들어지는 아미노산의 일종으로 산화적 손상을 보호하는데 중추적인 역할을 하는 매우 강력한 항산화 물질이며 항산화 활성을 측정하기 위한 지표로 사용된다(Wu et al., 2004). AJL의 간 세포 보호효과를 포함한 항산화 기전을 더 명확히 밝히기 위해 세포 내 GSH의 변화를 측정하였다(Fig. 4C). HepG2/2E1 세포에 3% EtOH를 단독으로 처리하여 산화적 스트레스를 유도한 세포에서 GSH의 농도는 정상군에 비해 현저하게 감소하였다. 그러나 AJL 20, 40, 80 ㎍/mL의 농도로 전처리한 후 세포에 3% EtOH를 처리한 결과 세포의 GSH의 함량은 AJL 농도에 비례하여 증가하는 결과를 보였다. 이러한 결과는 AJL 처리에 따라 외부로부터 산화적 스트레스 해소나 생체 내 자유라디칼을 제거하는 능력을 보유하고 있으며, H2O2와 지질과산화를 대사시키는 GSH-Px, GST에 전자공여체로 작용하여 세포 방어체계에 중요한 역할을 하는 GSH 작용에 영향을 미쳐 HepG2/2E1 세포의 구조 및 기능 유지에 도움을 주는 것으로 사료되어 진다.
AST 및 ALT 활성에 미치는 영향
간 기능 검사(Liver function test)는 간에서 생산 및 분비되거나 간손상에 의해 영향을 받는 효소나 단백질의 발현양을 측정하여 간 손상 혹은 이상여부를 발견하고 평가하는 방법으로서(Hoekstra et al., 2013; Kim, 2009) 대표적으로 아스파테이트 아미노전이효소(Aspartate Aminotransferase, AST)와 알라닌 아미노전이효소(Alanine Aminotransferase, ALT)의 발현 변화가 이용된다. AST는 아미노산과 α-케토글루타르산과 옥살로아세테이트 사이의 반응을 매개하고 전이 반응을 촉매하는 효소이며, ALT는 글루탐산의 아미노기를 알라닌으로 전이 반응을 촉매하는 효소로 알려져 있다. 또한 이 두 효소는 대부분 간에 주로 분포하고 특히 다양한 요인에 의해 간손상이 유발될 때, 두 효소의 발현이 급격히 증가되는 수치를 간손상 지표로 활용하고 있다(Sheth et al., 1998; Yang et al., 2012; Zhang et al., 2019).
본 연구에서는 AJL 처리에 따른 간손상 억제 효과를 확인하기 위해 AJL, silymarin 및 EtOH를 처리한 HepG2/2E1 세포의 배양액을 수거하여 세포가 분비한 AST와 ALT 활성을 측정하였다. Fig. 5에 나타난 바와 같이 AST 및 ALT 활성은 정상군과 비교할 때, EtOH 처리에 의한 간세포 손상은 각각 AST 8.42 U/L 및 7.72 U/L 증가가 관찰되었으며, AJL 20, 40, 80 ㎍/mL의 농도로 처리한 결과 AST 및 ALT 모두 농도 의존적으로 억제되어 간 세포의 손상이 개선되는 경향으로 나타났다. 특히 AJL 최고 농도인 80 ㎍/mL 농도에서 positive control인 silymarin과 유사한 수치로 간 손상을 막아주는 것을 확인할 수 있었다. 위 결과를 통해 EtOH 처리에 의해 유도된 간세포 손상이 AST 및 ALT 단백질의 발현 증가를 유도하며, AJL 처리에 의한 두 효소의 발현 감소는 간 손상에 대하여 간보호 및 간기능 개선 가능성을 기대할 수 있다. 모든 결과를 종합해 볼 때, AJL은 EtOH 처리에 의해 증가된 세포독성을 완화하였고, 간세포 보호능 및 간손상 억제 가능성을 제시하였다. 이상의 결과를 바탕으로 간손상 치료제 및 간기능 개선을 위한 건강기능식품 개발에 기초자료로 활용될 것이라 사료된다.
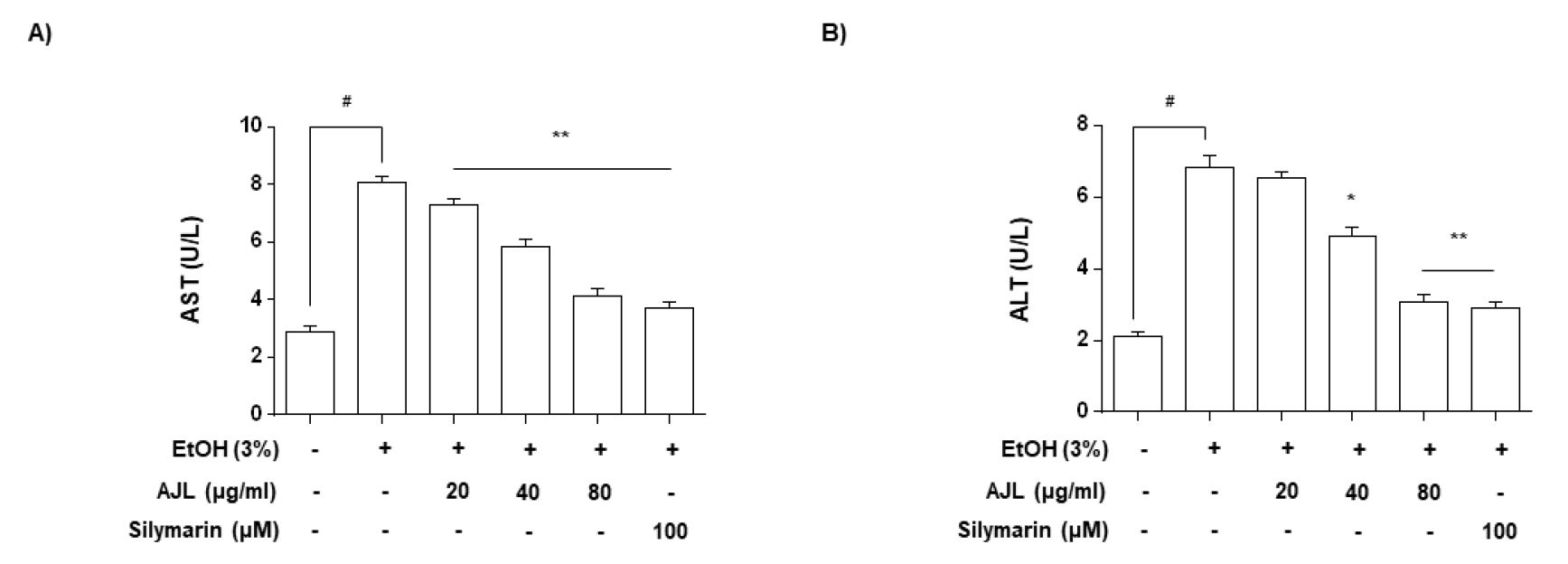
Fig. 5.
Effect of AJL on AST and ALT against EtOH-induced cell toxicity in HepG2/2E1 cells. (A) aspartate aminotransferase (AST) and (B) alanine aminotransferase (ALT) levels were measured using the colorimetric method. Each value is presented as the mean ± SD and is representative of the results obtained from three independent experiments. The significance was determined by the Student’s t-test (#p < 0.05, compared with control group; *p < 0.05 and **p < 0.01, compared with EtOH). Silymarin (100 μM) was used as a positive control.
적 요
활성산소종은 미토콘드리아 대사활동을 통해 생성되는 반응성이 강한 산소 함유 분자로서 특히 간에서 복잡한 세포 분자와 반응하여 산화적 스트레스를 유발하는 물질이다(Choi et al., 2012). 에탄올 대사 과정에서는 ROS가 생성되어 산화스트레스를 유발하며, 과도한 에탄올은 ROS를 제거하는 항산화 시스템을 억제함으로써 지방, 단백질 또는 DNA와 같은 생체 분자에 산화 손상을 유발하여 세포를 손상시킨다(Albano, 2006; Koch et al., 2004). 본 연구에서는 오리나무 잎 추출물(AJL)에서 알코올(EtOH)로 유발된 산화적 스트레스에 대한 간세포 손상의 보호 효과를 평가하기 위해 HepG2/2E1 세포에서 EtOH와 AJL 및 대조군 silymarin을 각각 처리한 후 세포생존율을 평가하고 세포독성이 없는 범위를 설정하여 활성산소종 생성량, 항산화 관련 지표(DPPH, ABTS, MDA, GSH) 및 간 손상 지표(AST 및 ALT)를 측정하였다. 알코올에 대한 간 보호 효과에서는 알코올만 처리한 군의 세포생존율이 53.8%로 감소하였으나 AJL을 함께 처리 군에서 세포생존율이 85.1%의 유의적인 증가로 간 보호 효과를 확인하였다. 다음으로 AJL에서 세포 내 ROS 생성 억제능은 에탄올 처리군에서 정상군에 비해 유의적으로 ROS 생성이 증가하였으나 AJL 농도별 처리시 정상군 수준으로 ROS 생성을 현저하게 감소시켰다. MDA 함량은 에탄올 처리군에서 무처리군에 비해 유의적으로 증가하였으나 AJL 처리시 농도 의존적으로 에탄올 처리군에 비해 유의적인 차이를 보이며 MDA 함량을 감소시켰다. GSH 함량은 에탄올 처리군에서 정상군보다 유의적으로 함량이 감소하였으나 AJL 농도별 처리군 모두 에탄올 처리군에 비해 GSH 함량을 증가시켰다. 또한 간손상 지표로 활용되는 AST 및 ALT 활성 변화 확인 시, 에탄올 처리에 따른 간세포 손상군에 비하여 AJL 처리군에서는 농도 의존적으로 현저하게 감소시켰으며, 대조군 silymarin과 비교하여 유사한 감소된 결과를 관찰하였다. 이상의 결과로부터 종합해 볼 때 AJL은 간손상에 대한 보호 및 간손상 억제 가능성을 기대할 수 있으며, 간기능 개선 효과에 대한 건강기능식품개발의 기초자료로서 활용될 수 있을 것이라 사료된다.