서 언
재료 및 방법
실험동물 및 시약
약재준비
대장염 유도
질병활성화정도(Disease activity index; DAI) 측정
Enzyme-linked immunosorbent (ELISA) assay
Western blot analysis
통계분석
결 과
DSS로 유도된 대장염 모델에서 체중감소에 대한 작약의 조절효과
DSS로 유도된 대장염 모델에서 대장 길이에 대한 작약의 조절효과
DSS로 유도된 대장염 모델에서 질병활성도(Disease activity index; DAI)증가에 대한 작약의 조절효과
대장 조직에서 염증매개 인자의 발현에 대한 작약의 조절 효과
고 찰
적 요
서 언
작약(Paeoniae radix)은 작약과(Paeoniaceae)에 속한 다년생 초본 약용식물로서 함박꽃(Paeonia lactiflora Pallas), 산작약(Paeonia obovata Max.) 또는 기타 동속 근연식물의 뿌리이다(Ministry of Food and Drug Safety, 2014; Oriental Medicine Pharmacology Textbook Compilation Committee, 2010). 꽃이 크고 한꺼번에 여러 송이가 피어서 함박꽃이라고 하며, 중국에서는 이 식물을 작(芍)이라고 부르고, 뿌리를 약(藥)으로 사용하기 때문에 작약(芍藥)이라고 한다(Bae, 2003).
한방에서는 진경, 진통, 수렴, 완화약으로 근육의 경련, 두통, 복통, 이질, 세균성감염 및 지한(止汗), 조경(調經) 등에 유효하며 특히 간(肝)에 작용하는데, 간(肝)의 기운을 부드럽게 하고 혈액을 보충한다. 작약의 약리 작용으로는 항알러지 및 항바이러스 효과(Ngan et al., 2015; Lee et al., 2008)와 뇌졸중의 후유증이나 동맥경화의 예방 및 치료, 항고지혈증에 관한 많은 연구가 보고되어 있으며(Park et al., 1999; Ro et al., 1997; Ji et al., 2002), 특히 유효성분인 paeonol은 파골세포 분화를 억제하여 골다공증의 예방 효과, 인지기능 향상 및 뇌경색에 대한 연구가 보고 되었다(Tsai et al., 2008; Zhong et al., 2009; Hsieh et al., 2006).
염증성 장질환(Inflammatory bowel disease)은 소화관에서 생기는 만성 염증질환으로 특히 궤양성 대장염은 결장과 직장에 염증이 만성적으로 나타나는 질환이다(Hyams, 2000; Danese et al., 2004). 궤양성 대장염은 국내에서는 드문 질환으로 인식되었으나 최근 서구화된 식생활, 스트레스 등의 다양한 원인으로 발병률이 증가하고 있다. 궤양성 대장염의 임상증상은 비정상적인 통증, 구토, 설사, 직장출혈, 몸무게 감소를 수반하며 조직병리학적인 관점에서는 염증, 직장길이 감소, 상처 부위에 염증세포의 침윤을 보인다(Hendrickson et al., 2002; Lichtenstein and Rutgeerts, 2010). 지금까지 발병원인은 정확히 밝혀지지 않았지만, 최근 규명된 병인을 보면, 흡연이나 식이와 같은 환경적 요인, 유전적 요인 또는 세균 감염 등이 원인으로 제시되고 있다. 이런 인자들은 단독 또는 복합적으로 관여할 수 있는데 특히, 유전학적 소인이 있는 사람은 원인 혹은 유발 인자에 노출되어 장 점막에 염증 및 면역반응이 초래되고 이 반응이 소멸되지 않고 비정상적으로 지속 증폭되어 만성적인 조직 손상을 일으키는 상태로 알려져 있다(Danese et al., 2004).
염증 매개인자들의 과도한 생성은 병리적 상태를 유발하여 패혈증 및 장기손상을 유도한다(Li et al., 2010; Agoff et al., 2000; Roberts et al., 2001). 염증매개인자와 궤양성 대장염과의 연관성이 보고되고 있는데, 즉 대장 조직에서의 염증인자의 증가는 다양한 세포의 분화와 증식에 영향을 주어 조직 손상을 초래 하는 것으로 추정되고 있다(Ishiguro et al., 2006). 특히 interleukin (IL)-6은 대표적인 염증성 사이토카인으로 대장염의 초기에 증가하여 호중구 및 면역세포를 염증부위로 모여들게 하여 만성 염증성 장질환을 지속시킨다(Rogler and Andus, 1998). 최근 궤양성 대장염 환자에서 염증성 사이토카인의 생성이 정상인에 비해 현저히 증가된다는 연구 결과가 보고되었다(Ogata and Hibi, 2003).
Cyclooxygenase (COX)는 prostaglandins (PGs)을 합성하는 효소로 염증, 면역조절 그리고 통증의 전달 등을 포함하는 다양한 생리적인 현상에 관여한다. cyclooxygenase (COX) 효소는 COX-1, COX-2 두 개의 isoenzyme이 존재하며, COX-1은 정상적인 위장관의 PGs 생산에 관여하여 점막 보호에 중요한 역할을 하는 것으로 알려져 있는 반면, COX-2는 사이토카인, 성장인자, 종양촉진자 등의 여러 자극에 의해 유도되며, 주로 조직에서 PGs를 생성하여 염증과 통증을 유발하는 것으로 보고되고 있다(Kawamori et al., 1998). 최근 대장염환자의 점막조직에서 COX-2의 발현이 증가되는 것이 보고되었다(Roberts et al., 2001). 따라서 대장조직의 염증인자 발현을 조절하는 천연물은 대장염 치료제 개발에 활용될 수 있는 소재로 사료된다.
현재 사용되는 궤양성 대장염 치료제로는 sulfasalazine, mesalazine 등의 aminosalicylate 제제, 스테로이드 제제가 있으나 이러한 약물들의 장기투여는 구토, 소화불량, 식욕부진, 두통뿐만 아니라 과민 반응에 의한 피부 발진, 발열, 췌장염, 간염, 용혈성 빈혈, 골수 억제 등의 심각한 부작용이 초래될 수 있다(Ishiguro et al., 2006). 따라서 궤양성 대장염에 대한 유효성과 안전성이 높은 천연물 유래 새로운 치료제 개발이 절실히 요구되고 있는 실정이다. 본 연구는 DSS (Dextran sulfate sodium)로 유도한 mouse 급성 대장염 모델에서 작약의 효능을 규명하여 궤양성 대장염 개선을 위한 기능성 소재로서의 가능성을 제시하고자 하였다.
재료 및 방법
실험동물 및 시약
실험동물은 수컷 7주령 BALB/c 마우스를 ㈜대한바이오링크(충북, 음성)로부터 공급받아 사용하였고 일주일간의 적응기간 이후 각 군당 7마리로 수용하였다. DSS (mol wt; 36,000- 50,000)는 MP 바이오메디컬(Solon, OH, USA)에서 구입하였다. COX-2와 GAPDH Ab는 Santa Cruz Biotechnology (Santa Cruz, CA, USA)에서 구입하였다. Anti-mouse IL-6 antibody (Ab), biotinylated anti-mouse IL-6 Ab, recombimant mouse (rm) IL-6는 pharmingen (Minneapolis, MN, USA)로부터 구입하였다. 이외의 다른 시약들은 Sigma Co. (Sigma-Aldrich, MO, USA)에서 구입하였다.
약재준비
실험에 사용한 작약은 주)휴먼허브(경산, 경북)에서 구입하였고, 준비된 약재를 증류수로 2회 세척한 뒤 건조하였다. 건조된 작약을 잘게 부순 후, 100 g의 약재를 1 L의 증류수를 가하여 100℃에서 2시간 열수추출을 시행하였다. 추출이 완료된 다음 여과지로 여과하고, 이를 동결건조기(Eyela, model FDU-2000, Japan)에서 건조한 뒤 얻어진 분말을 실험에 사용하였다(수득률 7.71%).
대장염 유도
급성 궤양성 대장염 유도를 위하여 7일 동안 5% (w/v)의 DDS를 포함한 물을 마우스에게 자유롭게 섭취하게 하였다. 마우스의 체중 감소 여부, 대소변 검사, 출혈 여부 등을 매일 같은 시간에 측정하였다. 실험동물들은 작약(100 ㎎/㎏)을 섭취시킨 그룹, 양성 대조군으로서 sulfasalazine (150 ㎎/㎏)을 섭취시킨 그룹, 그리고 음성 대조군으로서 물만을 섭취시킨 그룹으로 나누었다. 작약과 sulfasalazine은 물로 희석하여 DSS 처리되는 첫날부터 매일 1회 경구투여 하였다. 7일간 DSS 처리 후 마우스를 희생시키고 결과를 측정했다.
질병활성화정도(Disease activity index; DAI) 측정
장 질환은 체중감소, 출혈과 점액을 동반하는 설사 및 결장길이의 감소 등의 징후로 측정된다(Hendrickson et al., 2002). 보고된 연구결과에 의하면 DAI에는 세가지 주요한 임상 징후가 있는데, 체중감소, 설사, 직장출혈이다(Murthy et al., 1993). 체중감소는 초기와 현재의 체중 차이로 산출된다. 설사는 직장에서 분변에 덩어리의 형태가 없는 것과 직장에 연속된 액상의 분변 물질이 존재하는 것으로 세분화된다. 직장 출혈이 보이는 것은 출혈을 동반한 설사나 총 직장출혈, 그 밖의 설사와는 별개의 것이다. DAI는 다음과 같이 산출하였다.
DAI = (weight loss score) + (diarrhea score) + (rectal bleeding score)
여기서 사용된 의학적 변수는 인체에서 궤양성 대장염이 생겼을 때의 의학적 증상과 유사한 포괄적인 기능측정이다.
Enzyme-linked immunosorbent (ELISA) assay
대장조직에서 IL-6의 양을 측정하기 위하여 대장 조직 내 단백질을 분리하고 효소 면역측정법을 수행하였다. 간단히 요약하면, 먼저 96 well plates에 IL-6의 1차 항체를 PBS에 1 ㎍/㎖로 희석하여 각 well 마다 100 ㎕씩 coating한 뒤 4℃에서 overnight 하였다. 그 이후, 결합되지 않은 1차 항체를 제거하기 위하여 Tween 20이 0.05% 포함된 PBS (PBST)로 씻어낸 뒤 샘플을 넣고, 37℃에서 2시간 동안 반응시킨다. 0.2 ㎍/㎖로 희석한 IL-6의 2차항체를 well에 100 ㎕씩 넣고 37℃에서 2시간 동안 반응시킨다. 결합되지 않은 2차 항체를 PBST로 씻어낸 뒤, avidin-peroxidase (AP)를 well에 100 ㎕씩 넣고 37℃에서 30분간 반응시킨다. 그 후 2,2´-azino-bis-(3-ethylbenzthiazoline- 6-sulfonic acid) (ABTS)기질을 첨가하여 발색 정도를 ELISA reader기를 이용하여 측정한다. 단백질정량은 bicinchoninic acid (BCA) protein assay reagent (Sigma)로 측정하였다.
Western blot analysis
실험이 종료된 대장 조직을 ice-cold PBS로 2회 씻어주고 ice-cold protein extraction solution (Intron Biotechnology, Sungnam, Korea)로 lysis 시킨다. Lysate는 15,000 rpm, 4℃, 15분간 원심분리 하여 상층액을 샘플로 사용하였다. 그 후 2 × SDS sample buffer (Elpis Biotech, Daejeon, Korea)에 동량으로 섞고, 5 분간 95℃로 가열한 후 7.5% Gradi-Gel 2 Gradient Gel (Elpis Biotech, Daejeon, Korea)로 분리한다. 전기영동으로 분리된 단백질들을 electrophoretic transfer로 메틸화된 PVDF membranes (Roche Diagnotics, IL, US)에 이송시킨다. 이 membrane을 5% skim milk에 1 시간 동안 blocking하고 primary antibody와overnight하여 반응시킨다. 그 후, membrane을 PBST로 5회 세척하고 HRP-conjugated secondary antibody로 1 시간 동안 반응시킨다. 다시 PBST로 세척 후, chemiluminescence assay (Amersham Pharmacia Biotech, NJ, USA)로 결과를 확인하였다.
통계분석
실험 결과는 평균(mean) ± 표준편차(standard deviation, S.D.)로 표시하였으며, 각 데이터의 통계분석은 t-test와 Tukey post hoc test를 포함한 ANOVA 분석에 의해 검정하여, P < 0.05인 경우 유의성이 있는 것으로 판단하였다.
결 과
DSS로 유도된 대장염 모델에서 체중감소에 대한 작약의 조절효과
작약의 궤양성 대장염에 대한 개선효과를 실험하기 위하여 DSS로 유도된 동물모델을 이용하여 다양한 신체적인 증후들 중, 체중변화에 대한 작약의 효과를 측정하였다. 실험동물의 체중 변화를 일주일 동안 관찰한 결과, 정상군에서는 체중이 꾸준히 증가하였으나 DSS 단독군에서는 5일 이후부터 체중이 유의적으로 감소함을 확인하였다. 반면 작약(100 ㎎/㎏)을 투여한 군에서는 DSS 단독 투여군에 비해 대장염의 진행에 따른 체중 감소가 조절됨을 확인하였다(Fig. 1). 본 실험에서는 대장염 치료제로 사용되는 SFZ을 양성 대조군으로 사용하였으며 작약의 효과는 양성대조군과 비슷한 양상으로 나타났다.
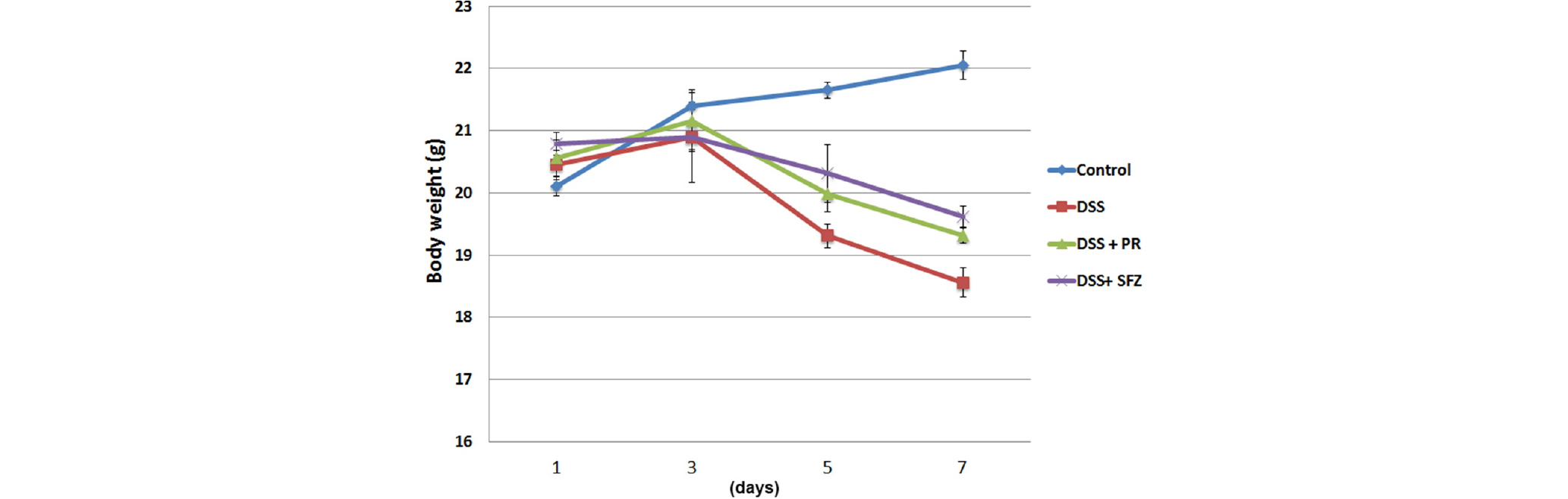
Fig. 1.
Effect of PR on DSS-induced the body weight loss in mice. Experimental colitis in mice (n = 7/ group) was induced by a 5% DSS dissolved in the drinking water for 7 days. PR (100 ㎎/㎏) was administered once a day for 7 days prior 5% DSS supplement. SFZ (150 ㎎/㎏) was used as a positive control. Body weight of mice was measured. Data were represented in the mean ± S.D. from triplicate experiments (#p<0.05 vs. control, *p<0.05 vs. DSS alone).
DSS로 유도된 대장염 모델에서 대장 길이에 대한 작약의 조절효과
급성대장염 동물모델에서 장 길이의 변화는 염증진행과 연관성이 있기 때문에 본 연구에서는 DSS로 유도된 동물모델에서 대장길이 변화에 대한 작약의 영향을 측정하였다. 실험결과, 정상군의 대장 길이는 8.15 ± 0.27 ㎝로 측정된 반면, DSS 투여군은 5.25 ± 0.49 ㎝로 무처리군에 비하여 대장 길이가 현저하게 짧아졌다. 작약과 SFZ군은 각각 6.51 ± 0.43 ㎝와 6.99 ± 0.56 ㎝로 DSS로 유도된 대장길이의 감소는 유의적으로 억제되었다(Fig. 2).
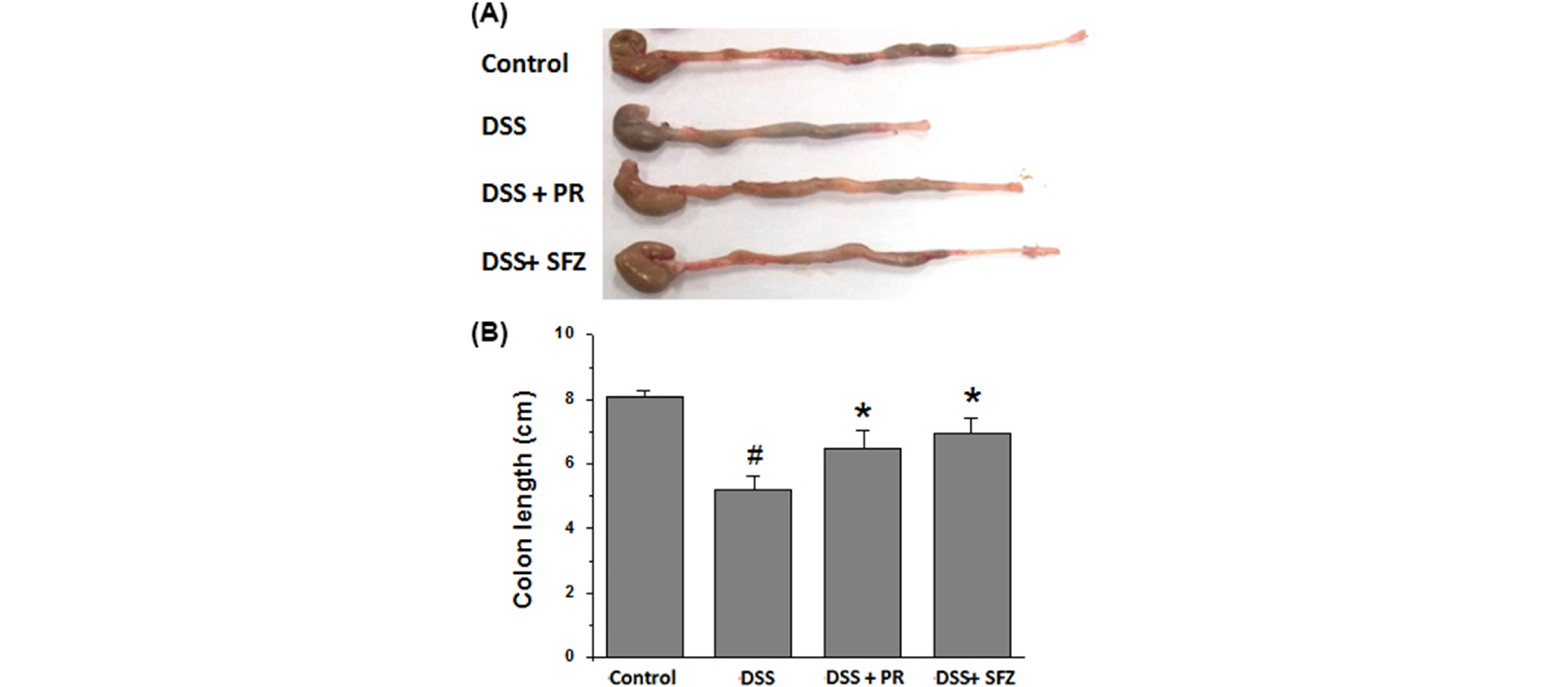
Fig. 2.
Effect of PR on DSS-induced the colon length shortening in mice. (A) Experimental colitis in mice was induced by 5% DSS dissolved in the drinking water for 7 days. PR (100 ㎎/㎏) was administered orally once a day for 7 days prior to 5% DSS supplement. The colons were removed at day 7 after DSS treatment, and the colon lengths were measured. (B) Relative colon lengths were represented. SFZ (150 ㎎/㎏) was used as a positive control. Data were represented in the mean ± S.D. from triplicate experiments (#p<0.05 vs. control, *p<0.05 vs. DSS alone).
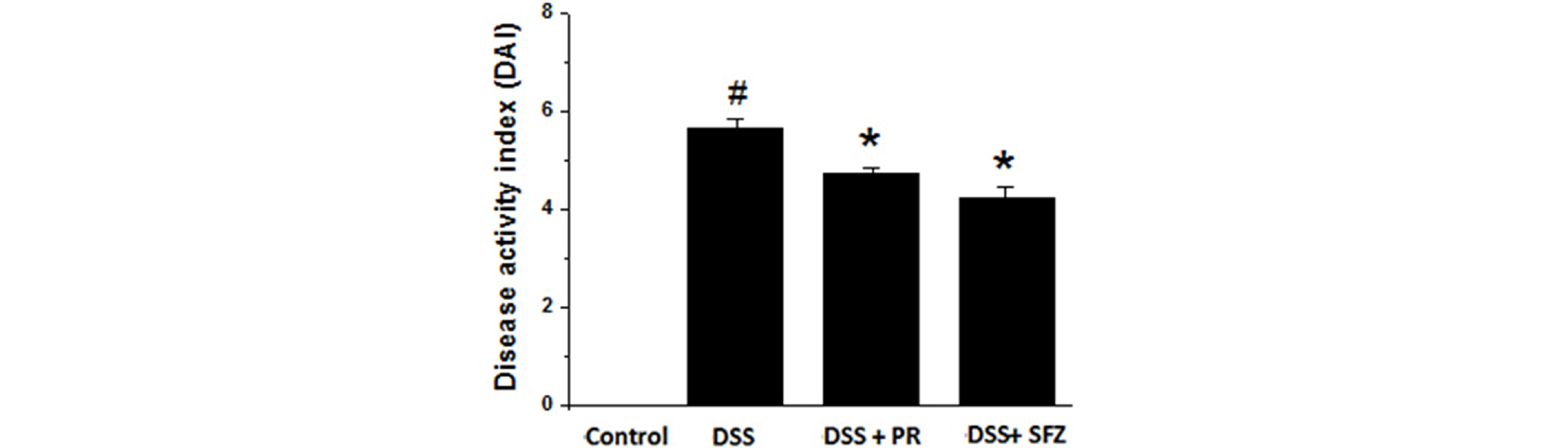
DSS로 유도된 대장염 모델에서 질병활성도(Disease activity index; DAI)증가에 대한 작약의 조절효과
DSS 궤양성 대장염 모델은 체중 감소, 설사, 혈변을 특징으로 하는 임상 증후가 나타난다(Murthy et al., 1993). 본 연구에서는 이러한 임상증상에 대한 작약의 영향을 측정하였다. 정상군에서는 아무런 증상이 나타나지 않은 반면, DSS 투여군에서는 DAI가 유의적으로 증가 하였다. 작약 투여군의 경우 DSS단독 투여군과 DAI수치를 비교하였을 때 유의적인 억제효과를 확인하였다. 대조약물로 사용된 SFZ군과 비교시 DSS 대장염 모델에서 DAI에 미치는 작약의 효과는 SFZ의 효과와 비슷한 양상이 확인되었다(Fig. 3).
대장 조직에서 염증매개 인자의 발현에 대한 작약의 조절 효과
염증성 사이토카인의 생성 증가는 대장염 발생 및 진행과정에 연관성이 높으며 이와 관련하여 본 실험에서는 DSS로 유도된 궤양성 대장조직 내 IL-6생성에 대한 작약의 효과를 ELSIA 방법으로 측정하였다. Fig. 4A에서 보이는 바와 같이, DSS 단독투여군 대장조직의 IL-6의 발현양은 정상군의 대장조직에 비하여 현저하게 높았다. 하지만, 작약 투여군에서는 DSS 단독 투여군보다 대장조직의 IL-6수준은 유의적으로 감소함을 확인하였다.
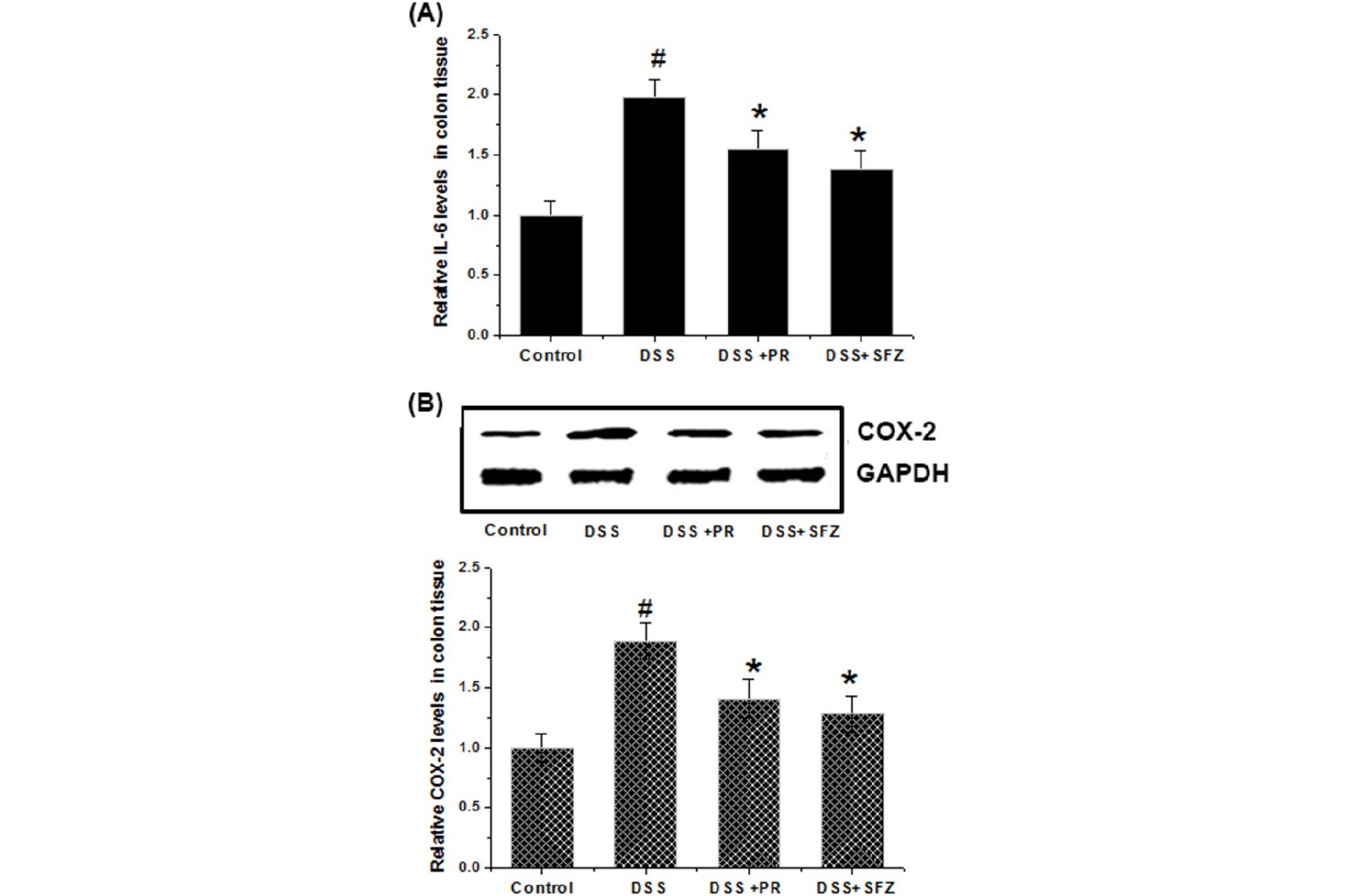
Fig. 4.
Effect of PR on the level of COX-2 and IL-6 expression in DSS-induced mouse colitis tissue. Experimental colitis in mice was induced by a 5% DSS dissolved in the drinking water for 7 days. PR was orally administered at doses of 100 ㎎/㎏ once a day for 7 days prior to 5% DSS supplement. At the end of experiment, colitis tissues were obtained from mouse and immediately lysed. (A) The levels of IL-6 in colitis tissue were evaluated by ELISA kit. (B) The expressions of COX-2 were determined by western blot. Data were represented in the mean ± S.D. from triplicate experiments (#p<0.05 vs. control, *p< 0.05 vs. DSS alone).
대장 조직 내 염증관련 효소인 COX-2의 발현에 대한 작약의 조절효과를 Western blot analysis로 측정하였다. 실험결과, DSS군의 대장조직에서는 정상군과 비교시 COX-2의 발현 수준이 증가하였으며 작약과 양성대조군 투여군에서는 DSS로 유도된 COX-2의 발현이 억제됨을 확인하였다(Fig. 4B).
고 찰
본 연구는 궤양성 대장염 대한 작약의 효과를 규명한 연구결과로 DSS로 유도된 궤양성 대장염 동물모델에서 체중감소, 결장길이 단축, 질병활성도 증가 등의 임상증상과 대장 조직에서의 염증매개인자 발현에 대한 작약의 조절효과를 규명하였다.
궤양성 대장염은 유럽이나 미국 등 육식을 주로 하는 서구에 흔한 질병으로, 국내에서는 드문 질환으로 인식되어 왔는데, 최근에는 우리나라에서도 식생활의 서구화에 따라서 발병 빈도가 높아지고 있다. 궤양성 대장염은 원인 불명의 대장 염증을 일으키며 호전과 악화를 반복하는 만성적인 질환으로 우리나라에서도 식생활의 서구화에 따라 궤양성 대장염의 발병 빈도가 높아지고 있다. 현재까지 궤양성 대장염에 대한 발병 기전은 명확하게 알려지지 않고 있으며, 치료제로는 스테로이드제제 및 면역억제제가 환자의 질병 완화를 위해 널리 사용되고 있다(Choi et al., 2012). 하지만, 장기간 투여 시 구역, 구토, 소화불량, 식욕부진, 두통뿐만 아니라 과민 반응에 의한 피부 발진, 발열, 췌장염, 간염, 용혈성 빈혈, 골수 억제 등의 부작용을 초래하기도 한다(Domènech, 2006). 따라서 대체치료제 개발에 대한 관심이 증가하고 있으며 최근에는 천연물 유래의 소재를 활용한 궤양성 대장염 치료제 개발에 많은 연구가 진행되고 있다. 일반적으로 DSS으로 유발시킨 궤양성 대장염 동물 모델의 경우, 초기에는 혈변, 체중 감소, 대장의 축소 및 점막 궤양 등이 생긴다. 이러한 양상은 사람의 궤양성 대장염과 흡사한 부분이 많아 대장염 연구에 많이 활용되고 있다(Cooper et al., 1993). 따라서 본 연구에서도 DSS로 유도된 동물모델을 활용하여 작약의 궤양성 대장염 개선 효과를 규명하였다. 실험결과, 우선 DSS투여군에서는 정상군에 비하여 체중감소가 급격히 일어나며 이러한 현상은 작약(100 ㎎/㎏)을 투여한 군에서 유의적으로 억제되었다. 또한 DSS로 7일 동안 투여된 집단에서는 정상군에 비해 결장 길이의 감소가 현저히 나타났으며, 이러한 현상은 작약에 의하여 유의적으로 감소되었다. 대장염 환자들에게 보이는 대표적인 임상 증상들로 체중감소, 설사, 직장 출혈 등이 있으며, 이런 지표들은 질병활성화 정도로 나타내어 질 수 있다. 본 연구에서는 DSS로 증가된 질병활성화 정도를 작약 투여에 의하여 현저하게 억제됨을 확인하였다. 본 연구에서 양성대조군으로 SFZ을 사용하여 작약과 비교실험을 하였고, DSS로 유도된 다양한 신체적인 증후들(체중 감소, 직장 길이, 설사, 잠혈 및 출혈)에 대한 작약의 효과는 양성대조군과 비슷한 효과를 나타내었다.
궤양성 대장염에서는 면역 반응을 유발하는 요인이 없어진 상황에서도 면역 조절기능의 결함으로 인하여 염증을 일으키는 세포가 병이 있는 부위로 계속하여 모이게 된다. 이들이 염증을 매개인자들을 분비하는 반면 염증을 가라앉히는 항염증 작용은 약화되므로 염증 반응이 계속되어 증폭되는 것으로 설명할 수 있다. 따라서 궤양성 대장염 환자의 대장조직에는 다양한 염증매개인자들의 발현양이 증가되어 있으며, 따라서 새로운 생물학적 치료법의 개발은 염증 매개인자의 생성을 차단하는데 집중되고 있다(Papadakis and Targan, 2000). 최근 연구결과에 의하면, 염증성 장질환 환자의 대장 상피세포에서 COX-2의 발현이 증가되어 있음이 보고 되었다(Hendel and Nielsen, 1997; Matuk et al., 2004). 따라서 대장 조직 내 COX-2 및 염증성 사이토카인 생성을 조절하는 물질은 대장염 치료제 개발에 중요한 단서를 제공할 수 있을 것이라고 사료된다. 본 연구에서는 DSS로 유도된 대장염 모델에서 대장조직 내 IL-6 및 COX-2 생성에 대한 작약의 효과를 측정하였다. 실험 결과, DSS단독군과 정상군과 비교 시 대장조직에서 IL-6 및 COX-2의 생성이 증가하였으나 작약 투여군 에서는 이러한 현상이 유의적으로 감소되었다. 이 결과로부터 작약은 DSS로 유도된 염증 매개인자인 IL-6 및 COX-2의 생성조절을 통하여 항염증 효과를 보임을 알 수 있다. 작약은 paeoniflorin, (+)-catechin, paeonol, albiflorin, gallic acid methyl ester, benzoic acid, hederagenin 등 다양한 생리활성 물질을 함유하고 있는 것으로 알려져 있다(Wu and Sheu, 1996; Chuang et al., 1996). 그 중 catechin의 항산화 및 항비만 효과(Vάzquez Cisneros et al., 2017), paeonol의 항암효과(Lyu et al., 2017), gallic acid methyl ester의 항염증 효과(Lim et al., 2018), 그리고 paeoniflorin의 항궤양성 효과 등 생리활성 효능에 관한 연구가 보고되고 있다. 작약 추출물의 항산화 및 암전이 억제 및 암세포 사멸 효과(Kim and Kim, 2018)에 대한 연구도 보고되었지만 작약 추출물과 유효성분과의 효능 비교분석 실험이 미비하여 단독추출물을 사용하는 것이 더 효율적인 방법인지에 대한 후속연구가 필요할 것으로 사료된다. 또한 본 연구에서는 작약의 궤양성 대장염 개선에 대한 임상증상 및 염증인자의 발현조절 대한 효과는 확인하였으나, 작약 추출물의 정확한 약리기전 규명연구는 부족하여 향후 작약의 약리기전 규명에 대한 추가연구가 필요할 것이다.
본 연구결과를 토대로 작약은 DSS 처리로 유도된 대장염 모델에서의 임상적 증후와 염증 인자의 활성화 수준을 유의적으로 감소시키는 것을 확인하였다. 이 결과에 기초하여 작약은 궤양성 대장염 치료제 개발에 근거자료로 활용될 수 있을 것으로 사료된다.
적 요
염증성 대장질환에 대한 작약의 효능 연구가 미비하여 본 연구에서는 dextran sulfate sodium로 유도된 궤양성 대장염의 임상증상인 체중감소, 결장단축, 질병활성화 정도에 대한 작약의 효과를 관찰하였다. 또한 대장 조직 내 염증매개인자인 interleukin-6및 cyclooxygenase-2의 생성에 대한 작약의 효과를 측정하여 다음과 같은 결과를 얻었다. 첫째 dextran sulfate sodium로 유도된 궤양성 대장염에서 체중 감소에 대한 작약의 효과를 관찰한 결과 유의적으로 억제함을 확인하였다. 둘째 DSS로 유도된 궤양성 대장염에서 결장 단축에 대하여 작약의 억제 효과가 유의성 있게 나타났다. 셋째 dextran sulfate sodium로 유도된 궤양성 대장염에서 임상증상인 설사, 잠혈 및 출혈 등의 질병활성화 정도에 대한 작약의 효과를 관찰한 결과 유의적으로 질병활성화 정도를 억제하였다. 넷째 대장 조직내 염증매개인자인 interleukin-6및 cyclooxygenase-2의 생성증가에 대한 작약의 억제효과를 확인 하였다. 본 연구는 작약의 효능을 과학적으로 입증한 결과로, 작약의 궤양성 대장염의 치료제 개발의 소재로서의 가능성을 시사한다.