서 언
2022년 포도 품종별 재배면적을 살펴보면 ‘Campbell Early’ 31.7%, 대립계 17.3%, ‘Shine Muscat’ 41.4%, MBA 6.5%, ‘Delaware’ 0.4%, 기타 2.7%로 ‘Shine Muscat’ 품종이 급격히 증가하고 오랜 기간 주요 재배 품종이었던 ‘Campbell Early’가 급격히 감소하였으며, 기타 품종 비율도 증가하였다(KREI, 2023). 2004년 칠레와 자유무역협정이 체결되어 씨없는 생식용 포도 품종의 수입이 증가하고 소비 양상이 달라지면서(Jung et al., 2020) 최근에 일본과 미국 등지에서 육성된 씨없는 포도 신품종이 국내에 도입되고 있으며, 국내에서도 씨없는 포도나 다양한 형태를 가진 품종 등이 육성되어 재배면적이 늘어나고 있는 실정이다(Kim et al., 2023).
작물에서 새로 육성된 신품종의 안정적인 재배를 위해서 가장 먼저 고려해야 할 사항은 내한성이라 할 수 있다. 내한성 설정을 위해서 사용하는 내한성 측정 방법으로는 온도별 전해질 누출율(electrolyte leakage, EL)을 측정하여 LT50 값을 계산하는 방법(Lee et al., 2012, 2013; Pagter and Arora, 2013), 저온 처리별 식물 조직의 갈변 검경법(Yu and Lee, 2020), 저온 처리별 발아율 측정 및 저온방출열을 측정하는 법(Jun et al., 2021; Quamme, 1991) 등이 있다.
식물이 동해를 입게 되면 동결점에서 눈 결정이 형성됨으로써 세포의 탈수와 세포막의 분리 등이 일어난다(Arora, 2018; Jun et al., 2021; Moran et al., 2011). 초기의 얼음 결정은 세포외간극에 만들어지고(Jun et al., 2021; Pearce, 2001; Wisniewski et al., 2014) 얼음 결정이 세포내액의 수분을 끌어당기게 됨으로써 세포의 탈수가 일어나게 된다. 이러한 과정이 더 심화되면 얼음 결정이 세포내 공간에서도 만들어지고 이러한 이유로 세포막이 붕괴되면서 세포가 죽게 된다. 따라서 세포내 결빙이 될 때 발산되는 잠열을 측정하여 세포내 결빙을 추정할 수 있다(Arora, 2018; Jun et al., 2021; Pearce, 2001). 그러나 다양한 작물에서 저온열방출을 통한 내한성을 측정할 때 감지가 어려워 일부 작물에서 적용하고 있는 실정이다(Jun et al., 2021; Liu et al., 2019; Salazar-Gutiérrez et al., 2014). 특히 눈을 대상으로 한 내한성 연구에서 LTE 분석은 상대적으로 많은 양의 시료가 아닌 제한된 시료를 대상으로 수행할 수 있어 효율적이라 알려져 있다(Neuner et al., 2019; Salazar-Gutiérrez et al., 2016).
포도의 내한성 관련 연구는 착과량 조절, 환상박피나 휴면기 가지의 형태에 따른 내한성의 변화 등으로 주로 재배 기술에 따른 내한성 증진 기술 방법 개발로 주로 이루어져왔으며(Choi et al., 2014; Kwon et al,. 2011; Songet al., 2000), 내한성 검정방법에 대한 연구는 미흡한 실정이다. 최근에 포도의 눈을 대상으로 한 내한성 연구에서 내한성이 약한 품종의 눈에서의 LTE는 내한성이 강한 품종 눈에서의 LTE보다 더 높게 값이 나타나 눈을 이용한 LTE 분석이 포도나무 내한성을 평가하는 데 유용하다는 보고가 있다(Jun et al., 2021).
따라서 본 연구에서는 최근 국내에 도입되어 재배되고 있는 품종들의 내한성을 저온열방출을 통해 조사하여 저온열방출법을 통한 내한성 측정 방법의 도입을 검정하고 재배한계지역 설정의 기초 자료로 활용하고자 하였다.
재료 및 방법
시험 재료
농촌진흥청 원예특작과학원 완주 과수 포장에 재배되고 있는 도입 품종 ‘IFG-6’, ‘My Heart’, ‘Ruby Seedless’, ‘Thompson Seedless’, ‘Vanessa Seedless’, ‘Violet King’, 최근 국내 육성 포도 품종인 ‘Jelly Pop’, ‘Shooting Star’, ‘Summer Crispy’와 국내에서 가장 재배가 많이 되고 있는 품종인 ‘Campbell Early’, ‘Kyoho’, ‘Muscat Bailey A’, ‘Shine Muscat’ 품종을 대상으로 하였다(Table 1, Fig. 1). 모든 품종은 간이비가림시설에서 재식 간격 2.7 × 2.7 m로 개량일자형 수형으로 조성하였으며, 단초전정을 실시하여 관리하였다.
5주의 나무에서 2022년에 생장한 신초를 2023년 1월 말에 신초의 3~8번째 마디 정도인 50 ㎝ 정도를 채취하여 실험을 수행하였다. 채취된 신초는 젖은 종이로 감싸 비닐백에 넣어 건조되지 않도록 하였으며, 실험 전까지 4℃ 냉장고에 보관하였다.
Table 1.
The name, pedigree, species, color of berry skin, origin of the table grape cultivars assessed in the experiment.
최저기온
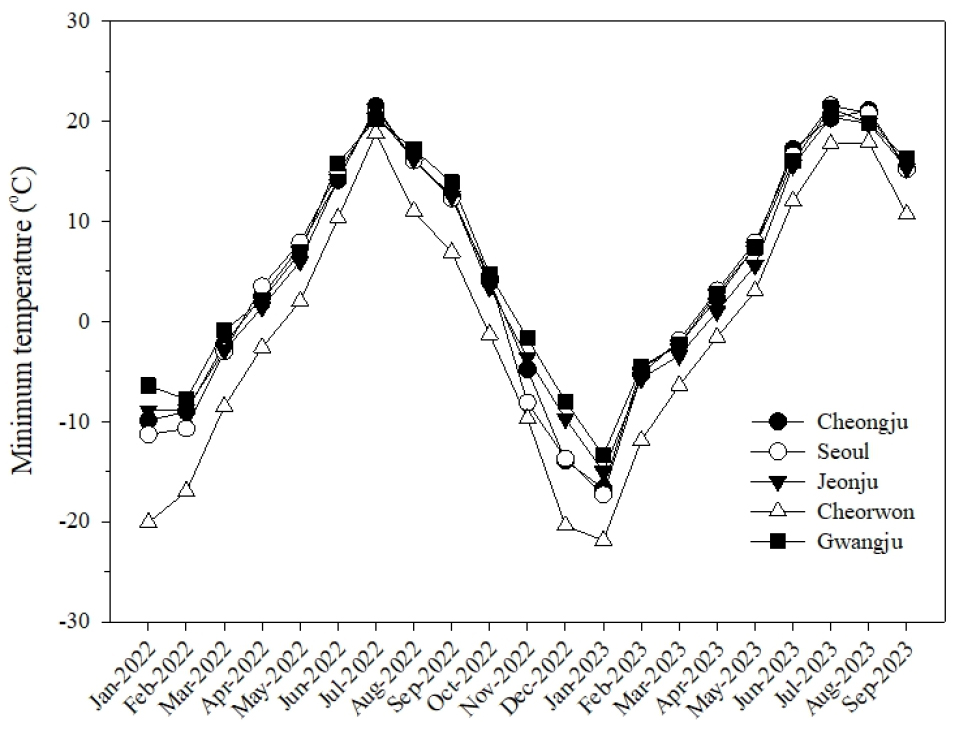
중북부(철원, 서울), 중부(청주), 남부(전주, 광주)를 기준으로 기상자료개방포털(Korea Meteological Administration, 2023)을 이용하여 2022~2023년 최저기온 데이터를 수집하였다.
Low temperature exotherm (LTE) 분석
Arora et al.(1992)과 Jun (2021)의 방법에 따라 온도 차이를 이용한 low temperature exotherm 분석을 수행하였다. 알루미늄호일에 열전도가 잘 될 수 있도록 thermal grease를 바르고 그 위에 크기가 비슷한 눈을 잘라 겹치지 않게 배치하였다. 이 부위에 copper-constantan thermocouple 선을 연결하여 호일을 접어 밀봉한 후 튜브에 넣었다. 저온 하강 속도와 온도 설정이 가능한 저온 순환 수조(RW-2040G, Jeio Tech, Seoul Korea)에 copper-constantan thermocouple 선이 연결된 튜브를 넣고 시간당 –2℃ 정도 하강하도록 –40℃까지 낮추어 눈을 넣지 않은 대조구와 실험구의 온도를 데이터 로거(CR-1000 M, Campvell Scientific, Inc., Logan, UT, USA)를 이용하여 실시간으로 측정하였다(Fig. 2). 측정된 데이터의 두 처리구간의 온도 차이를 비교하여 열이 방출된 온도를 도출하였다.
결과 및 고찰
13개 포도 품종의 LTE를 측정한 결과 LTE가 품종별로 비슷한 위치에서 측정되어(Fig. 3) 품종 간 비교가 가능하였다. LTE를 측정한 결과 ‘Shooting Star’, ‘IFG-6’, ‘Muscat Bailey A’, ‘Vanessa Seedless’, ‘Summer Crispy’, ‘Shine Muscat’, ‘Jelly Pop’, ‘Campbell Early’, ‘Ruby Seedless’, ‘My Heart’, ‘Kyoho’, ‘Thompson Seedless’, ‘Violet King’ 순으로 저온에 강한 것으로 나타났다(Table 2).
Table 2.
Low-temperature exotherms (LTEs) detected in the bud of assessed in the experiment.
| Cultivar | LTE (℃) |
| Introduced cultivars | |
| ‘IFG-6’ | -18.6 ± 0.53z |
| ‘My Heart’ | -14.5 ± 0.33 |
| ‘Ruby Seedless’ | -14.9 ± 0.41 |
| ‘Thompson Seedless’ | -13.0 ± 0.38 |
| ‘Vanessa Seedless’ | -17.0 ± 0.62 |
| ‘Violet King’ | -12.5 ± 0.41 |
| New bred cultivars by NIHHS | |
| ‘Jelly Pop’ | -15.8 ± 0.51 |
| ‘Shooting Star’ | -18.9 ± 0.75 |
| ‘Summer Crispy’ | -16.5 ± 0.43 |
| Most cultivated cultivars in Korea | |
| ‘Campbell Early’ | -15.4 ± 0.43 |
| ‘Kyoho’ | -14.1 ± 0.20 |
| ‘Muscat Bailey A’ | -18.4 ± 0.31 |
| ‘Shine Muscat’ | -16.3 ± 0.42 |
일반적으로 미국종 포도인 Vitis riparia와 V. labrusca 및 아시아종인 V. amurensis도 높은 내한성을 나타내지만 유럽종인 V. vinifera는 -20℃ 이하에서는 동해 피해로 인해 고사하는 것으로 보고된 바 있으나(Alleweldt et al., 1990; Pierquet and Stushnoff, 1978) 대부분의 최근 육성 품종은 교잡종으로 이루어져 있어 단순히 종의 특성만으로 내한성을 추정하기는 어렵다. 국내에서 품종별 포도 재배 지역 설정은 가장 많이 재배되고 있는 ‘Campbell Early’와 ‘Kyoho’를 기준으로 재배지역에서의 고사 여부로 판단하는 것이 일반적으로 활용하고 있는 방법이다. 그러나 정확한 수치 제시가 어려워 품종별 내한성 구분이 어려운 실정이다. LTE 측정으로 기준 품종인 ‘Campbell Early’와 ‘Kyoho’를 기준으로 수치를 제공하면 쉽게 재배 가능 여부를 판단할 수 있다.
2022~2023년 최저온도를 지역별로 살펴본 결과(Fig. 4), 본 실험이 수행된 전주 지역의 겨울철 월별 최저온도는 –14.8℃로 나타났으며, 북부 지역인 철원 지역은 –22.0℃로 전주 지역과 비교하면 겨울철 최저온도는 약 8℃ 정도 차이를 보였다(Fig. 3). 남부 지역인 광주는 –13.4℃로 전주지역보다 한겨울인 1월의 온도는 1.5℃ 정도 높은 것으로 나타났다. 북부지역으로 갈수록 겨울철 최저온도 기온의 차이가 크게 나타나는 것으로 조사되었다.
그러나 국내 포도 재배는 간이비가림시설이나 비가림하우스에서 재배되고 있어 기상온도와 실제 재배되고 있는 포도나무 근처의 미기상은 차이를 보이는데 여름철 온도는 노지보다 간이비가림시설에서 4~7℃ 정도가 높은 것으로 알려져 있으나 겨울철 온도는 크게 차이를 보이지 않는다고 보고된 바 있어(Lee et al., 2015; Park et al., 2006) LTE 수치를 이용한 내한성 검정이 포도 재배 시 실제 온도 피해 범위와 유사한 범위에 있을 것이라 추정되었다.
국내에서 전국적으로 재배되고 있는 ‘Campbell Early’의 경우 본 실험에서 8번째로 내한성이 강한 것으로 나타났으며, ‘Kyoho’의 경우 내한성이 약해 경기 북부지역에서는 노지 재배가 어려운 것으로 알려져 있는데 전주 지역의 경우 1월 최저기온이 –14.8℃로 ‘My Heart’, ‘Thompson Seedless’, ‘Violet King’ 등이 ‘Kyoho’ 보다 더 약한 것으로 나타나 재배 시 주의해야 할 것으로 판단되었다(Table 2, Fig. 4). 대부분의 품종이 실제 재배 시 내한성과 LTE 측정에 의한 결과가 비슷한 양상으로 나타났으나(Table 2) 국내 재배 시 내한성이 약한 편으로 알려져 있는 ‘Muscat Baily A’의 경우는 실험한 품종들 가운데 3번째로 강한 품종으로 나타나 탈순화 시기에 약한 품종일 것이라 추측되었으며, 추후 시기에 따른 내한성 측정이 필요할 것으로 판단되었다.
일반적으로 저온열방출은 감지가 어려우며 감지가 되더라도 조직에 따라 광범위한 온도 범위에서 방출되므로(Neuner et al., 2019) 반복적인 측정이 필수적이다. 많은 낙엽 과수에서 얼음 형성은 어는점보다 훨씬 낮은 온도에서도 억제되고(Kaya and Köse, 2017; Liu et al., 2019; Pramsohler et al., 2012), 꽃눈과 줄기에서 –40℃ 정도의 낮은 과냉각이 발생할 수 있다고(Ashworth et al., 1988; Neuner et al., 2019) 보고된 바 있다. 그러나 사과의 경우에는 사과꽃봉오리에서 LTE가 감지되지 않았다고 보고했으며, LTE 분석을 사용하여 내한성을 추정할 수 없다고 하였다(Salazar-Gutiérrez et al., 2016). 일부 작물에서는 저온조절유전자의 발현 여부를 분석함으로써 내한성 품종을 육성하는 데 활용하기도 한다(Choi et al., 1997). 포도의 경우 저온열방출이 다른 작물에 비해 잘 되는 것으로 보고된 바 있는데(Jun et al., 2021) 본 실험에서도 저온열방출 감지가 효과적으로 된 것으로 판단되었다(Fig. 3). 따라서 포도나무 눈에서와 같이 LTE가 감지될 수 있는 경우 exthotherm 분석은 깊은 과냉각 조직의 내한성을 결정하는 빠르고 편리한 방법으로 사용할 수 있다(Jun et al., 2021; Liu et al., 2019; Salazar-Gutiérrez et al., 2014).
포도의 안정적인 재배를 위해서는 저온 피해를 정확히 평가할 필요가 있는데 지금까지 일반적으로 많이 사용하던 눈의 EL 분석은 신속하며 재현 가능한 LT50 값을 제공하지만(Jun et al., 2021) 눈으로 실험을 할 경우, 많은 양의 시료가 필요하게 되어 현실적으로 실험하기에 어려움이 많았다. 따라서 본 실험과 같이 저온열방출을 활용한 분석을 통해 새로 도입되거나 육성된 품종의 눈의 내한성을 평가하는 방법을 활용하여 재배 지역을 설정할 필요가 있다고 판단되었다.
적 요
최근 국내 재배가 많거나 국내 도입이 되고 있는 13개 포도 품종의 눈을 대상으로 LTE를 측정한 결과 ‘Shooting Star’, ‘Muscat Bailey A’, ‘IFG-6’, ‘Vanessa Seedless’, ‘Summer Crispu’, ‘Shine Muscat’, ‘Jelly Pop’, ‘Campbell Early’, ‘Ruby Seedless’, ‘My Heart’, ‘Kyoho’, ‘Thompson Seedless’, ‘Violet King’ 순으로 저온에 강한 것으로 나타났다. LTE 값은 ‘Shooting Star’에서 –18.9℃로 가장 낮게 나타났으며, ‘Violet King’에서 –12.5℃로 가장 높게 나타났다. 이러한 결과를 통해 국내 재배 시 기준 품종으로 제시되고 있는 ‘Campbell Early’와 ‘Kyoho’를 기준으로 데이터를 상대 비교함으로써 효율적으로 지역별 재배 가능 여부를 판단할 수 있는 기초 자료로 활용할 수 있다.