서 언
재료 및 방법
실험재료
시료 건조방법
시약
일반성분
유리당
유기산
구성 아미노산
유리 아미노산
무기성분 분석
지방산 분석
통계분석
결과 및 고찰
일반성분
유리당
유기산
구성 아미노산
유리 아미노산
무기성분
지방산
적 요
서 언
고령화 사회로 진행됨에 따라 노화억제와 건강유지에 대한 관심이 높아지고 있으며, 건강한 삶을 유지하기 위한 일환으로 천연소재들의 생리활성 물질연구가 광범위하게 진행되고 있다(Goldberg, 1994). 특히, 식품으로 사용이 가능한 생약과 채소에 대한 연구들이 주를 이루어 항산화, 항암 및 항진균 등의 생리활성 및 유용성분에 관한 결과들이 다수 보고되고 있다(Han et al., 1992; Cao et al., 1996; Jansen, 2002).
적하수오는 다년생 초본으로 마디풀과(Polygonaceae)의 다년생 초본으로, 한의학에서는 덩이뿌리를 적하수오라 하여 약용으로 사용하며, 주산지는 중국의 하남, 호북, 귀주, 사천 등지이며, 그 외 강서, 산동, 호남에서도 서식한다(Chan et al., 2003). 중국의 춘추시대에 하씨라는 사람이 이름 모를 풀의 덩이뿌리를 캐어 먹고 머리가 까마귀처럼 새까맣게 되고 윤기가 나며 정력적으로 오래 살았다고 한 구전을 바탕으로 하씨(何), 머리(首), 까마귀(烏)의 글자를 따서 하수오(何首烏)라 부르게 되었다고 한다(Choi, 2009). 적하수오의 성분은 anthraquinone 화합물인 chrysophanol, emodin, rhein, physcion 및 2,4,6,4'- tetrahydroxystilbene-2-Ο-β-D-glucoside를 비롯한 배당체 등이 함유된 것으로 알려진 바 있다(Do et al., 2011). 한방에서는 보익정혈(補益精血), 해독절학(解毒截瘧), 윤장통변(潤腸通便) 등의 용도로 사용하며(Seo et al., 2006), 적하수오 에탄올 추출물은 혈당저하 및 당 대사 활성을 갖는 유효성분을 함유하고 있다고 보고된바 있다(Kim, 2008). Ban and Ko (2012)는 적하수오 메탄올 추출물의 항산화 화장품 천연 원료 개발 가능성을 제시하였고, Choi et al. (2012)은 고 콜레스테롤이 유발된 시험구 흰쥐에 적하수오를 경구 투여하여 한 결과 지질 감소효과가 나타났다고 보고한 바 있으며, 하수오가 xanthine oxidase와 hyperxanthine에 의해 손상된 혈관 내피세포의 회복 및 보호효과가 있는 것으로 보고한 바 있다(Lee et al., 2002). 이와 같이 약리적인 기능성이 확보된 적하수오의 식품개발을 위한 이화학적 성분 및 생리활성에 관한 연구는 부족한 실정이다.
본 연구에서는 식품원료목록에서 식용으로 사용이 가능하게 분류된 적하수오 덩이뿌리의 식품활용 및 산업화를 목적으로 1차가공단계인 건조과정에 따른 적하수오의 일반성분, 유리당, 아미노산, 지방산 및 무기성분을 분석하여 최적 건조조건을 구명하였다.
재료 및 방법
실험재료
본 실험에 사용한 적하수오(Polygonum multiflorum root, PMR)는 동부생약영농조합법인 부설 재배단지(위도 35°01’95″, 경도127°30’25″)에서 2017년 5월 구입하였으며, 식품의약품안전처 한약표준품 기준에 부합하는 원료를 본 실험의 재료로 사용하였다. 건조방법을 달리한 적하수오를 각각 분쇄하여 50 mesh 체로 거른 후, 실온에 보관하며 시료로 사용하였다. 추출물은 분말로 만들어 소분하여 진공포장 상태로 냉장보관하며 본 실험에 사용하였다.
시료 건조방법
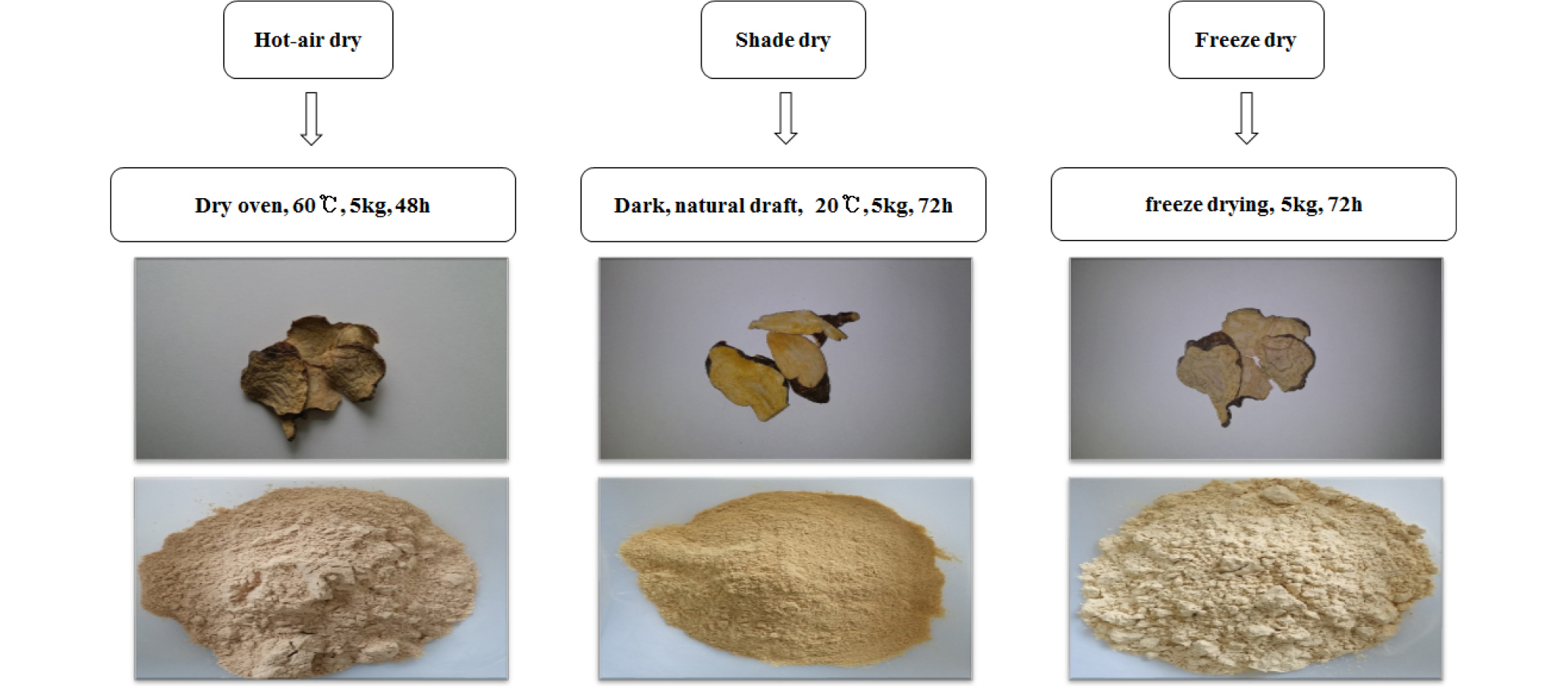
적하수오를 60℃에서 열풍건조, 통풍이 잘되는 20℃에서 음건 및 동결건조기를 이용한 동결건조방법으로 Fig. 1과 같이 각각 건조하여 사용하였다. 모든 성분분석은 건조된 시료에 함유된 양(dry basis)으로 계산하였다.
시약
본 실험에서 사용된 분석 및 추출, chromatography용 용매와 시약은 일급 또는 특급시약을 구입하여 사용하였다.
일반성분
일반성분은 AOAC (1996)방법에 따라 분석하였다. 수분은 시료 1 g을 각각 칭량병에 담고 105℃ dry oven에서 항량이 될 때까지 건조시켜 무게를 측정하여 구하였다. 조회분은 시료 2 g을 250℃에서 예비 회화한 후 600℃에서 직접 회화법으로, 조단백질의 함량은 Kjeldahl법(Sin, 1987)으로 측정된 질소량에 질소계수 6.25를 곱하여 산출하였으며, 조지방의 함량은 Soxhlet 추출법(Lee et al., 2008)으로, 조섬유는 Henneberg Stohmann 개량법(Kim et al., 2007)으로 구하였다. 가용성 무질소물의 함량은 총량에서 수분, 조회분, 조단백질, 조지방 및 조섬유의 함량을 뺀 값으로 산출하였다.
유리당
유리당 성분은 Wilson et al. (1981)의 방법에 따라 분석하였다. 즉 시료 5 g에 증류수를 가하여 교반시킨 후 100 ㎖로 정용하여 원심분리(50,000 rpm, 30 min)한 후 상징액을 취하여 0.45 ㎛ membrane filter (Millipore Co., USA)로 여과한 여액으로 HPLC (1200 Series, Agilent Technologies, USA)를 이용하여 분석하였으며(Table 1), 함량은 integrator에 의한 외부표준법으로 계산하였다.
Table 1. HPLC conditions for analysis of free sugars
유기산
유기산 함량은 Palmer and List (1973)의 방법에 준하여 분석하였다. 즉, 시료 5 g에 증류수를 가하여 교반시킨 후 100 ㎖로 정용하여 원심분리(50,000 rpm, 30 min)하고 상징액을 취하여 여과(Whatman No.2)하였다. 여과한 여액을 Sep-pak C18으로 정제시킨 다음, 0.45 ㎛ membrane filter (Millipore Co, USA)로 여과 후 HPLC를 이용하여 분석하였으며, 함량은 integrator에 의한 외부표준법으로 계산하였다.
구성 아미노산
아미노산 분석은 Strydom and Cohen (1993)의 방법에 따라 분해 및 유도체화 과정을 거친 후 HPLC (1200 Series, Agilent Technologies, USA)로 분석하였다. 시료 0.5 g과 6 N-HCl 10 ㎖을 시험관에 넣고 시험관 끝을 불로 녹여 밀봉한 후, 멸균기로 110℃에서 24시간 가수분해 시켰다. 가수분해가 완료된 시료는 여과화면서 methanol 50 ㎖로 정용하여 감압농축한 후, 20 ㎜ HCl 5 ㎖로 정용하였다. 0.45 ㎛ membrane filter로 여과하여 얻은 여액을 일정량 취한 후 AccQ-Tag 시약을 사용하여 유도체화 시킨 후 HPLC로 분석하였고 함량은 integrator에 의한 외부표준법으로 계산하였다. 이동상은 AccQ-Tag eluent (A), 100% Acetonitrile (B), water (C)를 gradient 조건으로 A:B:C를 초기 100:0:0 (%, v/v)에서 0.5분에 99:1:0 (%, v/v), 18분에 95:5:0 (%, v/v), 19분에 91:0:0 (%, v/v), 26분에 86.7:13.3:0 (%, v/v), 30분에 84:16:0 (%, v/v), 32분에 83:17:0 (%, v/v), 36분에 83:17:0 (%, v/v), 36분에 0:60:40 (%, v/v), 39분에 100:0:0 (%, v/v)로 설정하였다. 유속은 1.0 ㎖/min으로 하였고, 주입량은 5 ㎕로 설정하여, FLD (1200 Series, Agilent Technologies, USA)로 검출하였으며 AccQ-TagTM column (Water Co., 3.9 ㎜ I.D. × 150 ㎜ L.)을 이용하였다(Table 2). 함량은 적분계에 의한 외부표준법으로 계산하였다.
Table 2. HPLC conditions for analysis of amino acids
유리 아미노산
유리 아미노산 분석은 유리당 정량과 같은 방법으로 얻은 여액을 Ohara and Ariyoshi (1979)의 방법으로 분석하였다. 즉 시료 5 g을 유리당 전처리 방법과 같이 처리한 여액 10 ㎖에 sulfasalicylic acid 25 ㎎을 첨가하여 4℃에서 4시간 동안 방치시킨 후 원심분리(50,000 rpm, 30 min)하여 단백질 등을 제거하고, 상징액을 0.45 ㎛ membrane filter로 여과하여 얻은 여액을 일정량 취하여 AccQ-Tag 시약을 사용하여 유도체화 시킨 후 HPLC로 분석하였다(Table 2). 함량은 integrator에 의한 외부표준법으로 계산하였다.
무기성분 분석
무기성분은 건식분해법(Park, 2016)으로 전 처리하여 분석하였다. 즉 시료 0.5 g을 600℃에서 회화시켜 백색회분을 얻은 후, 2배 희석한 진한 염산 10 ㎖를 가해 여과하여 수욕상에서 증발건고 시킨 후 4배 희석한 염산 10 ㎖를 가한 후, 증류수를 이용하여 100 ㎖로 정용한 여액을 분석시료로 사용하였다. 각 무기성분의 정량은 원자흡광광도계(AAnalyst 400, Perkin Elmer, USA)로 각 원소의 표준 용액 농도를 0.1, 0.5 및 1.0 ppm으로 조제하여 표준 검량 곡선을 작성하여 분석하였다(Table 3).
Table 3. Atomic absorption spectrophotometer conditions for mineral analysis
지방산 분석
시료의 지방산은 Morrison and Smith (1964)의 방법에 따라 GC (7890A, Agilent, USA)와 MSD (5975C, Agilent, USA)를 이용하여 분석하였다(Table 4). 시료 1 g을 100 ㎖의 ether를 가하여 100℃의 hot-plate에서 끓고 30분간 환류 추출한다. 추출물을 여과하여 60℃ 항온수조에서 증발건고 시킨 후 0.5 N methanolic sodium hydroxide 2 ㎖를 넣고 5분간 환류 추출한다. 추출 후 14% BF3-methanol 2 ㎖를 가해 30분간 환류 추출한다. 위의 수기에 n-hexane 4 ㎖를 넣고 2분간 환류 추출 후 포화 sodium chloride를 가하여 층이 분리되면 윗층을 취하여 0.45 ㎛ membrane filter로 여과하여 분석시료로 사용하였다. 지방산은 GC-MS를 이용하여 분석하며, 표준품으로는 EC 10A-Kit (Supelco, USA)를 사용하여 각 peak의 retention time을 확인하였고 GC-MS의 Wiley library의 spectrum을 이용하여 동정하였다.
Table 4. GC-MS condition for the analysis of fatty acids
통계분석
모든 실험은 3회 반복하였으며, 실험결과를 SPSS 통계프로그램(ver. 12.0, SPSS Inc., USA)을 이용하여 평균값과 표준편차를 산출하였으며 Duncan's multiple test를 통해 그 유의성(p <0.05)을 확인하였다.
결과 및 고찰
일반성분
건조방법에 따른 적하수오의 일반성분 분석결과는 Table 5와 같다. 열풍건조 적하수오, 음건 적하수오 및 동결건조 적하수오의 수분함량은 각각 7.35%, 8.25% 및 3.18%로 동결건조 적하수오의 수분함량이 가장 낮게 나타났다. 이는 Lee et al. (2016)이 건조방법별 아로니아의 수분함량은 진공동결건조 시험구가 가장 적은 수분함량을 나타낸다고 보고한 연구결과와 동일한 경향을 나타내었다. 조단백질 함량은 동결건조 적하수오가 7.13%로 열풍건조 적하수오 4.29% 및 음건 적하수오 5.64%에 비하여 높은 함량을 나타내었다. 열풍건조 적하수오, 음건 적하수오 및 동결건조 적하수오의 조지방 함량은 각각 0.57%, 1.11% 및 0.91%로 나타났으며, 이는 같은 마디풀과 식물인 소리쟁이 뿌리의 조지방 함량 2.58%에 비하여 다소 낮은 함량을 보였다(Jeong, 2011). 조회분 함량은 각각 4.62%, 4.91% 및 5.28%로 나타났다. 열풍건조 적하수오, 음건 적하수오 및 동결건조 적하수오의 조섬유 함량은 각각 3.38%, 3.26% 및 2.92%로 나타났다. 가용성무질소물 함량은 동결건조 적하수오(80.58%)와 열풍건조 적하수오(79.79%)가 음건 적하수오(76.83%)에 비하여 높은 함량을 나타내었다. 가용성무질소물은 soluble sugar, starch, 일부 cellulose, hemicellulose 및 lignin 등으로, 탄수화물은 가용성무질소물과 조섬유의 합으로 표현 할 수 있다고 보고한 바 있다(Yoon et al., 2009). 건조방법에 따른 적하수오의 탄수화물 함량은 동결건조와 열풍건조에서 높게 나타나, 건조시간이 짧은 두 가지 건조방법의 가용성무질소물 손실이 적은 것으로 나타났다.
Table 5. Proximate compositions of PMR based on various dry method
yMeans with the same letter within the row are not significantly different at P<0.05 determined through DMRT.
유리당
건조방법을 달리한 적하수오의 유리당은 Table 6과 같이 fructose, glucose 및 sucrose가 검출되었으며, 총 유리당 함량은 동결건조 적하수오, 음건 적하수오 및 열풍건조 적하수오 순으로 열을 적게 가한 적하수오의 총 유리당 함량이 높게 나타났다. 열풍건조 적하수오에서 유리당 함량은 sucrose가 7.06%, glucose와 fructose가 각각 0.58%와 0.57%로 나타났으며, 음건 적하수오의 유리당 함량은 sucrose가 9.83%, glucose와 fructose가 각각 0.67%와 0.99%로 나타났다. 동결건조 적하수오의 유리당 함량은 sucrose가 12.06%, glucose와 fructose가 각각 0.99%와 1.47%로 나타났다. Kim and Joo (1989)는 인삼의 유리당을 추출할 때, glucose는 온도가 증가 할수록 감소하고, fructose는 온도가 증가 할수록 증가하며, sucrose는 80℃ 이하에서는 함량의 변화를 나타내지 않는다고 보고한 바 있다. 건조방법에 따른 적하수오에 함유된 glucose는 건조 온도가 증가 할수록 감소하는 동일한 결과를 나타내었으나 fructose와 sucrose는 동결건조 > 음건 > 열풍건조 순으로 높게 나타났다. 본 연구에서 3종의 유리당과 총당의 함량은 동결건조 시에 가장 높게 나타났는데, 이는 건조방법에 따른 온도의 영향이 큰 것으로 보인다.
Table 6. The contents of free sugars in the PMR based on various dry method
yMeans with the same letter within the row are not significantly different at P<0.05 determined through DMRT.
유기산
건조방법에 따른 적하수오의 유기산 분석결과는 Table 7과 같다. 적하수오의 유기산 분석결과 oxalic acid, tartaric acid, malic acid 및 malonic acid 총 4종의 유기산이 검출되었으며, 그중 oxalic acid가 모든 건조방법에서 가장 높게 나타났다. 이는 적하수오와 같이 지하부를 이용하는 야콘 연구에서 Kim et al. (2010)은 유기산 중에서 oxalic acid 함량이 가장 높게 나타난 것과 유사한 결과이다. 열풍건조 적하수오의 유기산 함량은 oxalic acid가 524.45 ㎎%로 나타났으며, tartaric acid, malic acid 및 malonic acid는 각각 84.70 ㎎%, 95.75 ㎎% 및 12.38 ㎎%로 나타났다. 음건 적하수오의 유기산 함량은 oxalic acid가 1,482.32 ㎎%로 나타났으며, tartaric acid, malic acid 및 malonic acid가 각각 143.66 ㎎%, 63.92 ㎎% 및 31.46 ㎎%로 나타났다. 본 연구에서 가장 많이 검출된 유기산인 oxalic acid는 체내에서 축척되어 무기질과 불용성염을 형성하여 무기질의 생체 내 이용도를 낮추는 것으로 알려져 있다(Lee et al., 2007). 본 연구결과 건조방법을 달리한 적하수오에 함유된 oxalic acid는 동결건조 적하수오, 열풍건조 적하수오 및 음건 적하수오 순으로 낮게 나타났다. 이는 Kim et al. (2012)이 대부분의 유기산이 데치기 과정 중 조리수에 용출되어 손실된다고 보고한 연구결과를 미루어 볼 때 건조 후 수분 함량이 다른 시험구에 비하여 동결건조 적하수오에서 낮은 함유량을 보였으며, 음건과 열풍건조에서는 수분을 포함한 절단 적하수오 덩이뿌리가 지속적인 열풍 건조과정 중 수분으로 용출된 것으로 판단된다. 따라서 oxalic acid의 함량이 낮은 유기산을 활용하고자 할 경우 동결건조 또는 열풍건조 방법을 적용하는 것이 효율적으로 판단된다.
Table 7. The contents of organic acid in the PMR based on various dry method
yMeans with the same letter within the row are not significantly different at P<0.05 determined through DMRT.
구성 아미노산
건조방법에 따른 적하수오의 구성아미노산 분석결과는 Table 8과 같다. 총 16종의 아미노산이 검출되었으며, 열풍건조, 음건 및 동결건조 적하수오의 총 아미노산 함량은 각각 3,469.03 ㎎%, 5,630.84 ㎎% 및 6,256.54 ㎎%로 동결건조 적하수오가 열풍건조와 음건 적하수오에 비하여 높은 함량을 보였다. 이는 Son et al. (2011)이 보고한 건조방법에 따른 매생이의 총 아미노산 함량이 동결건조 매생이에서 높았다는 결과와 유사하였다. 필수아미노산 함량 또한 음건 적하수오와 동결건조 적하수오가 각각 1,929.83 ㎎% 및 1,996.191 ㎎%로 열풍건조 적하수오(1,169.05 ㎎%)에 비하여 높게 나타났다. 총 구성아미노산 중 필수아미노산의 비율은 열풍건조 적하수오, 음건 적하수오 및 동결건조 적하수오가 각각 33.70%, 34.27% 및 31.91%로 큰 차이를 보이지 않았다. Rho and Lee (2006)의 연구에서 가열처리한 팥의 아미노산 함량이 가열온도에 비례하여 감소된다는 결과를 바탕으로 건조온도가 높아짐에 따라 아미노산 함량 감소가 발생함을 보고한 바 있으며, 본 연구에서도 동일한 경향을 확인하였다.
Table 8. Contents of total amino acids in the PMR based on various dry method
yTAA, total amino acid.
xEAA, total essential amino acid (Thr.+Val.+Met.+Ile.+Leu.+Phe.+His.+Lys.).
wEAA/TAA (%), total amino acid/total essential amino acid.
vMeans with the same letter within the row are not significantly different at P<0.05 determined through DMRT.
열풍건조 적하수오의 경우 구성 아미노산 중 arginine이 586.67 ㎎%로 가장 높았고, 다음으로는 glutamic acid, proline, aspartic acid 순으로 나타났다. 음건 적하수오도 arginine이 1,091.06 ㎎%로 가장 높았고, 다음으로는 glutamic acid, lysine, aspartic acid 순으로 높은 함량을 나타내었다. 가장 높은 아미노산을 함유하고 있는 동결건조 적하수오는 arginine이 1,258.01 ㎎%로 다른 건조방법 시료에 비하여 가장 많은 함량을 보였고, 다음으로는 glutamic acid, proline, serine 순으로 높게 나타났다. Kim et al. (1999)은 arginine과 histidine이 성장에 관여하는 필수아미노산으로 보고한 바 있다. 본 연구결과 적하수오에는 다량의 아미노산이 함유되어 있으며 그 중 모든 건조방법에서 다른 아미노산에 비해 arginine이 높은 함량을 확인하였으며, 그 중 동결건조 적하수오에서 가장 높은 반면 열풍건조 적하수오는 가장 낮은 함량을 보였다. 총 아미노산 함량과 필수아미노산 함량도 열풍건조 적하수오가 가장 낮은 함량을 나타내었다. 따라서 적하수오의 아미노산을 활용할 경우 동결건조 또는 음건의 방법을 택하는 것이 높은 아미노산 함량을 유지할 수 있는 방법으로 사료된다.
유리 아미노산
건조방법에 따른 적하수오의 유리 아미노산 분석결과는 Table 9와 같다. 총 16종의 아미노산이 검출되었으며, 구성 아미노산과 동일하게 arginine이 가장 높게 나타났다. 건조방법에 따른 적하수오의 유리 아미노산 함량은 arginine과 proline이 높게 나타났다. 열풍건조 적하수오, 음건 적하수오 및 동결건조 적하수오에 함유된 arginine은 각각 210.48 ㎎%, 170.44 ㎎% 및 258.51 ㎎%로 동결건조방법이 가장 높게 나타났으며, proline은 각각 135.11 ㎎%, 56.48 ㎎% 및 119.18 ㎎%로 열풍건조방법에서 높게 나타났다.
Table 9. Contents of free amino acids in the PMR based on various dry method
yTAA, total amino acid.
xEAA, total essential amino acid (Thr.+Val.+Met.+Ile.+Leu.+Phe.+His.+Lys.).
wEAA/TAA (%), total amino acid/total essential amino acid.
vMeans with the same letter within the row are not significantly different at P<0.05 determined through DMRT.
총 유리아미노산의 함량은 열풍건조 적하수오, 음건 적하수오 및 동결건조 적하수오에서 각각 487.75 ㎎%, 312.64 ㎎% 및 694.68 ㎎%로 나타났으며, 필수아미노산은 동결건조 적하수오가 154.59 ㎎%로 가장 높게 나타났다. Jeong (2011)은 적하수오와 같이 덩이뿌리를 사용하는 백합과 청미래덩굴과 뿌리를 활용하는 쇠무릎 뿌리의 총 아미노산 함량 중 필수아미노산 함량이 각각 17.7%와 19.09%로 보고한 바 있다. 이는 열풍건조 적하수오와 음건 적하수오보다는 높은 비중이지만 동결건조 적하수오가 22.25%로 비교적 유사한 비중을 나타내고 있다. 본 연구결과와 구성 아미노산의 결과를 바탕으로 미루어 볼 때 아미노산의 손실을 낮추기 위해서는 최종 적으로 동결건조방법을 활용하는 것이 적합한 것으로 판단된다.
무기성분
건조방법에 따른 적하수오의 무기성분 분석결과는 Table 10과 같다. 적하수오의 무기성분 분석결과 potassium, calcium, magnesium 및 sodium이 검출되었다. 열풍건조 적하수오의 무기성분 함량은 potassium이 1,077.18 ㎎%로 가장 높았으며, 다음으로는 calcium, magnesium 및 sodium의 함량이 각각 125.89 ㎎%, 110.36 ㎎% 및 8.14 ㎎% 순으로 높게 나타났다. 음건과 동결건조 적하수오도 potassium이 각각 1,392.02 ㎎%, 1,515.01 ㎎%로 가장 높게 나타났다. 다음으로는 magnesium, calcium 및 sodium의 순으로 확인 되었다. Potassium, calcium, magnesium 등 무기성분은 신경전달 및 신체의 생리작용에 관계하고 있는 것으로 아려져 있으며(Kim et al., 1999), 적하수오의 potassium 함량은 산약(3,698.7 ㎎%)과 우슬(4,665.7 ㎎%)보다 적지만, 동결건조 적하수오는 감초 등 약초 87종의 평균값인 1,649.7 ㎎%와 비슷한 함량을 보였다(Hwang et al., 1997). 본 연구결과 적하수오에 함유된 무기성분 중 potassium 함량이 월등히 높게 나타났으며, 건조방법에 따라 무기성분의 종류와 함량은 차이를 보였다. 또한 총 무기성분의 함량은 동결건조, 음건, 및 열풍건조 순으로 높게 나타났다.
Table 10. The contents of mineral in the PMR based on various dry method
yMeans with the same letter within the row are not significantly different at P<0.05 determined through DMRT.
지방산
건조방법에 따른 적하수오의 지방산 분석결과는 Table 11과 같다. 적하수오에 함유된 지방산은 포화지방산 1종, 불포화지방산 2종으로 총 3종이 검출되었다. 건조방법별 적하수오에서 모두 linoleic acid 함량이 가장 높게 나타났다. Kang (1987)은 동물실험에서 영양상 중요한 불포화지방산인 linoleic acid는 결핍될 경우 mouse의 성장이 저하되고 피부염, 피부건조 등의 증상이 발생함을 보고한 바 있다. 건조방법에 따른 포화지방산 palmitic acid와 단일 불포화 지방산 oleic acid는 열풍건조 적하수오가 가장 높게 나타났으며, 다가불포화지방산인 linoleic acid는 동결건조 적하수오가 가장 높게 나타났다. Son et al. (2011)은 매생이의 지방산분석에서 palmitic acid를 포함한 포화지방산은 열에 안정적이지만 oleic acid와 linoleic acid를 포함한 불포화지방산은 열에 불안정 적이므로 열풍건조 시 감소되어 본 연구의 건조방법에 따른 지방산 조성과는 차이를 나타내었다. 식물의 덩이뿌리를 사용하는 돼지감자의 지방산 함량 측정에서 Kim et al. (2014)은 linoleic acid, palmitic acid, ɤ–linolenic acid 및 oleic acid의 검출을 보고한 바 있다. 또한 수미, 세풍 및 조미 감자의 연구에서도 지방산 중 linoleic acid가 가장 높은 지방산 조성을 보여(Kwon et al., 2006) 적하수오의 주요 지방산인 linoleic acid가 높게 검출된 것과 유사한 경향을 보였다. 본 연구결과 포화지방산의 함량이 낮으며, linoleic acid의 함량이 높은 적하수오를 활용하기 위해서는 동결건조가 적합할 것으로 판단된다.
Table 11. The contents of fatty acids in the PMR based on various dry method
yMeans with the same letter within the row are not significantly different at P<0.05 determined through DMRT.
적 요
본 연구는 생산과 수요가 늘고 있는 마디풀과 하수오의 최적 건조방법 구명을 통한 식품소재화 및 산업화를 목적으로 수행하였다. 하수오의 최적 건조방법을 구명하기 위해 열풍건조, 음건 및 동결건조 적하수오의 일반성분, 유리당, 아미노산 및 지방산 등을 비교분석하였다. 건물량을 기준으로 건조방법에 따른 적하수오의 일반성분 함량을 비교 하였을 때, 수분함량은 동결건조 적하수오가 유의적으로 낮게 나타났다. 유리당 분석에서 총 유리당 함량은 동결건조 적하수오에서 높게 나타났으며, fructose, glucose 및 sucrose의 함량 역시 동결건조 적하수오, 음건 적하수오, 열풍건조 적하수오 순으로 높게 나타났다. 유기산은 총 5종이 검출되었으며, oxalic acid가 가장 높게 나타났다. 적하수오의 주요 구성 아미노산은 arginine, glutamic acid, proline, serine, lysine 등이며, 총아미노산 함량, 필수아미노산 함량은 모두 동결건조 적하수오에서 높게 나타났다. 총 구성 아미노산 중 필수아미노산 함량 비율은 음건 적하수오에서 높게 나타났다. 유리 아미노산은 세가지 건조방법 모두에서 arginine과 proline이 함량이 높게 나타났으며, 총아미노산 함량, 필수아미노산 함량 및 총 구성 아미노산 중 필수아미노산 함량 비율은 모두 동결건조 적하수가 가장 높게 나타났다. 적하수오의 무기성분은 총 4종이 검출되었으며, potassium이 가장 많았으며, sodium이 가장 낮게 나타났다. 적하수오에서 지방산은 포화지방산인 palmitic acid 1종과 불포화지방산인 oleic acid와 linoleic acid 2종이 검출되었다. 이상의 결과로 볼 때 하수오의 유용성분 손실이 가장 적은 건조방법은 동결건조로 생각되며, 산업적인 측면에서 비용을 고려한 건조방법은 건조온도를 조절한 열품건조 방법의 고안이 필요할 것으로 생각된다.