서 언
재료 및 방법
식물재료 및 추출
유효성분 분석
항산화 활성
세포 배양 및 세포 독성
UVB 조사
Western blot
통계학적 분석
결 과
추출용매에 따른 유효성분 함량
항산화 활성
세포독성
UVB 조사에 의한 DNA damage 억제 효과
UV 조사에 의한 항염증 효과
고 찰
적 요
서 언
신체의 가장 바깥층에 노출되어있는 피부 조직은 기본 신진대사를 통해 외부로부터 체내를 보호하고 항상성을 유지하는 중요한 기능을 담당하고 있다. 노화는 생명체의 자연스러운 현상이긴 하지만 다양한 원인으로 피부가 자극을 받으면 노화가 가속화되고 피부 고유의 기능이 점차 손상된다. 피부 노화는 나이가 증가하면서 개인의 유전적인 요인에 의하여 발생하는 내재적인 노화(intrinsic aging)와 자외선이나 외부 물질의 자극 등에 의한 산화적 스트레스에 의하여 발생하는 외인성 노화(extrinsic aging) 또는 광노화(photoaging)로 나눌 수 있다(Meinhard et al., 2001). 외인성 노화인 광노화의 주 원인은 태양광선에 의한 자외선의 자극에 의한 것으로 자외선은 생체 내 활성산소종(ROS: reactive oxygen species)의 생산과 항산화 방어체계(antioxidant defense system)의 균형을 깨뜨려 피부조직 내 활성산소의 과다 생성으로 세포내 구조와 세포막에 손상을 일으키며 산화 스트레스를 유발하게 된다. 이러한 ROS에 의한 피부의 산화적 스트레스는 DNA의 화학적 변형에 의해 DNA 구조 변화와 단백질 합성의 저해가 초래되고(Rastogi et al., 2010), 염증성 사이토카인(cytokine) 생성 촉진, 콜라겐(collagen) 합성 감소, 결체조직의 분해 촉진 등이 발생한다. 따라서 자외선에 의한 피부 손상을 감소시키는 것은 피부의 노화를 지연시켜 피부건강을 유지 시키기 위해 중요하다(Rivas et al., 2011).
자외선은 파장에 따라 UVA (320 ~ 440 ㎚), UVB (280 ~ 320 ㎚) 및 UVC (200 ~ 280 ㎚)로 구분 되어지며, 이 중 UVC는 대부분 오존층에서 흡수되므로 인체의 피부에 영향을 미치는 자외선은 UVA와 UVB이다(Pandel et al., 2013). UVA는 UVB 보다 표피 내에서의 흡수가 적고 피부 깊숙하게 침투할 수 있어 장기적인 피부 노출시 피부 노화 현상을 유발한다. 그러나 UVB 광자는 UVB 광자보다 유전독성이 약 1,000배 더 강하며 생물학적 피부손상을 유발한다(Yaar et al., 2007). UVB는 면역력 저하, DNA 손상, 피부암을 일으키는 주된 원인으로 작용 되며 피부 세포내의 산화반응이 촉진되어 항산화 방어기전의 불균형을 초래하고 일련의 염증반응을 일으키게 된다(Lim et al., 2002). 따라서 외부 환경적 산화적 스트레스로부터 피부세포를 보호하기 위해서는 안전성이 높은 천연물유래 항산화활성이 높은 소재개발이 절실하다(Kim and Jeong, 2021; Kwak, 2019)
명월초(Gynura procumbens)는 남부아시아, 인도네시아와 태국, 말레이시아가 원산지인 열대국화과의 식물이다. 인도네시아에서는 ‘sambungnyawa’라고 불리며, 신이 내린 장수채소로 알려져 있다(Rosidah et al., 2008). 일본과 중국에서 노화 방지 및 혈전 용해 효과를 지닌 장수식품으로 여겨지고 있으며, 해독작용에도 뛰어나 숙취해소에 좋고 피부미백에도 효과가 있다고 알려져 있다(Bhore et al., 2010; Hew et al., 2013; Kim et al., 2013; Yam et al., 2008). 뿐만아니라, 항당뇨(Zhang and Tan, 2000), 고혈압(Kim et al., 2006) 및 간과 고 콜레스테롤혈증(Kim et al., 2003)에도 효과가 있다고 알려져 있어 국내에서도 건강기능식품 소재로 관심을 받고 있다.
따라서 본 연구에서는 명월초의 추출 방법에 따른 항산화 효과 및 유효성분을 비교하고 자외선(UVB)조사에 따른 DNA손상억제 및 항염증 효과를 검증하여, 명월초의 화장품 및 의약품 소재산업화를 위한 기초적 자료를 제공하고 천연물 소재로써의 활용 가치를 증대시키고자 한다.
재료 및 방법
식물재료 및 추출
본 연구에 사용된 명월초는 충청북도농업기술원 유기농업연구소에서 재배된 시료를 제공받아 사용하였다. 채취된 명월초 잎은 동결건조하고 분말화하여 시료로 사용하였다. 건조된 명월초 20 g에 각 추출용매(물 100%, 주정 30%, 주정 70%, 및 주정 100%) 500 mL로 3일동안 실온에서 추출하였다. 추출 기간동안 매일 1시간 동안 초음파 처리(UCS-10, Jeiotech) 하였다. 추출된 추출물은 필터페이퍼에 여과하여 진공회전농축기(N-1110S, EYELA, Tokyo, Japan)로 농축한 후 동결건조하여(FDU-1200, EYELA) 분말화한 다음 분석 및 효능평가를 위한 시료로 사용하였다.
유효성분 분석
총페놀성 화합물 : 추출물 내 총 페놀성 화합물의 함량 분석은 Folin-Denis 방법(AOAC, 1995)을 참고하여 분석하였다. 추출물 50 μL와 증류 수 950 μL 및 folin 500 μL를 혼합한 후, 20% sodium carbonate 2.5 mL를 넣고 40분간 실온에서 정치시켰다. 상등액을 UV/Visible 분광 광도계로 725 ㎚에서 흡광도를 측정하였다. Tannic acid를 표준품으로 하여 정량 직선 방정식을 사용하여 정량하였다.
총플라보노이드 : 총플라보노이드 함량은 각 추출시료 0.5 mL, 증류수 3.2 mL, 5% NaNO2, 150 μL를 혼합하여 5분간 반응시켰다. 10% AlCl3용액을 첨가하여 1분간 더 반응시키고 1M NaOH를 넣고 혼합하여 510 ㎚에서 흡광도를 측정하였다. 시료내 총플라보노이드 함량은 농도별 catechin을 동일한 방법으로 반응하여 흡광도를 측정한 뒤 검량선을 작성하여 계산하였다.
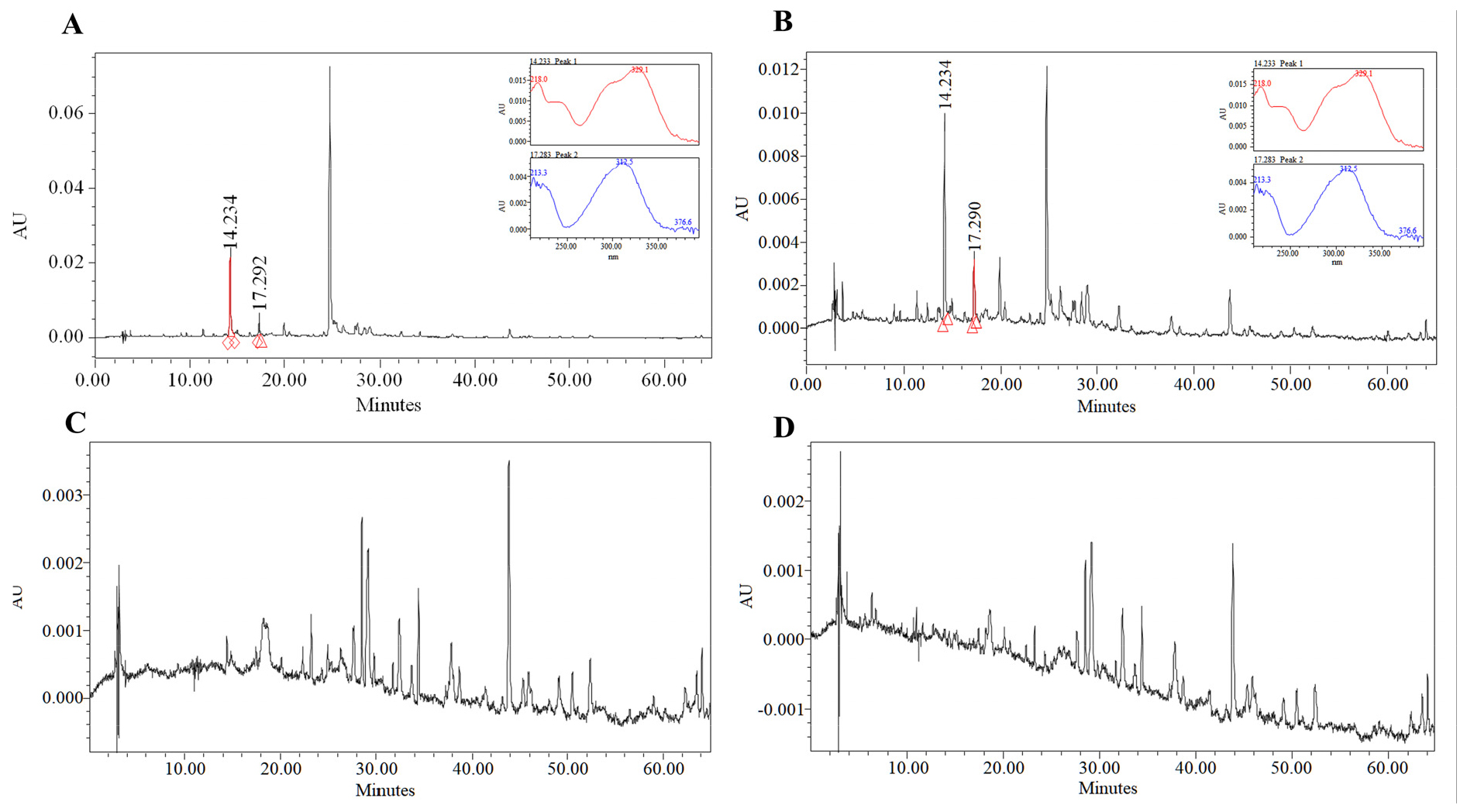
HPLC 분석 : 각 추출물내 chlorogenic acid와 caffeic acid 함량은 HPLC 2915/2996 system (Waters, Milford, MA, USA)을 이용하여 분석하였다. 칼럼은 Xbridge C18 (250 ㎜ × 4.6㎜, 5 μm, Waters)를 사용하였고, 이동상은 0.1%의 물(A)과 Acetonitrile (B)을 사용하여 분당 1 mL 유속으로 다음과 같은 조건에서 분석하였다. Gradient program: 0 min, 98% B; 0-60 min, 98-40% B; 60-65 min, 0% B; 65-70 min, 98% B; 70-75 min, 98% B. 추출물 내 Chlorogenic acid와 caffeic acid는 표준품과 비교하여 동일한 시간대 peak와 PDA를 이용한 표준품의 흡광스펙트럼을 확인하여 정성 분석하였고, 농도별 표준품 분석을 통해 정량선을 작성하여 시료의 함량을 분석하였다.
항산화 활성
1,1-diphenyl-2-picryl hydrazyl (DPPH)를 이용한 전자공여능(Bondet, 1997)과 2,2'-azinobis-(3-ethylbenzothiazoline-6-sulfonate) (ABTS) 라디칼 소거 활성(Van den Berg et al., 1999)를 통해 추출물의 항산화활성을 평가하였다. DPPH 용액은 515 ㎚에서 흡광도가 1.00이 되도록 희석하여 준비하고 ABTS 용액은 7 mM 3-ethylbenzthiazoline-6-sulfonic acid (2,2'azino-bis)와 2.45 mM potassium persulfate를 혼합하여 24시간동안 ABTS+ 을 형성시킨 후 증류수를 이용하여 734 ㎚에서 흡광도 값이 0.70이 되게 희석하여 준비하였다. 각 용액 760 μL와 농도별 추출시료(4 ㎎/m) 40 μL를 혼합한 다음 20분간 37℃에서 반응시킨 후 UV/Visible spectrophotometer (Human Cop, Seoul, Korea)를 이용하여 515 ㎚ (DPPH)와 734 ㎚ (ABTS)에서 흡광도를 측정하였다. 시료처리에 의한 항산화 활성은 대조구의 흡광도와 비교하여 %로 표시하였다.
세포 배양 및 세포 독성
본 연구에 사용된 인간 섬유아세포주인 Hs68 (human skin fibroblast)은 ATCC (Manassas, VA, USA)로부터 분양받아 사용하였다. Hs68 세포는 1% penicillin/streptomycin 및 10% fetal bovine serum이 포함된 DMEM에서 37℃, 5% CO2 조건하에 배양하였다. 각 추출물의 세포독성을 평가하기 위해 Hs68 세포를 96-well plate에 1 × 105 cells/well로 24시간 동안 배양한 다음 각 용매별 추출물 25, 50, 100, 200 μg/mL씩 처리하였다. 추출물 처리 24시간 후 CellTiter 96® AQueous One Solution (Promega, Madison, WI, USA)를 이용하여 490 ㎚에서 흡광도를 측정한 다음 무처리구와 비교하여 세포 독성을 평가하였다.
UVB 조사
인간 섬유아세포주인 Hs68을 60∅ cell culture dish에 2.5 × 105 cells/well로 24시간 배양한 다음 각 추출물 100 μg/mL로 처리하여 2시간 동안 배양한 다음 배지를 제거하고 UV Crosslinker (XL-1000, Artisan Technology Group, Champaign, IL, USA)를 이용하여 UVB를 40 mJ/㎠로 조사하였다. UVB 조사후 각 추출물 100 μg/mL가 포함된 배지를 첨가하고 24시간 배양 후 RIPA buffer (Thermo Scientific, Waltham, MA, USA)로 세포를 추출하여 BCA Protein Assay Kit (Abcam, Cambridge, MA, USA)를 이용하여 단백질을 정량한 다음 western blotting을 위한 시료로 사용하였다.
Western blot
단백질 정량된 세포 추출물은 SDS-PAGE를 통해 단백질을 분리하고 Trans-Blot Turbo Transfer System (Bio-Rad, Hercules, CA, USA)를 이용하여 단백질을 polyvinylidene difluoride membrane (PVDF)에 transfer 한 다음 1시간 동안 blocking (5% BSA in TBST) 하였다. 1차 항체를 1:2000으로 희석하여 4℃에서 overnight 처리하였다. 이후 10분 간격으로 TBST로 3회 세척하고, 2차 항체 1:5000으로 희석하여 1시간 동안 반응시켰다. 이후 10분 간격으로 TBST로 3회 세척하고, enhanced chemiluminescence (ECL) western blotting detection kit (Bio-Rad)로 반응하였다. 각 단백질 밴드는 ChemiDoc Imaging Systems (Bio-Rad)로 촬영하여 확인하였다.
통계학적 분석
모든 실험 결과는 3번 이상 수행하였으며, 통계분석은 SPSS 18.0 (Statistical Package for the Social Sciences) 을 이용하여 각 실험의 평균과 표준편차를 계산하였고, ANOVA를 통한 P < 0.05 수준에서 Duncan 다중검정법(duncan's multiple range test)으로 사후 검정하여 각 실험의 유의성을 검증하였다.
결 과
추출용매에 따른 유효성분 함량
본연구에서는 주정 농도별 명월초 추출물의 총페놀성 화합물, 총플라보노이드 화합물, 그리고 HPLC 분석을 통한 chlorogenic acid와 caffeic acid 함량을 비교하였다(Table 1). 총 페놀 화합물, 총 플라보노이드의 함량은 주정의 농도가 높을수록 함량이 높게 나타났다. 특히 주정 100% 추출물은 물 100% 추출물에 비해 총 페놀화합물과 총플라보노이드 함량이 각각 3.98배, 190.6배 높게 나타났다. 또한 chlorogenic acid 함량은 주정 100% 추출물에서 함량이 가장 높았고, 주정 농도가 낮을수록 함량이 감소하여 물 추출물에서는 검출되지 않았다. HPLC 분석에 의한 Chlorogenic acid는 14.2분과 caffeic acid 17.2분 대에서 peak가 확인되었고, 각 peak는 표준품의 PDA의 흡광 스펙트럼과 비교하여 최종적으로 확인하였다. Caffeic acid는 주정 100% 추출물에서만 검출되고 나머지 추출물에서는 검출되지 않았다(Fig. 1).
Table 1.
Content of active ingredients of extracts of Gynura Procumbens by different solvents.
| Samples | Active ingredients (㎎/g) | |||
| Total phenolic contents | Total flavonoid contents | Chlorogenic acid | Caffeic acid | |
| 100% water | 30.40±1.79 | 0.72±0.06 | ndz | nd |
| 30% alcohol | 49.46±2.31 | 1.17±0.70 | 0.25±0.05 | nd |
| 70% alcohol | 53.94±1.42 | 26.66±0.57 | 1.29±0.02 | nd |
| 100% alcohol | 121.02±1.88 | 137.29±0.79 | 3.05±0.07 | 0.017 |
항산화 활성
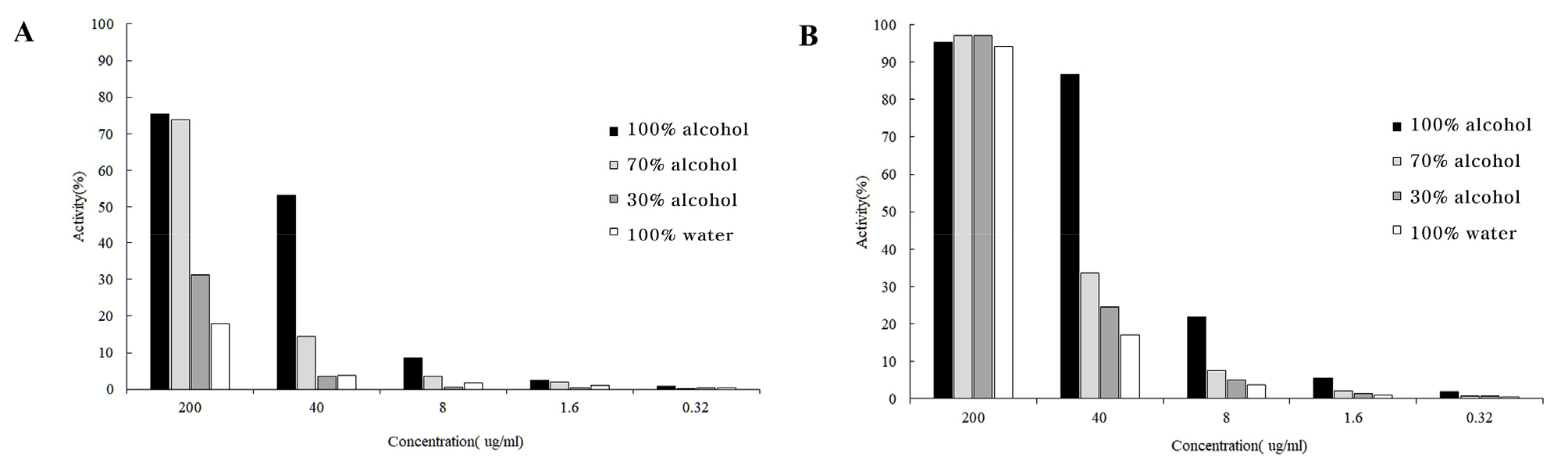
추출 용매별 명월초 추출물의 항산화 활성을 비교 평가하기 위해 DPPH와 ABTS 라디칼 소거활성을 측정하였다. 본 실험에서는 각 추출물 농도별 항산화 활성 평가를 통해 활성을 비교하였다(Fig. 2). DPPH 라디칼 소거활성은 추출물 200 μg/mL에서 가장 높은 활성을 나타냈으며, 주정의 농도가 높을수록 활성이 높았다. 주정 100%와 70% 추출물에서 각각 75.50%와 73.90%의 DPPH 라디칼 소거 활성을 나타냈다. 그러나 동일한 추출물의 농도에서 주정 30%와 물 100% 추출물은 31.20%와 17.10%로 상대적으로 낮은 활성을 나타냈다. 각 추출물의 DPPH 라디칼의 IC50 (inhibitory concentration 50)값은 주정 100%와 70% 추출물에서 각각 12.76 μg/mL, 185.17 μg/mL로 나타났으며, 주정 30%와 물 100% 추출물의 IC50값은 200 μg/mL 이상의 매우 낮은 활성 값을 나타냈다. ABTS 소거활성은 200 μg/mL에서 대부분 94% 이상으로 매우 높은 활성을 나타내어 추출물간 차이가 없었으나 추출물 농도 40 μg/mL일 때 주정 100%, 70%, 30%, 물 100% 추출물의 ABTS라디칼 소거활성은 각각 86.70%, 33.64%, 24.65% 및 17.00%로 나타나 추출 용매별 활성의 차이가 뚜렷하게 나타났다. 각 추출물의 ABTS 라디칼의 IC50값은 각각 12.80, 38.00, 47.89, 66.58 μg/mL로 추출용매의 주정 농도가 높은 순으로 값이 낮게 나타나 주정 100% 추출물의 ABTS 라디칼 소거활성이 가장 높은 것을 확인하였다.
세포독성
명월초의 추출용매별 추출물의 세포학적 연구를 위해 인간 섬유아세포주인 Hs68를 이용하여 추출물의 농도별 세포 독성을 평가하였다. 추출물 무처리구인 대조구에 비해 주정 농도별 추출물 25, 50, 100, 200 μg/mL의 농도로 처리하여 24시간후 세포 독성을 평가한 결과(Fig. 3), 전 처리구에서 세포 독성은 나타나지 않았다. 주정 100% 추출물 200 μg/mL에서 대조구에 비해 다소 낮은 세포 생존율을 보였으나 통계적으로 유의성은 나타나지 않았다. 본 연구에서 자외선에 스트레스에 의한 세포내 DNA 손상억제 및 항염증 활성을 비교하기 위해 주정 농도별 추출물을 100 μg/mL 농도로 처리하여 비교하였다.
UVB 조사에 의한 DNA damage 억제 효과
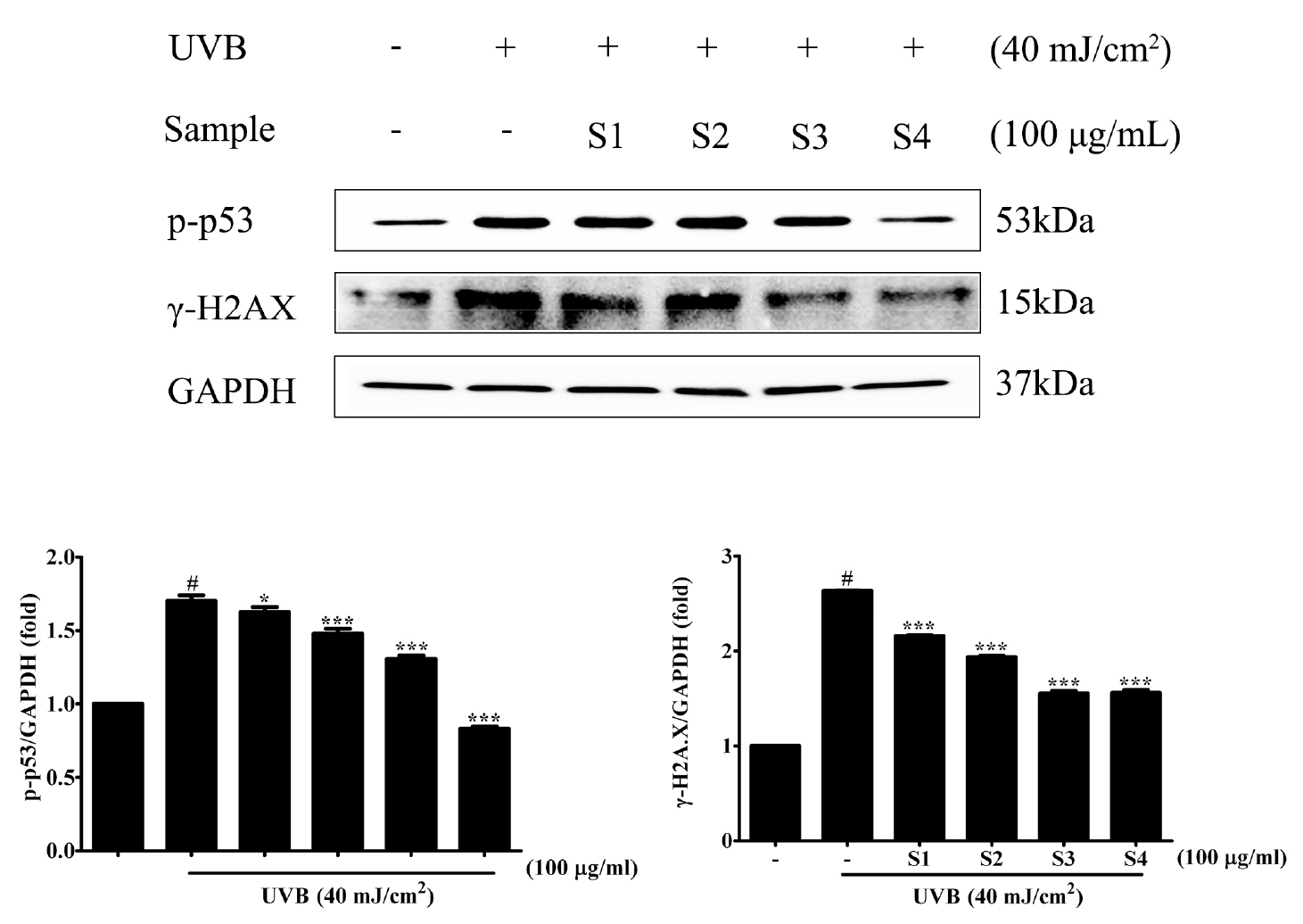
자외선 조사에 의한 명월초 추출물의 산화적 DNA 손상억제 효과를 확인하기 위해 Hs68 세포에 UVB를 조사하여 세포내 DNA 손상의 중요한 지표인자인 인산화된 p53 (p-p53)과 γ-H2AX(인산화된 H2AX) 단백질 발현을 확인하였다(Fig. 4). UVB 조사에 의해 p-p53과 γ-H2AX 단백질의 발현히 현저히 증가되었다. 대조구에 비해 물 100%와 주정 30% 추출물 처리에서는 p-p53과 γ-H2AX 단백질의 발현 억제는 다소 낮게 나타났으나 주정 100%와 70% 추출물에서는 두 단백질 인자의 발현히 현저히 낮아진 것을 확인하였다.
UV 조사에 의한 항염증 효과
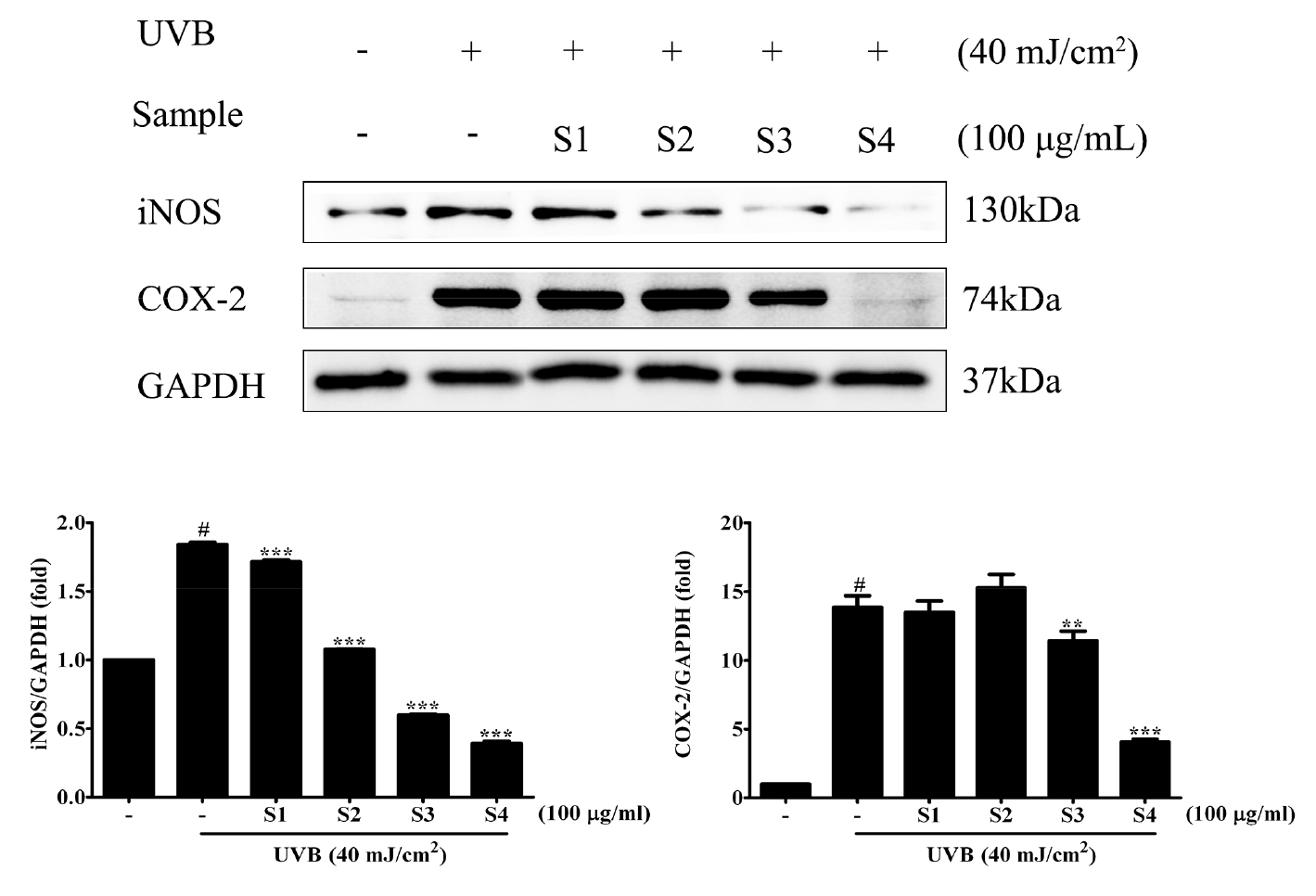
UVB를 조사에 의한 Hs68세포내 염증 반응 및 명월초 추출물의 항염증 반응을 확인한 결과(Fig. 5), UVB 무처리구에 비해 UVB(시료무처리) 처리구인 대조구에서 염증 반응의 중요한 조절 인자인 iNOS와 COX-2의 발현이 현저히 증가하였다. UVB에 의해 유도된 iNOS와 COX-2 발현은 추출 용매별 각 시료 100 μg/mL의 농도로 처리에 억제되었으며, 용매의 종류에 따라 항염증 활성이 현저한 차이를 나타내었다. 추출용매의 주정 농도에 따라 농도 의존적으로 항염증 활성이 높게 나타났다.
고 찰
인체 내에서 생성되는 활성산소는 항산화효소와 같은 기제들과의 평형이 무너지고 항상성이 깨어지게 되면 산화적 스트레스가 발생하게 된다. 그로 인해 노화, 당뇨, 비만과 같은 각종 만성 질병들의 원인이 된다(Halliwell, 1996). 식물계의 페놀계의 화합물은 식물의 2차 대사산물의 하나로서 다양한 구조와 분자량을 가지며, phenolic hydroxyl기를 가지고 있기 때문에 단백질 등의 거대 분자들과 결합하는 성질이 있어 항산화, 항균활성 등과 같은 여러 생리 기능을 가진다고 보고되어 있다(Choi et al., 2003; Kim et al., 2022). 명월초의 페놀 화합물은 gallic acid, protocatechuic acid, vanillic acid, syringic acid, chlorogenic acid, caffeic acid, p-coumaric acid, ferulic acid, sinapic acid 등이 보고되어 있다(Kaewseejan and Siriamornpun, 2015). 이 연구에서는 명월초 주정 100% 추출물이 가장 높은 항산화 효과 및 항염증 효과를 가진다는 사실이 밝혀졌다. HPLC 분석에 따르면 명월초 주정 100% 추출물에서 caffeic acid 및 chlorogenic acid의 함량이 각각 0.017 및 3.05 ㎎/g으로 가장 많은 함량을 보였다. 페놀성 화합물은 킬레이팅을 통해 금속이온들을 비활성화 시키고 추가적으로 superoxide-driven fenton reaction과 같은 활성산소종의 기원으로 알려져 있는 반응들을 억제하는 반응에 참여한다고 보고되어 있다(Arora et al., 1998; Rice-Evans et al., 1997). 명월초 주정 100% 추출물은 75.50% 및 의 86.70%의 DPPH 및 ABTS 라디칼 소거 활성을 보였다. 반면, 물 100% 추출물은 상대적으로 낮은 17.10% 및 17.00%의 DPPH 및 ABTS 라디칼 소거 활성을 보였다. 이러한 결과는 높은 농도의 주정 추출물이 유효성분 함량에 영향을 미친다는 것을 추론할 수 있다. 자외선은 피부 깊숙이 침투하여 ROS를 생성함으로써 세포의 DNA를 파괴시키거나 돌연변이를 일으켜 피부 상태를 악화(Kang et al., 2005)시키거나 피부에 홍반을 일으켜 iNOS (inducible Nitric Oxide Synthase) 매개에 의한 NO (Nitric Oxide) 생성의 증가를 유발한다고 알려져 있다(Goldsmithet al., 1996; Warren et al., 1993). p-p53, γ-H2AX, iNOS 및 COX-2는 명월초 주정 100% 추출물 처리구에서 가장 유의하게 감소 되었다. p-p53 및 γ-H2AX의 과도한 발현은 자외선에 의해 과도하게 생성된 ROS의 영향으로 p53은 세포 주기의 조절과 함께 DNA 손상을 감지하고 이에 대응하는 데 핵심적인 역할을 한다. 일반적으로 p53은 다양한 스트레스에의해 DNA가 손상되면 p-p53이 발현하며, 이는 손상된 DNA를 복구하기 위한 과정을 촉진 시킨다(Kastan et al., 1991). 또한 H2AX는 세포의 DNA 손상에 응답하는 데 중요한 히스톤 단백질로 DNA 이중 나선의 일부가 손상되면 H2AX는 손상된 지점에 높은 농도로 발현하고, 이것은 DNA 손상을 감지하고 수리 프로세스를 시작하는 신호로 작용합니다(Celeste et al., 2003; Sedelnikova et al., 2003). 특히, γ-H2AX는 DNA 이중 나선의 손상 지점에 형성되어 손상된 지점을 표시하고, DNA 수리 단백질들을 해당 지점으로 유도하여 손상을 수리하게 한다(Paull et al., 2000). 따라서 p-p53 및 γ-H2AX의 감소는 명월초 추출물내 항산화 물질에 의해 ROS를 안정화시켜 이러한 산화적 손상을 억제시킨 것으로 사료된다. iNOS 및 COX-2의 발현은 UVB에 야기되는 염증반응으로 iNOS 발현은 정상 인간 피부에서 UVB 조사 후 24시간 후에 유도된 것으로 보고되고 있다(Kuhn et al., 1998). 또한 UVB에 야기되는 염증반응에서 COX-2 (cyclooxygenase-2)의 발현에 관한 연구는 잘 알려져 있다(Chen et al., 2001). 이러한 염증반응에 있어 페놀성 화합물은 항염증에 효과적이라고 알려져 있다(Fang et al., 2008; Santangelo et al., 2007; Yu et al., 2009). iNOS 및 COX-2의 발현이 감소하는 경향은 명월초의 페놀성 화합물물의 함량 및 항산화 활성과 동일한 경향으로 나타났다. 종합적으로 명월초 주정 100% 추출물은 p-p53, γ-H2AX, iNOS 및 COX-2의 발현을 유의적으로 감소시켜 DNA damage 억제 및 항염증 효과를 나타냈다. 따라서 명월초 100% 주정 추출물은 DNA damage 및 염증반응을 조절할 가능성이 있는 천연물에서 추출헌 기능성 물질로 사용될 수 있음을 시사한다.
적 요
명월초(Gynura procumbens)를 활용한 천연물 기반 화장품 및 의약품 소재 개발을 위해 추출 방법에 따른 항산화 효과 및 유효성분을 비교하고 자외선(UVB)조사에 따른 DNA손상억제 및 항염증 효과를 검증하였다. 주정 농도별 명월초 추출물의 화합물, 총플라보노이드 화합물, 그리고 chlorogenic acid 및 caffeic acid 함량을 비교한 결과 주정 100% 추출 용매에서 유효성분의 함량이 가장 높게 조사되었다. 각 추추물의 DPPH와 ABTS 라디칼 소거활성에 의한 항산화 활성을 비교한 결과 추출 용매인 주정의 농도 의존적으로 항산화 활성이 높은 것으로 확인되었다. 또한 UVB로 조사된 Hs68 세포모델에서 명월초 추출물별 광노화 완화 효과를 확인하기 위해 DNA 손상억제 효과와 항염증 효과 확인였다. 100%주정 추출물은 UVB에 의한 p-p53과 γ-H2AX의 발현과 iNOS와 COX-2의 발현을 억제함으로써 산화적 DNA 손상 및 항염증 활성이 높은 것으로 나타났다. 따라서 UVB에 의해 과도하게 생성된 ROS의 영향으로 세포내 산화적 DNA 손상과 염증성 발현이 유발되며, 이러한 세포내 산화적 손상은 명월초 추출물의 항산화 물질에 의해 ROS를 감소시켜 산화적 손상이 억제되었을 것으로 사료된다. 또한 피부기능성 소재 개발을 위한 명월초의 효율적인 추출은 주정 또는 alcohol성 용매를 활용하는 것이 적절하다고 판단된다.