서 언
재료 및 방법
실험재료
시료 추출
Nitric oxide (NO) 생성능
MTT assay
Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR)
통계처리
결과 및 고찰
갈매나무과 분류군의 외부 형태학적 특성
갈매나무과 추출물의 NO 생성능
갈매나무과 추출물의 iNOS, COX-2, IL-1β, IL-6 및 TNF-α 발현
적 요
서 언
전 세계적으로 유행한 COVID-19는 병리학적으로 전염증성 사이토카인(Pro-inflammatory cytokines) 증가 및 면역력 저하 등과 같은 문제를 일으키며(Blanco-Melo et al., 2020; Pedersen and Ho, 2020; Wauters et al., 2020), 이런 면역력 저하는 다시 COVID-19의 감염률을 높이는 악순환의 결과를 초래해 사회적 문제를 야기시킨다(Anggriani et al., 2022). 이런 사회적 문제를 해결하고자 다양한 면역 조절관련 연구가 진행되고 있으며, 최근에는 면역증강, 항산화, 성인병 예방 및 노화방지 등과 같은 각종 생리활성을 나타내는 물질에 관한 연구가 활발히 수행되고 있다(Wagner, 1990).
인체에는 구조 및 화학적 장벽 외에도 외래 병원체에 맞서 싸우는 선천성 면역, 적응 면역 등 면역체계가 세밀하게 존재한다(Marshall et al., 2018). 선천적 면역세포 중 대식세포는 외래 병원체를 제거해 신체 항상성을 유지하는 중요한 역할을 하는 것으로 알려져 있는데(Hirayama et al., 2018), 외래 병원체의 자극으로 활성화된 대식세포는 식균작용과 산화질소(NO), 유도성 산화질소 합성효소(iNOS), 인터루킨-1β(IL-1β), 종양괴사인자-α(TNF-α) 등 다양한 면역자극 인자의 분비를 통해 외래 병원체를 제거하며, 이 중 NO는 면역 반응에 관여하는 T 세포 및 B 세포의 활성화를 유도한다(Medzhitov, 2007; Medzhitov and Janeway, 2000). 또한 식물체의 다당류는 대식세포를 활성화하여 신체의 면역체계를 강화하는데 특히 선천 및 적응 면역체계에 대한 활성 작용이 보고되고 있다(Geum et al., 2020; Shen et al., 2017). 즉 대식세포는 모든 면역체계에 관여하며, 대식세포의 활성화는 질병의 발생을 근본적으로 차단할 수 있는 중요한 표적이 될 수 있다(Mills and Ley, 2014; Mills et al., 2015).
갈매나무과(Rhamnaceae) 식물은 약 52속 925종이 전 세계에 널리 분포하고 있으며(Medan and Schirarend, 2004), 국내에는 7속(Berchemia 속, Hovenia 속, Paliurus 속, Rhamnella 속, Rhamnus 속, Sageretia 속, Zizyphus 속) 14분류군이 분포하는 것으로 알려져 있다(Chang and Kim, 2001; Choo et al., 1993). 갈매나무과 식물들은 전통 의약적으로 항암, 항염증의 의료용 및 과실의 식용 등 활용가치가 높은 분류군이며, 최근에는 헛개나무의 항염증 및 간 기능 강화 효능 연구(Kim et al., 2006; Woo et al., 2018), 망개나무 잎의 항염증 효능에 관한 연구(Kim et al., 2021), 먹넌출 열매 추출물의 대장암 세포 억제 효능(Kang et al., 2020), 상동나무 잎, 가지 추출물을 활용한 대장암과 폐암 세포 억제(Kim et al., 2019a) 및 항염증 활성(Kim et al., 2019b) 등 다양한 연구가 진행되고 있다. 그러나 국내에서 갈매나무과 분류군을 대상으로 전 세계적으로 유행 빈도가 증가하고 있는 전염병의 예방을 위한 면역증진 활성에 관한 연구는 Eo et al. (2021)의 상동나무 열매추출물의 면역력 증진 연구를 제외하면 미비한 실정이다.
따라서 본 연구의 목적은 자생지 및 분포 개체의 수가 적어 연구 재료로서의 활용에 어려움이 있는 좀갈매나무(R. taquetii)를 제외한 갈매나무과 13종[망개나무(B. berchemiifolia), 먹넌출(B. floribunda), 헛개나무(H. dulcis), 갯대추나무(P. ramosissimus), 까마귀베개(R. franguloides) 산황나무(R. crenata), 갈매나무(R. davurica), 털갈매나무(R. koraiensis), 돌갈매나무(R. parvifolia), 참갈매나무(R. ussuriensis), 짝자래나무(R. yoshinoi), 상동나무(S. thea), 묏대추나무(Z. jujube)]을 대상으로 분류군별 결실기 잎, 가지, 열매 등 3부위의 물 추출물에 대해 nitric oxide (NO) 생성능과 면역증진 관련 유전자 발현 검증을 수행하여 면역증진 활성효과의 가능성을 검증하고자 하였다.
재료 및 방법
실험재료
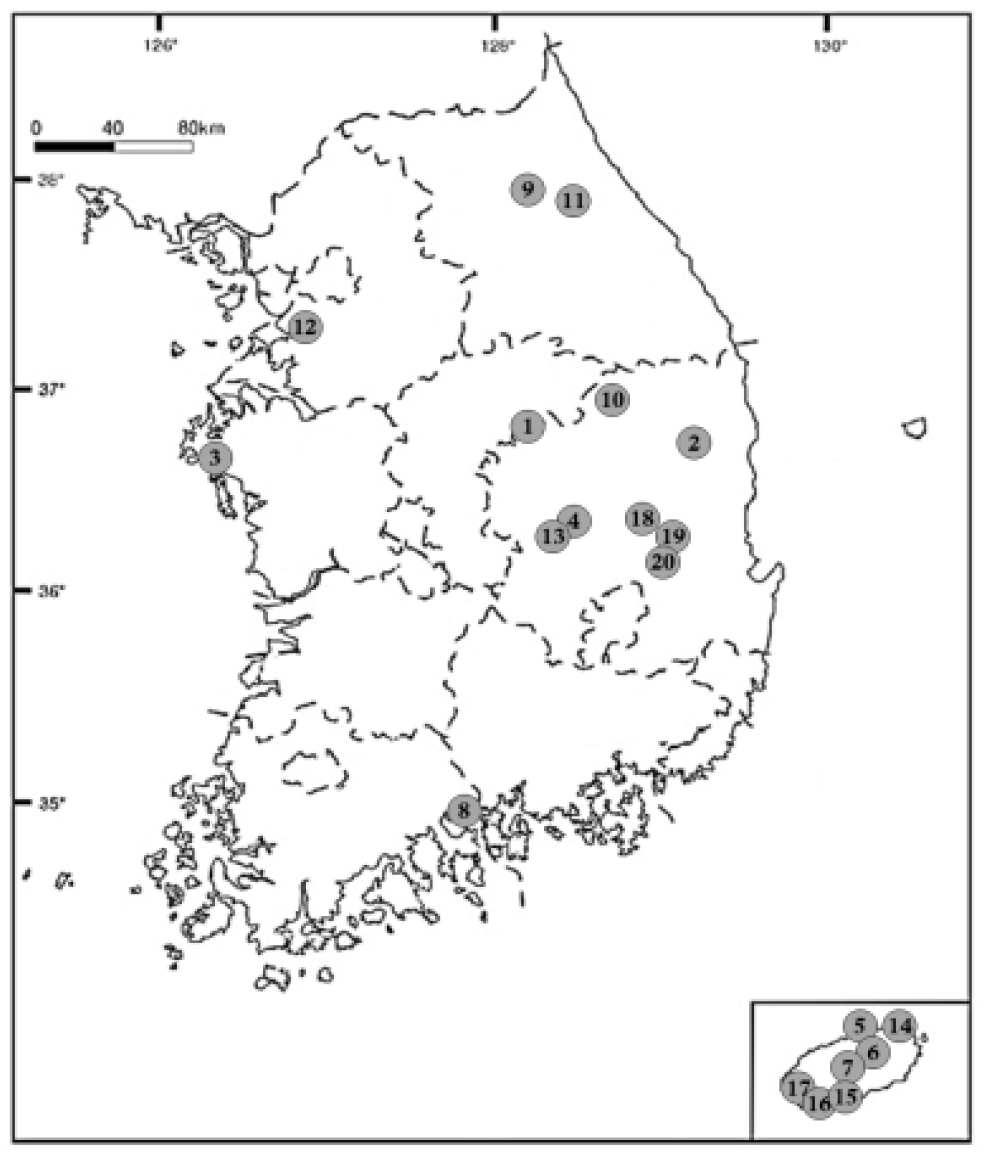
실험에 사용한 갈매나무과 13종의 잎, 가지, 열매 등의 재료는 안동대학교 정규영 교수의 식물분류학적 동정이 수반되어 2019년 4월부터 10월까지 결실기를 중심으로 수집하였다. 그리고 분류군별 증거표본은 국립산림과학원 산림약용자원연구소 식물표본관(FMRC)에 보관하였으며, 수집지와 증거표본 정보는 Fig. 1, Table 1과 같다.
Table 1.
The geographical infornation of Rhamnaceae in native habitats.
| NO | Taxon | Address | Coordinate | Voucher |
| 1 | B. berchemiifolia | CBz: Jecheon-si |
N 36°51′32.1″ E 128°05′16.2″ | FMRC-190829A1-A3 (FMRC) |
| 2 | 〃 | GBy: cheongsong-gun |
N 36°19′02.3″ E 129°13′16.3″ | FMRC-190828A1-A3 (FMRC) |
| 3 | B. floribunda | CNx: Taean-gun |
N 36°29′41.1″ E 126°21′46.7″ | FMRC-190905A1-A3 (FMRC) |
| 4 | H. dulcis | GB: Sangju-si |
N 36°19′35.6″ E 128°11′01.6″ | FMRC-190915A1-A3 (FMRC) |
| 5 | P. ramosissimus | JJw: Jeju-si |
N 33°33′51.6″ E 126°46′00.0″ | FMRC-190917A1-A3 (FMRC) |
| 6 | R. franguloides | JJ: Jeju-si |
N 33°30′57.1″ E 126°42′25.4″ | FMRC-190918A1-A3 (FMRC) |
| 7 | 〃 | JJ: Jeju-si |
N 33°26′23.4″ E 126°40′03.3″ | FMRC-190918A7-A9 (FMRC) |
| 8 | R. crenata | JNv: Yeosu-si |
N 34°49′33.6″ E 127°34′31.1″ | FMRC-190902A1-A3 (FMRC) |
| 9 | R. davurica | GWu: Pyeongchang-gun |
N 37°36′33.7″ E 128°40′14.6″ | FMRC-190924A1-A3 (FMRC) |
| 10 | R. koraiensis | CB: Danyang-gun |
N 37°00′32.4″ E 128°19′25.5″ | FMRC-191010A1-A3 (FMRC) |
| 11 | R. parvifolia | GW: Jeongseon-gun |
N 37°35′12.7″ E 128°53′52.1″ | FMRC-190910A1-A3 (FMRC) |
| 12 | R. ussuriensis | GGt: Gwangmyeong-si |
N 37°28′04.3″ E 126°51′32.8″ | FMRC-191010A7-A9 (FMRC) |
| 13 | R. yoshinoi | GB: Sangju-si |
N 36°20′48.6″ E 128°11′05.6″ | FMRC-191008A1-A3 (FMRC) |
| 14 | S. thea | JJ: Jeju-si |
N 33°33′51.6″ E 126°46′00.0″ | FMRC-190424A1-A3 (FMRC) |
| 15 | 〃 | JJ: Seogwipo-si |
N 33°15′50.9″ E 126°19′58.7″ | FMRC-190425A1-A3 (FMRC) |
| 16 | 〃 | JJ: Seogwipo-si |
N 33°11′59.9″ E 126°17′34.6″ | FMRC-190501A1-A3 (FMRC) |
| 17 | 〃 | JJ: Seogwipo-si |
N 33°16′20.8″ E 126°14′33.6″ | FMRC-190501A4-A6 (FMRC) |
| 18 | Z. jujube | GB: Andong-si |
N 36°31′27.8″ E 128°28′34.9″ | FMRC-190621A1-A3 (FMRC) |
| 19 | 〃 | GB: Uiseong-gun |
N 36°18′45.5″ E 128°44′35.0″ | FMRC-190926A1-A3 (FMRC) |
| 20 | 〃 | GB: Uiseong-gun |
N 36°17′08.1″ E 128°41′50.2″ | FMRC-190926A4-A6 (FMRC) |
시료 추출
수집한 재료(잎, 가지, 열매)를 세척하여 동결건조기(PFD-20V, MC Tech co., Ltd., Korea)를 활용해 건조하였다. 이후 각각의 시료를 분쇄하여 증류수 200 mL에 시료 10 g을 넣고 상온에서 48시간 교반 추출한 뒤 여과지(Advantec, No.2, Tokyo, Japan)로 filtering한 추출물을 동결건조한 후 멸균수에 녹여 실험에 사용하였다.
Nitric oxide (NO) 생성능
NO 측정은 Namkoong et al. (2015)의 측정방법인 Griess 시약(Sigma Aldrich, St. Louis, MO, USA)의 diazo기가 nitrite를 만나면 분홍색으로 변하게 되는 색 반응을 이용하였다. RAW 264.7 세포를 12 well plate에 1 × 105 / well이 되도록 분주 후 24시간 배양하였으며, 갈매나무과 식물 추출물을 처리하여 24시간 추가 배양하였다. 그리고 세포배양 상등액 50 μL와 Griess 시약 50 μL를 혼합하여 10분 동안 상온에서 반응시킨 후 UV / Visible spectrophotometer (Perkin Elmer, Waltham, MA, USA)를 이용하여 540 ㎚에서 흡광도 측정하였다.
MTT assay
세포독성을 확인하기 위해 RAW 264.7 세포를 12-well plate에 분주 후 24시간 배양하고, 추출물을 24시간 동안 처리한 후 각 well당 MTT (Tetrazolium Bromide, 1 ㎎/㎖) 200 μL를 뿌려주고 5% CO2, 37℃의 인큐베이터에 2시간 동안 배양한 후 suction하였다. 그리고 suction한 well에 DMSO 1 mL을 넣고 UV / Visible spectrophotometer를 이용하여 540 ㎚에서 흡광도를 측정하였다.
Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR)
Total RNA 추출은 시료 추출물을 처리한 마우스 대식세포 RAW264.7에 RNeasy Mini kit (Qiagen GmbH., Hilden, Germany)를 이용하여 수행하였으며, cDNA는 1 ㎍의 total RNA를 Verso cDNA kit (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 제조되었다. PCR은 PCR master mix kit (Promega Co., Madison, WI, USA)를 이용하여 수행하였고, 사용된 primer는 Table 2와 같다. PCR을 통하여 만들어진 DNA의 양을 확인하기 위해 1% agarose gel에 Safe shine green으로 염색 후 loading하여 전기영동으로 분리하였다. 이를 gel documentory system (Biorad, Chemidoc, MP imaging system, USA)으로 확인하였으며, housekeeping 유전자인 GAPDH (glyceraldehyde-3-phosphate dehydrogenase)를 포함하여 internal control로 사용하였다.
Table 2.
Sequence of oligonucleotide primers used for RT-PCR.
통계처리
모든 결과는 3회 반복 측정 후 평균 ± 표준편차로 나타내었고, 처리간 유의성은 Student’s t-test로 검증하여 p-value 값이 0.05 미만일 때 통계적으로 유의하다고 판정하였다(Microsoft Exel 2010, Microsoft, Redmond, WA, USA).
결과 및 고찰
갈매나무과 분류군의 외부 형태학적 특성
본 연구에서 재료로 활용한 갈매나무과 13종의 명확한 구분을 위해 외부형태적 특징을 비교하였으며, 잎, 턱잎(stipule), 꽃차례(inflorescence), 열매 등의 분류형질로 속(Genus)과 종(Species)이 구분되었다(Fig. 2). Ziziphus 속의 묏대추나무(Fig. 2-M)와 Paliurus 속의 갯대추나무(Fig. 2-D)는 두 분류군 모두 턱잎이 가시의 형태로 발달하는 유사성이 있으나 열매의 유형이 묏대추나무는 다육성의 핵과(drupe), 갯대추나무는 딱딱한 껍질에 싸여 있는 견과(nut)로 차이가 있으며, 또한 갯대추나무의 열매는 가로로 발달하는 날개가 있어 종이 구분되었다. 이와 다르게 턱잎이 가시의 형태로 발달하지 않는 Hovenia 속의 헛개나무(Fig. 2-C)와 Sageretia 속의 상동나무(Fig. 2-L)는 꽃차례의 형태가 헛개나무는 취산꽃차례(cyme), 상동나무는 원추꽃차례(panicle)인 차이에 의해 종이 구분되었다. 그리고 잎이 마주나며, 취산꽃차례를 이루고, 열매에 3개 또는 4개의 핵이 존재하는 형태적 특징에 의해 갈매나무과 내 다른 속과 구분되는 Rhamnus 속은 겨울눈(winter bud)에 분포하는 눈껍질(bud scale)의 유무와 잎 형태 및 털의 유무 등으로 속내 6분류군(산황나무, 돌갈매나무, 참갈매나무, 갈매나무, 털갈매나무, 짝자래나무)이 구분되었다(Fig. 2-F, G, H, I, J, K). 그리고 Rhamnella 속의 까마귀베개(Fig. 2-E)와 Berchemia 속의 망개나무(Fig. 2-A), 먹넌출(Fig. 2-B)은 잎 가장자리의 톱니(serrate)형태와 꽃차례의 종류에 의해 속과 종이 구분되었다(Choo, 1992; Ma et al., 2017; Prichard, 1955).
갈매나무과 추출물의 NO 생성능
NO는 면역 방어에서 혈압 조절, 혈소판 응집 억제 및 신경 전달에 이르기까지 넓은 범위의 생리학적 기능을 나타내는 것으로 알려져 있는데(Sharma et al., 2007; Tripathi et al., 2007; Xue et al., 2018) 활성화된 대식세포에서 분비되어 신체의 면역체계를 강화시키는 역할을 하지만 과도한 분비는 세포독성을 유발하는 것으로 보고되고 있다(Bohlen, 2015; Radak et al., 2012). 따라서 갈매나무과 식물 13종의 물 추출물에 대한 NO 생성능과 MTT assay를 통한 세포독성 평가를 수행하였으며, 그 결과는 Table 3, Fig. 3과 같다.
NO 생성능은 모든 추출물에서 증류수로 처리한 대조구에 비해 높은 활성을 나타냈으며, 대부분의 분류군이 잎이나 가지보다 열매 추출물에서 높은 면역증진 활성을 나타내는 것으로 확인되었다(Table 3). 이 중 80% 이상의 활성을 나타낸 추출물은 털갈매나무 열매(86.19%), 참갈매나무 열매(83.61%), 짝자래나무 잎(85.83%)와 가지(80.30%)였으며, 짝자래나무 열매(78.23%)와 상동나무 가지(79.01%)는 80%에 근접한 활성을 나타냈다. 그리고 갈매나무 열매(60.29%)는 60%대의 활성을, 헛개나무 열매(58.04%), 망개나무 열매(56.34%), 까마귀베개 열매(56.19%), 갈매나무 잎(54.58%), 상동나무 열매(51.60%), 산황나무 열매(51.29%) 및 돌갈매나무 열매(51.27%)는 50%대의 활성을 나타냈으며, 그 외의 추출물은 50% 미만의 NO 생성능을 나타냈다. 또한 RAW 264.7세포를 활용하여 갈매나무과 식물의 물 추출물이 세포독성을 나타내는지 확인한 결과 까마귀베개 잎(77.16%), 산황나무 열매(66.75%), 참갈매나무 열매(64.18%), 상동나무 가지(74.32%)와 열매(77.21%) 추출물이 20% 이상의 세포독성을 나타냈으나 그 외의 대부분 추출물은 80% 이상의 세포 생존율이 나타나 세포독성이 없는 것으로 확인되었다(Fig. 3).
갈매나무과 식물 중 먹넌출, 갯대추나무, 묏대추나무를 제외한 대부분의 분류군은 잎이나 가지, 열매 중 최소한 한 부위에서 50% 이상의 NO 생성능을 확인하였다. 특히 짝자래나무는 잎과 가지에서 각각 85.83%, 78.23%의 NO 생성능과 열매에서도 78.23%로 다른 분류군에 비해 비교적 높은 활성을 나타냈다. 또한 잎, 가지와 열매 부위 모두 80% 이상의 세포 생존율을 나타냈다. 이는 혈압 조절, 혈소판 응집 억제 등 생리학적 기능에 의한 면역체계관련 연구의 기초자원으로 갈매나무과 식물들은 높은 활용성을 내포하고 있으며, 특히 잎과 가지, 열매 모두 높은 활성을 보인 짝자래나무는 모든 부위를 활용할 수 있어 그 중요성이 높은 것으로 사료된다.
Table 3.
Nitric Oxide production of the Rhamnaceae extracts.
| NO | Taxon | NO production (%) | ||
| Leaves | Branchs | Fruits | ||
| 1 | B. berchemiifolia | 17.04 ± 6.27z | 48.90 ± 6.90 | 56.34 ± 2.95 |
| 2 | B. floribunda | 15.58 ± 2.55 | 12.70 ± 0.58 | 13.13 ± 1.37 |
| 3 | H. dulcis | 48.84 ± 1.17 | 34.35 ± 1.14 | 58.04 ± 1.64 |
| 4 | P. ramosissimus | 46.77 ± 2.20 | 12.58 ± 0.86 | 49.83 ± 1.19 |
| 5 | R. franguloides | 29.37 ± 0.26 | 41.39 ± 1.37 | 56.19 ± 3.59 |
| 6 | R. crenata | 11.83 ± 0.31 | 12.99 ± 0.99 | 51.29 ± 3.61 |
| 7 | R. davurica | 54.58 ± 1.94 | 11.82 ± 0.18 | 60.29 ± 1.35 |
| 8 | R. koraiensis | 11.82 ± 0.18 | 12.38 ± 0.19 | 86.19 ± 2.29 |
| 9 | R. parvifolia | 12.31 ± 1.01 | 12.19 ± 0.78 | 51.27 ± 1.01 |
| 10 | R. ussuriensis | 66.63 ± 3.06 | 12.47 ± 1.03 | 83.61 ± 3.78 |
| 11 | R. yoshinoi | 85.83 ± 9.52 | 80.30 ± 4.18 | 78.23 ± 1.08 |
| 12 | S. thea | 25.11 ± 0.49 | 79.01 ± 4.31 | 51.60 ± 2.26 |
| 13 | Z. jujube | 17.45 ± 0.60 | 12.56 ± 0.46 | 13.83 ± 1.75 |
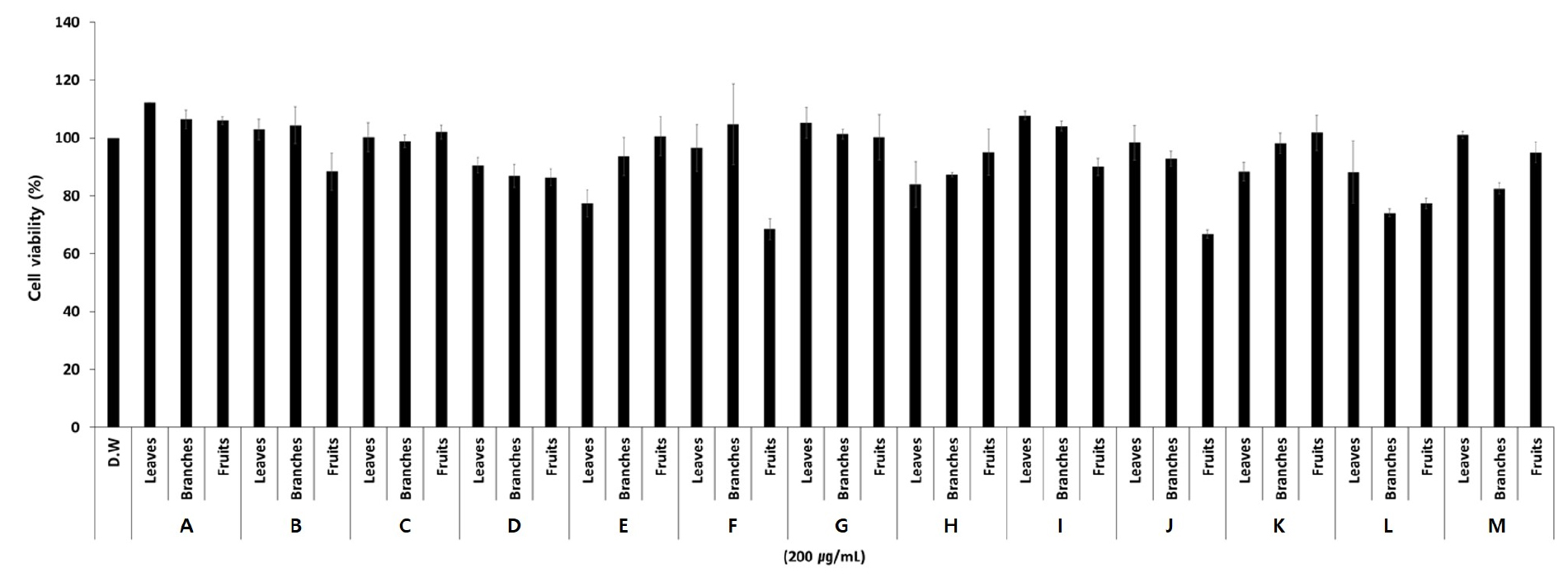
Fig. 3.
Effect of Rhamnaceae extracts on macrophage activation in RAW264.7 cells. RAW264.7 cells were treated with Rhamnaceae extracts for 24h. NO levels were measured by Griess assay and MTT assay, respectively. *P<0.05 compared to the cells without the treatment. A. B. berchemiifolia; B. B. floribunda; C. H. dulcis; D. P. ramosissimus; E. R. franguloides; F. R. crenata; G. R. davurica; H. R. koraiensis; I. R. parvifolia; J. R. ussuriensis; K. R. yoshinoi; L. S. thea; M. Z. jujube.
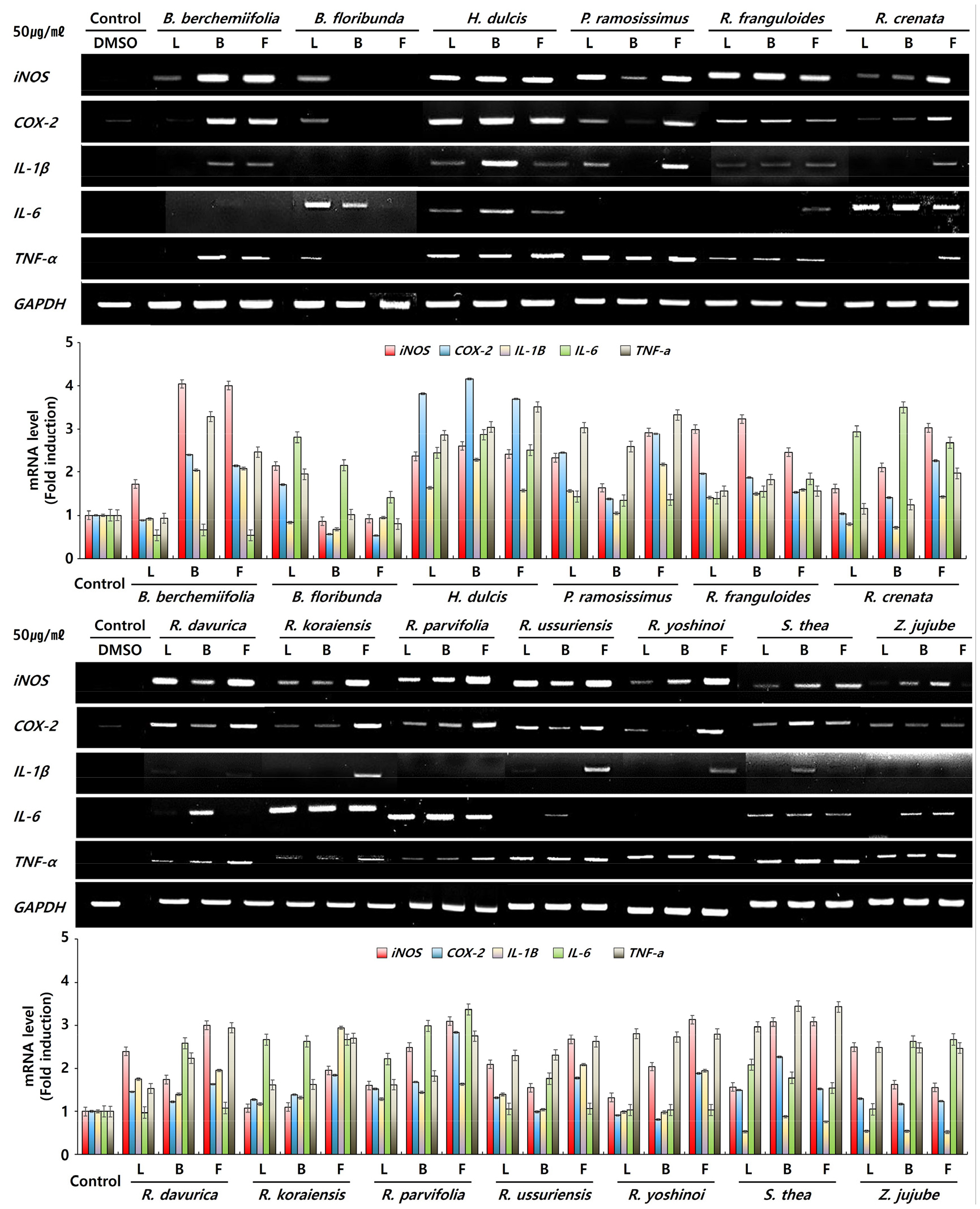
갈매나무과 추출물의 iNOS, COX-2, IL-1β, IL-6 및 TNF-α 발현
Cytokine은 면역세포의 증식 및 분화, 세포 간의 정보 전달 등 면역 반응의 매개체 역할을 한다(Sladkova and Kostolansky, 2007). 이에 따른 대식세포 활성화는 외래병원체에 대한 숙주 방어 및 면역 기능 항상성 역할을 하는 iNOS 및 COX-2의 발현과(Apetoh et al., 2017; Lee et al., 2012) 외부 병원체를 제거 역할을 하는 IL-1β, TNF-α의 생성을 유도한다고 알려져 있다(Barbara et al., 1996; Monmai et al., 2020; Seillet et al., 2014). 즉, 정상범위 내에서 cytokine의 생성 증가는 면역 활성이 증진됨을 의미한다(Yoo et al., 2014). 따라서 마우스 대식세포 RAW264.7에 갈매나무과 13종의 물 추출물이 iNOS, COX-2, IL-1β, IL-6 및 TNF-α와 같은 면역증진 유전자 발현에 영향을 미치는지 확인하였으며, 결과는 Fig. 4와 같다. iNOS와 COX-2 유전자는 먹넌출의 가지와 열매, 짝자래나무의 가지를 제외한 대다수의 부위에서 발현을 나타냈으며, 이중 iNOS 유전자는 망개나무 가지와 열매, 갯대추나무 열매, 까마귀베개 잎과 가지 등 11종류의 부위, COX-2 유전자는 헛개나무의 모든 부위와 갯대추나무 열매 등 5종류의 부위에서 높은 발현을 확인하였다. 그리고 TNF-α 유전자 또한 대다수의 부위에서 발현이 나타났으며, 헛개나무 및 상동나무의 모든 부위와 망개나무 가지, 갈매나무의 열매 등 10종류의 부위에서 높은 발현을 확인하였다. 반면 IL-1β 및 IL-6 유전자는 몇몇 분류군에 국한적으로 발현을 나타냈는데 IL-1β 유전자는 망개나무, 헛개나무, 까마귀베개의 가지와 열매 부위를 비롯한 산황나무, 털갈매나무, 참갈매나무, 짝자래나무, 상동나무의 열매 부위에서 발현을 확인하였다. 그리고 IL-6 유전자는 산황나무, 털갈매나무, 돌갈매나무 등 7분류군에서 발현이 나타났으며, 이 중 털갈매나무의 열매에서 높은 발현을 확인하였다.
상기 NO 생성능 및 iNOS, COX-2, IL-1β, IL-6, TNF-α의 발현 연구를 통해 갈매나무과 분류군의 물 추출물이 대식세포 활성화 및 면역증강 효과를 나타내는 것을 확인하였다. 하지만 최근 면역 반응에서 대부분의 산화 효소 유래 ROS(reactive oxygen species)가 산화 스트레스의 원인이 되며, 이는 면역세포의 기능 저하를 야기할 수 있어 산화환원 조절 기전의 중요성이 대두되고 있다(Ji et al., 2023; Sun et al., 2020). 즉 항산화와 같은 생리활성을 나타내는 페놀화합물 함량과 면역 활성은 상관관계에 있으며, 함량이 높을수록 면역 반응이 활성화된다고 사료된다. 하지만 본 연구에서는 분류군별 페놀화합물 함량에 대한 분석이 수행되지 않아 명확한 상관관계를 확인할 수 없었다. 따라서 추후 갈매나무과 분류군을 대상으로 한 페놀화합물 함량 분석과 함께 추가적인 면역 활성의 메커니즘 연구가 진행되어야 할 것으로 사료된다.
적 요
본 연구에서는 국내 자생하고 있는 갈매나무과 식물 13종에 대한 부위별(잎, 가지, 열매) 물 추출물의 NO 생성능을 통하여 면역증진 활성을 측정하여 기능성을 검토하였다. 망개나무, 헛개나무, 까마귀베개, 산황나무, 갈매나무, 참갈매나무, 상동나무 등에서 50% 이상 NO 생성능을 보여줌으로써 대식세포 활성화를 검증하였다. 또한 PCR 전기영동을 통하여 면역증진과 관련된 cytokine인 iNOS, COX-2, IL-1β, IL-6, TNF-α의 발현을 확인하였다. 본 연구를 통해 갈매나무과 분류군들의 부위별 NO 생성능, mRNA 발현 등과 같은 면역 활성에 대한 과학적 근거를 제시할 수 있었고, 이는 면역증진 관련 소재 발굴 및 제품 개발에 기초자료로 활용할 수 있을 것으로 판단된다.