서언
재료 및 방법
실험 재료 및 추출물의 제조
실험 동물 및 처리
병변 및 조직 손상 측정
PGE2 측정
조직분석
소핵시험
통계처리
결과 및 고찰
소핵시험을 이용한 익모초 물 추출물의 유전독성 평가
익모초 물 추출물의 위염 예방효능 평가
적 요
서언
위염은 크게 급성과 만성으로 분류되는데 급성위염은 장기간 비스테로이드성 제제를 사용하거나 위산이 과다 분비되는 경우와 과하게 알콜을 섭취하는 경우에 일어난다고 알려져 있으며, 만성위염은 과도한 스트레스나 Helicobacter pylori 감염과 관련이 깊다. 위염이 유발되면 히스타민, 펩신 또는 위산 분비에 의해 위 점막이 손상되며 이러한 작용에 따라 출혈과 발적을 동반한 병변이 나타난다(Chamberlain, 1993; Gao et al., 2009; Kandulski et al., 2008; Sipponen and Maaroos, 2015).
Prostaglandin E2 (PGE2)는 염증과 관계된 여러 질병 및 상태에 광범위하게 작용하는 인자이다(Ricciotti and Fitzgerald, 2011). PGE2는 COX (cyclooxygenase) 단백질이 세포막 인지질로부터 해방된 아라키돈산을 사용하여 합성하고, 합성된 PGE2는 위 점막의 혈류를 조절하거나 상피 세포의 운동성 및 위 점액분비, 위산분비 억제와 같은 여러 효과를 나타내 위의 항상성을 유지하는 역할을 한다(Wallace, 1992). COX는 적어도 두 개의 isoform이 존재하며, COX-1은 위장관과 대부분의 다른 기관에서 흔히 발현되며, COX-2는 대부분의 조직에서 감지할 수 없거나 매우 낮은 수준으로 발현되지만 위 점막 염증 또는 헬리코박터 감염에 의해 발현이 크게 증가하게 된다고 알려져 있다. 이는 COX-1이 주로 생리학적 조건아래 하우스키핑 효소로서 위 점막의 항상성을 유지하기 위해 발현되는 것으로 보고되고 있으며, COX-2는 특정 병리학적 조건에서 위장 점막의 방어와 수리를 위해 기능하는 것으로 알려져 있는데, COX-2는 고농도의 에탄올과 유해 물질로부터 위 점막을 보호한다고 알려져 있고, COX-2 억제제의 경우 위궤양 및 위염 치료를 지연시킨다고 보고되어 있다. 따라서 위에서 발현되는 COX-2의 염증반응은 위의 항상성을 유지하기 위한 이로운 염증반응으로 알려져 있다(Tanigawa et al., 2004).
위 내부에서 분비되는 PGE2는 EP2 (prostaglandin E2)와 EP4 (prostaglandin E4)를 경유하는 신호전달 경로를 통해 점액질 분비를 촉진시킨다고 알려져 있으며, 이러한 작용에 따라 위산 자극에 의한 위 점막의 손상을 예방하는 역할을 가진다(Takeuchi and Amagase, 2017). 이러한 이유에 따라 천연물을 이용한 위염 개선 평가에서 PGE2는 위염 예방효과를 평가하는데 흔히 이용된다(Alrashdi et al., 2012; Jeon et al., 2015; Jin et al., 2016; Nho et al., 2019).
유전독성평가는 특정 물질이 DNA 및 염색체 수준에서 유전적인 손상을 유발하는지를 평가하는 시험법으로, 일반 독성평가와는 다르게 보다 장기적인관점으로 발암성과 다음 세대로 전이될 수 있는 생식세포의 독성을 파악하며, 소핵시험은 염색체의 구조 및 수적 이상을 검출해낼 수 있다는 점에서 다른 유전독성 시험법이 비해 상대적으로 넓은 범위의 독성을 검출할 수 있다는 이점이 있다(Corvi et al., 2008). 보고에 따르면, 약용식물의 사용량과 관련연구가 증가되고 있지만 약용 식물의 안전한 섭취량 및 섭취 방법을 포함한 안전성 평가가 제대로 이루어지지 않고 있기 때문에 이에 대한 대책이 시급 한 상황이다(Jung et al., 2018; Kim et al., 2019; Park et al., 2018; Park et al., 2019; Woo et al., 2018; Yoo et al., 2017).
익모초(Leonurus japonicus Houttuyn)는 꿀풀과에 속하는 두해살이 식물로 우리나라에서 흔하게 발견할 수 있다(Jo, 2013). 익모초는 arteannuin B, leonurine, leonoside 및 leopersin G를 포함한 여러 가지 화합물을 포함하고 있다고 알려져 있다(Li et al., 2012). 보고에 따르면 익모초 추출물은 고지방식이에 의해 유도된 고지혈증을 개선시키고(Kim et al., 2010), 자외선으로 유도된 각질형성세포의 손상을 억제한다고 알려져 있다(Kim et al., 2016). 익모초에서 분리된 leonurine은 심장보호효과를 가지며, leonoside E는 간세포 보효효과를 나타낼 뿐만 아니라 15, 16-Epoxy-3αhydroxylabda-8, 13(16), 14- trien-7-one은 NF-κB (nuclear factor kappa B)를 억제시켜 항염증효과를 나타낸다고 보고되어 있으며(Khan et al., 2012; Li et al., 2012; Yeung et al., 1997). Wogonin은 알콜에 의해 유도된 위 점막 표피세포의 손상을 예방하는 것으로 알려져 있다(Park et al., 2004). 따라서 본 연구는 익모초 물 추출물 자체가 염산과 에탄올에 의해 유도된 위염을 예방할 수 있는지 알아보고자 하였다.
재료 및 방법
실험 재료 및 추출물의 제조
실험에 사용한 익모초(Leonurus japonicus Houttuyn)는 동신대학교 한의학과 정종길교수의 동정을 거쳤다. 실험재료를 물로 3회 이상 세척한 뒤 열풍건조기를 이용해 50℃ 조건에서 일주일간 건조하였다.
건조된 익모초 3,150 g을 분쇄한 뒤 시료 무게의 10 배에 해당하는 물을 3.15 L 넣은 뒤 환류 냉각추출방법을 통해 105℃에서 5시간, 2회 반복해 추출하였다. 추출된 익모초 시료는 회전감압녹충기(Eyela, NVC-2200, ToKyo, Japan)를 이용해 55℃에서 농축한 뒤, filter paper (Thermo, Waltham, MA, USA)를 통해 여과하였고, 여과된 추출물은 동결건조기를 통해 건조시켰다.
익모초 파우더를 475 g을 수득하여 약 15.1%의 수율을 확인하였고 0.5% carboxymethyl cellulose (CMC, Sigma, St. Louis, MO, USA)에 녹인 뒤 본 시험에 사용하였다.
실험 동물 및 처리
실험은 동물보호법에 근거한 한약진흥재단 한약자원본부의 동물실험윤리위원회에 의해 승인되었다(승인번호: NIKOM- 2017-007).
위염 동물모델에 대한 익모초 물 추출물의 예방효과 측정은 오리엔트 바이오(Jeongeup, Korea)에서 구입한 수컷 6주령 SD rat을 사용하였고, 총 다섯 그룹으로 분리하였으며, 실험군당 마릿수는 다음과 같다(정상대조군; n = 7, 음성대조군; n = 7, 양성대조군; n = 7, 100 ㎎/㎏ 익모초 물 추출물 투여군; n = 7, 500 ㎎/㎏ 익모초 물 추출물 투여군; n = 7).
시험 농도설정은 식품의약안전처의 보고에 따르면 익모초 물 추출물은 13주 동안 설치류에게 반복경구투여 시 독성이 나타나지 않아 독성평가 농도 범위 내에서 설정하였다(Min, 2012).
양성대조군 그룹은 omeprazole (Sigma, St. Louis, MO, USA)을 20 ㎎/㎏의 농도로 3일간 경구투여 하였다. 음성대조군 그룹은 0.5% carboxymethyl cellulose을 1 mL씩 3일간 경구투여 하였으며, 익모초 물 추출물 투여군은 각각 100 또는 500 ㎎/㎏ 농도로 3 일간 경구투여 하였다. 투여 마지막 날 시료 경구투여 30분 뒤 정상대조군을 제외한 실험동물에 150 mM HCl in 60% EtOH 1 mL을 경구투여 하여 30분간 위염을 유도하였고, 위염 유발 조건은 여러 실험을 참고하여 선정하였다(Choi et al., 2012; Hwang et al., 2016; Lee et al., 2016). 실험이 모두 끝난 뒤 실험동물들은 IACUC의 실험동물 관리 기준에 따라 이산화탄소를 과호흡시켜 안락사를 유도하였다.
병변 및 조직 손상 측정
추출물 투여에 다른 위염 억제 정도를 측정하기 위해 안락사를 진행한 뒤, 실험동물의 위를 적출하였다. 적출된 위는 절개하여 고정시킨 뒤 현미경을 통해 위벽에 발생한 손상 길이를 측정하여 병변의 면적을 구하였다.
위 조직 병변의 점수화는 Andrews의 방법(Andrews et al., 2002)을 참고하고, Chen의 방법(Chen et al., 2016)을 조금 변경하여 수행하였다. 점수화 정도는 다음과 같다. 0 = 병변 없음, 2 = 적당한 점막 표피세포 손상, 4 = 심각한 점막 표피세포 손상, 6 = 심각한 점막 표피세포와 선상피세포 손상, 8 = 심각한 점막표피세포와 선상피세포 손상 및 울혈.
PGE2 측정
PGE2 ELISA kit (Enzo, Farmingdale, USA)을 이용하였고, 제조사에서 제공한 프로토콜에 따라 실험을 수행하였다. 실험동물로부터 적출된 위의 일부는 일정한 무게로 나눈 뒤 RIPA buffer (Cell signaling technology, Danvers, Massachusetts, USA)에 녹여 단백질을 분리하였다. 원심분리기로 10분간 4℃, 13,000×g 조건에서 원심분리 하였고, Bradford assay를 이용하여 단백질 농도를 측정하였다(Kruger, 2009). 일정한 양의 단백질 용해액을 실험에 사용하였으며, 위 조직 무게당 PGE2 농도를 그래프로 표기하였다.
조직분석
실험동물로부터 적출된 위는 10% NBF (10% nutralized buffered formalin, Sigma, St. Louis, MO, USA)에 하루 동안 고정한 뒤, 조직처리 과정을 통해 파라핀으로 포매하였다. 포매가 끝난 위 조직은 위벽의 점막층, 근육층 및 장막을 확인할 수 있도록 5 ㎛ 두께로 절편을 제작하였으며, Dako Mayer’s Hematoxylin (Agilent, Santa clara, California, USA)과 Eosin Y (Sigma, St. Louis, Missouri, USA)를 이용해 염색하고 현미경을 이용해 관찰하였다.
소핵시험
소핵실험을 통한 유전독성평가는 6주령 ICR (institute of cancer research) 마우스를 오리엔트 바이오(Jeongeup, Korea)에서 구입하였으며, 총 다섯 그룹으로 분리하였고 그룹당 마릿수는 다음과 같다(정상대조군; n = 7, 음성대조군; n = 7, 500 ㎎/㎏ 익모초 물 추출물 투여군; n = 7, 1000 ㎎/㎏ 익모초 물 추출물 투여군; n = 7, 2000 ㎎/㎏ 익모초 물 추출물 투여군; n = 7).
실험에 사용된 동물에 2 일간 익모초 물 추출물을 경구투여 하였으며, 음성대조군 물질로 사용된 CPA (cyclophosphamide)는 70 ㎎/㎏의 농도로 이틀째에 단회 복강투여 하였다. 24시간 뒤 실험동물을 이산화산소를 이용해 안락사 시키고, 마우스 대퇴골의 양 끝을 절단하고 FBS (fetal bovine serum)를 한쪽으로 주입하여 반대편에서 흘러나오는 골수세포를 수거하였다. 채취한 골수를 5분간 4℃, 1,000 rpm 조건에서 원심분리 하였고, 상층액을 버린 후 골수세포를 부유시켜 slide glass에 도말한 뒤 실온에서 건조하여 검체를 만들었다. 검체는 메탄올로 고정한 뒤 5% giemsa 염색액으로 염색하여 소핵을 분석하였다. 4,000개의 다염성 적혈구(polychromatic erythrocyte, PCE)를 관찰하고, 이중 소핵 다염성 적혈구(micronucleated polychromatic erythrocyte, MNPCE)의 빈도를 측정한 동시에 정상체 적혈구(normochromatic erythrocyte, NCE)와 다염성 적혈구를 더한 전적혈구(PCE+NCE)에 대한 다염성 적혈구 빈도를 측정하였다.
통계처리
통계처리는 평균 ± 표준편차로 나타내었고, 유의성을 검정하기 위해 SPSS (Statistical Package for Social Science Inc., Chicago, IL, USA) 통계 프로그램을 사용하였다. 일원변량분석을 실시한 뒤, Tukey-Kramer Multiple Comparison Test를 사용하여 유의수준 p < 0.05 수준에서 통계적인 차이를 검증하였다.
결과 및 고찰
소핵시험을 이용한 익모초 물 추출물의 유전독성 평가
식품의약안전처의 최종보고서에 따르면 익모초 물 추출물은 13주 동안 설치류에게 반복경구투여 시 독성이 나타나지 않는 것으로 보고되어 있지만(Min, 2012) DNA 또는 염색체의 손상을 평가하는 유전독성 평가가 이루어지지 않았기에 소핵시험을 진행하였다.
수컷 ICR 마우스(6주령)를 통해 설치류의 hematopoietic stem cell (조혈모세포)에 대해 익모초 물 추출물의 투여가 소핵을 유발하는지 알아보았다. 시험기간 동안 익모초 물 추출물과 음성대조군(CYP, cyclophosphamide) 투여에 따른 사망동물은 확인되지 않았으며, 소핵을 포함한 다염성 적혈구의 빈도를 측정하였다.
시험 결과 500, 1000, 2000 ㎎/㎏ 익모초 물 추출물 투여군은 정상대조군과 비교하여 소핵을 포함한 다염성 적혈구와 세포독성을 나타내는 PCE/(PCE+NCE) 비율이 유의적으로 증가되거나 감소되지 않았다(Table 1).
Table 1. Results of micronucleus assay
yLJW; Water extract of Leonurus japonicus Houttuyn.
xMNPCE; Micronucleated polychromatic erythrocyte.
wPCE; Polychromatic erythrocyte.
vNCE; Normochromatic erythrocyte.
이는 익모초 물 추출물이 이와 같은 실험조건에서 설치류 골수세포에 소핵을 유도하지 않는 것으로 생각된다. 하지만 이는 추출물 투여에 따른 소핵유발평가만 이루어진 것으로 익모초 물 추출물의 정확한 안전성을 확보하기 위해 추후 동물세포를 이용한 염색체이상시험 및 세균을 이용한 돌연변이시험과 같은 추가 실험이 필요하다고 생각된다.
익모초 물 추출물의 위염 예방효능 평가
일정농도의 염산과 에탄올을 이용한 위염 설치류 모델에서 익모초 물 추출물(LJW)이 예방효과를 나타낼 수 있는지 알아보기 위해 동물실험을 진행하였다. 염산과 에탄올 경구투여는 위 점막세포와 표피세포를 대상으로 손상을 유발시킴으로 위산과다분비와 알콜섭취를 통한 급성 위염의 특징을 잘 나타내는 방법으로 흔히 이용된다(Hwang and Jeong, 2013). 이에 따라 익모초 물 추출물이 염산과 에탄올에 의해 유도된 위염모델에 대해 예방효과를 가질 수 있는지 확인하기 위해 실험을 진행하였다. 음성대조군은 정상대조군과 비교했을 때 혈흔과 발적이 크게 증가된 상태였고, 양성대조군은 20 ㎎/㎏ omeprazole 투여에 의해 혈흔과 발적이 대부분 예방되었고. 500 ㎎/㎏ 익모초 물 추출물을 투여한 실험군은 양성대조군보다 효과는 낮았지만 혈흔과 발적이 예방되는 효과를 나타냈다(Fig. 1A). 병변의 면적을 현미경으로 측정한 결과, 정상대조군과 비교하여 위염 유도군은 병변이 134.5 ± 13.0 ㎟로 나타났고 20 ㎎/㎏ omeprazole을 투여한 양성대조군 그룹의 병변은 13.3 ± 12.0 ㎟로 약 90% 이상의 억제율을 확인하였다. 100 ㎎/㎏ 또는 500 ㎎/㎏ 익모초 물 추출물 투여군은 각각 54.5 ± 10.0 ㎟와 34.8 ± 8.0 ㎟로 확인되었다(Fig. 1B).
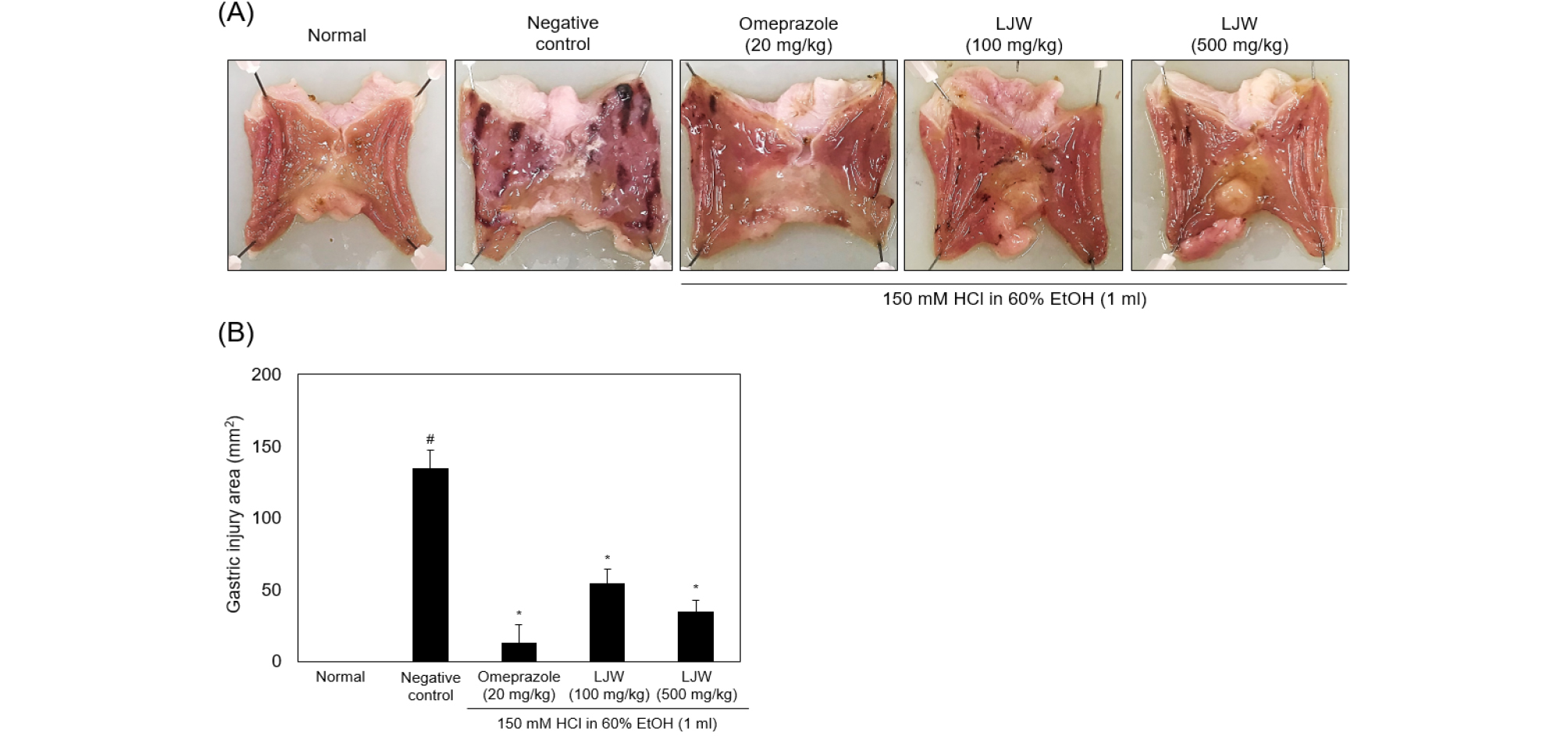
Fig. 1.
LJW prevented HCl/EtOH-induced gastric damage at macroscopic level. A. Normal, Negative control; 0.5% carboxymethyl cellulose 1 mL, Omeprazole; 20 ㎎/㎏ After 30 min treatment HCl/EtOH, omeprazole, LJW (100 ㎎/㎏); 100 ㎎/㎏ LJW After 30 min treatment HCl/EtOH, LJW (500 ㎎/㎏); 500 ㎎/㎏ LJW After 30 min treatment HCl/EtOH. (A) Morphological features. (B) Gastric injury area was measured using microscope. #p < 0.05, versus normal group; *p < 0.05, versus Negative control group. Groups comparisons were conducted using one-way ANOBA with Tukey-Kramer’s multiple comparison test. LJW, water extracts of Leonurus japonicus Houttuyn.
H&E 염색을 통해 조직손상정도를 확인한 결과 음성대조군에서 점막의 표피세포 및 선상피세포의 손상과 울혈이 나타났지만 양성대조군과 익모초 물 추출물 투여 시 점막의 표피세포 손상을 제외한 병변은 대부분 예방되는 것으로 확인되었다(Fig. 2A and 2B).
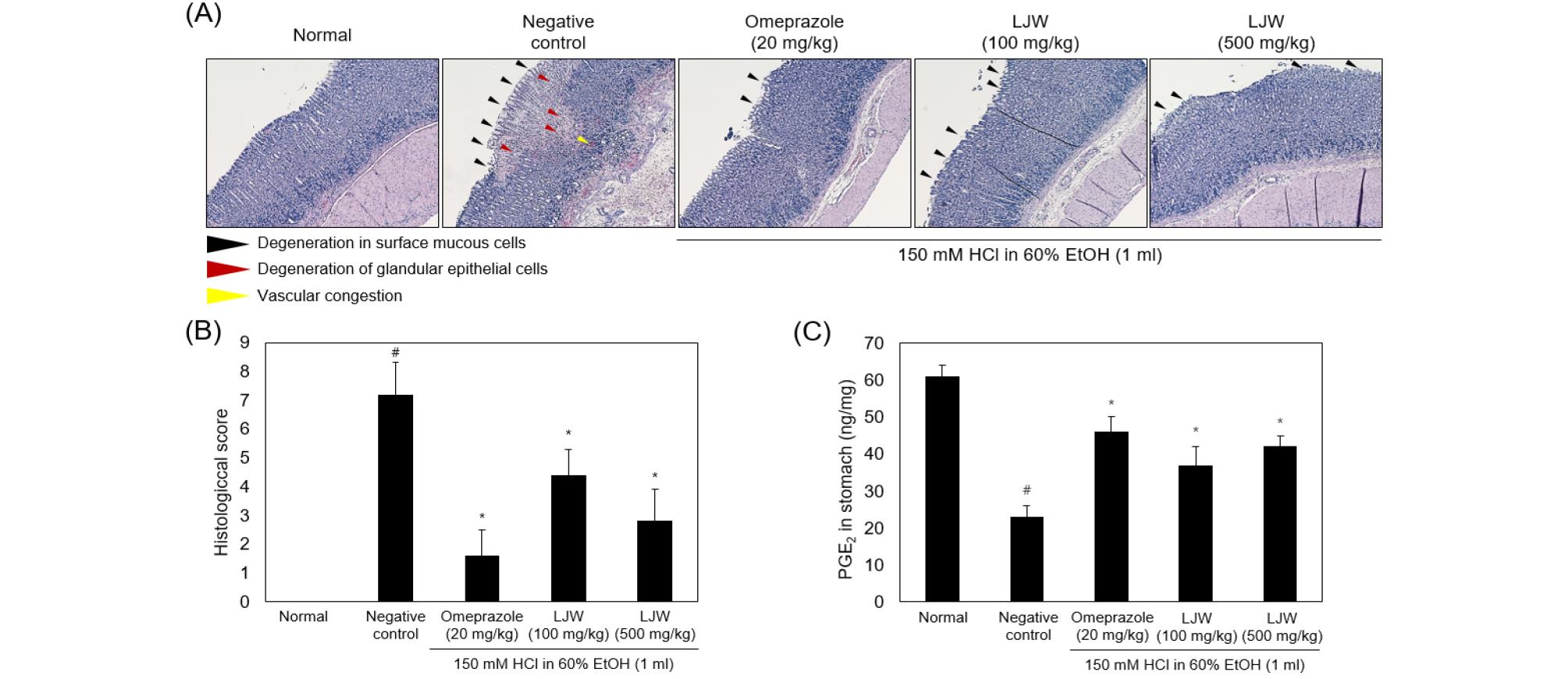
Fig. 2.
LJW prevented HCl/EtOH-induced degeneration in surface mucous cell, damage of glandular epithelial cell and vascular congestion. A. Normal, Negative control; 0.5% carboxymethyl cellulose 1 mL, Omeprazole; 20 ㎎/㎏ After 30 min treatment HCl/EtOH, omeprazole, LJW (100 ㎎/㎏); 100 ㎎/㎏ LJW After 30 min treatment HCl/EtOH, LJW (500 ㎎/㎏); 500 ㎎/㎏ LJW After 30 min treatment HCl/EtOH. (A) Representative microscopic image. (B) Histological score was scored as follows: 0 = symptomless, 2 = moderate degeneration in surface mucous cells, 4 = severe degeneration in surface mucous cells, 6 = severe degeneration in surface mucos cells and degeneration of glandular epithelial cells, 8 = severe degeneration in surface mucous cells, degeneration of glandular epithelial cells and vascular congestion. (C) PGE2 concentration in stomach. #p < 0.05, versus normal group; *p < 0.05, versus Negative control group. Groups comparisons were conducted using one-way ANOBA with Tukey-Kramer’s multiple comparison test. LJW, water extracts of Leonurus japonicus Houttuyn.
위에서 분비되는 PGE2는 위 내부의 점액 분비를 촉진시킴에 따라 외부 자극에 의한 점막 손상을 개선시킨다(Hoshino et al., 2003). 이러한 보고에 따라 위 조직에 포함되어있는 PGE2 농도를 확인한 결과 음성대조군은 23 ± 3 ng/㎎으로 정상대조군 (61 ± 3 ng/㎎)과 비교해 크게 감소되었고, 양성대조군은 46 ± 4 ng/㎎으로 음성대조군과 비교하여 크게 감소되지 않았으며, 100 ㎎/㎏ 또는 500 ㎎/㎏ 익모초 물 추출물 투여군은 각각 37 ± 5, 42 ± 3 ng/㎎으로 나타나 음성대조군 대비 크게 감소되지 않은 PGE2 농도를 확인하였다(Fig. 2C).
결과를 종합하였을 때 익모초 500 ㎎/㎏ 추출물 투여군은 20 ㎎/㎏ omeprazole 투여군에 비해 PGE2 농도와 위염 병변의 예방효능이 낮은 것으로 보이지만 omeprazole과 마찬가지로 위 내부의 출혈과 점막 소실을 예방 하는 것으로 나타났다. Omeprazole은 흔히 프로톤펌프억제제로 사용되며 위 내부의 효소를 저해해 위산 분비를 감소시켜 위산과다분비에 의한 위 손상을 개선시키는 효능을 가진다(Li et al., 2017; Park and Kim, 2011).
염산과 에탄올로 유도된 위염 모델에서 익모초의 조직손상 개선 효과는 위 점막보호효과를 가진 wogonin 성분이 작용할 것으로 예상되지만 익모초는 wogonin 뿐만 아닌 arteannuin B, leonurine, leonoside 및 leopersin G를 포함한 여러 가지 화합물을 함유하고 있다고 알려져 있기 때문에 이러한 단일 성분들을 사용해 위염 예방효과를 평가하여 위염에 대한 익모초의 효율과 효능을 개선시키는 연구가 필요하다고 생각되고, 향후 아스피린 등의 비스테로이드 항염증제(non-steroidal anti-inflammatory drugs, NSAIDs/NAIDs) 약물의 위점막 손상 및 출혈에 대한 보조제 또는 보충제로서의 가능성을 고려하여, 이에 대한 추가 실험이 필요하다고 생각된다.
적 요
본 연구는 에탄올과 염산으로 유도된 위염모델에 대해 익모초의 물 추출물이 위염예방효과를 나타내는지 알아보기 위해 진행하였고, 안전성 평가를 위해 유전독성평가인 소핵시험을 수행하였다. 익모초 물 추출물은 음성대조군 대비 위에서 분비되는 PGE2의 농도를 증가시켰을 뿐만 아니라 염산과 에탄올 투여에 의한 점막 표피세포 및 선상피세포의 손상과 울혈을 충분히 예방하는 것을 확인하였다. 또한 익모초 물 추출물에 대한 소핵시험을 실시한 결과, 익모초 물 추출물은 소핵을 유발하지 않는 것으로 나타났다. 결과를 종합하였을 때 익모초 물 추출물은 자체적으로 위염 예방효과를 나타냈지만 정확히 어떤 기전을 통해 예방하는지 추가적인 실험이 필요하다고 사료되며, 익모초에 포함된 여러 단일 성분을 이용해 위염 예방평가를 실시하여, 위염에 대한 익모초의 효능과 효율을 높이는 연구가 필요하다고 생각된다.




