서 언
재료 및 방법
시약
시료준비
세포배양
Nitric oxide (NO) 측정
Reverse transcription polymerase chain reaction (RT-PCR)
Isolation of nuclear protein from RAW264.7 cells
SDS-PAGE and Western blot analysis
Statistical analysis
결과 및 고찰
CNL이 RAW264.7세포에서 LPS 매개 NO의 과대생성과 iNOS의 과대발현에 미치는 영향
LPS로 자극된 RAW264.7세포에서 CNL 매개 NO 생성과 iNOS 발현 억제에 MAPK와 NF-κB 신호전달이 미치는 영향
RAW264.7세포에서 CNL이 Nrf2/HO-1 신호전달에 미치는 영향
RAW264.7세포에서 PI3K가 CNL 매개 Nrf2/HO-1 신호전달 활성화에 미치는 영향
RAW264.7세포에서 ROS가 CNL 매개 PI3K/Nrf2/HO-1 신호전달 활성화에 미치는 영향
적 요
서 언
염증 반응은 외부 병원체와 독소로부터 인체를 보호하기 위해 면역 체계가 자연적으로 유도하는 방어 메커니즘으로, 손상된 조직의 복구와 병원체 제거를 통해 신체의 항상성을 유지하는 데 중요한 역할을 한다고 알려져 있다(Riera-Romo et al., 2016). 정상적인 염증 반응은 면역 체계가 적절히 조절될 때 유익하게 작용하지만, 조절되지 않거나 과도하게 활성화된 비정상적인 염증 반응은 여러 병리적 상태를 초래할 수 있다. 특히, 이러한 비정상적인 염증 반응은 류마티스 관절염, 동맥경화증, 천식, 당뇨병, 만성 감염, 패혈성 쇼크, 그리고 알츠하이머병과 같은 염증성 신경퇴행성 질환 등 다양한 만성 염증 질환의 주요 원인으로 작용하는 것으로 보고되고 있다(Baek et al., 2020; Kim et al., 2023a). 따라서 비정상적으로 활성화된 염증 반응을 조절하고 염증 매개체의 과도한 생성을 억제하는 것은 만성 염증 질환의 예방과 치료에 있어 매우 중요한 과제로 부각되고 있다. 이에 따라 조절되지 않은 염증 반응을 억제하는 항염증제 개발이 활발히 진행되고 있으며, 특히 천연물 기반의 생리활성 물질은 부작용이 적고 효과적인 염증 조절 가능성을 보여 주며 주목받고 있다(Cao et al., 2019).
물엉겅퀴(Cirsium nipponicum)는 국화과(Asteraceae) 엉겅퀴속(Cirsium)에 속하는 다년생 초본 식물로, 흔히 ‘섬엉겅퀴’로 알려져 있다(Kim et al., 2023a). Cirsium nipponicum는 한국의 동해안 지역에서 주로 자생하며, 그 분포는 특히 울릉도에 집중되어 있는 것으로 보고되고 있다(Kim et al., 2023a). 엉겅퀴속 식물들은 전통적으로 간 보호와 당뇨 치료를 비롯한 다양한 질환의 치료에 널리 사용되어 왔으며, 이러한 약리적 효능 덕분에 오랜 기간 동안 중요한 약용 자원으로 인식되어 왔다. Cirsium nipponicum 역시 이러한 속 식물의 특성을 공유하며, 귀중한 약용 가치와 함께 생물학적 연구의 잠재적 대상으로 주목받고 있다(Kim et al., 2023b). 최근 연구에 따르면 엉겅퀴속 식물 중 특히 Cirsium japonicum는 대식세포에서 Nrf2/HO-1 신호전달 활성화를 통해 만성염증매개인자인 iNOS와 COX-2의 발현을 억제시키는 항염증 할성 효과를 보이며, 천연 항염증제로서의 잠재적 가치를 입증한 바 있다(Lee et al., 2012). 이러한 연구 결과는 엉겅퀴속 식물이 과도한 염증반응 조절에 기여할 수 있는 가능성을 제시하고 있다. 그러나 Cirsium nipponicum를 포함한 다른 엉겅퀴속 식물들의 항염증 활성과 그 작용 메커니즘에 대한 연구는 현재까지 거의 이루어지지 않아, 이 분야는 여전히 미개척 상태로 남아 있다. 이에 따라, 본 연구는 Cirsium nipponicum가 대식세포에서 과도한 염증반응에 미치는 영향을 분석하고, 그 메커니즘을 규명하는 것을 주요 목표로 하고 있다. 이를 통해 Cirsium nipponicum이 과도한 염증반응에서 수행할 수 있는 역할과 천연 항염증제로서의 가능성을 평가하고자 하였다.
재료 및 방법
시약
3-(4,5-Dimethylthiazol-2-yl)-2,5-Diphenyltetrazolium Bromide (MTT), LY294002, Griess Griess reagent, N-acetyl-L-cysteine (NAC), 그리고 lipopolysaccharide (LPS)는 Sigma-Aldrich에서 구매하였으며, Zinc (II) Protoporphyrin IX (ZnPP)는 Enzo Life Sciences에서 구매하였다. Primary antibody인 as extracellular signal-regulated protein kinases 1 and 2 (ERK1/2, cat. no: 9102), phosphorylated ERK1/2 (p-ERK1/2, cat. no: 4377), p38 (cat. no: 9212), phosphorylated p38 (p-p38, cat. no: 4511), c-Jun N-terminal kinases (JNK, cat. no: 9258), phosphorylated JNK (p-JNK, cat. no: 9251), p65 (cat. no: 8242), phosphorylated p65 (p-p65, cat. no: 3033), phosphoinositide 3-kinase (PI3K, cat. no: 4257), phosphorylated PI3K (p-PI3K, cat. no: 4228), heme Oxygenase 1 (HO-1, cat. no: 70081), nuclear factor erythroid 2-related factor 2 (Nrf2, cat. no: 12721), 그리고 β-actin (cat. no: 5125)은 Cell Signaling Technology에서 구매하였다. 또한 secondary antibody인 2anti-rabbit IgG, HRP-linked antibody (cat. no: 7074) 역시 Cell Signaling Technology에서 구매하였다.
시료준비
Cirsium nipponicum의 잎과 뿌리는 대한민국 경상북도 청송에 위치한 일두산방(Ildusanbang Co.)에서 제공받아 실험에 사용되었다. 제공받은 잎과 뿌리는 40°C의 조건에서 48시간 동안 열풍 건조 과정을 거쳤으며, 이후 상온에서 농도별 에탄올(10%∼70% 에탄올)을 용매로 하여 1:20의 비율(w/v)로 24시간 동안 추출이 진행되었다. 추출된 시료는 여과한 다음 여액을 감압농축 후 동결건조하여 분말 형태로 확보하였다. 동결건조된 Cirsium nipponicum 잎추출물(CNL)과 뿌리추출물(CNR)은 DMSO에 용해시켜 세포에 처리하였다.
세포배양
RAW264.7세포는 American Type Culture Collection에서 구매하여 실험 전반에 걸쳐 지속적으로 배양하였다. 세포는 10% FBS (Gibco; Thermo Fisher Scientific, Inc.), 100 U/mL 페니실린, 100 ㎍/mL 스트렙토마이신이 포함된 DMEM/F-12 배지(Hyclone; Cytiva)에서 배양하였으며, 37°C, 5% CO2가 유지되는 가습된 조건에서 배양하였다. 세포는 culture plate에서 70-80%의 밀도로 증식했을 때 계대배양을 수행하였다.
Nitric oxide (NO) 측정
Griess 분석법을 활용하여 RAW264.7 세포에서 LPS로 유도된 과도한 NO 생성을 CNL 또는 CNR이 억제하는 효과를 평가하였다. RAW264.7 세포를 12-well plate에서 배양한 후, CNL 또는 CNR을 2시간 동안 전처리한 뒤 LPS (1 ㎍/mL) 를 첨가하여 18시간 동안 배양하였다. 배양 후 상등액과 Griess 시약을 1:1 (v/v) 비율로 혼합하여 실온에서 15분간 반응시켰다. 이후 UV/가시광선 분광광도계(SpectraMax M2, Molecular Devices)를 이용해 540 ㎚에서 흡광도를 측정하였다.
Reverse transcription polymerase chain reaction (RT-PCR)
RAW264.7 세포를 12-well plate에서 배양한 후, CNL를 2시간 동안 전처리한 뒤 LPS (1 ㎍/mL) 를 첨가하여 18시간 동안 배양하였다. 배양 종료 후, RNeasy Mini Kit (Qiagen)를 사용하여 세포로부터 총 RNA를 추출하고 정량화하였다. 이후, Verso cDNA Kit (Thermo Scientific)을 이용하여 1 ㎍의 총 RNA로부터 cDNA를 합성하였다. PCR 증폭은 PCR Master Mix Kit (Promega)와 iNOS 프라이머를 사용하여 수행되었다. 본 연구에서 사용된 프라이머의 서열은 다음과 같다: iNOS mRNA, F: 5’-GTTACCATGAGGCTGAAATCC-3’, R: 5’-CCTCTTGTCTTTGACCCAGTAC-3’; GAPDH mRNA, F: 5’-GGACCTCATGGCCTACATGG-3’, R: 5’-TAGGGCCTCTCTTGCTCAGT-3’. 생성된 PCR 산물은 아가로스 겔 전기영동을 통해 확인하였으며, mRNA 밴드강도는 UN-SCAN-IT gel 소프트웨어 버전 5.1 (Silk Scientific Inc)을 사용하여 정량화하였다.
Isolation of nuclear protein from RAW264.7 cells
모든 처리를 완료한 후, RAW264.7 세포로부터 핵 단백질을 Nuclear Extract Kit (Active Motif)를 사용하여 제조사의 지침에 따라 추출하였다. 세포를 차가운 1× hypotonic buffer로 회수한 후, 4°C에서 15분간 방치하였다. 이후 detergent를 첨가하고 10초간 가볍게 교반하였다. 세포는 4°C에서 14,000 g로 1분간 원심분리하였으며, 생성된 펠릿을 핵 단백질 추출에 사용하였다. 펠릿은 lysis buffer에 재현탁된 후, 4°C에서 30분간 흔들어 용해시켰다. 용해된 펠릿은 4°C에서 14,000 g로 10분간 원심분리하여 핵 단백질을 포함한 상등액을 분리하였다. 추출된 핵 단백질은 -80°C에서 보관하며 추가 분석에 사용하였다.
SDS-PAGE and Western blot analysis
모든 처리를 완료한 후, 세포 단백질은 bicinchoninic acid assay kit (Thermo Fisher Scientific)를 사용하여 정량하였다. 단백질은 SDS-PAGE를 통해 150 V, 400 A 조건에서 1시간 동안 분리한 뒤, 100 V, 300 A 조건에서 2시간 동안 nitrocellulose membrane (Thermo Fisher Scientific)으로 전이시켰다. Membrane은 실온에서 5% nonfat milk로 1시간 동안 blocking한 후, 4°C에서 primary antibody (1:1,000)와 함께 overnight 동안 반응시켰다. 이후, secondary antibody (1:1,000)와 실온에서 1시간 동안 반응하였다. 단백질 밴드는 ECL Prime Western Blotting Detection Reagents (Amersham Biosciences Corp.) 처리 후 LI-COR C-DiGit Blot Scanner (LI-COR Biosciences)를 사용하여 시각화하였으며, 밴드강도는 UN-SCAN-IT gel 소프트웨어 버전 5.1 (Silk Scientific Inc)을 이용해 정량화하였다.
Statistical analysis
모든 실험은 최소 3회 반복하여 수행되었다. 통계 분석은 GraphPad Prism 버전 5.0 (GraphPad Software, Inc.)을 사용하여 수행하였으며, 데이터는 평균 ± 표준편차로 표시하였다. 데이터 분석은 일원배치분산분석(one-way ANOVA)을 수행한 후 Bonferroni 사후 검정을 통해 진행하였다. P<0.05는 통계적으로 유의한 차이를 나타내는 기준으로 간주하였다.
결과 및 고찰
CNL이 RAW264.7세포에서 LPS 매개 NO의 과대생성과 iNOS의 과대발현에 미치는 영향
대식세포는 세균이나 감염성 자극에 반응하여 iNOS를 발현하며, 이를 통해 NO를 생성하는 중요한 면역 반응을 수행한다(Minhas et al., 2020). 그러나 iNOS의 과도한 발현은 NO의 과잉 생산으로 이어질 수 있으며, 이는 신경퇴행성 질환인 파킨슨병과 알츠하이머병, 그리고 류마티스 관절염과 같은 다양한 만성 염증성 질환의 병리적 기전에 기여하는 것으로 보고되고 있다(Minhas et al., 2020). 특히, NO의 과잉 생성은 염증 반응을 지속시키고 조직 손상을 유발하며, 만성 염증이 심화되는 악순환을 초래할 수 있다. 이러한 이유로 iNOS 발현을 억제하여 NO 생성을 조절하는 전략은 이러한 만성 염증성 질환의 치료에 있어 효과적인 접근법으로 오랜 기간 연구되고 주목받아 왔다(Minhas et al., 2020).
따라서, CNL과 CNR의 항염증 효과를 극대화할 수 있는 최적의 추출 조건을 규명하기 위해, 다양한 농도의 에탄올에서 추출된 CNL 및 CNR이 대식세포에서 LPS로 유도된 NO 과대 생성에 미치는 영향을 비교 분석하였다. 분석 결과, CNR은 10% 에탄올 추출물부터 70% 에탄올 추출물까지 LPS로 유도된 NO 과도 생성을 효과적으로 억제하지 못한 것으로 나타났다(Fig, 1A). 반면, CNL은 10% 및 30% 에탄올 추출물에서 NO 과도 생성을 억제하지 못했으나, 50% 및 70% 에탄올 추출물에서는 NO 과도 생성을 유의하게 억제하는 효과를 보였다(Fig. 1A). 그리하여 우리는 70% 에탄올로 추출된 CNL을 활용하여 추가적인 연구를 수행하였다. 농도별 실험 결과, CNL은 농도 의존적으로 LPS로 유도된 NO 생성을 억제하는 항염증 활성을 나타냈다. 구체적으로, CNL은 100 ㎍/mL 농도에서는 NO 생성에 대한 억제 효과를 보이지 않았으나, 200 ㎍/mL 및 300 ㎍/mL 농도에서는 유의미하게 LPS 매개 NO 생성을 억제하였다(Fig. 1B). 이는 CNL이 과도한 염증 반응에서 NO 생성 조절에 관여할 가능성을 시사한다. 또한, 동일 농도(200 ㎍/mL 및 300 ㎍/mL)에서 iNOS 발현 역시 유의적으로 억제되었으며(Fig. 1C), 이는 CNL 매개 NO 생성의 억제는 iNOS의 발현억제에 기인한다라는 것을 의미한다. 한편, CNL은 실험에 사용된 모든 농도에서 RAW264.7 대식세포의 생존력에 부정적인 영향을 미치지 않았다(Fig. 1D). 즉, CNL은 세포독성을 유발하지 않으면서도 항염증 효과를 나타냈다. 이는 CNL이 안전성과 유효성을 모두 갖춘 천연물 기반 항염증제로서의 가능성을 보여준다.
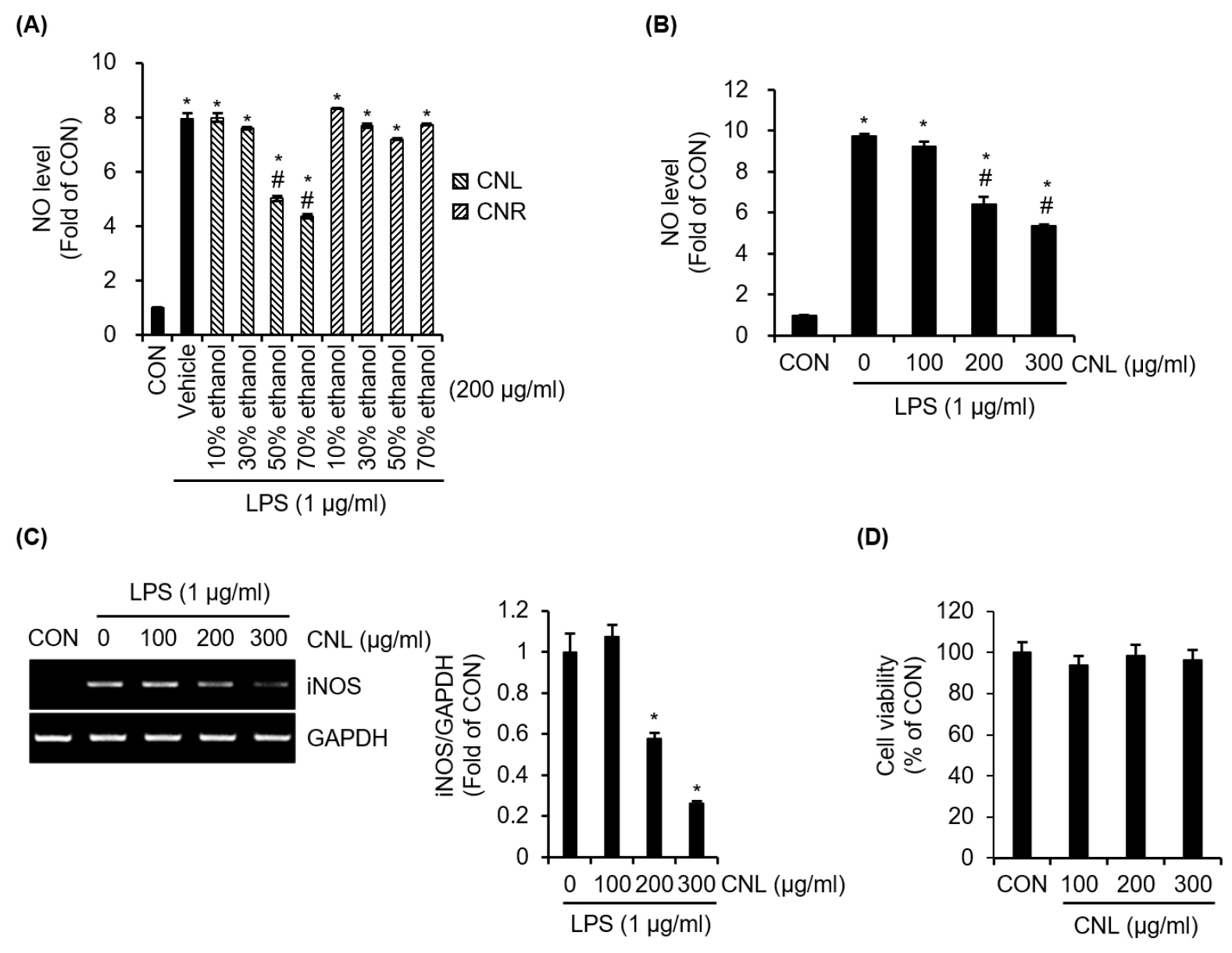
Fig. 1.
Effect of CNL or CNR on NO production and iNOS expression in LPS-stimulated RAW264.7 cells. (A) RAW264.7 cells were pre-treated with CNL or CNR extracts at various ethanol concentrations for 2 h, followed by an 18-hour incubation with LPS. NO levels were analyzed using the Griess assay. (B) RAW264.7 cells were pre-treated with CNL extracted using 70% ethanol for 2 h, followed by an 18-hour incubation with LPS. NO levels were assessed using the Griess assay. (C) NO levels were analyzed using the Griess assay. (B) RAW264.7 cells were pre-treated with CNL extracted using 70% ethanol for 2 h, followed by an 18-hour incubation with LPS. iNOS level was assessed using RT-PCR. (D) RAW264.7 cells were treated with CNL extracted using 70% ethanol for 24 h. The cell viability was assessed using MTT assay. *P <0.05 vs CON (untreated group). #P<0.05 vs Vehicle (LPS-only treated group).
LPS로 자극된 RAW264.7세포에서 CNL 매개 NO 생성과 iNOS 발현 억제에 MAPK와 NF-κB 신호전달이 미치는 영향
MAPK와 NF-кB 신호 전달 경로는 염증을 매개하는 핵심 경로로 알려져 있다(Park et al., 2022). ERK1/2, p38, JNK로 구성된 MAPK 경로와 NF-кB 신호 전달의 활성화는 NO와 iNOS와 같은 만성 염증 매개체의 생성을 촉진한다고 보고된 바 있다(Han et al., 2020; Xie et al., 2019). 따라서 MAPK와 NF-кB 신호 전달 경로의 억제는 오랫동안 항염증 치료 전략의 중요한 표적으로 간주되어 왔다(Park et al., 2022).
CNL이 LPS로 자극된 RAW264.7 세포에서 MAPK 및 NF-κB 신호 전달 경로를 억제하는지 조사하기 위해, 세포를 CNL로 2시간 동안 전처리한 후 LPS에 15분 동안 노출시켰다. 이후, ERK1/2, p38, JNK 및 p65의 인산화 수준을 측정하여 CNL이 해당 신호전달 분자에 미치는 억제 효과를 평가하였다. Fig. 2에 나타난 바와 같이, CNL은 LPS로 유도된 ERK1/2와 p38의 인산화를 억제하지는 못했으나 JNK의 인산화를 유의미하게 감소시켰다. 또한, CNL은 LPS로 유도된 p65의 인산화를 현저히 감소시키는 것으로 나타났다. 이러한 결과는 CNL은 JNK 및 NF-κB 신호전달 경로를 억제함으로써 iNOS 발현을 감소시키고, 이를 통해 NO 생성을 억제한다는 것을 시사한다. JNK와 NF-κB가 염증 반응을 유발하는 핵심 경로인 반면, ERK1/2와 p38은 염증반응보다는 세포 생존과 증식에 중요한 역할을 한다는 기존 연구 결과(Xie et al., 2019)를 미루어 볼 때, CNL이 염증을 유발하는 핵심 경로인 JNK와 NF-κB만 선택적으로 억제하는 것은 다른 세포 기능에는 영향을 미치지 않기 때문에 부작용이 적은 항염증제로 활용될 가능성을 보여준다.
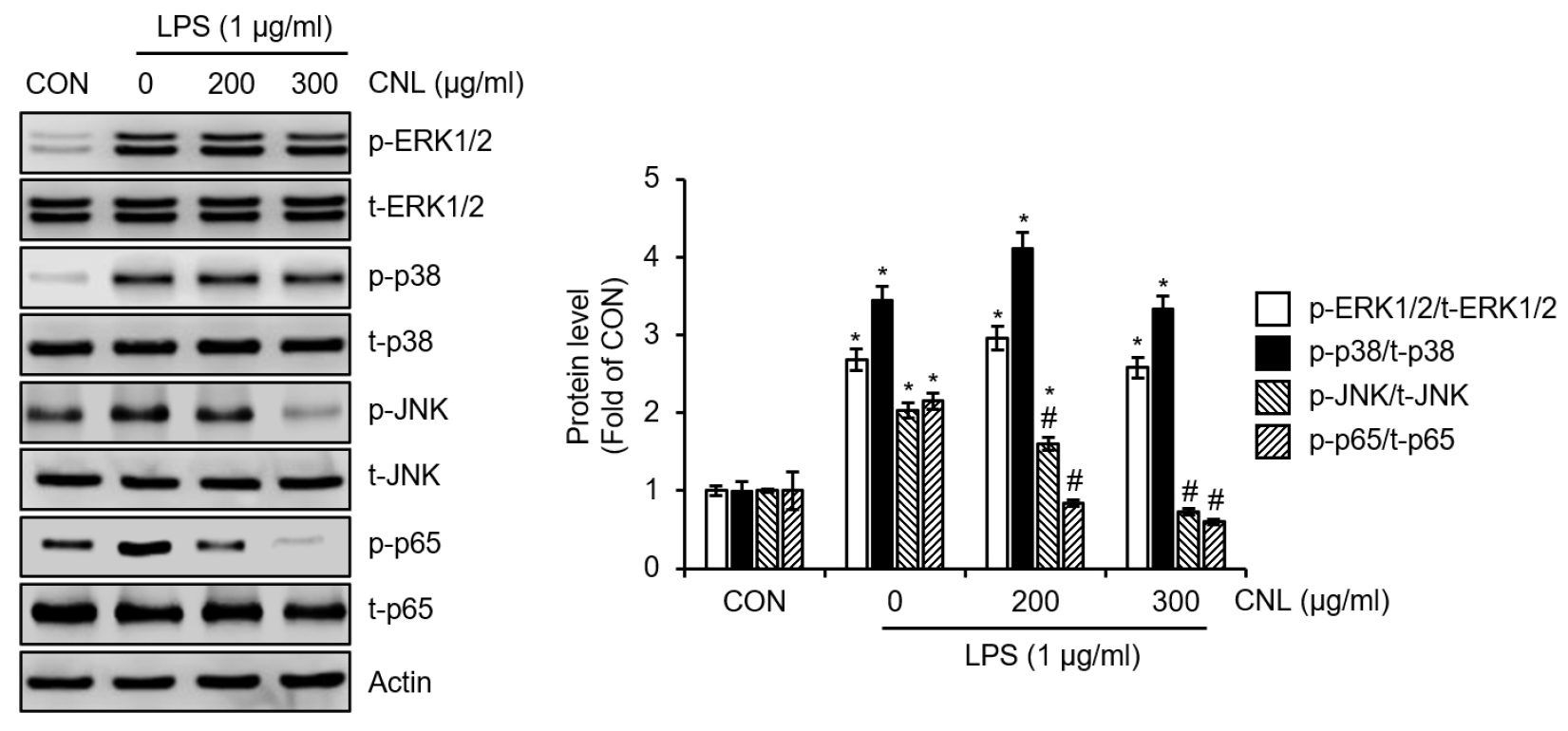
Fig. 2.
Effect of CNL on MAPK and NF-κB signaling pathway in LPS-stimulated RAW264.7 cells. RAW264.7 cells were pre-treated with CNL extracted using 70% ethanol for 2 h and then co-treated with LPS for 20 min. The protein level was assessed using Western blot analysis. *P <0.05 vs CON (untreated group). #P<0.05 vs Vehicle (LPS-only treated group).
RAW264.7세포에서 CNL이 Nrf2/HO-1 신호전달에 미치는 영향
HO-1은 heme을 biliverdin, iron, carbon monoxide로 분해하는 항산화 효소로, 단순히 산화 스트레스를 줄이는 것뿐 아니라 항염증 작용을 나타내는 것으로 잘 알려져 있다(Jin et al., 2016). 최근 연구에 따르면 대식세포에서 HO-1의 발현이 증가하면 LPS로 유도된 NO와 iNOS 같은 염증성 매개물질의 생성을 효과적으로 억제할 수 있다고 보고되었다(Jin et al., 2010; Park et al., 2009; Tsoyi et al., 2008). 반대로, HO-1이 결핍된 마우스는 심각한 염증 반응을 보이며, 이는 HO-1이 염증 반응을 억제하는 데 중요한 역할을 한다는 점을 의미한다(True et al., 2007). HO-1 발현은 Nrf2라는 전사 인자에 의해 조절된다. Nrf2는 세포가 산화 스트레스를 받을 때 Keap1이라는 억제 단백질과 분리되어 핵으로 이동한다. 핵으로 이동한 Nrf2는 HO-1의 발현을 촉진하여 염증 반응을 완화하는 데 기여한다(Johnson et al., 2008). 이와 같은 Nrf2/HO-1 신호 전달 경로는 염증성 질환의 진행을 억제하는 데 있어 중요한 역할을 하기 때문에, 이 경로를 활성화하는 것은 염증성 질환 치료를 위한 유망한 접근법으로 주목받고 있다(Jin et al., 2016). 즉, Nrf2가 활성화되면 세포가 산화 스트레스에 대처할 수 있는 방어 기전을 강화할 뿐 아니라 HO-1을 통해 염증을 억제할 수 있어 산화 스트레스와 염증이라는 두 가지 주요 병리적 요인을 동시에 조절할 수 있는 잠재력을 제공할 수 있다. 이러한 메커니즘은 HO-1의 발현을 촉진하는 물질이 항염증 치료제 개발에 있어 중요한 후보가 될 수 있음을 시사한다.
CNL이 Nrf2/HO-1 신호 전달 경로에 미치는 영향을 조사하기 위해, RAW264.7 세포에 CNL을 처리한 후 다양한 시간대에서 HO-1 및 핵 내 Nrf2 단백질 수준을 분석하였다. Fig. 3A에 나타난 바와 같이 CNL은 처리 3시간 째부터 RAW264.7 세포에서 HO-1 단백질 수준을 증가시켰고. 처리 1시간 째 핵 내 Nrf2 단백질 수준을 유의미하게 증가시켰다. 또한, CNL이 Nrf2/HO-1 신호 전달 경로를 통해 NO 생성 억제에 기여하는지 확인하기 위해 HO-1 억제제인 ZnPP와 함께 세포를 처리한 후 NO 수준의 변화를 측정하였다. Fig. 3B에 따르면 ZnPP가 없는 조건에서 CNL은 LPS로 유도된 NO 과생성을 현저히 억제하였다. 그러나 ZnPP가 존재하는 조건에서는 CNL의 NO 과생성 억제 효과가 감소하는 것으로 나타났다. 이러한 결과는 CNL에 의해 매개되는 Nrf2/HO-1 신호 전달 경로의 활성화가 LPS로 유도된 NO 과생성을 억제하는 데 중요한 역할을 한다는 것을 시사한다. 게다가 CNL 매개 Nrf2/HO-1 신호 전달 경로의 활성화은 CNL이 산화적 스트레스를 완화하고 염증성 매개인자의 생성을 감소시킬 수 있어 만성 염증성 질환의 병리적 요인을 효과적으로 해결할 가능성을 보여준다.
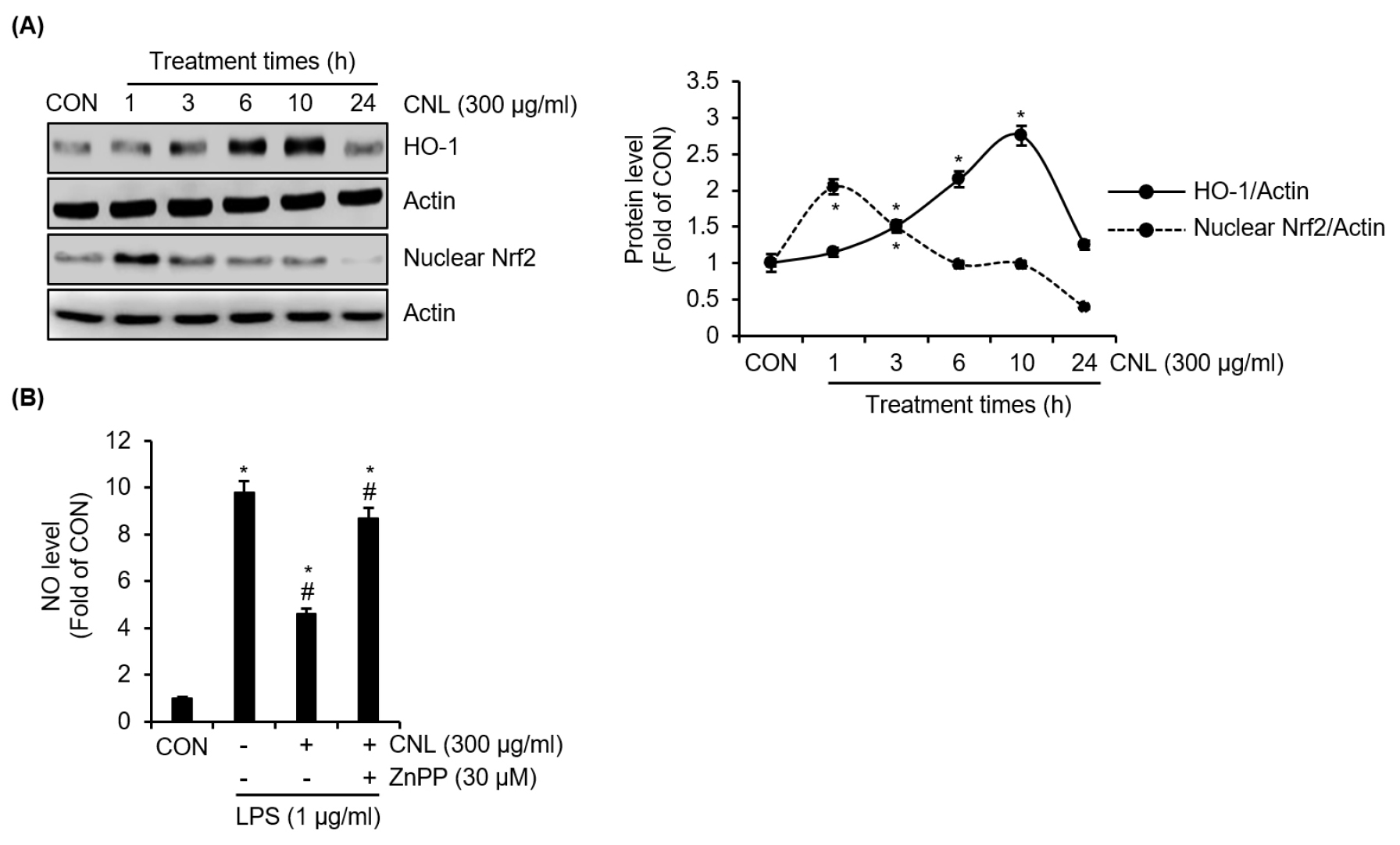
Fig. 3.
Effect of CNL on Nrf2/HO-1 signaling pathway in RAW264.7 cells. (A) RAW264.7 cells were treated with CNL extracted using 70% ethanol for the indicated times. The protein level was assessed using Western blot analysis. (B) RAW264.7 cells were pre-treated with CNL extracted using 70% ethanol in absence or presence of ZnPP for 2 h, and then co-treated with LPS for 18 h. The NO level was assessed using Griess assay. *P <0.05 vs CON (untreated group). #P<0.05 vs Vehicle (LPS-only treated group).
RAW264.7세포에서 PI3K가 CNL 매개 Nrf2/HO-1 신호전달 활성화에 미치는 영향
이전 연구에서는 PI3K가 세포 방어를 강화하고 세포 생존을 촉진하는 중요한 역할을 하는 상위 신호 전달 분자임이 밝혀졌다. 특히, PI3K는 Nrf2 활성화를 조절하여 산화 스트레스와 염증 반응에 대처할 수 있는 세포의 방어 메커니즘을 지원하는 것으로 알려져 있다(Xu et al., 2015). PI3K의 억제제인 LY294002를 사용한 연구에서는 PI3K가 억제될 경우 Nrf2/HO-1 신호 전달 경로의 활성화가 저해되며, 이는 결과적으로 세포의 방어 능력이 크게 약화 되었다(Meng et al., 2014). 이러한 결과는 PI3K가 Nrf2/HO-1 경로를 통해 세포 항상성과 생존을 유지하는 데 중요한 조절자로 작용함을 시사하며, PI3K의 기능을 타겟으로 하는 연구가 산화 스트레스와 염증성 질환 치료에 있어 중요한 단서를 제공할 수 있음을 의미한다.
CNL이 Nrf2/HO-1 신호 전달 경로를 활성화하는 데 있어 PI3K 신호 전달의 역할을 확인하기 위해, PI3K 억제제인 LY294002와 CNL을 함께 처리한 후 HO-1 및 핵 내 Nrf2 단백질 수준의 변화를 분석하였다. Fig. 4A에 나타난 바와 같이, LY294002로 PI3K를 억제했을 때, CNL 단독 처리군에 비해 HO-1 및 핵 내 Nrf2 단백질 수준의 증가가 완화되다. 또한, Fig. 4B에 따르면 CNL은 처리 후 1시째 부터 PI3K의 활성화 지표인 PI3K 인산화를 현저히 증가시켰다. 이러한 결과는 CNL이 Nrf2/HO-1 신호 전달 경로를 효과적으로 활성화하기 위해 PI3K의 활성화가 필수적임을 나타낸다. 이는 PI3K가 CNL의 작용 메커니즘에서 핵심적인 상위 조절자로 작용하며, 항산화 및 항염증 효과를 발휘하는 데 중요한 역할을 한다는 점을 시사한다. 따라서, CNL이 PI3K를 활성화하여 Nrf2/HO-1 신호 전달 경로를 조절하는 기전은, CNL이 염증성 질환 및 산화 스트레스 관련 질환 치료에 있어 유망한 천연물 기반 치료제로 활용될 가능성을 보여준다.
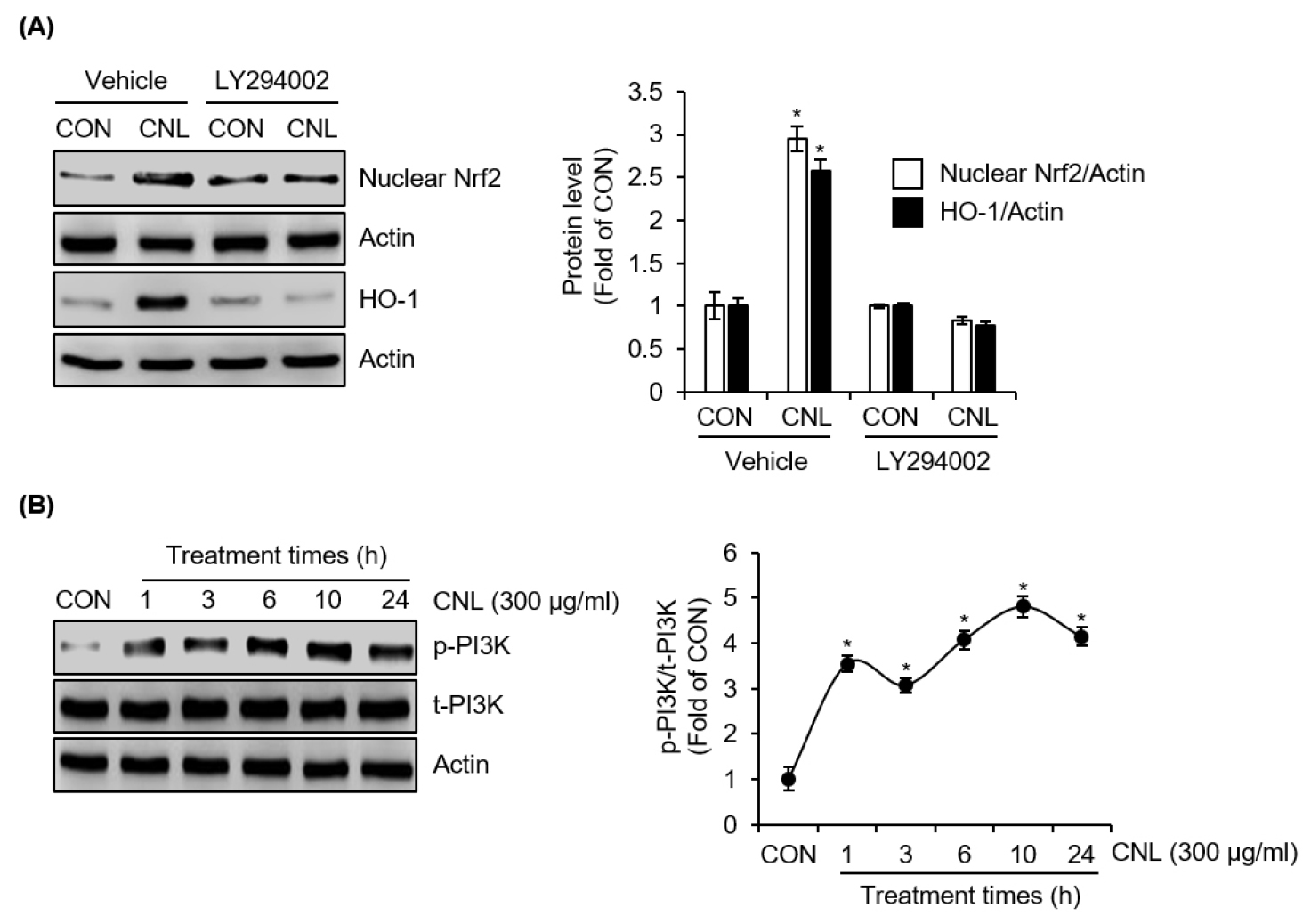
Fig. 4.
Effect of PI3K on CNL-mediated activation of Nrf2/HO-1 signaling pathway in RAW264.7 cells. (A) RAW264.7 cells were pre-treated with LY294002 (20 μM) for 2 h, and then co-treated with CNL extracted using 70% ethanol for 1 h or 6 h. The protein level was assessed using Western blot analysis. (B) RAW264.7 cells were treated with CNL extracted using 70% ethanol for the indicated times. The protein level was assessed using Western blot analysis. *P <0.05 vs CON (untreated group).
RAW264.7세포에서 ROS가 CNL 매개 PI3K/Nrf2/HO-1 신호전달 활성화에 미치는 영향
ROS는 HO-1 발현에 관여한다고 알려져 있다(Liu et al., 2011). CNL이 PI3K를 활성화하는 메커니즘을 추가적으로 조사하기 위해 ROS 억제제인 NAC와 함께 CNL을 처리하고, CNL이 유도한 PI3K 인산화의 변화를 분석하였다. Fig. 5A에 나타난 바와 같이 NAC에 의한 ROS 억제는 NAC 없이 CNL만 처리한 그룹과 비교했을 때, CNL에 의해 유도된 PI3K 인산화를 감소시켰다. 또한, NAC를 통한 ROS 억제는 CNL이 유도한 HO-1과 핵 내 Nrf2 단백질 수준의 증가를 저해하였다(Fig. 5B). 이러한 결과는 CNL에 의한 Nrf2/HO-1 신호 전달 경로의 활성화가 ROS 매개 PI3K 활성화에 의해 조절됨을 시사한다.
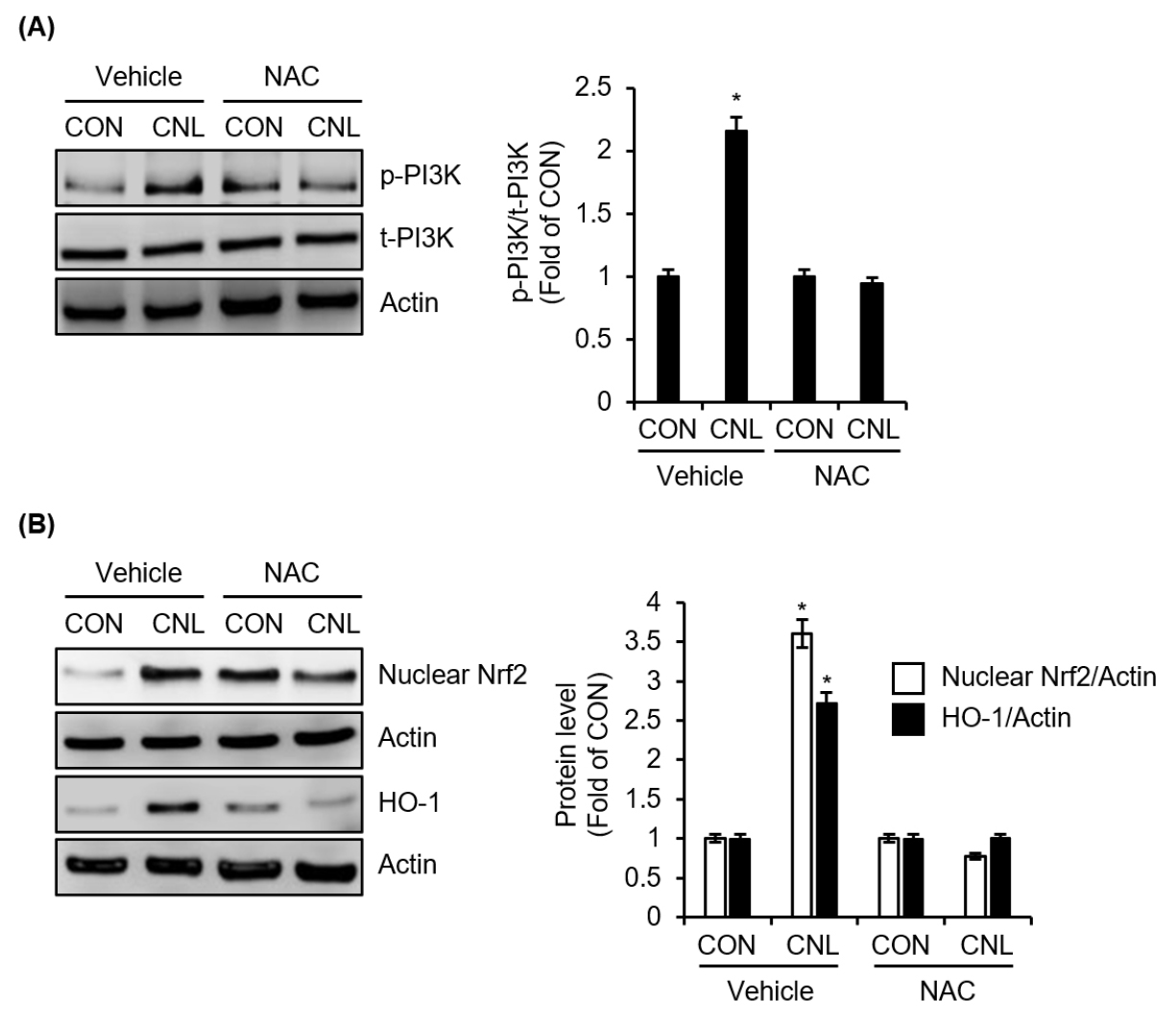
Fig. 5.
Effect of ROS on CNL-mediated activation of PI3K/Nrf2/HO-1 signaling pathway in RAW264.7 cells. (A) RAW264.7 cells were pre-treated with NAC (10 mM) for 2 h, and then co-treated with CNL extracted using 70% ethanol for 1 h. The protein level was assessed using Western blot analysis. (B) RAW264.7 cells were pre-treated with NAC (10 mM) for 2 h, and then co-treated with CNL extracted using 70% ethanol for 1 h or 6 h. The protein level was assessed using Western blot analysis. *P <0.05 vs CON (untreated group).
적 요
본 연구는 CNL이 LPS로 자극된 RAW264.7세포에서 JNK와 NF-κB 신호 전달을 억제하는 동시에 ROS/PI3K/Nrf2/HO-1 신호 전달을 활성화하여 iNOS 발현을 감소시키고 NO 생성을 억제한다는 점을 구명하였다. 이러한 결과는 CNL이 다기능 항염증제로서 치료 가능성을 지닌다는 점을 보여준다. 특히, CNL이 여러 신호 전달 경로를 통해 항염증 효과를 발휘할 수 있다는 점은 단일 경로를 표적으로 하는 기존 치료법에 비해 유망한 대안이 될 수 있다. 그럼에도 불구하고, 본 연구에는 몇 가지 한계점이 존재한다. 첫째, 본 연구는 LPS로 자극된 RAW264.7 대식세포를 사용하여 in vitro에서만 진행되었다. 이러한 결과는 잠재적인 항염증 기전을 시사하지만, 생리학적 환경에서의 복잡한 상호작용을 세포 배양 모델만으로 완전히 재현할 수는 없다. 따라서, 이러한 효과를 검증하고 CNL이 생체 내에서 전체 유기체 차원에서 어떻게 작용하는지를 이해하기 위해 추가적인 in vivo 연구가 필요하다. 둘째, 본 연구에서는 CNL이 항염증활성을 나타내는데 어떤 특정 성분이 작용하는지 밝혀지지 않았다. 이는 CNL의 항염증 관련 연구 결과를 완전히 이해하는 데 한계를 줄 뿐 아니라 CNL을 활용한 효과적인 치료제를 개발하는 데도 어려움줄 수 있다. 이를 해결하려면, CNL의 화학적 성분을 분리하고, 그중 활성 성분을 찾아내는 분석이 필요하다. 또한, 이렇게 확인된 성분의 구조와 항염증 관련 신호 전달 경로에서의 역할을 규명하는 추가 연구가 이루어져야 한다.




