서 언
재료 및 방법
시험 재료
생장조절제 처리
과실 특성
총페놀화합물 함량 분석
시료 전처리 및 고분자 탄닌 추출
고분자 탄닌 함량 분석
통계분석
결과 및 고찰
과실 특성 조사
총페놀화합물 함량
종자 형성률과 탄닌 함량
적 요
서 언
포도의 무핵재배는 1959년 ‘Delaware’에서 gibberellin (GA) 처리를 통한 무핵화가 성공한 이후(Kishi and Tazaki, 1959) 무핵재배 품종을 다양화하거나 재배방법을 개선하고자 하는 연구들이 수행되었다(Ben-Tal, 1990; Lee et al., 1996, 2003a, 2003b; Yu, 2003). 식물 생장을 촉진시키는 호르몬 중 단위결과를 유기하여 종자를 없애는 생장조절제는 auxin, GA 및 cytokinin 계열 물질로 일반적으로 단용으로 이용하거나 두 가지 이상을 혼용하여 사용한다(Chun et al., 2003; Gustafson, 1936; Kim et al., 1994; Lee et al., 2013). Cytokinin 계열 물질로 thidiazuron (TDZ)을 주로 사용하는데 TDZ는 ‘Campbell Early’에서의 과립 비대(Kim et al., 2002)와, GA와 혼용 시 ‘Himrod Seedless’와 착립이 불안정한 ‘Kyoho’에서 과립 비대와 결실률 향상에 효과가 있는 것으로 보고되었다(Ben-Tal, 1990; Byun and Kim, 1995; Byun et al., 1993; Lee et al., 2013). 또한 streptomycin (SM) 및 GA 처리가 배유핵의 분열을 저해하여 무핵화를 유기한다고 보고된 바 있다(Lee et al., 2003).
2002년 포도 재배의 품종별 비율은 ‘Campbell Early’ 73.5%, ‘Kyoho’ 12.8%, ‘Muscat Bailey A’ (MBA) 4.9%, 기타 품종이 8.8%였으나 2022년에는 ‘Campbell Early’ 31.7%, 대립계 17.3%, ‘Shine Muscat’ 41.4%, MBA 6.5%, ‘Delaware’ 0.4%, 기타 2.7%로(KREI, 2023) ‘Shine Muscat’와 주로 무핵으로 재배되는 대립계 품종의 비율이 전체의 58.7%를 차지해 씨없는 품종이나 씨를 없앤 품종들에 대한 요구가 늘어난 것을 확인할 수 있다. 이처럼 다양한 모양과 향을 가진 씨없는 포도 품종들이 증가하고 소비 양상도 다양해짐에 따라(Jung et al., 2020) 국내에서도 씨없는 포도나 다양한 형태를 가진 품종 등이 육성되어 재배면적이 늘어나고 있는 실정이다(Kim et al., 2023).
최근에 보급된 ‘Stella’는 국립원예특작과학원에서 ‘Neomart’와 ‘Beni Pizzutello’ 를 교배하여 육성한 Vitis Vinifera L. 계통의 흑색 포도 품종으로 2017년에 최종 선발되었으며, 숙기는 9월 상순이다(Choi et al., 2022). ‘Stella’는 체리 ‘Satonishiki’과 같은 향이 있으며, 과립 모양이 럭비공과 같은 형태를 띠고 있어 소비자들의 호감도가 높을 가능성이 있는 포도이다(Fig. 1). 특히 ‘Stella’는 껍질이 과육과 분리가 잘되지 않고 얇아 과립째 식용할 수 있으나 떫은맛이 강한 종자가 있어 식이편이성을 높이기 위해 생장조절제를 통해 무핵화하는 것이 필수적이나(Kim et al., 2023; Oh et al., 2022) 생장조절제 처리에 의한 반응에 대한 연구가 전무한 실정이다.
따라서 본 연구에서는 최근 국내에서 육성된 ‘Stella’ 포도에 생장조절제를 처리하여 무핵화 유도 및 과실 특성 변화를 조사하고, 향후 품종 보급 시 기초 자료로 활용하고자 실험을 수행하였다.

Fig. 1.
Fruit appearance of ‘Stella’ grape under different growth regulator treatments. (A) Control; (B) Streptomycin 200 ㎎/L + 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 1 ㎎/L; (C) streptomycin 200 ㎎/L + 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 3 ㎎/L; (D) streptomycin 200 ㎎/L + 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 5 ㎎/L; (E) 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 1 ㎎/L (no streptomycin); (F) 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 3 ㎎/L (no streptomycin); (G)1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 5 ㎎/L (no streptomycin).
재료 및 방법
시험 재료
실험은 전북 남원시 아영면에 위치한 농장(35°30'36.0"N 127°36'49.3"E)에서 2020년에 식재된 국내 육성 포도 품종 ‘Stella’ 10주를 대상으로 하였다. 재배는 비가림하우스 형태의 시설에서 이루어졌으며, 재식간격 2.7 m × 2.7 m, 개량일자형 수형으로 조성하였으며, 단초전정을 방식으로 관리하였다.
생장조절제 처리
만개기(2023년 5월 28일) 10일 전에 SM 200 ㎎/L 처리구와 무처리구를 나누어 처리하였다. 그 후 두 처리구에서 단위결과를 유도하기 위한 1차 침지 처리는 만개기에 실시하였으며, 과립 비대를 위한 2차 침지 처리는 1차 처리 후 10일 후에 실시하였다.
1차 침지 처리는 GA 25 ㎎/L과 TDZ 2 ㎎/L을 혼용하여 고정 처리하였으며, 2차 침지 처리는 GA 25 ㎎/L에 TDZ를 1, 3, 5 ㎎/L으로 달리하여 각 처리구의 과방을 침지하는 방식으로 처리하였다. 또한 비교를 위해 생장조절제를 처리하지 않은 대조구를 두었다.
과실 특성
과실은 과방중, 과실의 길이, 과실의 너비, 중량, 가용성 고형물 함량, 산 함량, 과피 색, 수확량 등을 조사하였다. 각 처리별 무작위로 추출한 과방 15송이를 대상으로 과방중, 과립중, 과립의 종경 및 횡경를 조사하였다. 과방중과 과립중은 전자저울을(SW-1 & BJ-620, CAS, Korea) 사용하였으며, 과립의 종경 및 횡경은 캘리퍼스를 이용하여 측정하였다. 가용성 고형물(total soluble solids, TSS) 함량은 무작위로 반복 당 10개의 과립을 선택하여 거즈 2겹을 이용하여 착즙 후 20°C로 자동 보정되는 디지털 당도계(RA-520N, Kyoto Electronic, Japan)를 이용하여 측정하였다. 적정산도(titratable acidity, TA)는 동일한 과즙을 자동산도 분석기(Titroline easy, Schott, Germany)를 이용하여 측정한 후 포도의 주요 유기산인 주석산 함량으로 환산하여 나타내었다. 가용성 고형물 함량과 산 함량은 총 5반복으로 측정하였다. 과피색은 과실 특성 조사에서 사용한 송이에서 무작위로 반복 당 30개의 과방의 중간 부위를 색차계(CR-300, Minolta, Japan)를 이용하여 Hunter L, a, b값을 측정하여 비교하였다. 수확된 과실을 처리구별로 5과방을 무작위로 선발하여 과방 당 전체 과립 수에 대한 유핵 과립 수의 비를 계산하여 종자형성율을, 종자 수는 종자가 있는 유핵 과립 당 종자의 수를 조사하여 산출하였다. 과피 두께는 수확한 과립에서 과피를 과육에서 조심스럽게 분리하여 과육 부위를 거즈를 이용하여 제거한 뒤 물성측정기(TA1, AMETEK, Berwyn, PA, USA)로 측정하였다.
총페놀화합물 함량 분석
포도 껍질을 과육으로부터 잘 분리한 후 증류수로 세척하였다. 모아진 포도 껍질은 3일 동안 동결건조시킨 후 분쇄기를 사용하여 분쇄하였다. 분쇄한 포도 껍질 시료 0.3 g에 추출용매 (물 : 아세톤 : 메탄올 = 0.36 : 0.48 : 0.16, v/v) 10 mL을 넣고 sonication하여 30분간 추출하였다(DH.WUC.D10H, Daihan Scientific, Wonju, Korea). 추출이 끝나면 원심분리(12,000 rpm, 10분)하여 상등액과 침전물을 분리하여 상등액을 실험에 사용하였다. 총 페놀화합물 함량은 Folin-Ciocalteu 방법에 따라 Folin-Ciocalteu‘s reagent가 포도의 폴리페놀 화합물에 의해 환원된 결과 청색으로 발색하는 원리로 측정하였다(Kim et al., 2003). 즉, 분석에 앞서 1 mL 추출액을 농축하여 용매를 모두 제거한 후 dimethyl sulfoxide (DMSO)에 녹여 분석 시료로 사용하였다. 분석 시료 0.1 mL에 0.5 mL Folin-Ciocalteu working solution을 첨가하고 0.4 mL의 20% sodium carbonate (Na2CO3)을 넣고 잘 혼합한 다음 40℃의 shaking water bath (MaXturdy, Daehan Scientific Co.)에서 2시간 동안 교반하면서 반응시켰다. 200 mL의 반응용액을 취하여 96-well micro plate의 well에 넣은 후 microplate reader (Multiskan GO, Thermo Fisher Scientific. Walthan, MA, USA)를 이용하여 blank solution을 blank로 하여 760 ㎚에서 흡광도를 측정하였다. Blank solution의 경우, 0.1 mL DMSO을 취하여 이하 같은 방법으로 하였다. 총 페놀화합물 함량은 갈산(gallic acid) 검량선을 이용하여 산출하였으며, 1 g 건조중량(dry weight, DW)에 대한 gallic acid equivalent (㎎ GAE/g DW)로 나타내었다.
시료 전처리 및 고분자 탄닌 추출
탄닌 화합물 추출은 Downey와 Hanlin (2010)의 추출법을 인용하여 수행하였다. ‘Stella’ 과방을 실험 포장에서 수확한 후 과피를 송이에서 조심스럽게 분리하여 각각 거즈 및 증류수로 이물질을 제거하고 과피만을 분리하여 동결건조기(FDCF- 12012, Operon Advantech, Korea)를 이용하여 동결건조하였다. 보관된 실험 재료는 추출 전 분쇄하고 15 mL plastic tube에 500 ㎎ 씩 정량하여 사용하였다. 정량된 과피 샘플에 추출 용매 5 mL를 첨가한 후, 초음파 추출기(DH. EUC. D10H, 200W, 40KHz, Daehan Scientific, Korea)를 이용하여 30분 추출한 후, 원심분리기(VS-550, Vision Scientific, Korea)로 1,500 rpm에서 10분간 원심 분리를 수행하였다. 원심 분리 후, 상등액은 새로운 15 mL plastic tube에 옮겼다. 남아있는 침전물에 추출용매 1 mL를 사용하여 추출을 한 번 더 수행하였다. 추출된 상등액은 고분자 탄닌 함량을 분석하는데 사용하였다.
고분자 탄닌 함량 분석
포도의 고분자 탄닌 함량분석은 Singleton (1974)의 방법을 참조하여 수행하였다. 추출된 상등액 20 μL와 증류수 1200 μL를 2 mL microtube에 넣고, 100% Folin-Ciocalteu phenol reagent 시약 100 μL 및 15% Na2CO3 (Sodium carbonate) 시약 300 μL를 순서대로 첨가하였다. 반응 시약을 첨가한 후, 최종 볼륨이 2 mL가 되도록 증류수 380 μL를 추가로 첨가하였다. 또한, 암조건의 실온에서 2시간 동안의 반응 시간을 거친 후, microplate로 200 μL씩 옮겨 다기능 흡광 분석기(Multiskan Go, Thermo Fisher Scientific, Waltham, USA)를 사용하여 765 ㎚에서 흡광도를 측정하였다. 고분자 탄닌 함량은 표준 시약 tannin acid를 사용하여 검량선을 작성하였으며, 모든 실험은 4반복으로 이루어졌다.
통계분석
실험 결과의 통계 처리는 공개용 통계소프트웨어인 R program (Ver 2.13.0)의 통계분석패키지 ‘Rcmdr’ (Ver 1.6-4)을 이용하여 분산분석을 하였고, 처리간 유의성은 Tukey’s honestly significant difference test를 통해 0.05% 수준에서 검증하였다.
결과 및 고찰
과실 특성 조사
‘Stella’ 포도의 과방 무게는 국립원예특작과학원에서 제시된 ‘Stella’의 평균 과중인 400 g 보다 모든 처리구에서 조금 작게 300 g 내외로 나타났다. SM 처리 유무와 상관없이 TDZ 농도 5 ㎎/L에서 대조구와 비슷한 과방중을 보였으나 다른 처리구에서는 상대적으로 과방중이 감소하였다(Table 1). 과립중은 무처리구에서 7 g 이었으나, 2차 처리 시기에 TDZ를 5 ㎎/L 처리한 처리구를 제외한 대부분의 생장조절제 처리구에서는 과립중의 유의미한 증가가 없었다(Table 1). TDZ 농도 상승과 함께 과립 중량이 증가하는 경향을 보였으나 무처리구와 비교했을 때 유의미한 차이는 없었다. Cytokynin 활성을 나타내는 TDZ는 기존 연구에 따르면 GA에 비해 ‘Campbell Early’나 ‘Kyoho’ 등에서 과립 비대 효과가 높다고 알려져 있으며, GA 단용 처리보다 TDZ과 혼용할 경우 과립중이 증가한다는 보고들이 있으나(Lee et al., 1996, 2013) ‘Stella’의 경우 SM 처리 후 2차에 TDZ 5 ㎎/L를 처리한 구에서만 과립중의 증가가 관찰되었고, 나머지 처리구에서는 오히려 과립중이 감소해 과립 비대 효과가 제한적임을 알 수 있었다. 과형은 생장조절제 처리가 과실의 길이/너비(Length/Diameter, L/D) 비율을 감소시켜, 대조구에서 유지되었던 럭비공 형태의 과형이 변형되어 길쭉하지 않은 형태로 변형되었다(Table 1, Fig. 1). 과실의 당도는 모든 처리구에서 20 °Brix 이상으로 나타났으며, 산도와 색도에서의 차이도 크지 않았다(Table 1). 이는 생장조절제가 ‘Stella’의 주요 품질 요소인 당도와 산도에 큰 영향을 미치지 않음을 시사한다. 색도의 경우 생장조절제 처리구가 대조구보다 a 값과 b 값이 높은 경향이었으나 생장조절제 농도에 따른 뚜렷한 증감 경향은 보이지 않았다(Table 1). 색도의 a 값은 양수로 커질수록 빨강색을 음수로 갈수록 녹색을 나타내며, b 값은 양수로 갈수록 노랑색을 음수로 갈수록 파랑색을 나타내는데 본 연구에서는 모든 값의 수치 차이가 적게 나타나 육안으로도 뚜렷한 경향이 보이지 않았다(Fig. 1). 또한 ‘Pione’와 ‘Kyoho’의 경우 생장조절제 2회 처리는 무핵률과 과방중을 증가시키지만 당도와 산도 등에는 영향을 미치지 않는다는 연구 보고 결과와 비슷한 양상이었다(Lee et al., 1996, 2003a, 2003b, 2013). 종자가 있는 유핵 품종의 경우, SM 처리와 1회 GA와 사이토키닌 혼용 처리 또는 2회 GA와 cytokinin 혼용 처리 등으로 인해 과립의 크기를 처리하지 않는 과립보다 2배 이상 키운다는 보고들이 있다(Kobayashi et al., 2002; Lee et al., 2003a, 2003b, 2013). 이렇듯 과립중의 크기가 다른 포도 품종에 생장조절제 처리를 했을 때는 비대되는 것과 달리 ‘Stella’의 과립이 생장조절제 농도가 증가할수록 비대하지 않는 경향이었기 때문에 당도와 산도에도 큰 영향이 없는 것으로 판단된다.
Table 1.
Fruit characteristics of ‘Stella’ grape under different plant growth regulator treatments.
|
Strepto- mycin |
TDZ concentration of 2nd treatment (㎎/L) |
Weight of bunch (g) | Berry |
SSC (%) |
TA (%) | Hunter valuez | |||||
|
Weight (g) |
Length (㎜) |
Diameter (㎜) | L/D ratio | L | a | b | |||||
| Control | 323.8 ay | 7.0 b | 28.8 a | 19.6 b | 1.5 a | 20.0 a | 0.6 a | 21.5 a | 1.9 b | 0.0 c | |
| + | 1 | 308.5 b | 5.4 d | 24.5 d | 18.4 c | 1.3 b | 20.4 a | 0.6 a | 21.7 a | 1.8 b | -0.1 c |
| 3 | 306.5 b | 6.4 c | 26.1 c | 19.5 b | 1.3 b | 19.6 a | 0.6 a | 21.5 a | 2.8 a | 0.5 b | |
| 5 | 341.0 a | 6.6 c | 26.2 c | 20.0 b | 1.3 b | 20.7 a | 0.6 a | 21.2 a | 2.1 b | 0.3 bc | |
| - | 1 | 284.9 b | 5.5 d | 23.7 d | 18.5 c | 1.3 b | 20.6 a | 0.7 a | 20.8 a | 2.2 b | 0.5 b |
| 3 | 299.0 b | 5.6 d | 24.5 d | 19.1 c | 1.3 b | 20.5 a | 0.6 a | 20.1 a | 2.9 a | 0.1 c | |
| 5 | 375.5 a | 7.8 a | 27.6 b | 21.2 a | 1.3 b | 20.2 a | 0.6 a | 21.6 a | 3.0 a | 0.8 a | |
총페놀화합물 함량
본 연구에서는 다양한 생장조절제 처리가 ‘Stella’ 포도의 총 페놀화합물 함량에 미치는 영향을 분석하였다(Fig. 2). 실험 결과, 생장조절제를 처리하지 않은 대조구에서 가장 높은 총 페놀화합물 함량이 확인되었다. 또한 동일한 TDZ 농도에서 SM을 처리한 처리군이 SM을 포함하지 않은 처리군보다 상대적으로 높은 총 페놀화합물 함량을 보였다. 이러한 결과는 Petal et al. (2023)의 연구에서 보고된 바와 차이를 보인다. Patel et al. (2023)은 SM이 식물 호르몬인 GA의 형성 및 가용성을 억제하여, GA가 2차 대사산물 합성에 중요한 역할을 하므로 스트렙토마이신이 해당 경로에 영향을 미칠 수 있다고 제시하였다. 그러나 본 연구에서는 SM뿐 아니라 다양한 생장조절제가 복합적으로 작용한 결과, 모든 생장조절제 처리구에서 총 페놀화합물 함량이 대조구보다 감소하는 경향을 보였다. 이러한 결과는 SM의 단독 작용보다는 생장조절제의 복합적인 영향이 총 페놀화합물 함량 변화에 보다 중요한 역할을 할 가능성을 시사한다. 따라서 생장조절제와 SM 간의 상호작용 및 그 기작에 대한 추가적인 연구가 필요할 것으로 판단된다.
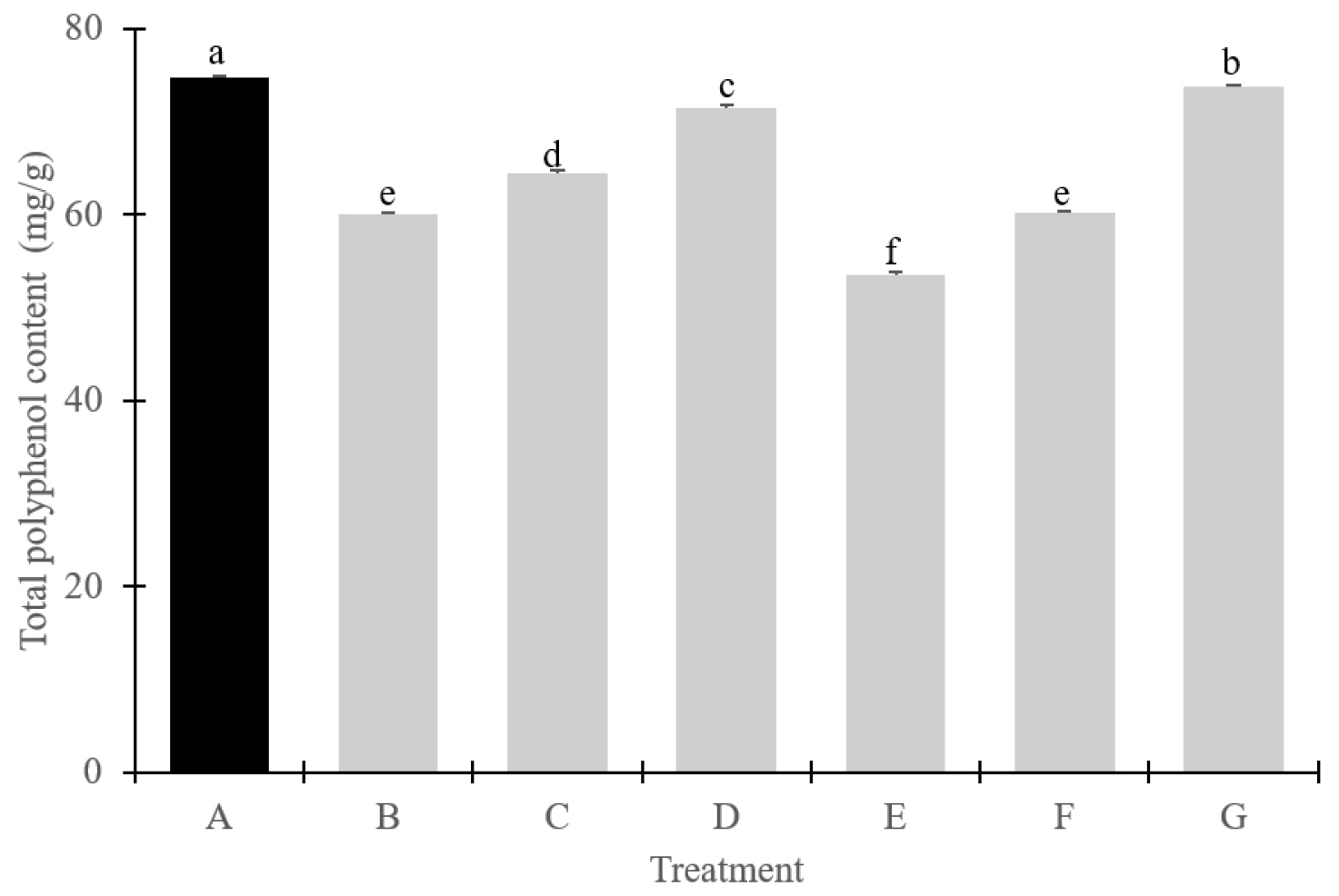
Fig. 2.
Total polyphenol content of ‘Stella’ grape by different growth regulator treatments. (A) Control; (B) Streptomycin 200 ㎎/L + 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 1 ㎎/L; (C) streptomycin 200 ㎎/L + 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 3 ㎎/L; (D) streptomycin 200 ㎎/L + 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 5 ㎎/L; (E) 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 1 ㎎/L (no streptomycin); (F) 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 3 ㎎/L (no streptomycin); (G)1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 5 ㎎/L (no streptomycin).
종자 형성률과 탄닌 함량
‘Stella’ 과실의 생장조절제 처리는 떫은맛이 나는 종자를 없애기 위한 목적이 가장 크기 때문에 종자 형성률을 조사하였다(Tabel 2). 대조구에서 72%의 무핵률을 기록한 반면 생장조절제 처리구에서는 모두 100%의 무핵화가 달성되었다(Table 2). 따라서 생장조절제 처리가 ‘Stella’ 과실의 무핵화에 매우 효과적임을 확인할 수 있었다. Shiozaki et al. (1996)은 유럽종 품종과 같이 세력이 지나치게 강한 품종의 경우에 SM을 개화 전에 처리하면 무핵률을 향상시킬 수 있다고 하였는데 세력이 왕성한 ’Stella’도 본 연구에서 개화 전 SM 처리뿐만 아니라 생장조절제 처리가 전체적으로 무핵화에 효과적인 것으로 나타났다. 종자의 수는 수분 시 충분한 화분의 양과 화분 활력에 의해 결정되는데, 기후의 영향으로 화분 활력이 저하되어 대조구에서도 적은 수의 종자가 형성된 것으로 판단되었다.
Table 2.
Seed formation rate and thickness of berry skin of ‘Stella’ grape under different growth regulator treatments.
| Streptomycin |
TDZ concentration of 2nd treatment (㎎/L) | % of seedless berry |
No. of seed per seeded berry |
Thickness of berry skin (㎜) |
| Control | 72.0 bz | 1.2 a | 0.3 c | |
| + | 1 | 100.0 a | 0.0 b | 0.4 b |
| 3 | 100.0 a | 0.0 b | 0.4 b | |
| 5 | 100.0 a | 0.0 b | 0.5 a | |
| - | 1 | 100.0 a | 0.0 b | 0.3 c |
| 3 | 100.0 a | 0.0 b | 0.3 c | |
| 5 | 100.0 a | 0.0 b | 0.4 b |
대부분 유럽종 포도 품종은 과피와 종자에서 높은 탄닌 농도를 가지며, 이는 떫은 맛을 더 많이 유발하는 주요 원인이 된다(Chira et al., 2009). ‘Stella’도 유럽종에 가까운 품종이고, 연차에 따라 종자에서 떫은맛이 나타나는 특징이 있어 생장조절제를 통한 무핵화 처리가 필수적이라고 판단되었으며, 생장조절제 처리로 과피의 두께, 탄닌 함량의 변화가 나타났는지 조사하였다. TDZ 농도가 증가할수록 과피 두께도 증가하였으며, 특히 SM을 병행한 처리구에서 그 경향이 더 뚜렷하게 나타났다(ㅍTable 2). 최근 토마토 과피에서 세포 분열과 과일 크기에 대한 cytokinin의 역할 연구가 진행된 바 있으며, cytokinin의 활성이 감소했을 경우 과피 두께와 과일의 크기가 줄어든다는 보고가 있었는데(Gen et al., 2022), 본 연구의 cytokinin 처리 결과도 농도가 낮을수록 과피의 두께가 얇고 과일의 크기도 작아진 경향을 보였다. 또한 GA 신호 경로에서 SIPRE2 유전자가 과피 두께를 조절하는 것으로 나타나 SIPRE2 유전자가 억제될 경우 세포 확장이 줄어들어 과피 두께가 감소한다는 연구도 보고된 바 있는데(Zhu et al., 2019), 본 실험에서 대조구 종자에서 생성되는 GA 함량보다 생장조절제 처리된 처리구의 GA 함량이 상대적으로 낮았을 가능성도 있을 것으로 판단되었다. TDZ 농도가 증가할수록 과피 두께와 마찬가지로 총 페놀 함량과 고분자 탄닌 함량도 다소 증가하는 경향을 보였다(Fig. 2, Fig. 3). 그러나 총 페놀 함량의 경우 SM을 처리하지 않은 TDZ 5 ㎎/L 처리구는 대조구와 비슷한 수준을 보였고, 다른 처리구에서는 대조구보다 모두 낮은 값으로 조사되었다(Fig. 2). 고분자 탄닌 함량의 경우는 SM을 병행 처리한 경우 TDZ 농도가 3, 5 ㎎/L일 경우 대조구보다 높게 나타났으나 SM을 처리하지 않는 처리구에서는 모두 대조구보다 낮게 나타났다(Fig. 3). 토마토의 연구에서 GA가 cytokinin의 신호를 억제하며 두 호르몬이 식물 성장과 대사에서 상호 억제적인 영향을 미친다고 하였으며(Fleishon et al., 2011), 이러한 상호작용은 탄닌과 같은 2차 대사산물의 축적에도 영향을 줄 수 있다고 하였다. 또한 ‘Einset Seedless’ 포도에 GA 처리를 한 결과, 단일 처리에서는 고분자 탄닌 함량이 유의미하게 증가하였으나 처리가 반복되면 감소하는 경향을 보였다는 연구 결과도 있었는데(Kaplan et al., 2021) 본 연구에서는 SM 처리와 TDZ 농도가 고분자 탄닌 형성에 더 영향을 미친 것으로 판단되었다.
본 연구에서는 생장조절제 처리가 ‘Stella’의 무핵화 100% 달성에 효과적임을 확인하였으며, TDZ 농도가 증가함에 따라 과피 두께와 고분자 탄닌 함량이 증가하는 경향을 보였다. 그러나 과립 비대 효과는 제한적이었고, 과실의 당도와 산도에는 큰 영향을 미치지 않았다. 이러한 결과는 생장조절제를 통해 ‘Stella’ 품종의 무핵화를 달성할 수 있으나 과립 크기 및 기타 품질 요소의 개선을 위해서는 추가적인 연구와 최적화가 필요함을 시사한다.
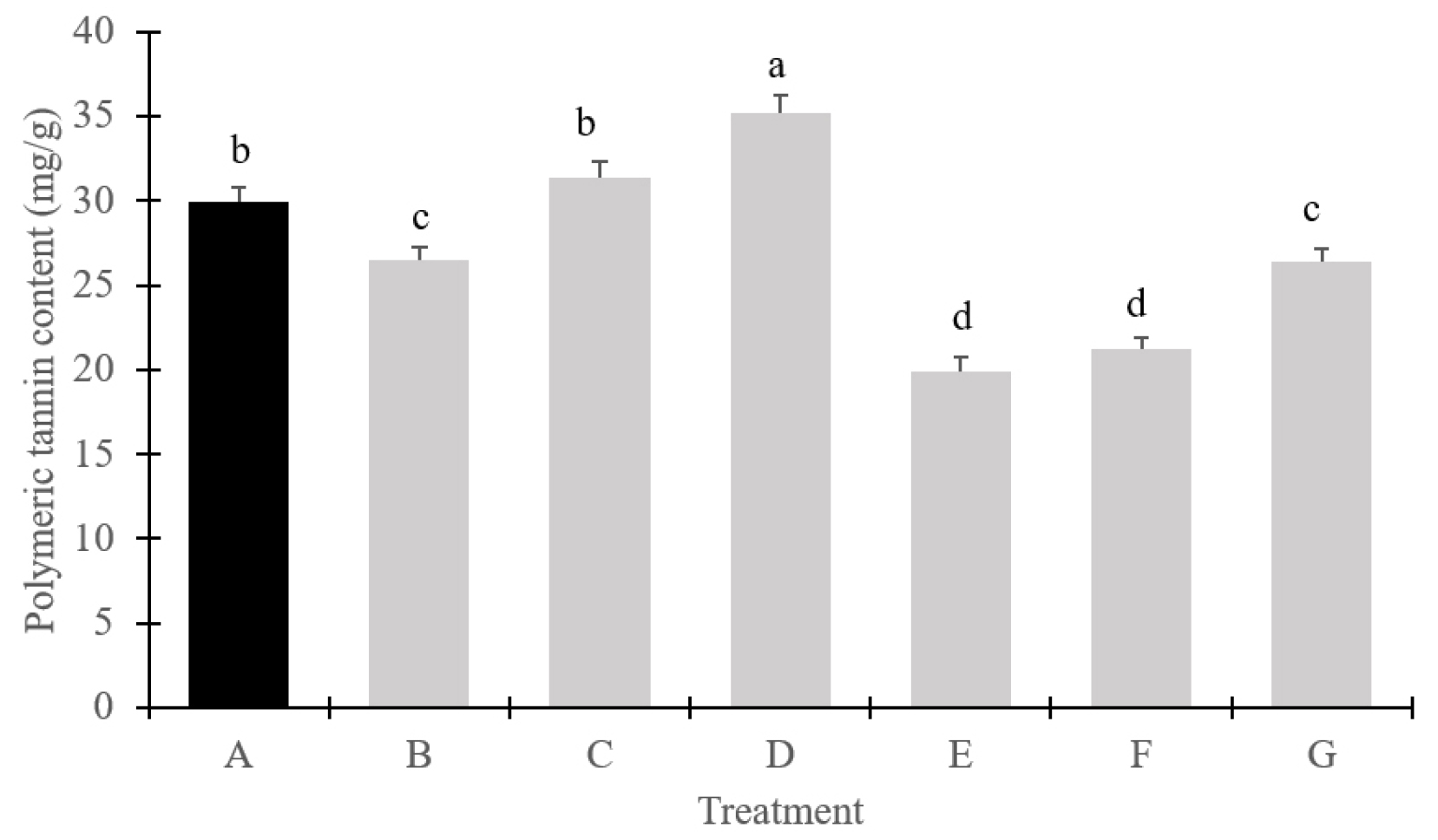
Fig. 3.
Polymeric tannin content of ‘Stella’ grape cultivars by different growth regulator treatments. (A, control; B, streptomycin 200 ㎎/L + 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 1 ㎎/L; C, streptomycin 200 ㎎/L + 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 3 ㎎/L; D, streptomycin 200 ㎎/L + 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 5 ㎎/L; E, 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 1 ㎎/L; F, 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 3 ㎎/L; G, 1st GA 25 ㎎/L + FCF 2 ㎎/L / 2nd GA 25 ㎎/L + TDZ 5 ㎎/L).
적 요
본 연구는 ‘Stella’ 포도의 무핵화 및 과실 품질에 대한 생장조절제의 효과를 조사하였다. 생장조절제 처리는 스트렙토마이신(SM) 200 ㎎/L와 지베렐린(GA) 25 ㎎/L에 다양한 농도(1, 3, 5 ㎎/L)의 티디아주론(TDZ)을 혼합하여 적용하였다. 모든 처리구에서 과방 무게가 300-400 g 범위였으며, 대조구와 TDZ 5 ㎎/L 처리구가 유사하였고, 다른 처리구에서는 더 작은 과방 무게를 보였다. 대부분의 생장조절제 처리구에서는 과립 중량이 유의미하게 증가하지 않았으나, TDZ 5 ㎎/L 처리구에서는 예외적으로 증가하였다. 과실의 길이/너비 비율은 생장조절제 처리구에서 낮아져 과실의 럭비공 형태가 변형되었다. 모든 처리구의 가용성 고형물 함량은 20% 이상이었고, 산도와 색도에서 유의미한 차이는 없었다. 특히, 모든 생장조절제 처리구는 대조구의 72% 무핵률에 비해 100% 무핵화를 달성하였다. 과피 두께와 고분자 탄닌 함량은 TDZ 농도가 증가함에 따라 증가하는 경향을 보였으며, 특히 SM 처리군에서 그 경향이 두드러졌다. 이러한 결과는 생장조절제 처리가 스텔라 포도의 무핵화에 효과적임을 보여주지만, 과립 크기와 다른 품질 특성에 미치는 영향은 다양하여 생장조절제 적용의 추가 최적화가 필요함을 시사한다.




