서 언
규칙적이고 적절한 운동은 고혈압, 뇌졸중, 심혈관질환, 당뇨, 고지혈증, 암 등의 예방 및 완화에 도움을 준다고 알려져 있으나(James et al., 2015; Muhammad et al., 2019) 과도한 운동을 하게 되면 과량의 활성산소가 생성되고 근육조직 등에 활성산소로 인한 산화적 손상이 일어나게 된다(Alessandro et al., 2015; Hyun, 2009). 인체는 이러한 산화적 손상에 대응하기 위하여 항산화 효소를 생산하여 몸을 보호하나 개인의 건강상태, 연령 등에 따라 방어능력에 큰 차이가 있다. 따라서 과도한 운동으로 인한 손상을 방어할 수 있는 소재에 대한 필요성이 대두되고 있다(Eo et al., 2020; Urso and Clarkson, 2003).
생강(Zingiber officinale Roscoe)은 생강과에 속하는 여러해살이풀로서 전 세계적으로 재배되고 있으며, 전북, 경북, 충남 지역이 국내 주산지이다(Kim et al., 1996). 생강의 뿌리는 특유의 맛과 향으로 다양한 음식에 향신료로 폭넓게 사용되고 있으며 디저트나 차로 활용되기도 한다(Sheo, 1999; Sung et al., 2003). 한방에서는 기침, 오한, 구토 등과 소화촉진, 복통설사에 약재로 사용하고 있으며(Kim et al., 2010), 생강의 생리활성에 대한 연구로는 항염증(Ryu, 2007), 항균(Son, 2010), 항산화(Ali et al., 2008; Lee et al., 2011), 항암(Rosalia et al., 2018), 항비만(Jing et al., 2017) 등이 보고 된 바 있다. 또한, 최근에는 생강을 가공하여 생리활성을 증진시키는 연구가 진행되어 발효숙성생강의 항산화 및 항균활성 증진(Seo, 2017), 숙성 흑생강의 항산화 활성(Kim et al., 2018) 등이 보고되었다.
본 연구에서는 전처리방법 별로 동결건조, 열풍건조, 숙성된 생강 추출물이 근육세포에서 산화적 손상에 대한 방어효과를 나타내는지를 L6 근육세포(L6 rat skeletal myoblast cell line)에 과산화수소와 함께 각각의 생강추출물을 처리 후 세포생존율에 미치는 영향을 측정하여 확인하였다. 또한 가장 우수한 근육세포보호효과를 보인 숙성생강 추출물을 마우스에 2주간 경구 투여하고 treadmill에서의 달리기 운동 지속시간 및 혈액지표에 미치는 영향을 측정하여 과도한 운동 스트레스에 대한 방어효과를 나타내는지 여부를 확인하고자 하였다.
재료 및 방법
실험 재료
본 실험의 재료로 사용된 생강은 전북 봉동지역에서 생산된 생강을 사용하였고 이전에 보고된 방법(Lee et al., 2012)에 따라 동결건조생강(FG), 열풍건조 생강(HG), 숙성생강(AG) 시료를 제조하였으며, 제조방법은 다음과 같다. 동결건조생강(FG)은 생강을 -44℃에서 급속동결하고 동결건조기(Ilshin Biobase, Korea)를 사용하여 5 mTorr의 감압조건에서 동결건조 하였다. 열풍건조생강(HG)은 생강을 열풍건조기(한국종합기계제작소, Korea)를 사용하여 50℃에서 7일간 건조하여 사용하였다. 숙성생강(AG)은 항온항습기(Asung Tech, Korea) 를 사용하여 80℃, 습도 85% 조건에서 10일간 숙성시킨후 열풍건조 하였다. 제조된 모든 생강시료는 증류수를 사용하여 상온에서 추출하고 감압농축한 후 –60℃에 보관하면서 실험시료로 사용하였다.
세포배양
Rat의 근육에서 유래된 L6 cell line은 한국세포주은행에서 분양받아 사용하였으며 37℃, 5% CO2 조건에서 10% Fetal bovine serum (FBS, Gibco, USA), 1% Antibiotic Antibiotics (AA, Gibco, USA)를 포함한 Dubecco’s modified Eagle’s Medium (DMEM, Gibco, USA)을 사용하여 배양하였다. 배양된 세포를 2% horse serum (Gibco, USA)과 1% AA를 포함한 DMEM을 사용하여 myotube로 분화시킨 후 실험을 수행하였다.
근육세포 보호효과 측정
세포생존율 측정은 MTT (3-(4,5-dimethylthiazol-2-yl) -2,5-diphenyltetrazolium bromide) assay 방법을 사용하였다(Vistica et al., 1991). 근육세포에 대한 생강시료의 보호효과를 알아보기 위하여 L6 세포를 1 × 105 cells/mL로 96-well plate에 분주하고 배양 후 분화시키고 각각의 농도의 생강시료 추출물과 1.5 mM H2O2 (hydrogen peroxide)를 동시에 처리하였다. 다시 24시간 동안 배양시킨 후 MTT (0.5 ㎎/mL in PBS (phosphate-buffered saline)) 용액으로 염색하여 540 ㎚에서의 흡광도를 측정하였다. 생강시료 추출물의 L6 세포 보호효과는 아래의 식과 같이 H2O2 처리시의 세포사멸율에 대한 생강시료 추출물 처리시의 회복율을 산출하여 백분율(%)로 나타내었다.
실험동물
동물실험은 한국식품연구원 동물실험윤리위원회로부터 승인(KFRI-M-11019) 받아 수행하였다. 체중 350 g 내외의 ICR 마우스 수컷을 중앙실험동물로부터 분양받아 1주간 적응시킨 후 실험에 사용하였다. 사육조건은 온도 23℃, 습도 50%였고, 실험기간 중 음수 및 사료는 자유로이 섭취시켰다.
운동시험
Treadmill을 이용하여 유산소성 운동부하 실험을 실시하였다. 운동시험에 적응을 위한 예비운동 실험으로 1일차 5 m/분의 속도로 5분간, 2일차 10 m/분 속도로 10분간, 3일차 15 m/분 속도로 15분간, 4 ~ 5일차 20 m/분 속도로 20분간 운동을 시키면서 운동능력이 현저히 떨어지는 개체는 탈락시켰다. 예비운동을 거쳐 선정된 동물을 운동미실시군(NE), 운동군(E), 운동+저농도와 고농도의 동결건조생강 추출물 섭취군(E+FG), 운동+ 저농도와 고농도의 숙성생강 추출물 섭취군(E+AG) 6 그룹으로 나누어 진행하였으며, 각 군당 6 마리로 구성하였다. 2주간 1일 1회 증류수에 녹인 각각의 생강시료를 저농도(50 ㎎/㎏), 고농도(200 ㎎/㎏) 농도로 경구 투여하고 2시간 뒤 20 m/분의 속도로 20분간 운동을 시켰다. 마지막 날 운동 직후 희생시켜 안와채혈 하고 2000 g로 10분간 원심분리 하여 혈장을 분리한 후 -70℃에 보관하면서 분석에 사용하였다. 혈장 시료내 lactate dehydrogenase (LDH), lactate, creatinine, glutamic oxaloacetic transaminase (GOT), glutamic pyruvate transaminase (GPT) 함량은 혈액분석기(HITACHI, 7020, Japan)를 이용하여 colorimetry 방법으로 분석하였다.
통계분석
통계분석은 GraphPad prism 프로그램(CA, USA)을 사용하였다. 결과는 평균±표준편차로 나타내었으며 군간의 통계적 유의성 검정은 one-way ANOVA를 이용하여 p < 0.05일 때 유의한 것으로 판단하였다.
결과 및 고찰
근육세포 보호효과
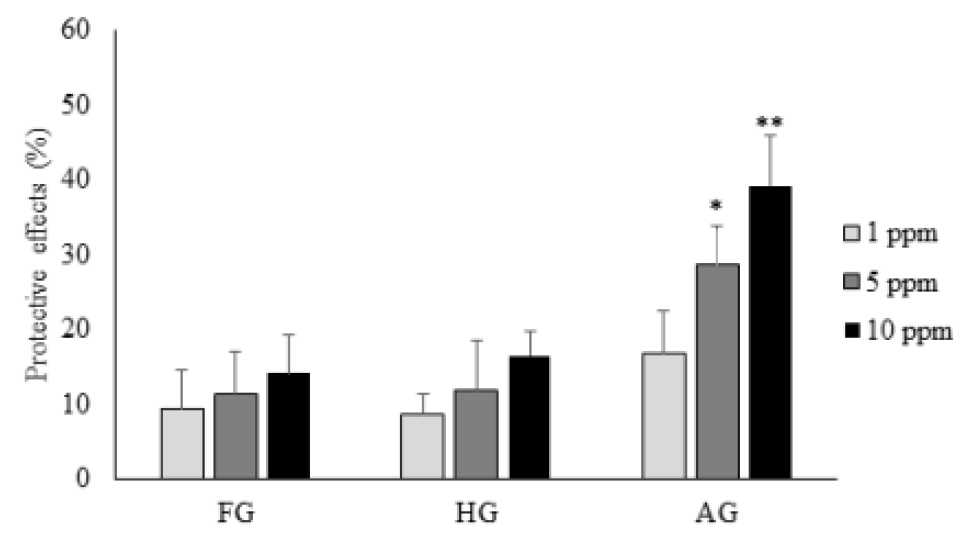
생강시료가 산화적 스트레스로부터 근육세포 보호효과를 나타내는지를 확인하기 위하여 L6 세포를 사용하여 H2O2로 유발된 산화적 손상에 대한 사포사멸방어효과를 측정하였고 그 결과는 Fig. 1에 나타내었다. L6 세포에 1.5 mM의 H2O2를 처리한 결과 45.5%의 세포가 사멸되었고 숙성생강시료 10 ppm을 함께 처리시 H2O2로 인한 세포사멸이 39.2% 감소되었다. 한편 동결건조생강은 동일농도에서 14.2%의 세포사멸 억제효과를 나타내어 숙성생강의 근육세포보호효과가 더 높았으며 열풍건조생강 생강은 10 ppm에서 16.5%의 세포사멸 억제효과를 나타내어 열처리의 온도 및 시간에 따라 근육세포보호효과가 증가하는 경향을 나타내었다.
Kim et al. (2018)은 생강을 숙성시켜 열풍건조 및 동결건조하고 각각을 80% 메탄올로 추출하여 실험한 결과 열풍건조생강 시료가 동결건조 시료보다 높은 ABTS (2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)) 라디칼 소거 활성 및 환원력을 나타내었다고 보고한 바 있어 열처리에 따라 항산화 관련 활성이 증가하는 경향이 본 연구의 결과와 일치하였다. 또한 Lee et al. (2020)은 생강을 숙성시키면 항산화 활성성분인 총페놀, 플라보노이드 및 6-shogaol 함량이 증가된다고 보고한 바 있어 이들 성분이 숙성생강의 항산화 활성에 기여하는 것으로 판단된다.
마우스의 운동능력 및 혈액지표에 미치는 영향
열처리를 하지 않은 비교군인 동결건조생강 추출물과 세포실험에서 가장 우수한 활성을 나타낸 숙성생강 추출물 투여 2주 후의 treadmill 주행시간 (treadmill에서 3초 이상 이탈하는데 까지 걸리는 시간)은 Table 1에 나타내었다. 숙성생강추출물 200 ㎎/㎏ 섭취군(E+AG)은 증류수를 투여한 군(E)이나 동결건조생강추출물 섭취군(E+FG)에 비하여 통계적으로 유의하지는 않았으나 treadmill 평균주행시간이 22 ~ 25초 증가하였다. 이때 체중의 증가량은 운동군(E)이 운동미실시군(NE)보다 낮았고 동결건조생강추출물 섭취군(E+FG)과 숙성생강추출물 섭취군(E+AG)은 운동군 보다는 소폭 증가하였으나 유의적인 차이는 없었다.
Table 1.
Effects of ginger extracts on body weight and running time in mice. NE: non exercise group, E: exercise group, E+FG: exercise+frozen dried ginger feeding group, E+AG: exercise+aged ginger feeding group (n=6)
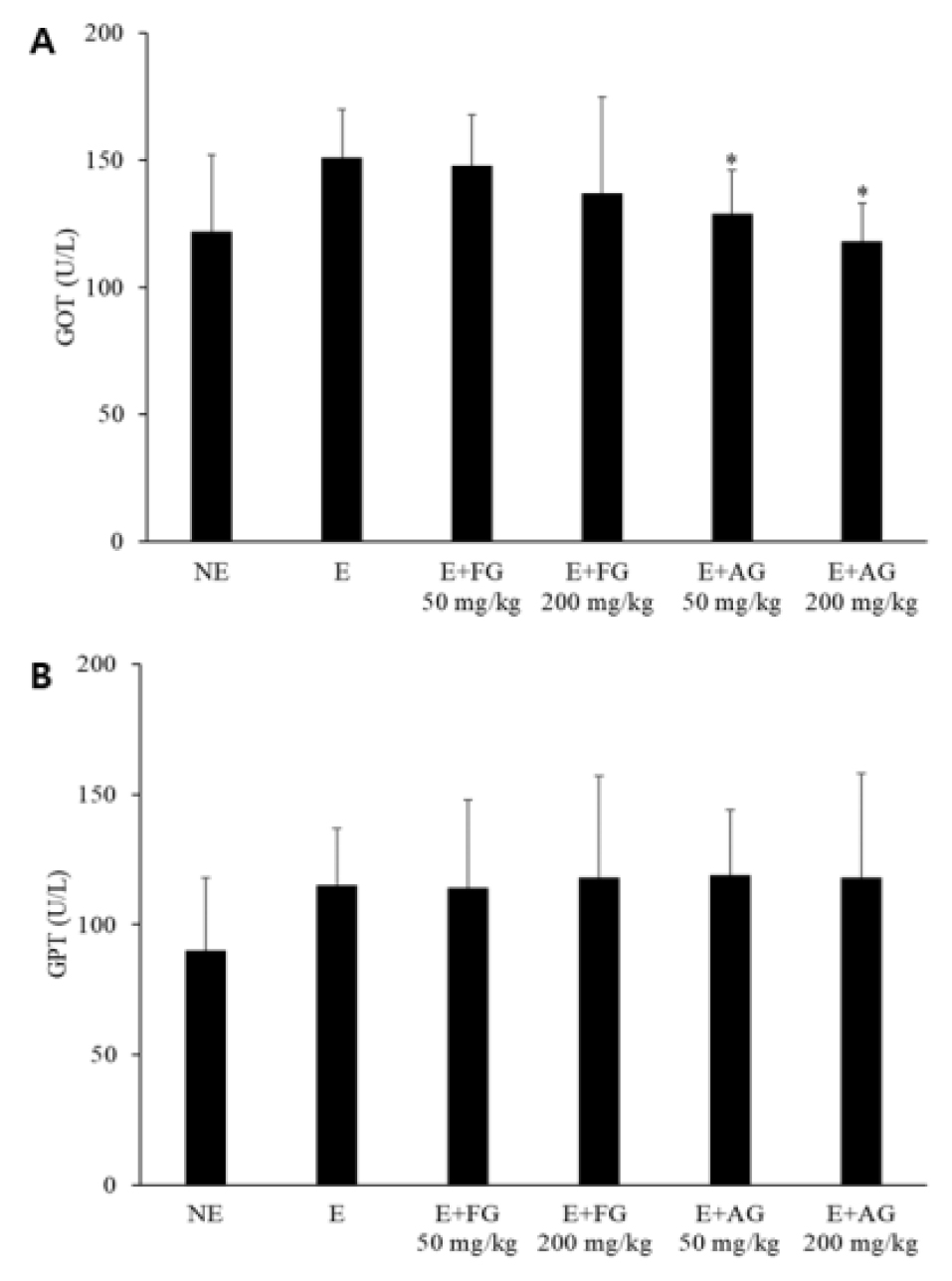
과도한 운동은 근육과 혈중 젖산 농도를 증가시키며, 이는 젖산탈수소효소(LDH)에 의해 조절된다(Berthoin et al., 2003; Brown et al., 1997). 또한 creatinine은 근육에서 생성되는 노폐물의 일종으로 이 또한 과도한 운동에 의해 증가한다. 본 실험에서의 운동 후 혈액 분석결과 역시, 운동군은 운동미실시군에 비하여 LDH, creatinine, lactate 농도가 모두 증가하였고 숙성생강은 운동으로 인해 증가된 LDH와 lactate를 유의적으로 감소시켰고 creatinine은 유의하지는 않았으나 약 0.3 ㎎/dL 감소시켰다(Fig. 2). 한편 동결건조생강은 LDH와 lactate를 소폭 감소시켰으나 감소폭이 크지 않았다. GOT는 유산소 해당과정에 관여하며 GPT는 단백질을 에너지로 전환시키는데 작용하는 전이효소이다(Ha and Rho, 2010). 본 연구결과, 운동에 의해 혈중 GOT와 GPT의 활성이 증가되었고, 숙성생강 섭취군은 혈중 GPT에는 큰 변화가 없었으나 혈중 GOT 활성이 운동군에 비하여 유의적으로 감소하였다(Fig. 3).
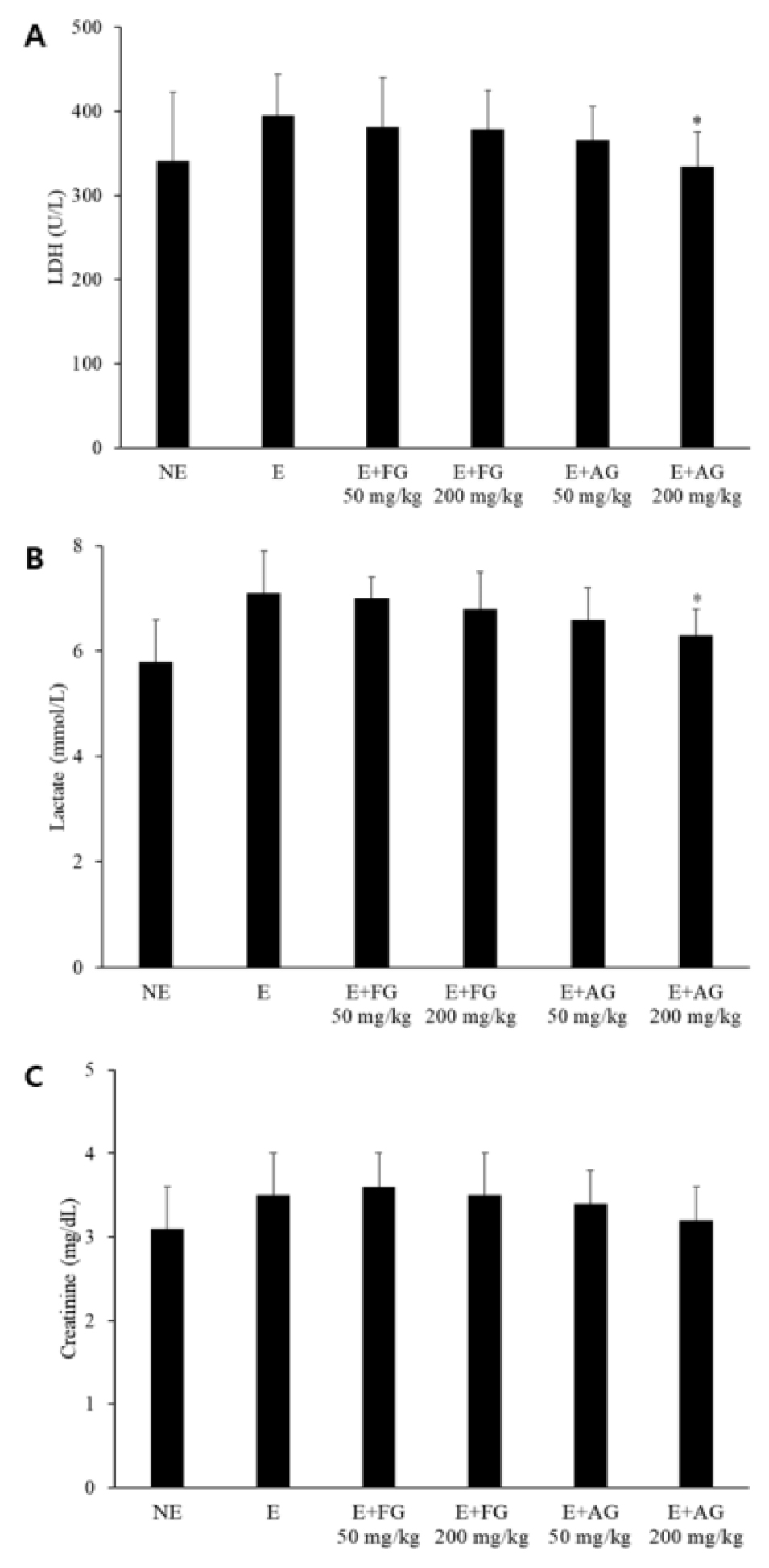
Fig. 2.
Changes of mouse blood LDH, lactate and creatinine by administration of ginger extracts. NE: non exercise group, E: exercise group, E+FG: exercise+frozen dried ginger feeding group, E+AG: exercise+aged ginger feeding group. A: effects on LDH level, B: effects on lactate level, C: effects on creatinine level. *P < 0.05 compared with exercise group.
적 요
생강의 운동 스트레스에 대한 방어효과를 알아보기 위해 동결건조, 열풍건조, 숙성한 생강을 제조하여 추출물을 근육세포에 H2O2와 함께 처리한 결과 생강을 숙성한 시료는 숙성하지 않은 시료에 비하여 우수한 근육세포 보호효과를 나타내었다. 또한 숙성생강 추출물을 마우스에 투여시 운동으로 인한 혈액내 LDH, lactate, GOT 증가를 억제시키는 경향을 나타내었다. 따라서 숙성생강을 섭취시 과도한 운동으로 인한 스트레스에 대한 방어효과를 기대할 수 있을 것으로 사료된다. 이러한 결과를 토대로, 향후 생강의 숙성 온도 및 시간에 따른 운동 스트레스 방어효과를 측정하여 가장 높은 활성을 나타내는 최적의 숙성조건을 확립하는 연구를 진행할 예정이다.