서 언
재료 및 방법
실험재료
미생물 배양과 풋귤 발효
RAW264.7 세포주 배양
RAW264.7 대식세포의 생존율 측정
NO 생성량 및 사이토카인 생성량 측정
플라보노이드 함량 분석
통계처리
결 과
풋귤 발효에 따른 세포생존율 및 NO 생성에 미치는 영향
풋귤 발효 시간 및 시료양에 따른 발효물의 면역증진 효능 비교
풋귤 발효에 따른 플라보노이드 함량 변화
고 찰
적 요
서 언
풋귤은 Citrus unshiu Marcov.의 덜 익은 과실로서 한국의 제주도 지역에서 대량 재배가 이루어지고 있다. 감귤은 비타민, 유기산, 미네랄 및 플라보노이드 성분을 포함하고 있으며(Kawaii et al., 1999; Tanizawa et al., 1992), 더욱이 미숙과인 풋귤은 완숙한 과실보다 플라보노이드 성분이 약 30%가량 더 풍부하게 포함되어 있다(Kang et al., 2005). 풋귤에 포함되어 있는 주요 플라보노이드류는 narirutin, hesperidin으로 대부분 당과 결합된 배당체(glycoside) 형태로 존재하며, 이들의 aglycone 형태인 naringenin, hesperetin과 그 외 rutin 및 polymethoxyflavonoid인 nobiletin과 tangeretin 등이 있다(Kim et al., 2022; Kim and Lim, 2020). 이들의 기능성에 대해 항산화 작용(Chen et al., 1990; Miller et al., 1997; Yuting et al., 1990), 순환기계 질환의 예방(Mastantuono et al., 2015), 항염증(Choi et al., 2007), 항알러지(Niu et al., 2020), 항균(Yi et al., 2008), 항바이러스(Jia et al., 2018) 효과 등이 보고되었다. 특히aglycone 형태인 naringenin및 hesperetin은 콜레스테롤 농도와 중성지질 농도 저하작용, 간질환 개선 등의 효과가 배당체에 비해 우수하다고 보고되었다(Cha et al., 2000; Kim et al., 1999; Li et al., 2022). 이는 당이 결합된 형태의 플라보노이드가 당이 유리되어 분해되었을 때 분자량이 낮아져 체내 흡수가 원활하여 생리활성 작용이 상승하는 것으로 보고된 바 있다. 이전 연구에서는 기존 물질을 분해하거나 새로운 형태로 전환하여 기능성을 향상시킬 수 있는 방법으로 미생물을 활용한 발효과정을 제시하여 배당체 형태의 플라보노이드가 비배당체 형태로 전환되거나 미생물의 2차 대사과정을 통해 새로운 물질로 전환시켰다(Xu et al., 2023). 대표적으로 유산균을 이용하여 발효한 꾸지뽕 열매 추출물이 발효 전과 비교하여 총 폴리페놀 함량이 32% 증가하고 면역증진과 연관된 사이토카인들이 활성화되었다(Seo et al., 2013). 또한 새싹보리 및 식물 혼합추출물에 대해 유산균을 이용하여 발효한 결과 RAW264.7세포에서 TNF-a와 IL-1b, IL-6 생성이 현저히 증가하였다(Kim et al., 2023). 이와 같이 유용 미생물을 이용하여 천연물을 발효한 경우 미생물의 대사과정을 통하여 생성된 2차 대사산물과 미생물 유래 물질이 면역증진 효과를 나타내는 것을 알 수 있다.
면역은 외부의 병원균, 바이러스 등의 침입으로부터 인체를 보호하기 위한 주요 방어기전으로 병원성 미생물의 생체 내 침입을 통제하거나 제거하도록 단핵구, 호중구, 호염구, 호산구 등 백혈구, 대식세포 및 자연살해세포 등이 상호작용하여 그 체계를 유지한다(Cruvinel et al., 2010). 체내에 넓게 분포된 대식세포는 바이러스 등 외부 침입 물질을 포식하고 면역 조절인자인 nitric oxide (NO)와 interleukin-6 (IL-6), tumor necrosis factor-a (TNF-a)와 같은 염증성 사이토카인을 생산하여 인체 면역 체계에 중요한 역할을 한다(Higuchi et al., 1990).
따라서 본 연구에서는 풋귤에 포함된 플라보노이드류가 미생물 발효에 의해 변화되는 성분을 확인하고, 면역 기능성이 향상되는 효과를 확인하여 식품 원료로 적용할 수 있도록 최적 공정을 개발하여 풋귤의 기능성 소재로서의 가능성을 검토하였다.
재료 및 방법
실험재료
본 연구에 사용한 풋귤은 제주도 서귀포시에서 재배된 귤을 수확하여 사용하였다. 제주특별자치도 조례에 따라 2023년 8월 15일부터 9월 15일 사이에 수확하고 세척한 후 습식 분쇄하여 동결건조한 후 얻어진 동결건조 파우더를 90°C에서 15분 살균한 뒤 실온에서 냉각하여 발효에 사용하였다.
미생물 배양과 풋귤 발효
본 발효 실험에 사용된 두 미생물 균주는 Bacillus subtilis B21043 (BS)과 Lactobacillus sakei B21065 (LS)로 제주 전통식품 전복젓갈로부터 분리되었다. 전복젓갈 시료 50 g을 수집한 후, phosphate buffer saline (PBS, pH 7.0) 450 mL을 가하여 약 1시간 균질화하였다. 균질화 된 시료는 연속 십진 희석하여 각 농도에서 100 mL씩 3반복으로 Lactobacilli MRS agar (Difco) 평판배지에 도말 한 후, 30℃에서 48시간 동안 배양하였다. 단일 colony로 확인될 때까지 최소 3번의 계대배양하였다. 단일 colony로 보이는 균주는 유전자 염기서열 분석을 위해 total gDNA를 추출 정제한 후 27F와 1492R primer를 사용하여 DNA 증폭 후 분석하였고, 염기서열 결과는 NCBI Blast를 통해 동정 확인하였다. DNA 추출 이후 Blast까지의 전반 과정은 Solgent (Korea)사의 가이드라인에 따라 분석이 진행되었다. 풋귤 발효를 위해 MRS agar 평판배지의 순수 단일 colony를 MRS broth 배지에 접종하여 37℃에서 OD600 ㎚= 1.0 – 1.2 농도가 될 때까지 24시간-48시간 전배양하였다. 살균한 풋귤 시료에 전배양한 균주를 각각 10% 접종하여 37°C, 200 rpm으로 발효기에서 발효하였다. 최적의 발효 조건을 탐색하고자 미생물 종류, 발효시간, pH, 풋귤 건조물(unripe Citrus unshiu Marcov. powder, UCP) 비율 등을 달리하여 발효기(FSBC-LF01, Centrion, Incheon, Republic of Korea)에서 발효하였으며, 발효조건은 Table 1과 같다. pH가 7.0으로 보정된 시험군은 1 M NaOH 용액을 사용하여 발효기에서 자동 보정하였다. 발효가 완료된 풋귤 발효액은 여과지(NO.2; advantec, Tokyo, Japan)로 여과하여 여과액을 동결건조한 뒤 세포실험 및 성분 분석에 사용하였다.
Table 1.
Fermentation conditions of unripe Citrus unshiu Marcov. Powder.
| Samples | Ingredients | pH |
Time (h.) |
Air flow (L/min) | rpm | |||
| UCPz(g) |
MRS broth (mL) |
BSy (mL, OD600nm=1) |
LSx (mL, OD600nm=1) | |||||
| 1-1 | 18 | 450 | 50 | 5.4±0.5 | 12 | 0.1 | 200 | |
| 1-2 | 18 | 450 | 50 | 5.1±0.5 | 12 | |||
| 1-3 | 18 | 450 | 25 | 25 | 4.7±0.5 | 12 | ||
| 1-4 | 18 | 500 | 4.9±0.5 | 12 | ||||
| 1-5 | 500 | 7.0±0.5 | 12 | |||||
| 2-1 | 18 | 630 | 35 | 35 | 7.0±0.5 | 24 | ||
| 2-2 | 18 | 630 | 35 | 35 | 7.0±0.5 | 48 | ||
| 2-3 | 18 | 630 | 35 | 35 | 7.0±0.5 | 72 | ||
| 3-1 | 10 | 630 | 35 | 35 | 7.0±0.5 | 48 | ||
| 3-2 | 20 | 630 | 35 | 35 | 7.0±0.5 | 48 | ||
| 3-3 | 30 | 630 | 35 | 35 | 7.0±0.5 | 48 | ||
RAW264.7 세포주 배양
마우스 대식세포주인 RAW264.7 세포는 ATCC에서 분양 받아 사용하였다. RAW264.7 세포는 10% 비활성화 우태아 혈청(fetal bovine serum, FBS; Welgene, Daegu, Republic of Korea) 용액 및 1% penicillin과 streptomycin (PEST; WelGene Co. Welgene) 용액을 함유한 Dulbecco’s modified Eagle’s medium (WelGene Co. Welgene) 배지를 이용하여 37°C, 5% CO2가 공급되는 배양기(Thermo Fisher Scientific Thermo Fisher Scientific, Waltham, MA, USA)에서 배양하였다.
RAW264.7 대식세포의 생존율 측정
마우스 대식세포주인 RAW 264.7 세포에서 풋귤 발효물의 세포독성 평가를 위하여 WST-1 assay를 실시하였다. RAW264.7 세포를 96-well plate에 1.5 × 105 cells/well이 되도록 동일하게 분주하고 18시간 동안 배양하였다. 기존의 배지를 제거하고, 각 시료(12.5~1,000 ㎍/mL)가 포함된 새로운 배지로 교체 후 다시 24시간 동안 배양하였다. 배양이 끝난 후, 배지에 WST solution (2-(4-Iodophenyl)-3-(4-nitrophenyl)-5-(2,4-disulfophenyl)-2Htetrazolium)을 10 μL씩 넣고 2시간 동안 배양하였다. 각 well의 흡광도는 VerasaMax ELISA microplate reader (Molecular Devices Inc., Sunnyvale, CA, USA)를 이용하여 450 ㎚에서 측정하였다.
NO 생성량 및 사이토카인 생성량 측정
RAW264.7 세포를 96-well plate에 1.5 × 105 cells/well이 되도록 동일하게 분주하고 18시간 동안 배양하였다. 이후, 풋귤 발효물을 다양한 농도로 24시간 처리하였다. NO 생성량은 산화된 형태인 NO2- (nitrite)의 농도를 측정하였으며, Griess reagent (1% sulfanilarnide in 5%, phosphoric acid and 1% a-naphthyamide in H2O)를 이용하여 측정하였다. 96-well plate에 배양 상층액 100 μL와 Griess reagent 100 μL를 혼합한 후 빛을 차단하여 10분간 실온에서 반응시켜 540 ㎚에서 흡광도를 측정하였다. 세포배양액 내 TNF-a, IL-6 측정은 ELISA kit (R&D Systems, St. Louis, MO, USA)를 이용하여 제조회사에서 제시한 방법에 따라 측정하였다.
플라보노이드 함량 분석
플라보노이드 10종의 함량은 Hyeon et al. (2023)의 방법에 따라 측정하였다. 각 시료 10 ㎎에 70% methanol (v/v) 4 mL를 넣고 10분간 sonication 한 후 0.5 ㎛ PTFE filter (Advantec)로 여과한 것을 시험용액으로 하여 high performance liquid chromatography (HPLC; Dionex Ultimate 3000 Ultimate-DAD system; Thermo Fisher Scientific, Waltham, MA, UAS)로 정량하였다. Mobile phase A는 0.5% acetic acid (Sigma-Aldrich Co., St. Louis, MO, USA)를, B는 acetonitrile (Honeywell, Charlotte, NC, USA)을 사용하였다. 분석용 컬럼은 Cadenza CD-C18 (4.6 × 150 ㎜, 3 ㎛; Imtakt Corp., Kyoto, Japan)을 사용하였으며, 온도는 40°C를 유지하였다. 분석조건은 0~4분, 20% B; 4~16분, 20~35% B; 16~28분, 35~75% B로 하여 4분간 유지후 7분간 초기 조건으로 회복하여 총 39분간 분석을 수행하였다. Flow rate는 0.8 mL/min으로 하였으며, injection volume은 10 μL로 하여 278 ㎚에서 검출하였다. 플라보노이드 10종의 함량은 표준품 rutin, narirutin, naringin, hesperidin, neohesperidin, quercetin, naringenin, hesperidin (HPLC grade, Sigma-Aldrich Co., St. Louis, MO, USA), heperetin, nobiletin, tangeretin (HPLC grade, ChemFaces, Wuhan, Hubei, China)을 이용하여 표준검량곡선(R2=1.00000~0.99995)에 peak의 면적을 적용하여 구하였다. 모든 분석은 3반복 수행하여 평균값을 구하였다.
통계처리
동일 실험을 3회 반복하여 실시하였으며, 실험결과는 평균±표준편차로 나타내었다. NO 측정 및 사이토카인의 생성량 측정 각 군의 통계학적 검정에는 Student's t-test를 사용하여 p값이 0.05 미만 수준에서 통계적 유의성을 검토하였다. 또한 플라보노이드 함량분석 각 군의 통계학적 검정은 GraphPad Prism 8 (GraphPad software, La Jolla, CA, USA)에서 이루어졌으며, one-way ANOVA를 사용하여 p값이 0.05 미만 수준에서 통계적 유의성을 검토하였다.
결 과
풋귤 발효에 따른 세포생존율 및 NO 생성에 미치는 영향
풋귤 발효에 따른 면역증진 효과를 확인하기 위하여 1차 발효 실험을 수행하였다. pH를 자동 보정하지 않는 조건에서 풋귤 건조물에 BS, LS 미생물을 각각 접종한 발효물(1-1, 1-2), 미생물 두 종을 혼합한 발효물(1-3), 미생물을 접종하지 않고 풋귤 건조물 단독 배양(1-4), 풋귤 건조물을 넣지 않고 미생물 배양 배지만 배양한 대조군(1-5)을 RAW264.7 대식세포에 24시간 처리한 결과 1,000 ㎍/mL 농도까지 세포 생존율에 영향을 미치지 않았다(Fig. 1). 따라서 이후 실험에서는 1차 발효물 시료 5점은 농도 1,000 ㎍/mL까지 처리하여 실험하였다.
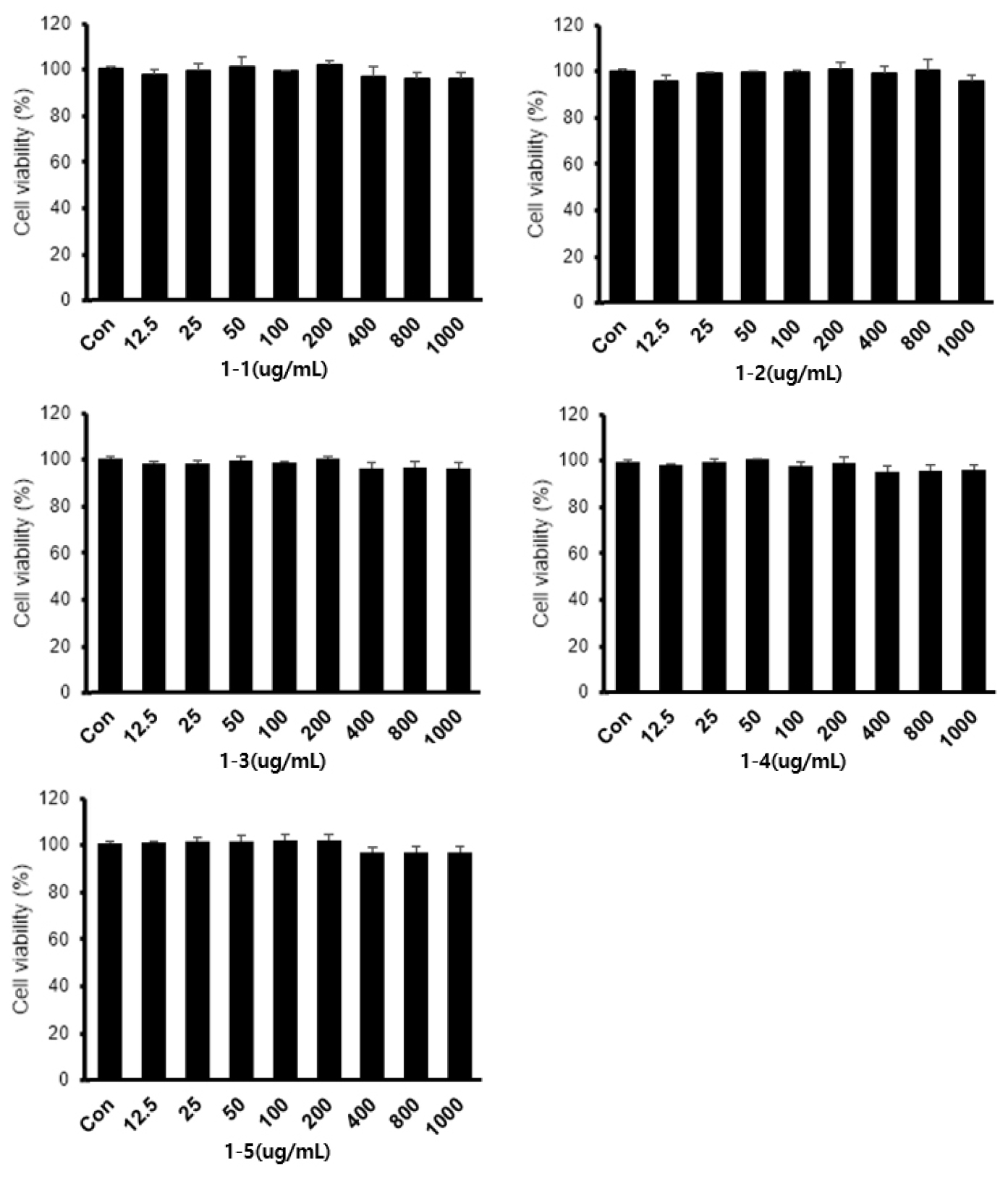
Fig. 1.
Effect of fermented UCP containing different mixtures of microorganisms on the cell viability of RAW264.7 macrophages. The samples represent the fermented products of UCP mixture shown in Table 1. The viability was measured by WST-1 assay. The values are expressed as mean±SD (n=3).
1차 발효물 5점을 농도별로 RAW264.7 대식세포에 처리하여 NO 생성량을 확인한 결과, 1-5 시료를 제외한 나머지 시험군 모두 NO 생성이 유의적으로 증가하였고, 특히 두 종의 미생물을 혼합발효한 1-3 시험군에서 NO 생성이 강력하게 유도되었다(Fig. 2). 위 결과를 바탕으로 이후 발효에서는 미생물 두 종을 혼합하여 발효 실험을 수행하였다.
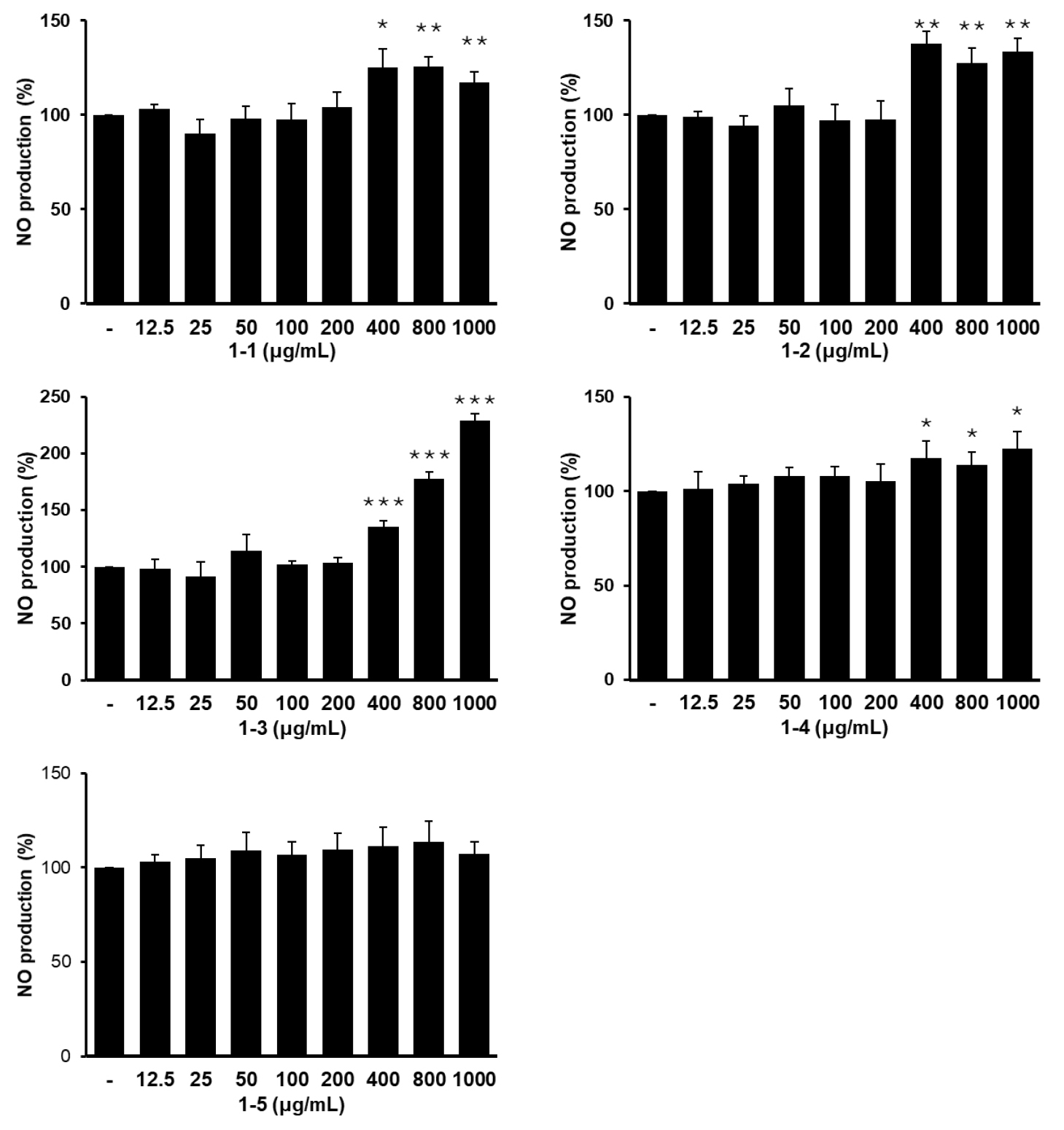
Fig. 2.
Effect of fermented UCP containing different mixtures of microorganisms on NO production in RAW264.7 macrophages. The samples represent the fermented products of UCP mixture shown in Table 1. Data was presented as mean ± SD (n=3). * means p < 0.05, ** means p < 0.01, *** means p < 0.001 vs. non-treated control.
풋귤 발효 시간 및 시료양에 따른 발효물의 면역증진 효능 비교
풋귤 발효의 최적 조건을 찾기 위해 1차 발효에서 도출한 미생물 2종 혼합 발효 조건을 기초로 하여 2차 발효는 발효시간에 따른 발효물의 면역증진 효과를 비교하였다. 발효시간을 24 (2-1), 48 (2-2), 72 (2-3)시간 3가지 조건으로 발효하여 3점의 발효물을 얻었다. 얻어진 발효물을 각각 RAW264.7 대식세포에 24시간 처리한 결과 25~800 ㎍/mL 처리 농도에서 세포 생존율에 영향을 미치지 않았다(Fig. 3A). 위 결과를 토대로 2차 발효물 3점에 대한 추가 실험은 800 ㎍/mL 농도까지 수행하였다.
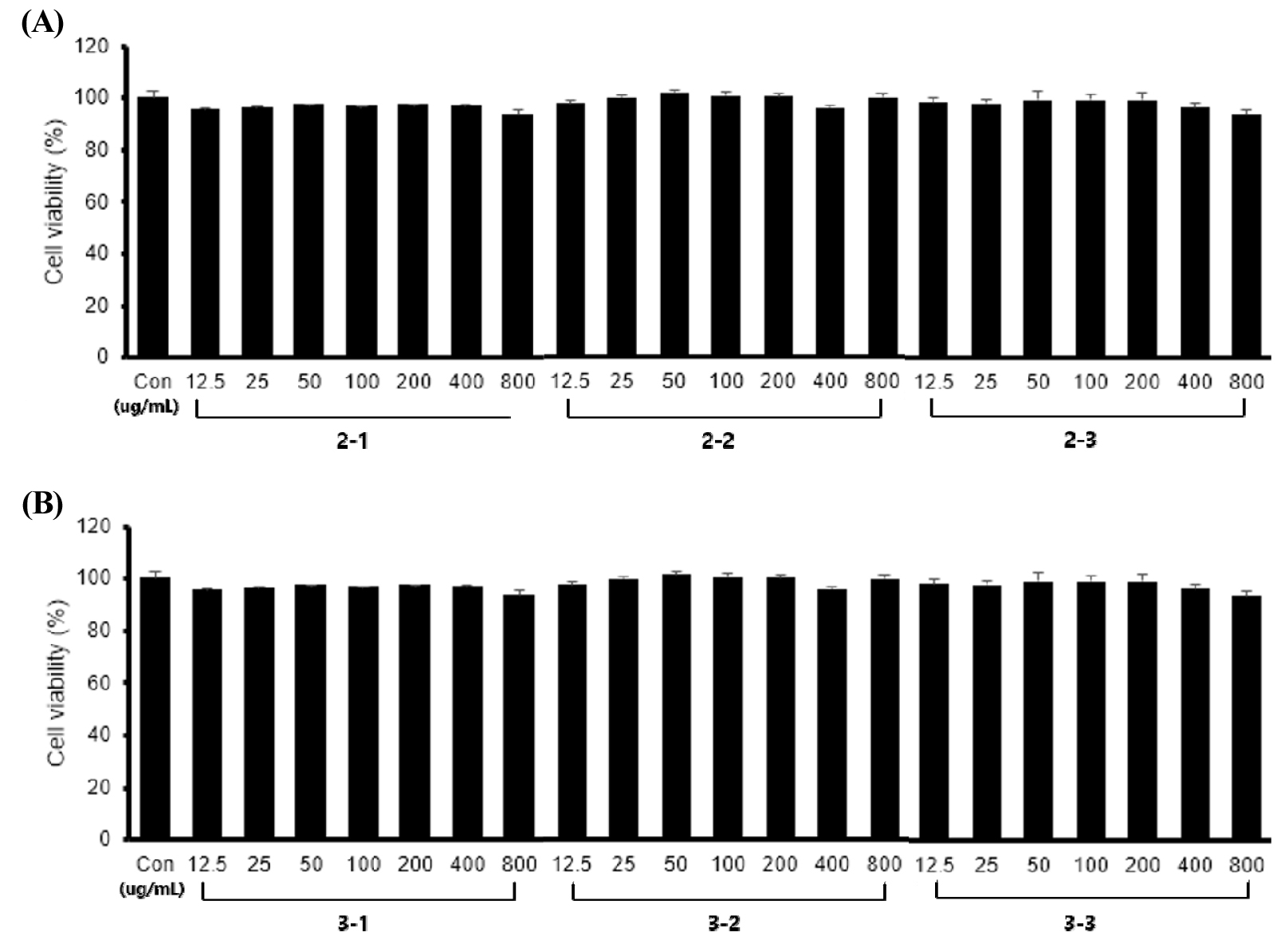
Fig. 3.
Effect of UCP fermented for various times (A) and doses (B) on the cell viability of RAW264.7 macrophages. The samples represent the fermented products of UCP mixture shown in Table 1. The viability was measured by WST-1 assay. The values are expressed as mean±SD (n=3).
RAW264.7 대식세포에 2차 발효물을 농도별로 처리하여 TNF-a 및 IL-6 생성량을 비교한 결과, 3가지 발효물 모두 대조군에 비해 TNF-a와 IL-6 함량이 증가하였으며, 특히 48시간 발효물 2-2 처리군에서 TNF-a와 IL-6 분비량이 200 ㎍/mL 농도 이상에서 유의미하게 증가하였다(Fig. 4). 따라서 이후 실험에서는 발효시간을 48시간으로 고정하여 실험을 수행하였다.
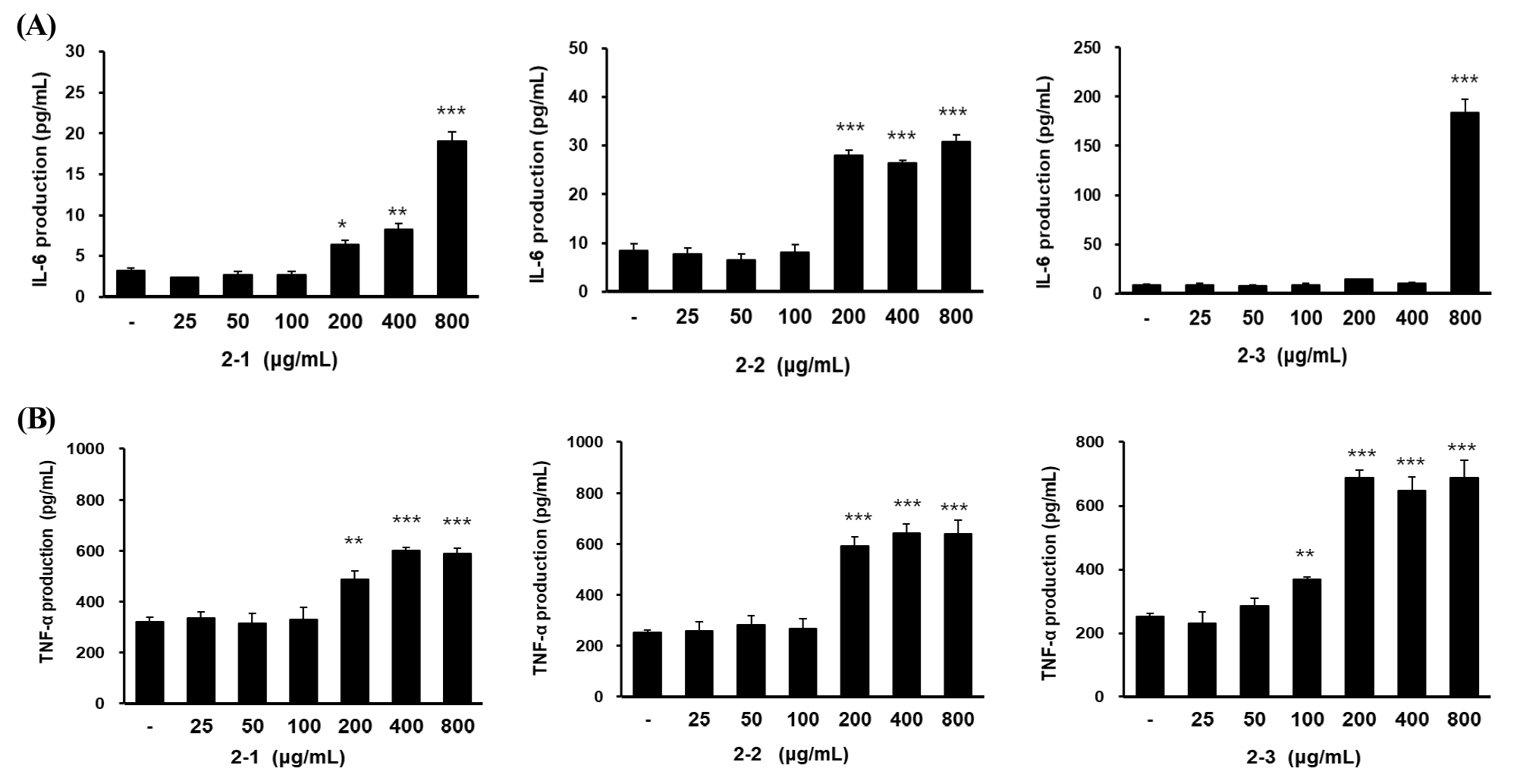
Fig. 4.
Effect of UCP fermented for various times on cytokines IL-6 (A) and TNF-a (B) production in RAW264.7 macrophages. The samples represent the fermented products of UCP mixture shown in Table 1. Data was presented as mean ± SD (n=3). * means p < 0.05, ** means p < 0.01, *** means p < 0.001 vs. non-treated control.
1,2차 발효 결과와 더불어 UCP 투입양에 따른 차이를 확인하고자 UCP 양을 각각 10 (3-1), 20 (3-2), 30 (3-3) g으로 조절하고, 3차 발효를 실시하여 발효물 3점(3-1~3)을 얻었다. 3점의 발효물을 RAW264.7 대식세포에 24시간 처리하여 세포 생존율을 확인하였고(Fig. 3B), UCP 투입양이 증가할수록 TNF-a와 IL-6 생성량이 유의적으로 증가함을 확인하였다(Fig. 5).
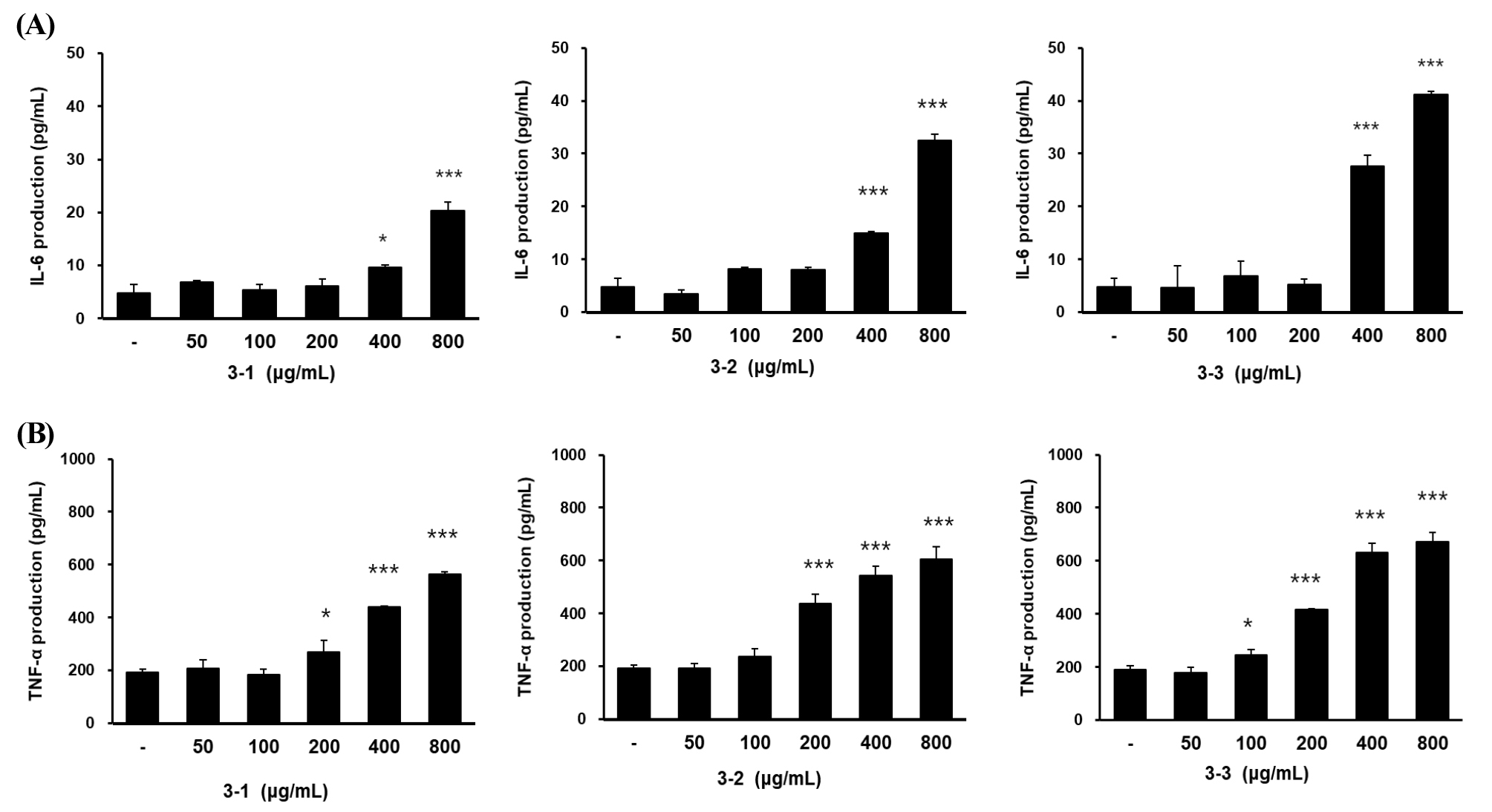
Fig. 5.
Effect of fermented products with different UCP doses on the production of cytokines IL-6 (A) and TNF-α (B) in RAW264.7 macrophages. The samples represent the fermented products of UCP mixture shown in Table 1. Data was presented as mean ± SD (n=3). * means p < 0.05, ** means p < 0.01, *** means p < 0.001 vs. non-treated control.
풋귤 발효에 따른 플라보노이드 함량 변화
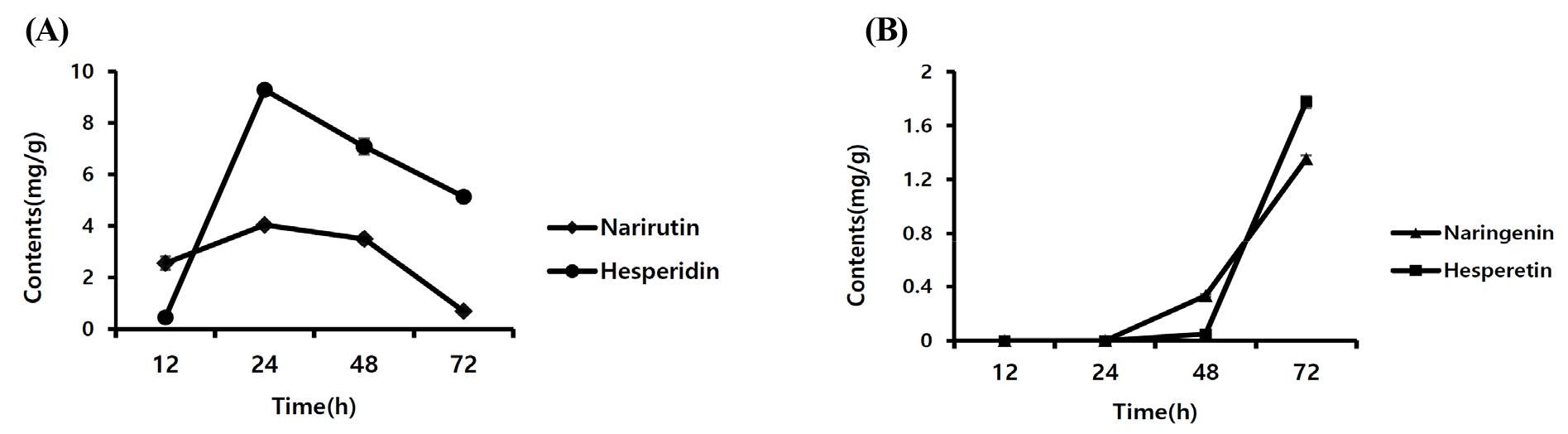
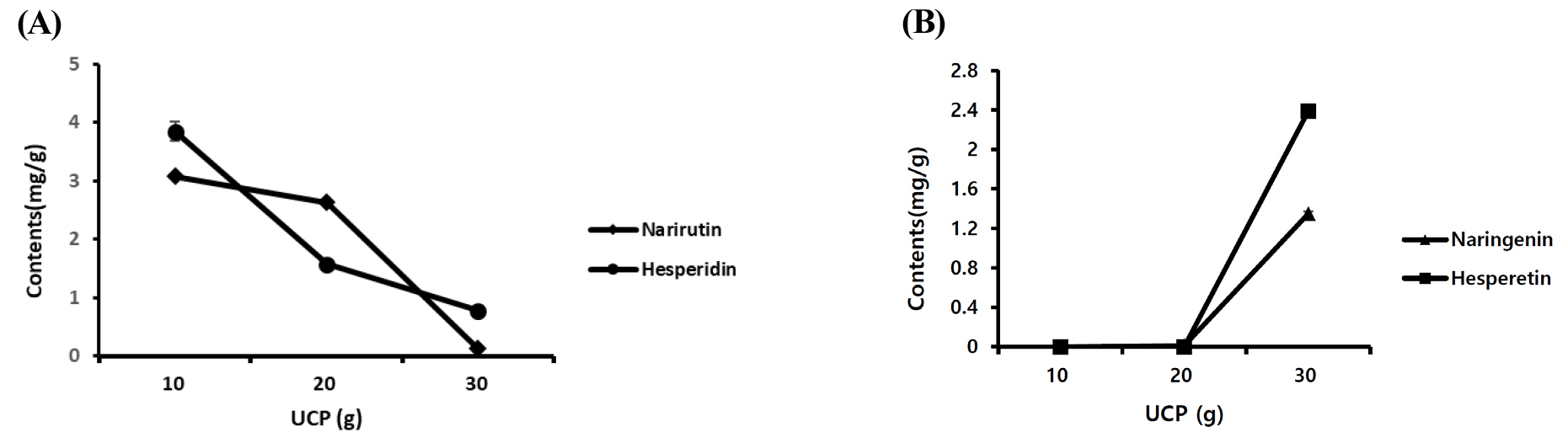
발효에 사용된 미생물의 종류, 발효 시간 및 UCP의 투입량 변화에 따라 각 발효물에 포함된 플라보노이드 10종의 함량 차이를 분석하였다(Table 2). 사용한 미생물이 다른 1차 발효물 5종에서 UCP가 미포함된 대조군을 제외한 나머지 시험군에서 rutin, narirutin, hesperidin, nobiletin 및 tangeretin 총 5종의 성분이 검출되었으며, 시료 간 각 성분들의 함량 차이는 유의적으로 나타나지 않았다. 그 중 미량성분인 nobiletin 및 tangeretin은 미생물 미처리 시험군인 1-4에서 함량이 가장 높았으며 1-1, 1-3 시료에서 유의적으로 함량이 낮았다. 또한 미생물 BS만 처리한 시험군 1-1에서 tangeretin은 불검출 되었다. 발효시간에 따라 플라보노이드 함량 차이를 분석한 결과 24시간 발효물(2-1)에서 플라보노이드 5종이 검출된 반면 48, 72시간 발효물(2-2, 2-3)에서는 플라보노이드 7종이 검출되었다. 발효시간이 길어질수록 주요성분인 narirutin과 hesperidin 함량이 감소하였고, aglycone 형태인 naringenin과 hesperetin 두 성분의 함량은 증가하였다(Fig. 6). 발효에 사용한 UCP량에 따라 플라보노이드 함량 차이를 분석하였다. 분석결과 UCP 사용량이 적은 3-1 시험군에서 5종의 성분이 검출되었고, UCP 사용량이 많은 3-2, 3-3 시험군에서 6종의 플라보노이드가 검출되었다. 사용한 UCP 양이 증가할수록 주요성분 narirutin과 hesperidin 함량이 감소한 반면 30 g을 사용한 3-3 시험군에서 naringenin과 hesperetin 함량이 큰 폭으로 증가하였다. 그 외 3-3 시험군에서 rutin, nobiletin 함량이 감소하였고, tangeretin은 불검출되었다(Fig. 7).
Table 2.
Contents of flavonoids in fermentation unripe Citrus unshiu Marcov. Powder.
| Samples | Contents (mg/mL)z | |||||||||
| Rutin | Narirutin | Naringin | Hesperidin | Neohesperidin | Quercetin | Naringenin | Hesperetin | Nobiletin | Tangeretin | |
| 1-1 | 0.242 ± 0.006 | 2.436 ± 0.034 | NDy | 0.432 ± 0.013 | ND | ND | ND | ND | 0.019 ± 0.001 | 0.003 ± 0.001 |
| 1-2 | 0.230 ± 0.012 | 2.512 ± 0.132 | ND | 0.401 ± 0.020 | ND | ND | ND | ND | 0.013 ± 0.001 | ND |
| 1-3 | 0.239 ± 0.014 | 2.587 ± 0.137 | ND | 0.441 ± 0.025 | ND | ND | ND | ND | 0.020 ± 0.001 | 0.004 ± 0.001 |
| 1-4 | 0.240 ± 0.024 | 2.559 ± 0.259 | ND | 0.458 ± 0.058 | ND | ND | ND | ND | 0.027 ± 0.004 | 0.010 ± 0.002 |
| 1-5 | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND |
| 2-1 | 0.267 ± 0.001 | 4.039 ± 0.011 | ND | 9.283 ± 0.058 | ND | ND | ND | ND | 0.041 ± 0.001 | 0.020 ± 0.001 |
| 2-2 | 0.421 ± 0.005 | 3.498 ± 0.067 | ND | 7.081 ± 0.315 | ND | ND | 0.333 ± 0.009 | 0.049 ± 0.002 | 0.040 ± 0.001 | 0.023 ± 0.001 |
| 2-3 | 0.236 ± 0.006 | 0.700 ± 0.011 | ND | 5.137 ± 0.072 | ND | ND | 1.353 ± 0.028 | 1.777 ± 0.044 | 0.041 ± 0.001 | 0.022 ± 0.001 |
| 3-1 | 0.222 ± 0.002 | 3.078 ± 0.042 | ND | 3.848 ± 0.160 | ND | ND | ND | ND | 0.040 ± 0.001 | 0.018 ± 0.001 |
| 3-2 | 0.240 ± 0.001 | 2.631 ± 0.009 | ND | 1.570 ± 0.009 | ND | ND | 0.012 ± 0.001 | ND | 0.024 ± 0.00 | 0.010 ± 0.001 |
| 3-3 | 0.088 ± 0.001 | 0.123 ± 0.003 | ND | 0.779 ± 0.005 | ND | ND | 1.349 ± 0.025 | 2.389 ± 0.052 | 0.020 ± 0.001 | ND |
고 찰
유산균은 당류를 발효하여 젖산 및 다양한 대사산물을 생산하는 미생물로 최근에는 건강 증진과 질병을 예방하는 probiotics로서 연구가 폭 넓게 진행되고 있으며, 건강기능식품, 기능성 화장품 원료 등의 제조에 널리 이용되고 있다. 또한 발효식품을 통하여 인체 내로 섭취한 유용 미생물들은 장내로 유입되어 유익균의 생육을 유지한다. 게다가 항산화 작용, 항암 작용, 면역 활성화 작용, 혈중 콜레스테롤 저하 등의 작용이 있어 질병을 예방하는데 도움이 된다고 보고되어 있다(Masood et al., 2011).
감귤류에 미생물을 적용하여 발효에 의한 성분 변화, 항산화(Xu et al., 2023), 항균(Chun and Bae, 2015), ACE 저해능(Choi et al., 2015)에 대한 연구가 수행되었으나 완숙과에 비해 유기산, 식이섬유, 플라보노이드 등이 많이 포함되어 있는 감귤 미숙과에 대한 발효 연구는 미미한 편이다.
본 연구에서는 감귤 미숙과인 풋귤이 면역증진에 관여하는 NO의 생성과 사이토카인의 분비를 증가시킬 수 있는 미생물 발효 공정을 연구하고 플라보노이드 성분 변화를 분석하고자 하였다.
미생물 종류를 달리한 1차 발효시험에서 BS와 LS 각각 단독 사용한 시험군에 비해 두 종의 미생물을 복합으로 발효한 시험군에서 NO의 생성량이 농도의존적으로 유의차있게 증가하였다. Jung and Oh (2022)의 연구 결과에 따르면 파인애플 발효 시 사용한 유산균의 종류와 혼합 사용 정도에 따라 항산화 효과 차이가 관찰되었으며, 미생물을 최대 4종 혼합하여 발효하였을 때 2종을 혼합한 시험군 대비 DPPH 라디칼 소거능이 14% 이상 더 높게 나타났다. 이와 유사하게 본 연구 결과에서도 BS, LS 두 미생물 간의 시너지 효과가 발생하여 풋귤 발효물의 면역증진 효과가 큰 폭으로 증가하였음이 확인되었음으로 앞으로 혼합된 두 미생물이 플라보노이드가 풍부한 식물의 발효에 이용가치가 높을 것으로 판단된다.
염증성 사이토카인은 면역세포에서 분비되는 단백질로서 이들은 면역 세포의 분화와 활성을 자극하거나 세포를 이동시키는 강력한 신호전달분자이다. 1차 발효와는 다르게 2차 발효에서는 pH가 유산균 발효에 영향을 미친다는 Ha et al. (2016)의 연구결과에 따라 pH를 7.0으로 발효기 자동보정기능을 활용하여 보정하고 혼합 미생물을 사용하여 24, 48, 72시간 발효 시 200 ㎍/mL 농도에서 IL-6가 각각 6.4, 28.0, 14.2 pg/mL 로 나타났으며, TNF-a는 각각 488.8, 593.7, 688.22 pg/mL로 측정되었다. 48시간 발효하였을 때 두 종의 사이토카인이 낮은 농도에서 모두 다량 분비되었고, IL-6인 경우 72시간 발효물에서 고농도에서만 분비량이 높았으므로 향후 산업 측면에서 생산비용을 고려하였을 때 48시간이 가장 적정한 발효시간으로 판단되었다. 발효 시간이 길어짐에 따라 미생물의 대사과정이 계속 진행되어 미생물이 섭취할 수 있는 물질의 양이 감소하고, 변환된 물질의 양이 증가함에 따라 미생물의 생장율이 감소하는 것으로 사료된다.
투입된 UCP의 양에 따라 각 시험군의 사이토카인 분비량을 측정한 결과 400 ㎍/mL 농도에서 IL-6가 각각 9.6, 14.3, 27.6 pg/mL 로 나타났으며, TNF-a는 각각 440.2, 542.7, 630.8 pg/mL 로 측정되었다. 1 L 발효기에 UCP를 최대 30 g 투입할 수 있었고, 미생물이 섭취할 수 있는 UCP의 양이 많아질수록 사이토카인의 분비량이 증가하는 것으로 나타났다.
본 연구에서 사용한 미생물 비율은 10%(v/v)로 고정하였고, UCP 투입량만 증가하였음으로 미생물과 UCP의 적정 비율은 확인할 수 없었다. Woo et al. (2021)의 연구에 따르면 미생물과 발효 재료간의 비율에 따라 발효물의 효능과 성분 변화에 차이가 나타났으므로 향후 BS, LS 두 미생물의 혼합비율 및 유산균과 발효 재료간의 혼합 비율은 추가 연구가 필요하다.
발효 미생물, 발효 시간, UCP 사용량에 따른 플라보노이드 함량 변화를 분석한 결과 1차 발효 실험에서 발효 미생물 간의 주요 플라보노이드 함량은 유의적 차이가 나타나지 않았다. 발효시간을 달리하여 2차 발효 실시 시험군에서 24시간 발효 시험군에서는 미검출되었던 naringenin 및 hesperetin 비배당체 플라보노이드 성분이 발효시간이 길어질수록 높은 함량으로 분석된 반면 narirutin과 hesperidin은 큰 폭으로 감소하였다. 또한 UCP 사용량을 달리하여 발효한 경우 UCP 사용량이 많을수록 narirutin과 hesperidin 함량은 감소하고 naringenin 및 hesperetin 함량은 증가하였다. 이와 더불어 미량성분인 pentamethoxyflavone 계열의 nobiletin과 tangeretin 또한 감소하는 것으로 나타났다. Guo et al. (2021)의 연구에 의하면 citrus속에서 유래된 두 종의 플라보노이드 hesperetin-7-O-rutinoside과 naringenin-7-O-rutinoside이 유산균에 의해 전환되어 각각 비배당체 형태인 hesperetin과 naringen으로 전환되었고, 미생물의 종류에 따라 전환되는 속도와 양이 다르게 나타났다. 또한 lactobacillus를 이용하여 Citrus sinensis 착즙액을 발효하였을 때 비배당체 형태 또는 배당체에서 1개의 당이 분해된 플라보노이드 성분인 hesperetin, kaempferol-7-rhamnoside 및 isorhamnetin-3-glucoside 성분들이 발효 72시간에 함량이 가장 높게 분석되었고, narirutin 및 kaempferol-7-rhamnoside 성분들은 발효시간이 경과함에 따라 함량이 감소하였다(Xu et al., 2023).
본 연구를 통해서도 BS 및 LS가 UCP에 포함된 플라보노이드 성분들을 비배당체 형태로 전환시키고, 발효시간과 UCP 사용량에 따라 전환되는 양이 달라짐을 확인할 수 있었다. 다만 UCP 발효물이 RAW264.7 세포에서 NO 생성량을 증가시키고 사이토카인 분비를 촉진함에 있어 생성된 플라보노이드류가 어떤 영향을 미치는지는 확인할 수 없었다. 사용한 미생물 종류에 따라서 플라보노이드 함량에 유의적 차이가 없었으나 NO 생성량은 증가하였고, 발효시간 및 UCP 사용량에 따라 비배당체 플라보노이드 함량과 사이토카인 분비량의 유의적으로 증가하는 추세이지만 명확하지는 않았다. Komatsuzaki et al. (2005)의 연구에 따르면 유산균의 대사산물로 g-aminobutyro acid (GABA)와 같은 유기산들이 대량 생성되고 면역 증진 효과가 있다고 밝혀졌다. 또한 Xu et al. (2023)에서는 Citrus sinensis 착즙액의 유산균 발효물에서 플라보노이드 성분의 함량 변화 이외에도 아미노산 16종 및 유기산 11종의 급격한 함량 변화가 측정되어 유산균이 착즙액 발효에 미치는 영향이 뚜렷하다고 보고하였다. 따라서 미생물을 이용한 감귤 미숙과 발효물의 면역 증진 효과와 성분 변화 관계를 증명하기 위해 향후 유기산 및 아미노산 등의 1차 대사산물의 함량 분석이 필요하다고 사료된다.
본 연구결과를 토대로 감귤 미숙과인 풋귤이 BS 및 LS에 의해 발효되어 플라보노이드 성분이 비배당체 형태로 전환되었으며, RAW264.7 대식세포에서 NO 합성이 증가하고 TNF-a, IL-6의 분비가 증대되어 면역증진 효과를 가진 기능성 소재로서 활용 가능하다는 것을 시사하였다.
적 요
연구에서는 감귤 미숙과 풋귤의 미생물 발효산물이 RAW264.7 대식세포에 미치는 면역증진 효과와 발효 조건에 따른 플라보노이드 함량 차이를 조사하였다. 풋귤 건조분말(UCP)을 전통발효 식품에서 분리한 Bacillus subtilis B21043(BS)과 Lactobacillus sakei B21065(LS)으로 발효하였으며, 두 미생물을 혼합하여 발효하였을 때 RAW264.7 세포에서 NO의 생성이 용량 의존적으로 유의하게 증가하였다. 또한 발효시간을 달리하여 발효한 경우 48시간 발효한 시험군에서 다른 시험군 대비 낮은 농도에서도 TNF-α, IL-6 분비가 농도 의존적으로 유의하게 증가하였다. 추가적으로 UCP 사용량을 변화한 결과 사용량이 많을수록 TNF-α와 IL-6가 높게 생성되었다. 각 발효 시험군에 대해 플라보노이드 10종의 함량 분석을 실시하였다. 사용한 발효 미생물 종류에 따라 플라보노이드 함량은 유의차가 없었으나 발효시간이 경과하고 UCP 사용량이 증가할수록 비배당체 형태의 플라보노이드인 naringenin과 hesperetin 함량이 증가하였다. 따라서 감귤 미숙과 풋귤의 발효물은 면역 증진 제품을 개발하기 위한 기능성 식품 소재로 사용될 수 있으며, 향후 대량 발효 공정 개발 등에 대한 연구가 필요할 것으로 판단된다.