서 언
재료 및 방법
실험재료
추출물 제조
세포 배양
Oil red O staining
SDS-PAGE and Western blot analysis
통계분석
결과 및 고찰
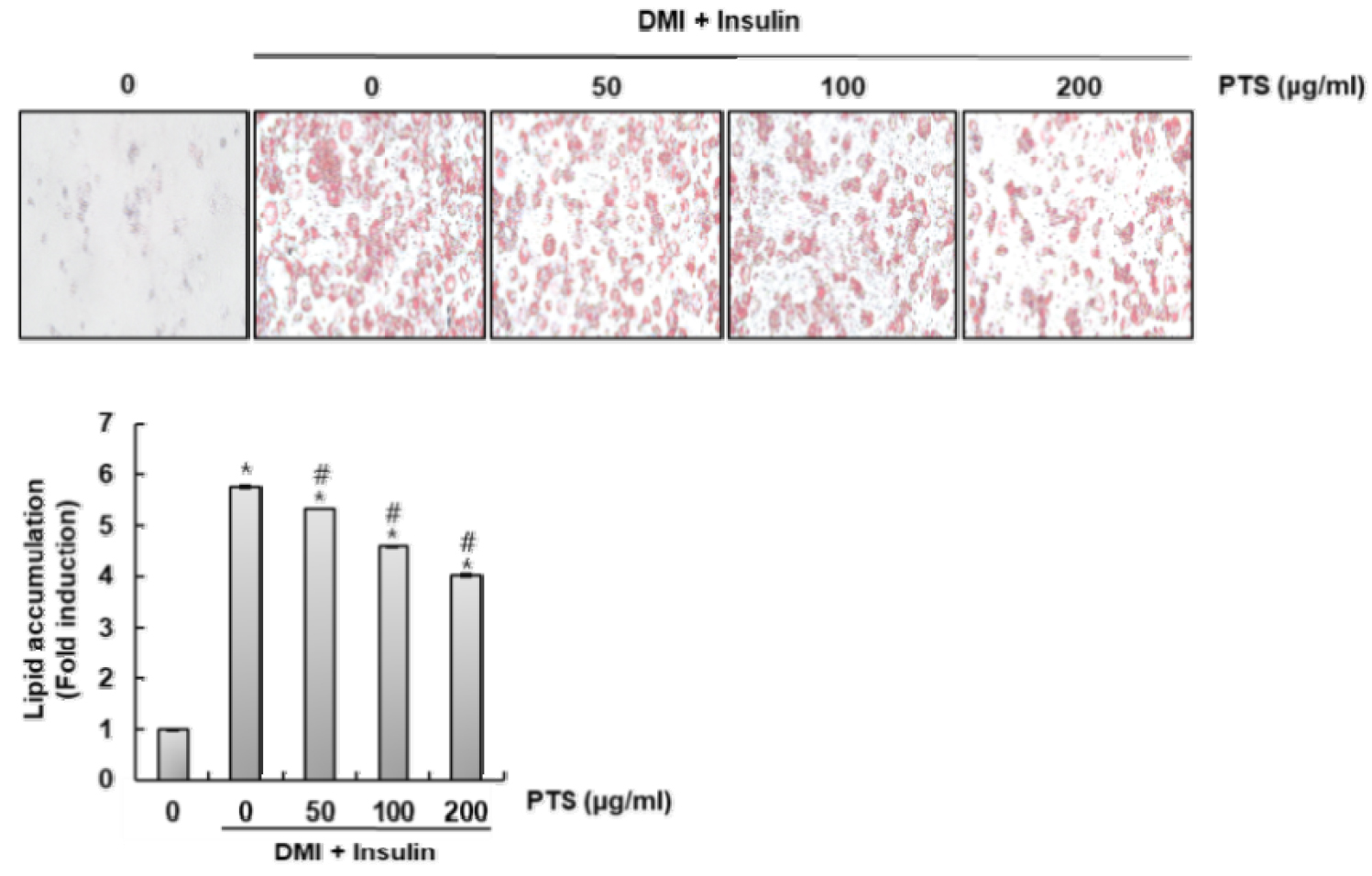
송담 줄기 추출물(PTS)이 3T3-L1 세포의 지질형성에 미치는 영향
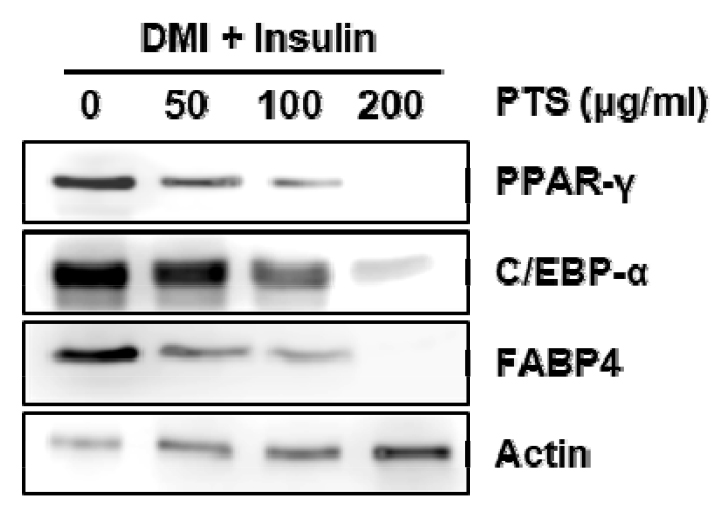
송담 줄기 추출물(PTS)이 3T3-L1 세포의 adipogenesis 관련 단백질 발현에 미치는 영향
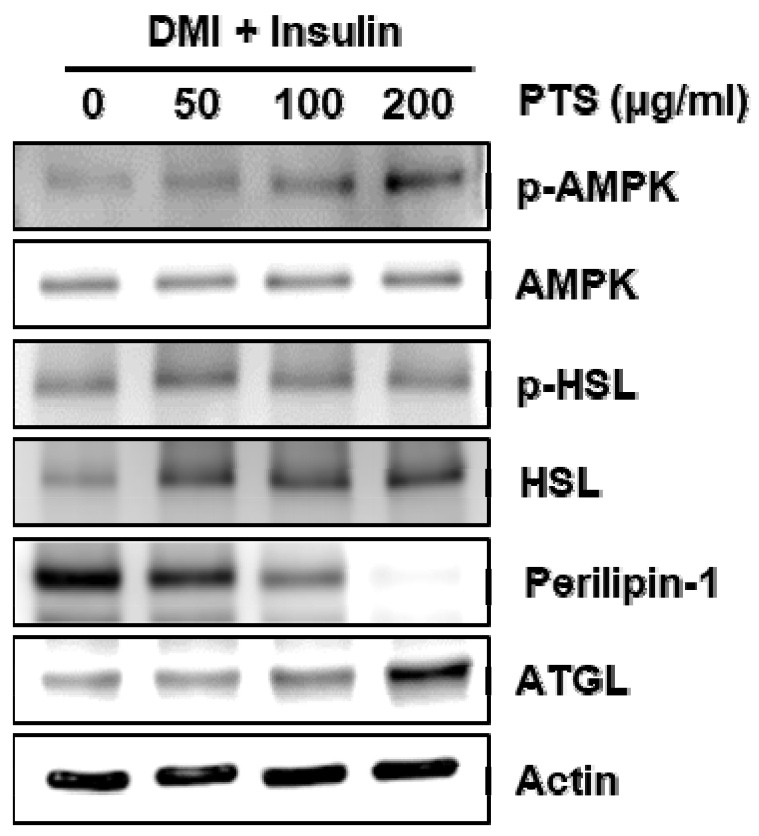
송담 줄기 추출물(PTS)이 3T3-L1 세포에서 lipolysis 관련 단백질 발현에 미치는 영향
적 요
서 언
세계보건기구(WHO)에서 비만은 체내지방조직이 비정상적이거나 과도한 상태의 질환으로 정의된다(Cuthberton et al., 2020; Yu et al., 2021). 비만은 식량 공급과 소비의 증가, 신체활동의 감소와 좌식활동의 여가생활 증가로 인해 전 세계에서 만성질환의 가장 큰 원인이 될 것으로 예상되었으며(Grundy, 1998), 1975년의 비만의 발병률은 1% 미만이었지만, 2016년에는 8%로 40년간 크게 증가했다(Jaacks et al., 2019). 또한 비만은 당뇨병, 고혈압 및 심혈관 질환과 같은 많은 병리학적 장애를 유발한다고 알려져 있다(Pi-Sunyer, 2002). 그렇기에 비만을 예방 및 치료하는 소재의 개발이 필요한 실정이다. 지방세포는 지질대사와 에너지의 균형을 조절하는 중요한 역할을 수행하지만 과도한 지방세포의 증식과 비대는 비만을 유도한다고 알려져 있다(Otto and Lane, 2005; Park et al., 2012).
담쟁이덩굴(Parthenocissus tricuspidata (Siebold & Zucc.) Planch)은 포도과(Vitaceae)에 속하는 낙엽 덩굴식물로 한국, 중국, 일본, 대만 및 유럽에도 분포한다. 이들의 덩굴손은 잎과 대로 성장하며 끝에 둥근 흡착근이 존재하여 바위나 오래된 건물, 또는 나무의 높은 곳까지 오를 수 있으며, 보통 길이가 10 m 이상 자라는 식물이다(Jo et al., 2012). 담쟁이덩굴은 phenolic acid, flavonol, anthocyanin 및 hydroxybenxoic acid 등 다양한 기능성 성분이 함유되어 있다고 알려져 있다(Hwang et al., 1995; Wang et al., 1982). 또한, 담쟁이덩굴은 민간에서 뿌리와 잎을 관절염, 황달, 신경통, 후두염 및 치통 등에 사용해왔으며(Jo et al., 2012), 담쟁이덩굴이 약재로 사용될 경우, 반드시 나무를 감고 올라간 담쟁이덩굴을 사용해야 한다(Cho and Choi, 2013). 현재, 소나무를 감고 올라간 담쟁이덩굴을 송담이라 부르고 있다. 지금까지 담쟁이덩굴은 항말라리아, 항산화 및 항당뇨 활성이 있다고 보고되었지만, 항비만에 관한 연구는 전무한 실정이다(Cho and Choi, 2013; Saleem et al., 2004; Son et al., 2007). 당뇨는 비만과 관련된 주요한 대사질환으로 송담의 항당뇨 활성이 항비만 활성으로부터 기인한 것일 수 있으므로 본 연구에서 지방전구세포인 3T3-L1 세포를 이용하여 송담의 항비만 활성을 검증하였다.
재료 및 방법
실험재료
마우스의 지방전구세포인 3T3-L1 세포의 배양에 사용된 배지는 DMEM/F-12으로 Lonza (Morristown, NJ, USA)에서 구매하였다. Dexamethasone, 3-Isobutyl-1-methylxanthine (IBMX), insulin and Oil Red O staining solution은 Sigma-Aldrich (St. Louis, MO, USA) 사에서 구입하였다. 그리고 Western blot 분석을 위해 사용된 일차 항체와 이차 항체들은 Cell Signaling Technology (Danvers, MA, USA)에서 구입하였다.
추출물 제조
본 연구의 시료인 담쟁이덩굴(Parthenocissus tricuspidata (Siebold & Zucc.) Planch)은 제주도에서 자생하는 식물로써 소나무를 타고 올라간 담쟁이덩굴(송담)을 사용하였다. 분쇄된 송담 줄기 10 g을 200 mL 증류수에 침지 후 15℃에서 150 rpm으로 교반하여 3일간 추출하였다. 3일 후 15,000 rpm에서 20분간 원심분리 후 추출물을 회수 후, 동결건조했으며 최종적으로 송담 줄기 추출물(PTS)을 얻었다. 동결건조 된 추출물은 –80℃ 냉동고에 보관하며 연구를 위한 시료로 사용하였다.
세포 배양
본 연구에서 사용된 마우스 지방전구세포 3T3-L1 세포는 American Type Culture Collection (Manassas, VA, USA)에서 구입하였다. 3T3-L1 세포는 10% bovine calf serum, 100 U/mL penicillin과 100 ㎍/mL streptomycin이 포함된 DMEM/F-12 배지로 37℃, 5% CO2 하에서 배양되었다. 지방전구세포에서 지방세포로의 분화와 지질축적을 유도하기 위해 3T3-L1 세포가 well에 가득 채워진 후(D0), 3T3-L1 세포를 DMI (10% FBS, 1 μM dexamethasone, 0.5 mM 3-isobutyl-1-methylxanthine and 10 ㎍/mL insulin)배지에 48시간 배양하였다. D2에는 3T3-L1 세포를 10% FBS와 10 ㎍/mL insulin을 포함하는 DMEM/F-12 배지에서 48시간 배양하였다. 그 후 D4에도 D2와 동일한 조성의 배지로 48시간 배양하였다. D6에는 10% FBS가 포함된 DMEM/F-12 배지로 교체하여 배양하였다.
Oil red O staining
송담 줄기 추출물(PTS)이 3T3-L1 세포에서 지질방울의 형성에 미치는 영향을 육안으로 확인하기 위해 Oil Red O staining을 하였다. 처리된 3T3-L1 세포를 D8에 회수하여 1 × phosphate-buffered saline (PBS)로 2회 세척 후, 상온에서 1시간 동안 10% formalin으로 세포를 고정시켰다. 고정된 3T3-L1 세포를 증류수로 2회 세척 후, 60% isopropanol을 처리하여 5분 동안 상온에 방치하였다. 5분 후, 3T3-L1 세포를 완전히 건조하고 상온에서 20분 동안 Oil Red O 용액(60% isopropanol and 40% water)으로 염색하였다. 염색 후, 증류수로 5회 세척하였고, 염색된 3T3-L1 세포의 지질방울을 광학현미경(Olympus, Tokyo, Japan)으로 촬영하였다. 촬영 후, 100% isopropanol로 염색된 부분을 녹여 UV/Visible spectrophotometer (Xma-3000PC, Human Corporation Co., Seoul, Korea)를 이용하여 500 ㎚에서 흡광도를 측정하였다.
SDS-PAGE and Western blot analysis
세포로부터 단백질을 추출하기 위해, 송담 줄기 추출물(PTS) 처리가 끝난 세포를 4℃에서 유지된 1 × phosphate-buffered saline (PBS)로 2회 세척 후, protease inhibitor cocktail (Sigma-Aldrich Co.)과 phosphatase inhibitor cocktail (Sigma-Aldrich Co.)이 포함된 radioimmunoprecipitation buffer (Boston Bio Products, Ashland, MA, USA)를 4℃에서 30분간 처리하여 단백질을 추출하였다. 추출된 단백질은 bicinchoninic acid protein assay (Pierce Biotechnology Inc., Waltham, MA, USA)로 정량분석 후 동일한 양의 단백질을 10% SDS-acrylamide gel로 전기영동하고, PVDF membrane (Bio-Rad, Hercules, CA, USA)에 이동 후 5% non-fat dry milk을 상온에서 1시간 동안 blocking하였다. 1시간 후, 1차 항체를 5% bovine serum albumin (BSA, GenDEPOT, TX, USA)에 용해시켜 4℃에서 16시간 동안 반응시킨 후 membrane을 0.05% tween-20이 포함된 tris-buffered saline (TBS-T)로 5분간 3회 세척하였다. 그 후 2차 항체는 5% non-fat dry milk에 용해시켜 membrane에 상온에서 1시간 처리하였고, TBS-T로 5분간 3회 세척 후 membrane은 ECL western blotting substrate (Amersham Biosciences Co., Little Chalfont, England)와 C-DiGit® Blot Scanner (LI-CDR, USA)를 이용하여 단백질 발현을 확인하였다.
통계분석
모든 결과는 3회 반복측정 후 평균 ± 표준편차로 나타내었고, 처리간 유의성은 Student’s t-test로 검증하여 p-value 값이 0.05 미만일 때 통계적으로 유의하다고 판정하였다(Microsoft Excel 2010, Microsoft, Redmond, WA, USA).
결과 및 고찰
송담 줄기 추출물(PTS)이 3T3-L1 세포의 지질형성에 미치는 영향
성숙한 지방세포에 과도한 지질형성은 비만을 유도한다고 알려져 있다(Cuthberton et al., 2020). 그리하여, 송담의 항비만 활성을 검증하기 위해 PTS가 DMI/insulin으로 유도되는 3T3-L1 세포의 지질형성을 억제하는지 Oil red O staining을 통해 확인하였다. 그 결과 PTS는 농도 의존적으로 지방세포에서 DMI/insulin으로 유도되는 과도한 지질형성을 억제하는 것으로 나타났다(Fig. 1). 본 결과로 미루어 볼 때, 지방세포에서 PTS의 과도한 지질형성 억제는 PTS에 항비만 활성이 있음을 보여준다고 판단된다.
송담 줄기 추출물(PTS)이 3T3-L1 세포의 adipogenesis 관련 단백질 발현에 미치는 영향
비만은 지방전구세포의 분화와 지방생성과정인 adipogenesis에 의하여 지방세포 내 중성지질의 축적으로 야기되며, 이러한 adipogenesis를 억제하는 것은 비만 예방 및 치료를 위한 주요한 방법으로 알려져 있다(Cao et al., 1991). 지방전구세포의 adipogenesis와 관련 주요한 인자들 중 C/EBPα (CCAAT/enhancer binding protein-alpha)는 주로 간, 장 조직 또는 지방에서 발현되며 지방세포의 특이적 인자로 다면발현성의 전사활성인자로 알려져 있다(Otto and Lane, 2005). 그리고, PPARγ (peroxisome proliferator-activated receptor-gamma)는 지방세포조직에서 발현되어 지방세포 분화과정에 중요한 조절인자이며(Otto and Lane, 2005), 분화 초기, 중기 사이의 지방생성을 조절하는 인자로서 PPARγ의 과발현은 과도한 지질형성을 초래한다고 보고되고 있다(Floresta et al., 2017). FABP4 (Fatty acid-binding protein 4)는 주로 대식세포와 지방조직에서 발현되며 지방산 저장과 지방분해를 조절하는 중요한 인자이다(Floresta et al., 2017). 그리하여, PTS의 지질형성 억제가 adipogenesis 관련 단백질 발현 억제에 기인된 것인지 확인하기 위해 Western blot 분석을 통해 C/EBPα, PPARγ, 그리고 FABP4의 발현이 억제되는지 검증하였다. 그 결과, PTS는 농도 의존적으로 PPARγ, C/EBPα 그리고 FABP4의 발현을 감소시키는 것으로 나타났다(Fig. 2). 본 결과로 미루어 볼 때, PTS는 PPARγ, C/EBPα 그리고 FABP4의 발현 감소를 통해 지방전구세포의 adipogenesis을 억제하여 지방세포의 과도한 지질형성을 억제하는 것으로 판단된다.
송담 줄기 추출물(PTS)이 3T3-L1 세포에서 lipolysis 관련 단백질 발현에 미치는 영향
비만 예방 및 치료에는 과도한 지질형성 억제뿐만 아니라, 지질분해(Lipolysis) 또한 중요한 분자타겟으로 여겨지고 있다(Kim et al., 2016). Lipolysis는 다양한 인자들에 의해 조절되는데, 그 중 AMPK (AMP-activated protein kinase)는 AMP : ATP 비율의 변화에 반응하여 활성화되며, 활성화 시 에너지 항상성을 회복시키기 위해 ATP를 생성하고, AMPK의 활성화는 백색지방세포에서 지방산의 흡수를 억제하고 기질의 산화를 촉진함으로 항비만 효과를 일으킨다(Gaidhu et al., 2009). HSL (Hormone-sensitive lipase)은 triacylglycerol을 조절하는 중요한 효소로 간주되며, HSL의 인산화는 세포질에서 지질방울의 표면으로의 이동을 촉진하여 diacyglycerol에 작용하여 하나의 지방산과 monoacylglycerol로 분해한다(Lafontan and Langin, 2009). Perilipin-1은 지질방울의 표면단백질로 외부의 lipase에 대해 보호 및 노출작용을 하며, perilipin의 인산화는 HSL의 작용과 지방분해의 시작을 돕는 지질방울의 표면에 중요한 물리적 변화를 유도한다(Lafontan and Langin, 2009). ATGL (Adipose triglyceride lipase)은 지방조직에서 높게 발현되며 지방세포의 분화과정에 현저하게 증가한다(Kershaw et al., 2006). 또한 triacylglycerol로부터 첫 번째 지방산을 절단하여 지방분해를 시작한다(Gaidhu et al., 2010). 그리하여, PTS의 지질형성 억제가 lipolysis 활성화에 기인된 것인지 확인하기 위해 Western blot 분석을 통해 lipolysis 관련 단백질의 발현정도를 확인하였다. 그 결과, PTS는 AMPK와 HSL의 활성형인 AMPK와 HSL의 인산화를 증가시켰고, ATGL의 발현을 증가시키는 것으로 나타났다. 또한 PTS는 perilipin-1의 발현을 억제시켰다(Fig. 3). 본 결과를 미루어 볼 때, PTS는 지방세포의 지질을 분해시켜 과도한 지질형성을 억제하는 것으로 판단된다.