서 언
단백질과 유기 복합체를 형성하여 각종 대사체계를 교란시키는 중금속 오염은 산업 활동, 광업 및 특정 살충제 등의 사용으로 발생한다(Blundell and Jenkins, 1977). 중금속 오염물질은 토양과 폐수, 미세먼지 등 다양한 경로를 통하여 생체내로 전달되어 생명을 위협하며, 특히 독성 중금속은 환경에 지속적으로 존재하며 먹이사슬에 축적되어 심각한 위해를 초래한다(Gall et al., 2015). 따라서 중금속으로 오염된 환경을 복원하기 위한 다양한 연구들이 시도되고 있다.
중금속을 정화하는 물리화학적 처리방법으로는 물을 사용하여 오염된 토양을 세척하거나(soil washing), 토양 내에 전류를 흘려 전기장에 의해 중금속 이온을 제거하거나(electrokinetic remediation), 화학 첨가제를 이용하여 중금속을 용해도 또는 독성이 낮은 물질로 전환시키는(stabilization and solidification) 방법이 있다(Giannis and Gidarakos, 2005; Zhao et al., 2022). 또한 오염된 수용액 내의 중금속을 불용성 화합물로 침전시켜 제거하거나(chemical precipitation), 이온교환 매체에 중금속을 흡착시켜 정제하는(ion exchange) 방법이 보고되었다(Matlock et al., 2002). 근래에는 넓은 표면적과 높은 반응성을 가진 나노 입자를 중금속과 결합시켜 제거하거나(nanotechnology), 물속의 중금속에 전류를 가하여 응집체를 만들어 처리하거나(electrocoagulation), 오염된 토양이나 물에 숯, 진흙, 금속 슬래그 등을 첨가하여 중금속을 포함하는 안정적인 광물상을 형성시키는(geochemical immobilization) 기술도 개발되고 있다(Bazrafshan et al., 2015; Nejad et al., 2018).
생물학적으로는 다량의 중금속을 흡수하는 능력을 가진 식물체를 이용하여 토양과 물속 중금속을 농축 및 제거하거나(phytoremediation), 독성물질을 분해하는 미생물을 사용하여 정화하는(bioremediation) 방법이 있다(Mani and Kumar, 2014). 특히 식물과 미생물을 이용하는 생물학적 방법은 환경 친화적이고 2차 오염 가능성이 낮으며, 비교적 적은 비용과 노동력이 소요되는 장점이 있어 수용성이 높다(Bhat et al., 2022; Jeyakumar et al., 2023). 또한 생태계에 서식하는 생물을 이용하여 오염물질을 흡수하거나 분해하는 생물정화방법은 기존의 식물과 박테리아뿐만 아니라 미세조류, 곰팡이, 효소 등 새로운 생물종들의 발굴로 형태가 다양해지고 있다(An et al., 2022; Leong and Chang, 2020; Rahman and Singh, 2020; Shen et al., 2022).
현대생명공학기술을 이용하여 환경오염물질을 감소·제거하거나 환경오염에 내성을 가지고 생장함으로써 환경을 복원하는 목적으로 개발된 환경정화용 유전자변형생물체(Living Modified Organism, LMO)는 생물정화의 효율을 한층 더 높였다. Nicotiana glauca는 TaPCS1 유전자의 과발현으로 카드뮴과 납 축적능이 각각 9배, 36배 더 증가한 반면 Arabidopsis thaliana는 GSH1과 AsPCS1유전자의 동시 과발현으로 카드뮴과 비소 축적능이 크게 향상되었다(Guo et al., 2008; Martínez et al., 2006). 또한 Liriodendron tulipifera는 merA 유전자의 과발현으로 수은의 방출속도를 10배 더 높였다(Rugh et al., 1998).
한편, 개발된 환경정화용 LMO를 실제 오염지에 적용하기 위해서는 생태계와 생물다양성에 미치는 잠재적인 영향 평가를 포함한 과학적이고 체계적인 위해성평가가 필수적이다. 국내에서는 환경정화용 LMO의 수입 혹은 생산을 위한 위해성심사와 이용, 취급 및 유통 등에 관한 안전관리를 환경부에서 담당하고 있다(KBCH, 2024). 환경부 산하기관인 국립생태원은 환경부의 LMO 안전관리 업무를 위탁 받아 환경정화용 LMO의 위해성심사 기준 마련을 위한 위해성평가 용도의 환경정화용 LMO를 개발 중이며, 그 일환으로 중금속으로 오염된 폐광산에서 자생하는 식물상을 조사한 후 유용유전자를 선별하기 위한 후보 식물종을 선정하였다(Nam et al., 2019). 본 연구에서는 이 식물종들의 특성을 보다 상세하게 분석하여 환경정화용 LMO의 개발 및 위해성평가를 위한 기초자료로 활용하고자 하였다.
재료 및 방법
실험에 사용된 식물종은 이전 연구결과(Nam et al., 2019)를 토대로 국내 폐광산에서 자생하며 중금속 축적능이 높은 7종으로 선택하였다. 선정된 대상 식물종은 질경이(Plantago asiatica), 개망초(Erigeron annuus), 돼지풀(Ambrosia artemisiifolia), 망초(Conyza canadensis), 쑥(Artemisia princeps), 달맞이꽃(Oenothera odorata), 벌개미취(Aster koraiensis)였다. 연구대상지인 폐광산은 충청남도에 위치한 금과 은, 동, 텅스텐을 채굴하던 금속광산으로 2001년 폐광되었다(Fig. 1; Nam et al., 2019).
폐광산 토양의 중금속 농도는 갱구(Site A) 토양의 비소와 아연 함량이 각각 435.3 ㎎ ㎏-1, 191.1 ㎎ ㎏-1, 갱미(Site B) 토양의 비소와 아연 함량은 각각 12,686.1 ㎎ ㎏-1, 2,042.2 ㎎ ㎏-1 인 반면 대조구(Site C) 토양의 비소와 아연 함량은 각각 36.0 ㎎ ㎏-1, 103.8 ㎎ ㎏-1 이었다(Chun et al., 2021). 이 지역의 2019~2023년 전체 평균온도는 11.8℃, 평균최대온도는 18.6℃, 평균최저온도는 6.0℃였고, 전체 월평균 강수량은 101.8 ㎜로 기록되었다(Fig. 2; KMA, 2024).
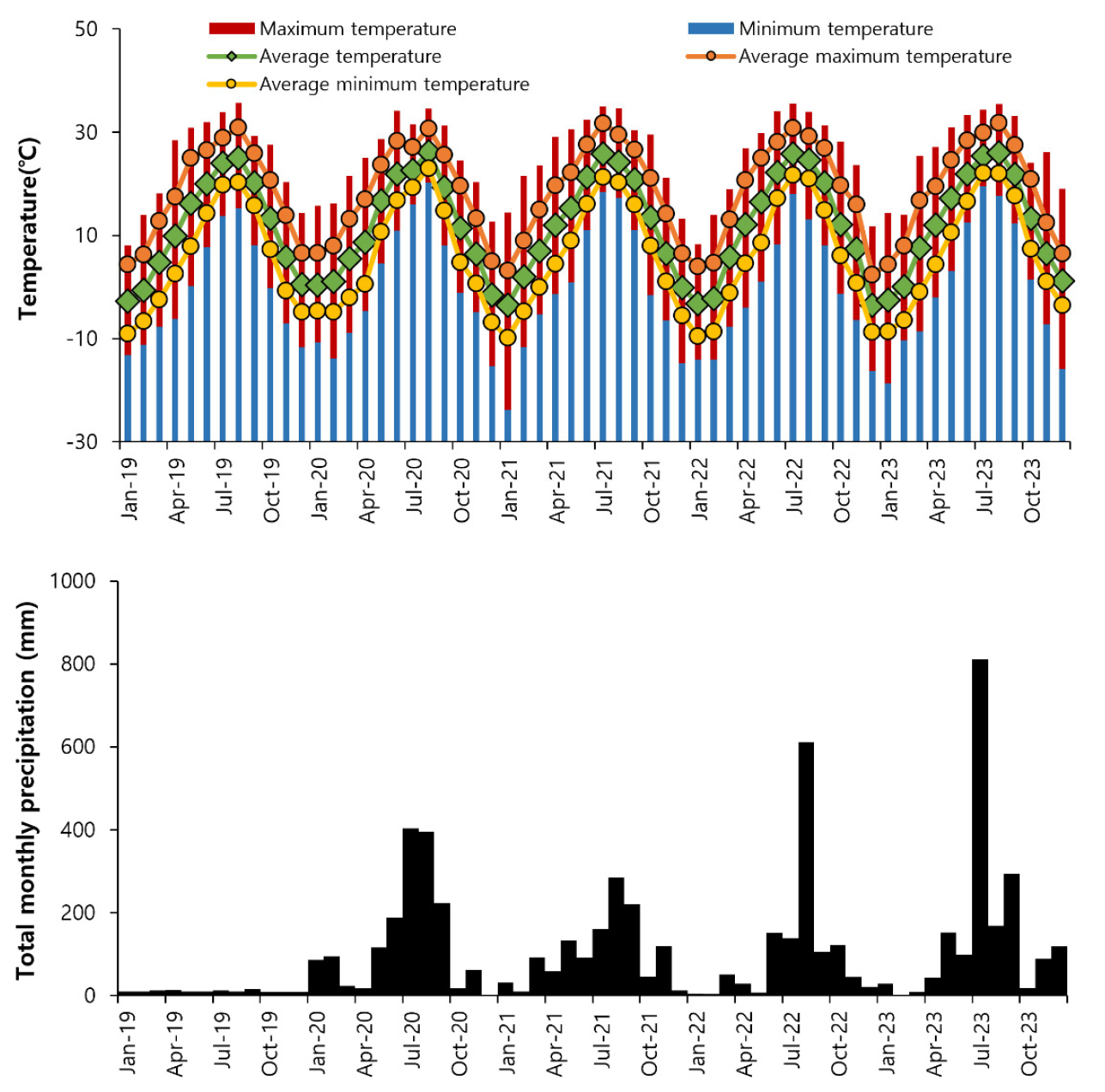
Fig. 2.
Meteorological characteristics of the sampling area from 2019 to 2023. Data were obtained from the monthly weather reports of the Cheongyang Meteorological Station (KMA, 2024).
토양오염도에 따른 식물의 생장특성을 분석하기 위해 폐광산 갱구와 갱미 주변 및 대조구 주변에서 자생하는 7종의 식물체를 최대한 온전히 확보하여 채취한 후 초장과 건중량을 측정하였다. 초장은 지면에서부터 식물체의 정단부까지의 길이를 측정하였다. 건중량은 식물체를 지상부와 지하부로 나누어 65℃ 건조기에서 5일간 건조한 후 측정하였다.
식물체내 중금속과 무기성분의 함량은 토양 및 식물체 분석법(NIAST, 2000)에 따라 측정하였다. 갱미 주변에서 자생하는 식물체를 5주씩 채취하여 흐르는 물에 깨끗이 씻은 후 지상부와 지하부를 나누어 건조하였다. 건조된 시료는 잘게 분쇄한 후 0.1 g을 정량하여 황산과 질산을 넣고 200℃에서 2시간 가열하여 산분해한 다음 5% 질산용액으로 전처리하였다. 전처리된 시료는 유도결합플라즈마 분광광도계(Agilent 5900 ICP-OES, Agilent Technologies, Inc., Santa Clara, USA)를 이용하여 비소와 아연, 인, 칼륨, 칼슘, 나트륨 함량을 측정하였고, 질소 함량은 원소분석기(Flash EA2000 Series Elemental analyzer, ThermoFisher Inc., Cambridge, UK)를 사용하여 측정하였다. 또한 지하부와 지상부의 중금속 분석 결과를 토대로 각 식물이 축적한 중금속이 지하부에서 지상부로 이동하는 비율을 나타내는 이동계수(Translocation Factor, TF)를 구하였다.
통계처리는 Statistica (version 8.0, StatSoft Inc., Tulsa, OK, USA)를 이용하여 일원분산분석(One-way analysis of variance, ANOVA)을 실시하였고, 그룹간 유의성은 던컨의 다중범위검정(Duncan’s multiple range test)으로 5% 유의수준에서 검정하였다.
결과 및 고찰
생장특성
본 연구에서 중금속 농도가 높은 폐광산의 갱구(Site A)와 갱미(Site B) 토양에서 자란 식물체와 중금속으로 오염되지 않은 토양(Site C)에서 자란 식물체의 생장을 비교 분석한 결과 달맞이꽃을 제외한 대부분의 식물 초장이 토양오염도에 따라 크게 달랐다(Fig. 3). 갱구와 갱미 토양에서 자란 질경이의 초장은 오염되지 않은 토양에서 자란 질경이보다 각각 42.9%, 38.1% 작았다. 갱구와 갱미 토양에서 자란 망초의 초장은 오염되지 않은 토양에서 자란 망초보다 각각 17.8%, 22.6% 작았다. 개망초의 초장은 갱구에서 자란 식물체에서 83.9% 감소한 반면 돼지풀은 갱미에서 자란 식물체에서 48.2% 감소하였다. 벌개미취의 초장은 오염되지 않은 토양에서 자란 식물체와 갱구에서 자란 식물체 간에는 차이가 없었으나 갱미에서 자란 식물체에서는 53.7% 감소하였다. 반면, 쑥의 경우 갱구와 갱미에서 자란 식물체의 초장이 오염되지 않는 토양에서 자란 식물체보다 컸으며, 특히 갱구에서 자란 쑥의 초장은 59.6% 더 증가하였다.
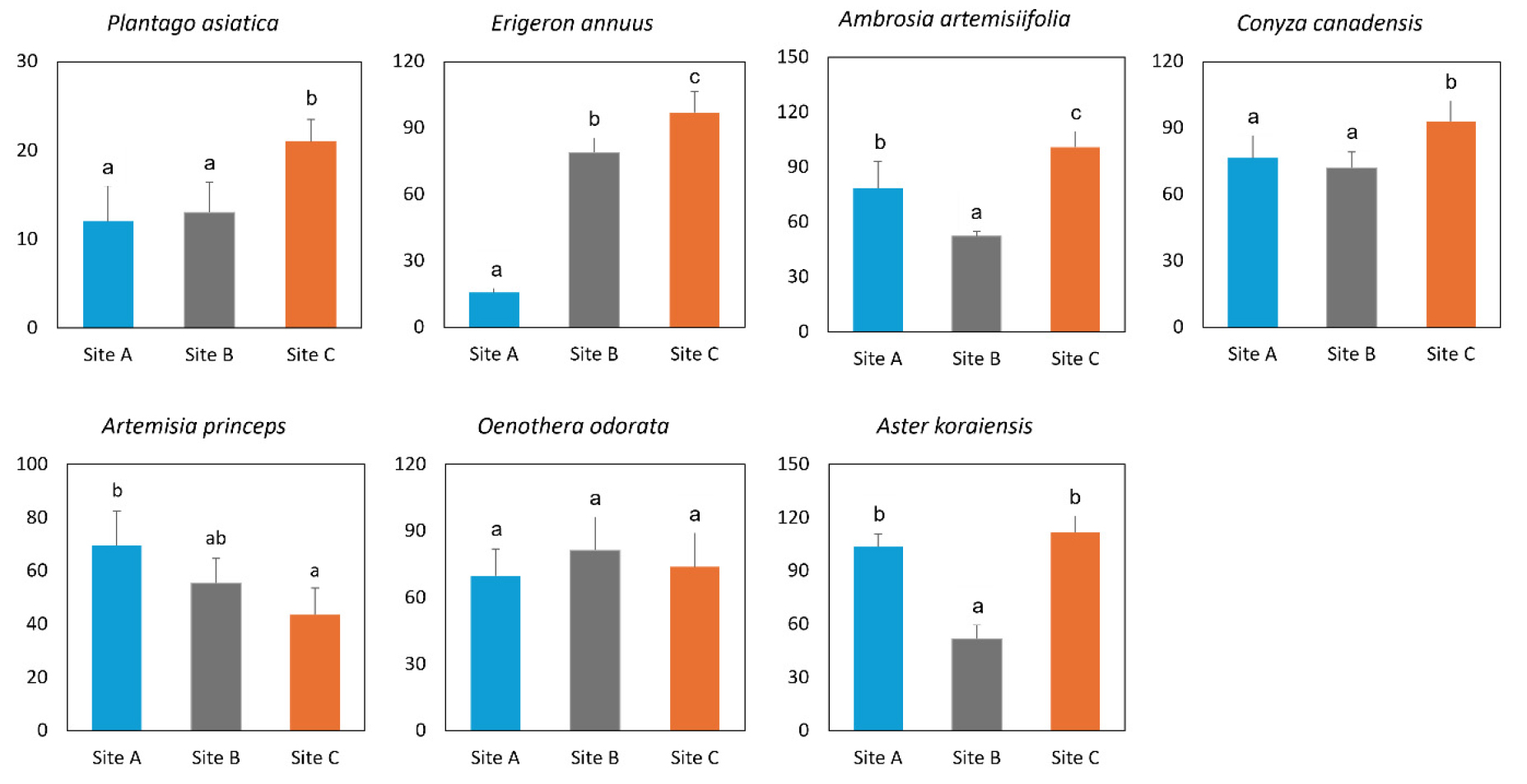
Fig. 3.
Comparision of plant height (㎝) of seven plant species grown in heavy metal-contaminated and uncontaminated soils. Samples were collected from mine entrance (Site A), mine tailing area (Site B), and control area (Site C). Data are means (n = 5) ± standard deviations. Different letters indicate significant differences between mean at the p < 0.05 level by one-way ANOVA.
토양오염도에 따른 식물체의 건중량 변화를 비교 분석한 결과 질경이와 망초, 쑥, 달맞이꽃, 벌개미취의 지상부 건중량은 중금속으로 오염된 토양에서 자란 식물체와 오염되지 않은 토양에서 자란 식물체 간에 차이가 없었다(Table 1). 개망초의 경우 갱미에서 자란 식물체는 오염되지 않는 토양에서 자란 식물체보다 지상부 건중량이 127.4% 더 증가하였다. 반면, 돼지풀의 지상부 건중량은 오염되지 않은 토양에서 자란 식물체와 비교하여 갱구와 갱미에서 자란 식물체에서 각각 42.0%, 91.0% 감소하였다. 지하부의 건중량은 조사된 모든 식물에서 토양오염도에 따른 통계적 유의차가 없었다. 토양오염도에 따른 지상부와 지하부의 건중량 비율은 개망초에서 통계적 유의차를 보였고, 갱구에서 자란 식물체의 지상부와 지하부의 건중량 비율은 오염되지 않은 토양에서 자란 식물체의 지상부와 지하부의 건중량 비율보다 53.0% 감소하였다.
Table 1.
Comparision of plant dry matter of seven plant species grown in heavy metal-contaminated and uncontaminated soilsz.
zSamples were collected from mine entrance (Site A), mine tailing area (Site B), and control area (Site C). Data are means (n = 5) ± standard deviations. P-values are based on one-way ANOVA tests. Vaues within rows followed by the same letters are not significantly different at p < 0.05 per Duncan’s test.
중금속 스트레스는 식물 생장에 중요한 효소와 단백질들을 불활성화 하거나 광합성, 호흡과 같은 대사 반응을 변화시켜 생장을 방해한다고 알려져 있다(Ghori et al., 2019; Hossain et al., 2012). 따라서 중금속에 노출된 식물은 성장이 둔화되고 바이오매스 생산이 감소하여 결국 수확량이 줄어든다. 본 연구에서는 비소가 토양환경보전법상의 토양오염우려기준을 8.7배 초과한 갱구(Site A) 토양에서 자란 식물과 비소와 아연의 토양오염우려기준을 각각 253.7배, 3.4배 초과한 갱미(Site B) 토양에서 자란 식물을 오염되지 않은 대조구(Site C) 토양에서 자란 식물과 비교하였을 때 대부분의 식물 초장은 오염환경에서 감소하였으나 건중량은 돼지풀을 제외하고는 크게 감소하지 않는 것으로 확인되었다. 특히 갱구와 갱미에서 자란 개망초의 초장은 대조구 초장의 0.16배, 0.81배였으나, 지상부 건중량은 대조구보다 1.2배, 2.3배 더 증가하는 것으로 나타났다. 오염지의 환경복원을 위해 사용되는 식물은 오염물질의 분해능과 축적능이 뛰어날 뿐만 아니라 바이오매스 생산량이 높아야 하며, 특히 지상부 건중량이 높을 때 경제적으로 더 유리하다고 보고된 바 있다(Kwon et al., 2019; Martínez et al., 2006). 따라서 해바라기와 벌개미취, 왕갯쑥부쟁이와 같은 국화과 식물들의 이용가치가 높게 평가되어 왔다(January et al., 2008; Kwon et al., 2019). 본 연구에서는 개망초, 벌개미취, 쑥 등의 국화과 식물을 비롯하여 달맞이꽃이 중금속으로 오염된 환경에서도 생육이 양호한 것으로 확인되었다.
중금속 축적 및 전이 특성
식물의 중금속 축적능은 식물 종과 서식지에 따라 다르다고 알려져 있다 (Bergqvist and Greger, 2012). 오염되지 않은 토양에서 자란 식물체의 비소 농도는 일반적으로 0.009~1.7 ㎎ ㎏-1로 보고(Pais and Jones, 1997)되었고, 오염된 지역의 식물 잎에서 아연과 카드뮴, 납과 같은 중금속 농도는 오염되지 않는 지역의 식물보다 더 높았다(Kandziora-Ciupa et al., 2013). 토양오염도가 가장 높은 갱미 토양에서 자란 식물체의 중금속 축적능과 저항성을 비교한 결과는 Table 2과 3에 나타내었다. 지하부의 비소함량은 망초에서 136.7 ㎎ ㎏-1로 가장 높았고, 벌개미취와 쑥에서 각각 105.2 ㎎ ㎏-1, 94.3 ㎎ ㎏-1으로 높았다(Table 2). 돼지풀의 지하부 비소함량은 3.5 ㎎ ㎏-1로 다른 식물에 비해 크게 낮았다. 지상부의 비소함량도 망초에서 21.6 ㎎ ㎏-1로 가장 높았고, 쑥과 벌개미취는 각각 20.1 ㎎ ㎏-1, 16.9 ㎎ ㎏-1 이었다. 한편 조사된 모든 식물의 이동계수는 0.11~0.76으로 흡수한 비소의 대부분을 지하부 조직에 축적하는 것으로 분석되었다.
Table 2.
Concentrations of arsenic (㎎ ㎏-1) in shoots and roots and translocation factor (TF) of seven plant species grown in soils contaminated by heavy metalsz.
| Root | Shoot | TFy | |
| Plantago asiatica |
54.2 ± 40.7 (26.7 – 125.0)x |
7.7 ± 2.4 (4.3 - 10.0) |
0.21 ± 0.05 (0.16 - 0.28) |
| Erigeron annuus |
57.1 ± 35.4 (29.2 - 118.0) |
5.1 ± 1.8 (2.8 - 7.1) |
0.11 ± 0.08 (0.06 - 0.24) |
| Ambrosia artemisiifolia |
3.5 ± 1.4 (2.2 - 5.4) |
1.9 ± 1.6 (0.7 - 4.4) |
0.76 ± 0.61 (0.13 - 1.42) |
| Conyza canadensis |
136.7 ± 49.7 (62.6 - 168.0) |
21.6 ± 5.1 (12.6 - 25.1) |
0.21 ± 0.11 (0.14 - 0.38) |
| Artemisia princeps |
94.3 ± 25.8 (61.7 - 126.0) |
20.1 ± 3.7 (15.9 - 26.0) |
0.23 ± 0.11 (0.16 - 0.42) |
| Oenothera odorata |
34.5 ± 23.6 (10.8 - 67.9) |
5.6 ± 2.2 (3.2 - 8.3) |
0.22 ± 0.13 (0.11 - 0.41) |
| Aster koraiensis |
105.2 ± 56.5 (56.2 - 180.0) |
16.9 ± 10.5 (8.0 - 30.6) |
0.18 ± 0.12 (0.06 - 0.37) |
zSamples were collected from mine tailing area. The arsenic content of the mine tailing area soil was 12,686.1 ㎎ ㎏-1 (Chun et al., 2021). Data are means (n = 5) ± standard deviations.
중금속으로 오염된 폐광산 토양에서 자란 식물의 지하부 아연함량은 질경이가 104.8 ㎎ ㎏-1로 가장 높았고, 벌개미취와 망초, 달맞이꽃은 각각 87.2 ㎎ ㎏-1, 81.9 ㎎ ㎏-1, 66.6 ㎎ ㎏-1 이었다(Table 3). 지상부의 아연함량은 벌개미취에서 100.0 ㎎ ㎏-1으로 가장 높았고, 그 다음 망초(98.5 ㎎ ㎏-1), 질경이(94.0 ㎎ ㎏-1), 돼지풀(89.7 ㎎ ㎏-1), 쑥(61.4 ㎎ ㎏-1), 개망초(40.9 ㎎ ㎏-1), 달맞이꽃(17.9 ㎎ ㎏-1) 순이었다. 조사된 식물의 아연 이동계수는 달맞이꽃을 제외하고 모두 1 이상이었다. 특히 돼지풀의 이동계수는 2.87로 흡수한 아연의 지상부 전이도가 조사된 식물 중에서 가장 높았고, 나머지는 1.02~1.27 사이로 확인되었다.
Table 3.
Concentrations of zinc (㎎ ㎏-1) in shoots and roots and translocation factor (TF) of seven plant species grown in soils contaminated by heavy metalsz.
| Root | Shoot | TFy | |
| Plantago asiatica |
104.8 ± 48.3 (62.9 - 182.0)x |
94.0 ± 34.4 (65.0 - 140.0) |
1.02 ± 0.55 (0.54 - 1.88) |
| Erigeron annuus |
37.3 ± 11.2 (22.9 - 45.6) |
40.9 ± 7.2 (29.8 - 49.0) |
1.22 ± 0.52 (0.65 - 1.88) |
| Ambrosia artemisiifolia |
33.6 ± 13.5 (16.0 - 46.9) |
89.7 ± 15.8 (64.1 - 106.0) |
2.87 ± 0.89 (1.87 - 4.01) |
| Conyza canadensis |
81.9 ± 15.6 (62.0 - 97.2) |
98.5 ± 23.4 (69.5 - 134.0) |
1.27 ± 0.48 (0.72 - 1.94) |
| Artemisia princeps |
55.0 ± 7.3 (47.6 - 65.5) |
61.4 ± 7.8 (53.6 - 73.5) |
1.12 ± 0.07 (1.04 - 1.20) |
| Oenothera odorata |
66.6 ± 18.7 (48.1 - 97.9) |
17.9 ± 1.8 (15.1 - 19.9) |
0.28 ± 0.06 (0.19 - 0.34) |
| Aster koraiensis |
87.2 ± 26.6 (62.5 - 126.0) |
100.0 ± 26.0 (73.1 - 138.0) |
1.20 ± 0.36 (0.83 - 1.70) |
zSamples were collected from mine tailing area. The zinc content of the mine tailing area soil was 2,042.2 ㎎ ㎏-1 (Chun et al., 2021). Data are means (n = 5) ± standard deviations.
본 연구에서 전반적으로 아연의 이동계수는 비소의 이동계수 보다 높게 나타났다. 이동계수는 뿌리로부터 다른 기관 특히 종자로의 중금속 전이를 방지하기 위한 식물체의 총체적 노력을 의미하며 대부분 1 이하의 값을 나타내지만 이 값이 1보다 큰 경우에는 식물체가 해당 오염원에 적극적으로 대항하지 않고 이용하기 위하여 축적한다고 알려져 있다(Antoniadis et al., 2017). 중금속과 준금속은 대사 반응에 참여하고 미량 영양소(예: Cu, Zn, Mn, Fe, Ni, 및 Mo)로 작용하여 식물 발달에 중요한 역할을 할 수 있지만 한계 농도를 초과할 때는 식물의 생장과 발달을 저해하는 것으로 간주된다(Hänsch and Mendel, 2009). 모든 생명체의 세포 기능에 참여하는 아연은 결핍되면 식물의 성장 저하, 잎의 황백화, 불임 등의 원인이 되는 미량 영양소로, 본 연구에서 식물체들은 지하부로부터 지상부로의 아연 이동에 적극적으로 저항하지 않는 것으로 나타났다(Al Jabri et al., 2022; Broadley et al., 2007). 반면 비소, 카드뮴, 크롬(VI), 수은 및 납과 같은 중금속은 매우 낮은 농도에서도 독성을 나타내는 중금속으로 식물체는 능동적으로 이러한 독성 중금속의 지상부로의 전이를 억제하기 때문에 본 연구에서도 비소의 이동계수는 낮게 유지되는 것으로 나타났다(Rahman and Singh, 2019).
무기성분 특성
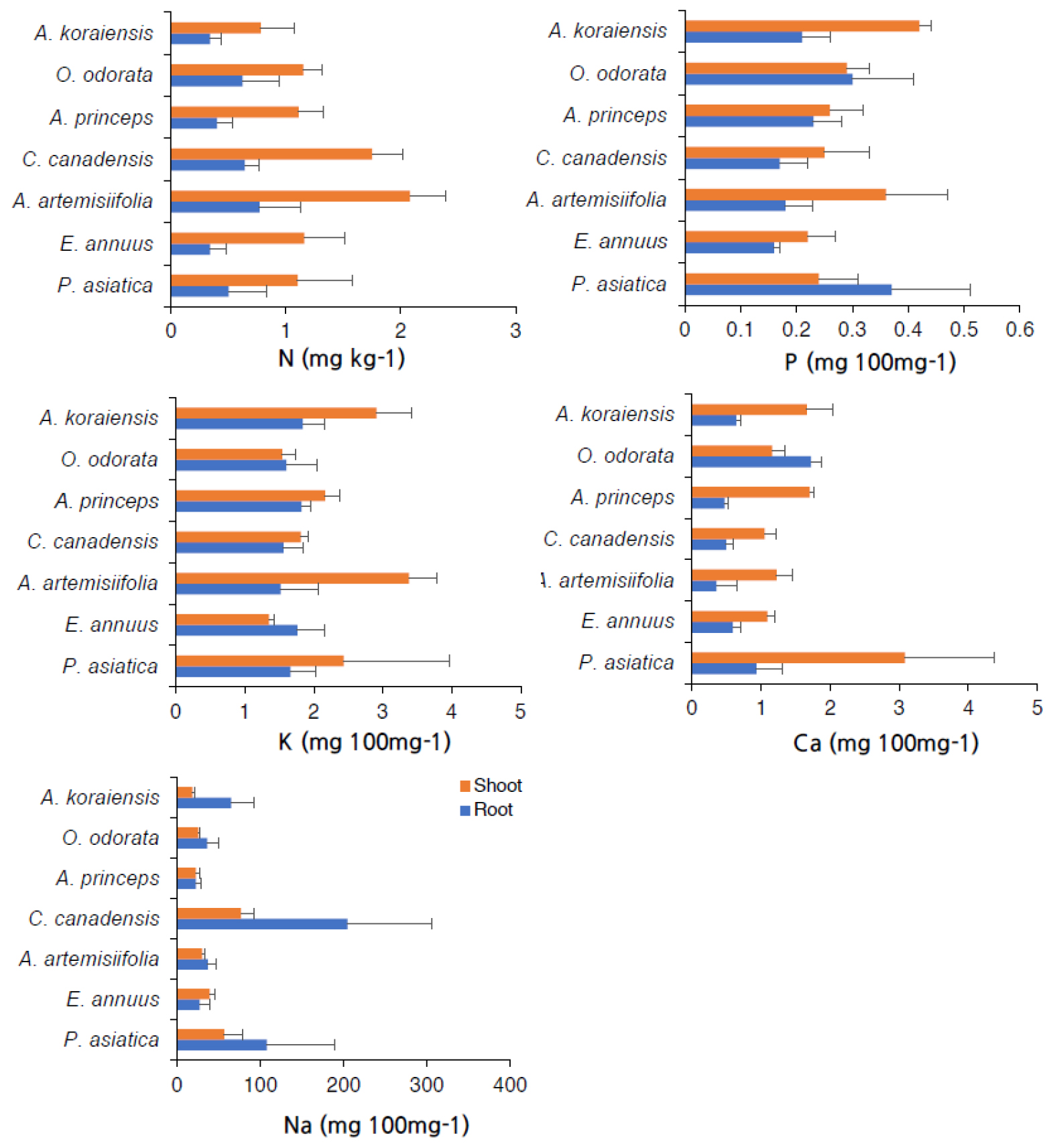
중금속으로 오염된 폐광산의 갱미 토양에서 자란 식물체의 무기성분 함량을 분석한 결과는 Fig. 4에 나타내었다. 지하부의 질소함량은 돼지풀이 0.77 ㎎ ㎏-1로 가장 높았고, 망초와 달맞이꽃이 각각 0.64 ㎎ ㎏-1, 0.62 ㎎ ㎏-1 이었다. 지상부의 질소함량도 돼지풀에서 2.08 ㎎ ㎏-1로 가장 높았고, 그다음이 망초(1.75 ㎎ ㎏-1), 개망초(1.16 ㎎ ㎏-1), 달맞이꽃(1.15 ㎎ ㎏-1), 쑥(1.1 ㎎ ㎏-1), 질경이(1.1 ㎎ ㎏-1), 벌개미취(0.78 ㎎ ㎏-1) 순이었다. 인 함량은 지하부는 질경이에서 0.37 ㎎ 100 ㎎-1로 가장 높은 반면 지상부는 벌개미취에서 0.42 ㎎ 100 ㎎-1로 가장 높았다. 칼륨 함량은 지하부의 경우 가장 높은 벌개미취와 가장 낮은 돼지풀에서 각각 1.84 ㎎ 100 ㎎-1, 1.52 ㎎ 100 ㎎-1로 식물 간에 큰 차이가 없었으나 지상부의 경우 가장 높은 돼지풀이 3.38 ㎎ 100 ㎎-1인 반면 가장 낮은 개망초는 1.3 ㎎ 100 ㎎-1로 확인되었다. 지하부의 칼슘 함량은 달맞이꽃이 1.72 ㎎ 100 ㎎-1로 다른 식물들(0.35~0.93 ㎎ 100 ㎎-1)에 비해 높았고, 지상부의 칼슘 함량은 질경이가 3.08 ㎎ 100 ㎎-1로 다른 식물들(1.05~1.70 ㎎ 100 ㎎-1) 보다 높게 분석되었다. 지하부의 나트륨 함량은 망초가 204.6 ㎎ 100 ㎎-1으로 쑥(22.1 ㎎ 100 ㎎-1), 개망초(26.7 ㎎ 100 ㎎-1), 달맞이꽃(35.9 ㎎ 100 ㎎-1), 돼지풀(36.6 ㎎ 100 ㎎-1) 보다 5.6~9.3배 더 높았다. 지상부의 나트륨 함량도 망초에서 76.5 ㎎ 100 ㎎-1로 가장 높았고, 그 다음이 질경이(56.3 ㎎ 100 ㎎-1), 개망초(39.0 ㎎ 100 ㎎-1) 순이었다.
식물체 내에서 알칼리 금속이나 질소, 인과 같은 무기 영양소는 효소활성, 기공작용, 세포 전기적 중성 등 식물의 생장과 발달에 필수적이다. 알칼리 금속과 중금속은 식물 세포내의 결합 사이트에 대해 경쟁하여 이온 농도의 불균형을 초래하고 결과적으로 전기적 중성에 영향을 미칠 수 있는 것으로 알려져 있으며, 특히 칼륨은 중금속과 뿌리 세포벽에서의 결합 사이트 경쟁으로 중금속 흡수를 줄인다는 보고(Zhang et al., 2022)가 있다. 또한 알칼리 금속에 의한 토양 pH의 증가로 중금속의 용해도가 감소하여 식물체의 중금속 흡수 가능성이 줄어든다는 연구(Rengel et al., 2015)도 보고되었다. 본 연구에서 비소나 아연과 같은 중금속 농도가 높은 폐광산 토양에서 자란 식물체는 뿌리 부근에서 Na+, K+, Ca2+와 같은 알칼리 금속 이온 및 여러 전하를 갖는 NH4+, NO3- 또는 P2O4, PO43-와 같은 질소나 인의 원자단이 중금속 이온과 식물체 뿌리 세포벽에서 전기적으로 중성을 유지하기 위해 경쟁 반응한 결과에 따라(Whalen et al., 2021) 뿌리에서의 흡수율이 차이가 나타나는 것으로 분석되었다. 한편 본 연구에서는 지하부보다 지상부에서 질소, 인, 칼륨과 칼슘의 함량이 높은 경향을 보였다. 지하부에서는 비소와 아연과 같은 중금속 이온과의 경쟁으로 인과 칼륨 및 질소와 칼슘의 흡수가 제한되거나 중금속 이온으로 치환되어 상대적으로 낮은 농도를 유지하는 것(Qin et al., 2020)으로 예상된다. 반면, 나트륨은 지상부보다 지하부에서 높게 나타났는데, 이는 나트륨이 대부분의 식물체의 필수 원소가 아니며 식물체 세포질에 Na+가 축적되면 세포질 대사를 방해하기 때문에(Tester and Davenport, 2003) 지상부로의 이동이 억제된 것으로 판단된다.
본 연구에서 폐광산에서 자생하는 식물들의 아연 이동계수는 대부분 1 이상으로 나타났으나 치명적 독성을 가진 비소의 이동계수는 낮게 유지되고 있어 중금속 오염지의 정화 용도에 활용이 제한적인 것을 확인할 수 있었다. 따라서 식물체의 독성 중금속의 이동계수를 높이는, 즉 독성 중금속의 방어 기작을 회피할 수 있는 다양한 연구로 이들의 지하부에서 지상부로의 이동을 촉진할 수 있도록 한다면 식물을 이용한 중금속 오염지 정화에 더욱 유효할 것으로 판단된다. 또한, 폐광산을 비롯한 국내의 다양한 오염지를 대상으로 한 추가적인 식물자원 특성 조사는 이러한 가능성을 더욱 더 높여줄 수 있을 것으로 기대된다.
적 요
본 연구는 오염지 환경복원 소재 개발을 위해 중금속으로 오염된 폐광산에서 자생하는 7종의 식물을 대상으로 생장 특성과 중금속 축적 및 전이 특성, 무기질 특성을 비교 분석하였다. 쑥을 제외한 식물의 초장은 오염환경에서 감소하였으나 건중량은 감소하지 않았고, 특히 개망초의 건중량은 오염토양에서 자란 식물체에서 1.2~2.3배 더 증가하였다. 독성 중금속인 비소의 지하부 축적량은 망초와 벌개미취, 쑥에서 94.3~136.7 ㎎ ㎏-1로 높았으나 지상부로의 이동계수는 모든 식물에서 1 이하로 흡수한 비소의 대부분을 지하부에 축적하는 것으로 분석되었다. 반면 아연 축적량은 질경이와 벌개미취, 망초에서 높았고, 이동계수가 대부분 1 이상으로 지상부 전이도가 높았다. 무기성분은 대부분의 식물에서 질소와 인, 칼륨, 칼슘 함량은 지하부보다 지상부에서 높은 반면 나트륨 함량은 지상부보다 지하부에서 높았다.