서 언
재료 및 방법
시험재료
종자 수분흡수율 측정
종자 발아특성 조사
왜당귀 유묘 생육특성 조사
왜당귀 유용성분 분석
통계분석
결과 및 고찰
종자 수분흡수율
GA3 농도 및 온도에 따른 발아특성
GA3 농도별 생육특성
GA3 농도별 유용성분 특성
적 요
서 언
왜당귀[Angelica acutiloba (Siebold & Zucc.) Kitagawa]는 산형과(Apiaceae), 당귀속(Angelica)에 속하는 식물로 약재명으로 일당귀라고 불리며, 국내에서는 참당귀(A. gigas)와 더불어 많이 재배되는 약용작물 중 하나이다(Choi et al., 2015; Lee, 2003; Lee et al., 2020a). 당귀류는 우리나라를 비롯하여 중국, 일본에서도 약재로 사용하고 있는데 한국에서는 참당귀, 중국에서는 중국당귀(A. sinensis), 일본에서는 왜당귀를 그 기원으로 하고 있다(Kim et al., 2011).
최근 국민 생활수준 향상과 코로나 19 팬데믹으로 인해 건강과 면역력 향상에 도움이 되는 건강 기능성 식품에 대한 관심이 높아지면서, 약재 및 기능성 채소류의 소비도 증가하는 추세이다(Lee and Kim, 2021). 약재로 사용되는 왜당귀 뿌리의 추출물은 사이토카인(cytokine), 케모카인(chemokine) 등 염증매개물질 억제를 통한 항염증 효과(Han, 2013), 항암제로 사용되는 사이클로포스파마이드(cyclophosphamide)의 백혈구 수 감소 억제 효능 및 항산화 효과(Cho et al., 2017; Kang et al., 2003; Lee, 2008) 등 의약분야를 비롯하여 피부의 섬유아세포(fibroblasts)에서 콜라겐 합성 촉진과 분해 억제를 통한 광노화 예방과 같은 미용분야에서도 다양한 효능이 알려져 있는데(Kang et al., 2015; Park et al., 2017), 주요성분으로는 ligustilide, n-butylidenephthalide 등이 알려져 있다(Han et al., 1998; Kim et al., 2009). 또한 왜당귀의 어린 잎과 줄기 등 지상부는 조단백질 함유량이 높고, 포도당 생산에 관여하는 α-gucosidase의 저해활성으로 혈당 조절에 효능이 있으며, 독특한 향을 가지고 있어 쌈채소나 장아찌용으로 판매량이 지속적으로 증가하고 있다(Choi et al., 2017; Eom et al., 2021). 그러나 최근 기후변화에 따른 이상기온 등으로 왜당귀 국내 생산량은 2017년 기준 622 톤에서 2021년 250 톤으로 급격히 감소함으로써 국내 수요 충족을 위해 수입량이 증가하고 있는 실정이다(MAFRA, 2022).
지베렐린(GA)은 식물의 종자발아, 지상부 생육, 화분의 성숙 및 조기 개화 등 여러 발달과정을 유도하는 기능이 밝혀져 다양한 작물의 효율적인 재배 및 생산을 위해 활용되고 있는 식물 생장조절 호르몬이다(Achard and Genschik, 2009; Schwechheimer, 2012). 지금까지 GA를 활용하여 억새, 제비꽃속(Viola)의 종자 발아율 개선, 서어나무 장기저장 종자의 휴면타파(Yook et al., 2019; Kwon et al., 2020; Han et al., 2019), 게발선인장의 생육촉진 및 개화유도(Lee et al., 2020b), 흑노호(Kadsura coccines)의 발아 및 생육촉진(Je et al., 2023), 블랙베리의 무핵화(Jeong et al., 2018) 등 다양한 식물을 대상으로 발아율 향상과 생산량 증대를 위한 재배관련 연구가 수행된 바 있다. 그러나 당귀속 식물의 경우 지금까지 참당귀 종자 생리 관련 연구를 비롯하여 왜당귀의 적정 발아온도 및 광조건에 대한 연구결과 정도가 보고되었을 뿐, 왜당귀의 효율적 재배와 생산기술 개발을 위해 GA3 등 작물에 흔히 사용되는 식물생장조절제를 처리한 후 효과를 구명한 연구는 수행된 바 없다(Lee et al., 2012; Moon et al., 2003; Yu et al., 1995). 이에 본 연구는 현재 약용 또는 식용으로 널리 재배되는 왜당귀를 대상으로 GA3처리에 따른 종자 발아특성, 유묘의 생육 및 유용성분 특성을 분석함으로써 왜당귀의 생산 효율성과 활용성을 증진하고 최적 재배기술을 확립하고자 수행되었다.
재료 및 방법
시험재료
본 연구를 위해 강원도 태백시에 소재한 재배 농가에서 2021년 10월에 채종한 왜당귀 종자를 영하 2℃의 저온저장고에 보관하였다가 2022년 2월 충실종자를 선별하여 실험에 활용하였다. 선별된 왜당귀 종자의 평균 길이는 5.07 ± 0.42 ㎜, 너비는 1.70 ± 0.25 ㎜, 두께는 0.74 ± 0.21 ㎜였다.
종자 수분흡수율 측정
침지시간에 따른 왜당귀 종자의 수분흡수율 추정을 위해 먼저 100립씩 5반복으로 건조종자의 무게를 측정하고, 종자를 증류수에 침지한 후 최초 1일은 2시간 간격, 이후 3일간은 24시간 간격으로 종자 무게를 반복 측정하였다. 이때 종자 내부로 흡수된 수분량만을 추정하고자 종자 표면의 수분은 매번 필터페이퍼로 모두 제거한 후 고정밀 분석용 저울(PAG214C, ohaus co., USA)을 이용하여 0.001 g 단위까지 무게를 측정하였다. 이를 바탕으로 Baskin and Baskin (2003)의 공식을 통해 왜당귀 종자의 수분흡수율(Percent of moisture absorption)을 산출하였는데 그 공식은 아래와 같다.
Ws : 무게 증가율, Wh : 각 시간별 생중량, Wi : 종자 초기 건중량
종자 발아특성 조사
GA3 농도와 온도에 따른 발아특성을 확인하기 위해 충실한 왜당귀 종자를 선별, 증류수에 48시간 침지과정을 거친 후 GA3 농도별 용액(0, 50, 100, 500, 1,000 ㎎/L)에 처리군별 24시간 추가 침지하였다. 이후 NaOCl 2% 용액에 5분간 소독한 뒤 증류수로 3회 이상 세척하였다. 이후 90 × 15 ㎜ petridish에 GA3 처리농도별 왜당귀 종자 20립씩 각각 치상하여 온도 5, 10, 15, 20, 25, 30℃ 총 6구간에 3반복으로 종자다온도발아기(NL/50080000, Seed Processing Holland BV, Netherlands)에 넣고 암조건 하에서 발아특성을 관찰하였다. 조사기간 동안 petri dish 내부가 마르지 않도록 증류수를 정기적으로 보충하였다. 종자 발아 여부의 기준은 유근이 5 ㎜ 이상 발달하였을 때로 하였고, 매일 발아 종자 수를 조사하였다.
왜당귀 유묘 생육특성 조사
GA3 처리농도에 따른 왜당귀 유묘의 생육특성을 관찰하고자 발아특성 조사구와 동일한 방법으로 처리한 종자를 처리구별 30립씩 3반복으로 50구 양묘용 포트(가로 54×세로 28×높이 9 ㎝)에 원예용상토(Zeolite: 4%, Pearlite: 7%, Vermiculite: 6%, Cocopeat: 68%, Peat moss: 14.73%, Organic fertilizer: 0.201%, Humectant: 0.064%, pH regulator: 0.005%)를 채워 파종한 후 온실에서 재배 관리 하였다. 2개월 뒤 발아한 개체들 중 처리구별 무작위로 20개체를 선발하여 지상부(유묘 높이, 잎 길이, 너비, 수) 및 지하부(뿌리 길이 및 직경)의 1차 생육특성을 측정하였으며, 이후 보다 큰 포트에 이식하여 기르면서 파종 4개월 후(2차)와 6개월(3차) 후 시점에서 동일한 방법으로 생육특성을 반복 조사하였다.
왜당귀 유용성분 분석
3차 생육특성조사 후 식물체의 지하부에 대한 유용성분을 분석하였다. 지하부를 세척 후 열풍건조기(DY-420H, Lassele, Korea)를 이용하여 40℃에서 72 시간동안 건조 후 분쇄하였고, 건조분말 10 ㎎과 98% 에탄올 1 mL를 혼합하여 15 - 35℃에서 30분 동안 초음파 추출한 후 여과된 추출물을 사용하였다. 고정상은 Mightysil RP-18 GP (5 ㎛, 4.6 × 250 ㎜), 이동상은 H2O와 acetonitrile을 7:3 비율로 혼합하여 사용하였다. 왜당귀의 유용성분인 (Z)-Ligustilide는 한약진흥재단 천연물물질은행(Gyeongsan, Korea)으로부터 분양받았으며, 동시분석 조건은 Table 1과 같다.
Table 1.
HPLC conditions applied for analysis of A. acutiloba
통계분석
처리별 생육특성 및 유용성분 값은 IBM statistics 26(IBM Corp., New York, USA) 프로그램을 사용하여 일원배치분산분석(One-way ANOVA)과 Duncun’s Multiple Range Test (DMRT)를 수행하여 유의수준 5% (p < 0.05)으로 검증하였다.
결과 및 고찰
종자 수분흡수율
왜당귀 종자의 수분흡수율은 Fig. 1과 같다. 건조 종자 100립의 평균 무게는 0.264 ± 0.019 g이였으며, 증류수에 종자를 침지한 후 2시간이 경과한 시점에서 평균 0.424 ± 0.028 g으로 증가하여 수분흡수율이 62.07%로 산출되었다. 이후 침지 12시간까지 2시간 단위로 5%에서 10%씩 수분흡수율이 증가하다가 침지 48시간이 경과한 시점에서 평균 0.583 ± 0.019 g으로 122.15%의 수분흡수율을 나타냈다. 다만 침지 72시간이 지난 시점의 수분흡수율이 121.06%로 48시간 이후 대비 약 1.1% 감소한 것은 침지 후 종자에 묻은 수분 제거 과정에서 발생한 오차에 의한 것으로 사료된다(Fig. 1).

Fig. 1.
The moisture absorption rate of A. acutiloba seeds, incubated at ordinary temperature (20 ± 5℃) in distilled water for 72 h. zValues followed by different letters within a column indicate significant difference (p < 0.05) between substrates for that parameter using DMRT (Duncan’s Multiple Range Test), (n ≥ 5, mean ± SD).
종자 발아를 저해하는 휴면기작은 종피의 불투수성 등에 의한 물리적 휴면(physical dormancy), 종자 내 발아억제물질로 인한 생리적 휴면(physiological dormancy), 탈리시 미숙배를 가지는 형태적 휴면(morphological dormancy), 형태적·생리적 휴면이 동시에 나타나는 형태생리적 휴면(morphophysiological dormancy), 물리적·생리적 휴면이 동시에 나타나는 조합휴면(combinational dormancy) 등 크게 5가지로 구분되는데(Baskin and Baskin, 2003; Baskin and Baskin, 2004), 동일 과(Family) 또는 속(Genus)의 분류군들도 지리적 위치와 생태적 특성에 의해 휴면기작의 종류와 그 정도가 다르게 나타난다(Park et al., 2019).
본 연구 결과 왜당귀의 종자는 침지 후 비교적 짧은 시간 내에 높은 수분흡수율을 나타내어 두꺼운 종피나 세포벽의 불투수성에 의한 물리적 휴면(morphological dormancy)의 영향은 거의 없는 것으로 판단된다. 또한 Lee et al. (2020a)은 왜당귀 종자 발달 기간에 따른 발아율을 조사한 결과 개화 후 50일이 지난 시기부터는 양호한 발아율을 나타낸다고 한 바, 생리적 휴면(physiological dormancy) 특성도 크지 않다고 생각된다. 이러한 결과로 미루어 볼 때 왜당귀 파종 시 별도의 종자 휴면타파 처리는 필요하지 않으며, 파종 전 최소 48시간 수분 침지를 수행할 경우 충분한 양의 수분이 종자 내부로 흡수됨으로써 발아 효율성을 높일 수 있을 것으로 판단되었다.
GA3 농도 및 온도에 따른 발아특성
본 연구에서 관찰된 왜당귀의 발아특성은 Fig. 2과 같다. 5℃에서는 GA3 처리와 관계없이 발아가 진행되지 않았으며, 30℃에서는 무처리 대조구에서 18.33%의 낮은 발아율을 나타낸 반면 GA3의 농도가 증가함에 따라 발아율이 증가하는 것을 확인하였다.
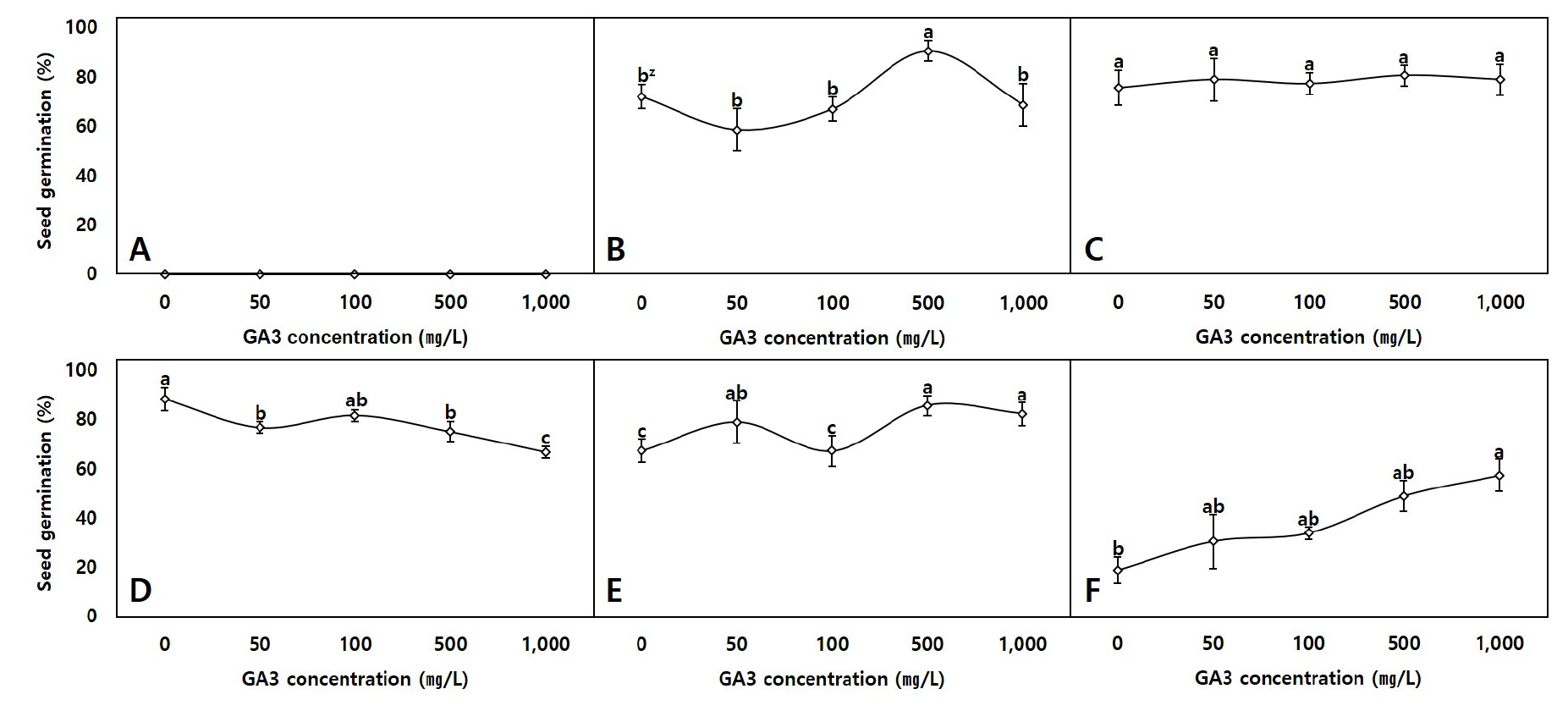
Fig. 2.
Seed germination characteristics of A. acutiloba to GA3 treatment conditions and temperatures. A. 5℃; B. 10℃; C. 15℃; D. 20℃; E. 25℃; F. 30℃. zValues followed by different letters within a column indicate significant difference (p < 0.05) between substrates for that parameter using DMRT (Duncan’s Multiple Range Test), (n ≥ 3, mean ± SD).
종자의 발아에서 중요한 배(embryo)의 발달은 식물 종에 따라 충족되어야 하는 온도 조건이 상이하다(Baskin and Baskin, 2004). 식물의 종자는 유리한 환경이 조성될 때까지 발아의 시기를 스스로 조절하며, 적정온도 이하 또는 이상의 온도에서는 종자의 생리적 휴면(Physiological dormancy)이 유도된다(Geshnizjani et al., 2018). Moon et al. (2003)은 왜당귀의 적정 발아온도가 10℃ 에서 25℃ 사이라고 하였는데, 본 연구에서도 10 - 25℃에서 처리구별 모두 양호한 발아율을 보이며 선행 연구와 유사한 결과를 나타냈다. 또한 발아되지 않은 5℃의 처리구는 경우 적합하지 않은 온도로 저온에 의한 생리적 휴면이 진행되는 것으로 판단되었다.
한편 5℃ 처리구를 제외한 10·15·20·25℃ 조건에서는 GA3 농도에 따라 발아율이 증가하거나 감소하는 등의 차이가 명확히 관찰되지 않았다. 그러나 30℃에서는 GA3 무처리 대조구에서 18.33%의 낮은 발아율을 나타낸 반면, GA3 처리농도가 높아짐에 따라 발아율도 향상되어 GA31,000 ㎎/L 처리구에서는 56.67%까지 증가되었다. GA3는 식물체에서 휴면현상을 타파하는 신호전달물질로 작용하며, α-amylase 분비를 촉진해 배유(endosperm)의 전분이나 단백질 가수분해를 통해 종자의 발아를 유도하는 것으로 알려져 있다(Chen and Chang, 1972; Kim and Lee, 2013; Kim et al., 2009). 또한 GA3처리가 고온에서 아스파라거스, 자소엽, 애기닥나무 등의 종자 발아율을 증가시키는 결과를 미뤄볼 때(Dhoran and Gudadhe, 2012; Kim et al., 2022; Lee et al., 2001) 왜당귀는 통상적으로 알려진 발아의 적정온도인 10℃에서 25℃보다 높은 30℃ 조건에서 고온스트레스에 따른 종자 휴면현상이 일부 나타났으나 배 발달과 휴면타파 효과가 있는 GA3의 생리적 기능에 의해 해당 장애가 완화되어 나타난 결과로 사료된다(Finch-Savage and Leubner-Metzger, 2006).
GA3 농도별 생육특성
GA3 처리농도별 왜당귀의 생육특성은 파종 후 2개월, 4개월, 6개월이 지난 시점에서 총 3회에 걸쳐 측정하였으며 그 결과는 Fig. 3, 4과 같다. 파종 2개월 후 측정한 1차 생육특성 조사결과에서는 처리구별 생육차이가 명확하게 나타나지 않았는데, 유묘 높이는 평균 4.42 ~ 4.50 ㎝, 잎길이는 평균 2.48 ~ 2.74 ㎝, 잎너비는 평균 2.64 ~ 2.87 ㎝ 등으로 조사되었고, 뿌리직경에서 약간의 생육차이를 확인할 수 있었다. 반면 파종 후 4개월과 6개월 차에 측정한 2차, 3차 생육특성 조사에서는 측정된 모든 지상부와 지하부의 생육특성에서 GA3 처리농도 증가에 따른 생육 차이가 확인되었다. 즉 2차 측정부터는 유묘 높이, 잎길이 및 너비, 잎 수, 뿌리직경 등 모든 생육특성에서 GA3 500 ㎎/L 처리구와 1,000 ㎎/L 처리구가 가장 높은 생육량 증가를 나타냈고, 3차 측정시 생육특성 차이가 더욱 명확히 나타나 대조구 대비 GA3 농도 증가에 따른 생육량 증대 효과가 확인되었다.
GA는 tetracyclic diterpenoids로서 줄기신장, 잎팽창, 개화시기 조절 등 식물생장의 다양한 발달과정에 영향을 미치는데(Salazar-Cerezo et al., 2018; Zi et al., 2014) 애기장대를 대상으로 수행된 뿌리생장 촉진 실험(Fu and Harberd, 2003), 배풍등, 시호 등의 지상부 및 지하부 생육량 변화 실험(Lee et al., 2002; Lee et al., 2014), 딸기, 토마토, 오렌지 열매의 생육촉진 낙과 억제 실험(Hifny et al., 2017; Paroussi et al., 2002; Tomar et al., 2016) 등의 연구에서 대조구 대비 GA3 처리구의 우수한 생육특성 또는 열매의 크기 증가, 낙과율의 감소와 같은 효과가 보고되었다.
본 연구에서도 파종 4개월 후의 2차 및 6개월 후인 3차 생육측정 결과에서 대조구 대비 GA3의 농도 증가에 따라 생육량이 증가하는 것을 확인함으로써 선행연구와 유사한 결과가 나타났다. Lee et al. (2014)은 GA3 처리에 따른 배풍등의 발아 및 생육특성 연구에서 유묘의 생육 차이는 발아기간의 단축 또는 지연에 기인한다고 보고하였다. 그러나 본 연구에서는 발아 후 출엽된지 얼마되지 않은 1차 생육특성에서는 GA3농도별 유묘 생육에 큰 차이가 확인할 수 없었으나 4개월이 지난 2차 생육특성부터 생육량의 차이가 관찰되었다. 이는 앞서 서술한 Lee et al. (2014)의 고찰보다는 왜당귀의 경우 세포핵에 위치하는 DELLA 단백질들의 생장억제 기능에 대한 GA의 억제효과와 이러한 기능을 통한 뿌리 발달 및 줄기 신장, 화분의 성숙 등 식물의 여러 생육단계에 관여하는 생리적 기능에 의해 생육량이 증가하는 것으로 사료되며(Achard and Genschik, 2009; Davière and Achard, 2013), 연구의 결과를 미뤄볼 때 왜당귀 생육촉진을 위한 GA3 처리농도는 500 ㎎/L 또는 1,000 ㎎/L가 적정하다고 판단된다.
GA3 농도별 유용성분 특성
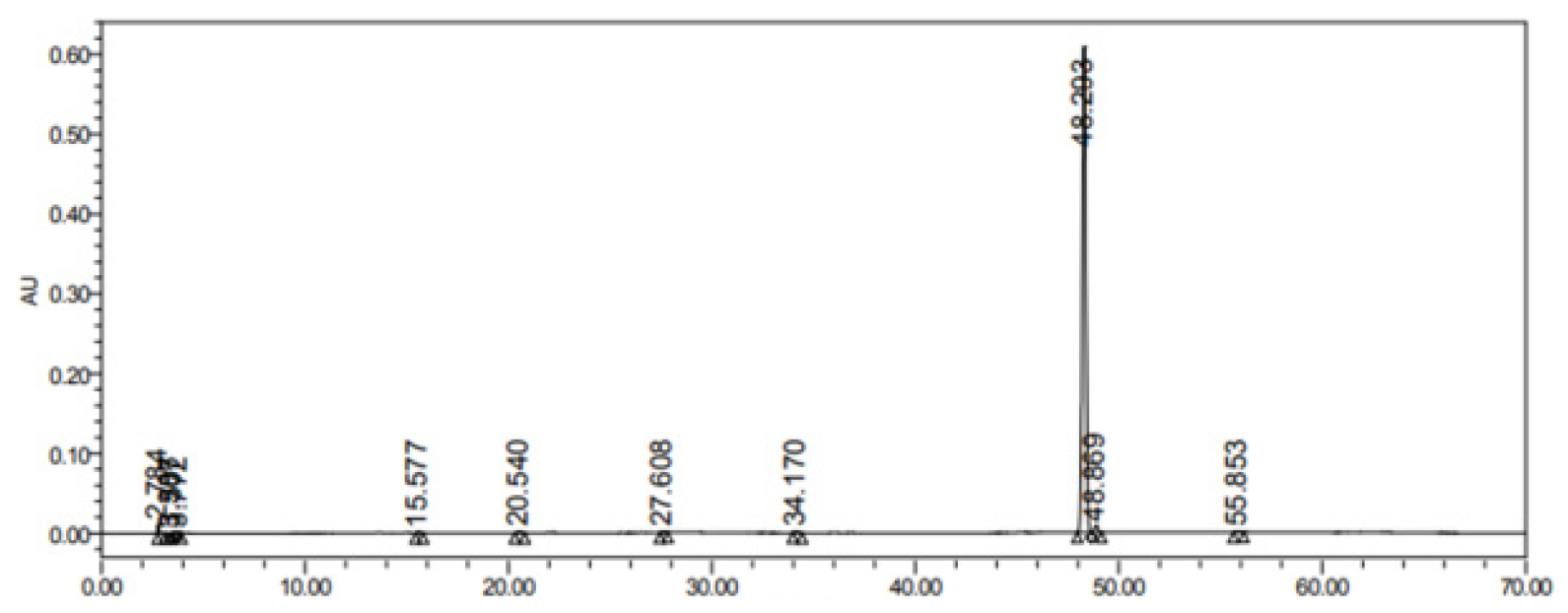
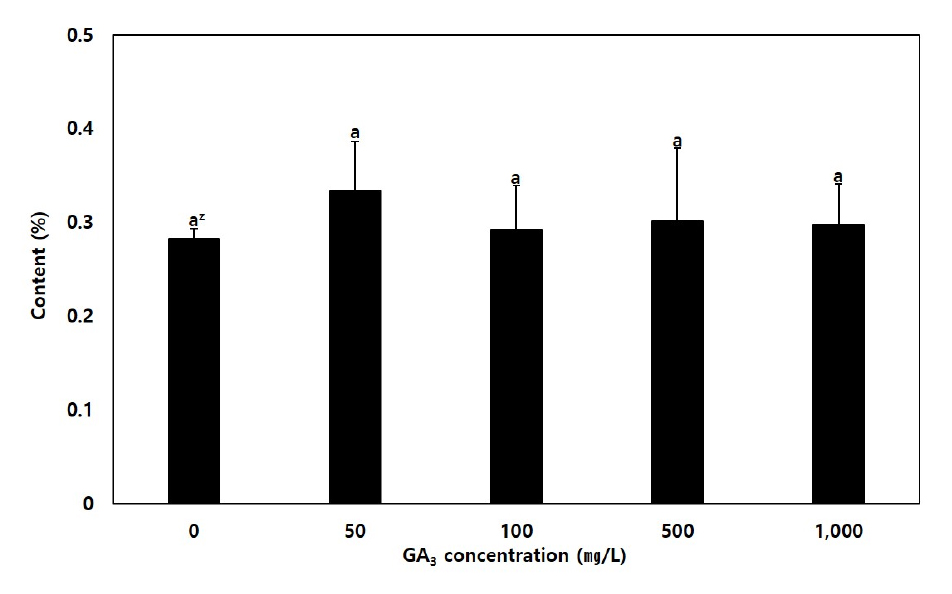
왜당귀의 유용성분인 (Z)-ligustilide의 표준 HPLC크로마토그램을 분석한 결과 48.203분에 검출되었는데(Fig. 5), 이를 기준으로 할 때 GA3처리농도별 왜당귀 지하부의 (Z)-ligustilide 함량은 처리간 유의한 차이는 나타나지 않았다(Fig. 6).
식물을 대상으로한 지베렐린의 처리는 주로 생육촉진을 통한 효율적인 재배 및 생산이 목적이다(Achard and Genschik, 2009; Schwechheimer, 2012). Ozkan et al. (2016)은 재배종 체리를 대상으로 GA3의 분무처리를 통해 열매의 크기, 색도 및 경도에 등과 같은 생육특성의 향상효과를 확인하였으나 페놀화합물이나 안토시아닌 같은 유용성분 함량에 대해서는 대조구와 처리구의 차이가 미미하거나 오히려 감소하였다고 보고하였다. 또한 Rohamare et al. (2013)은 향신료로 사용되는 Trachyspermum ammi L.을 대상으로 한 GA3 엽면시비 실험결과 생육량의 증가와 잎에 함유된 에센셜오일 중 p-Cymene, γ-Terpinen가 감소하는 경향을 보고하였다. 본 연구에서도 GA3의 처리를 통해 발아율이나 생장량과 같은 생육특성은 개선되었으나 왜당귀의 유용성분인 (Z)-ligustilide의 함량에 대해서는 뚜렷한 효과를 확인할 수 없었다.
적 요
왜당귀[Angelica acutiloba (Siebold & Zucc.) Kitagawa]를 대상으로 종자 발아 및 유묘 생육, 유용성분 함량과 관련된 GA3 처리 효과를 분석하여 왜당귀 재배시 기초자료를 제공하고자 하였다. 왜당귀 종자의 수분흡수율은 침지 2시간이 경과한 시점에서 62.07%를 나타냈고, 48시간이 경과한 시점에서 122.15%로 가장 높은 값을 나타냈다. 왜당귀 종자의 적정 발아온도는 10℃에서 25℃로 확인되었으며, 5℃에서는 발아가 진행되지 않았고, 30℃에서는 GA3 농도가 증가함에 따라 발아율이 유의하게 증가하였다. 또한 유묘 생육은 GA3 처리농도가 높아질수록 양호하였으나 유용성분 함량의 경우 실험구에 따른 유의성이 확인되지 않았다. 이러한 결과는 약용 및 식용으로 활용성이 높은 왜당귀에 대한 최적 재배와 생산기술 정립에 기초자료로 활용할 수 있을 것으로 판단된다.