서 언
재료 및 방법
실험재료 및 추출물 조제
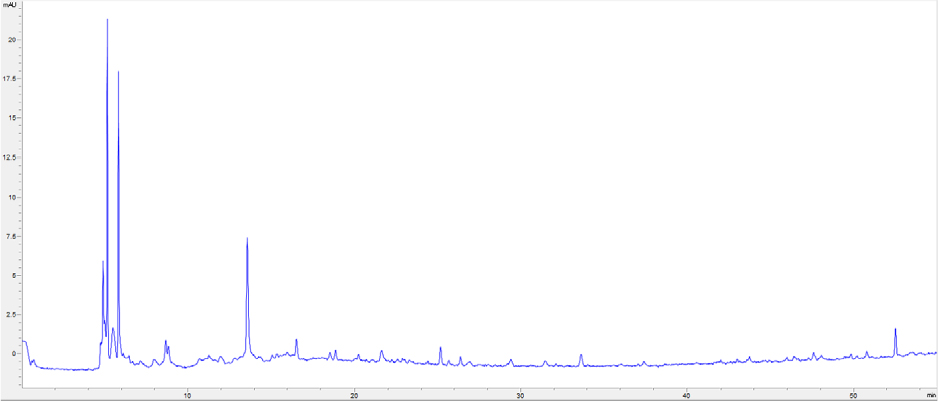
High-performance liquid chromatography (HPLC) 분석
세포배양 및 MTT assay
Nitric Oxide 생성량 측정
Prostaglandin E2와 cytokine 생성량 측정
Western blot analysis에 의한 단백질 발현 분석
통계 처리
결과 및 고찰
추출물 조제 및 HPLC 분석
세포생존에 미치는 LRE 및 LPS-PG의 영향
iNOS 발현 및 NO의 생성에 미치는 LRE의 영향
COX-2 발현 및 PGE2의 생성에 미치는 LRE의 영향
염증성 사이토카인의 생성에 미치는 LRE의 영향
NF-κB 신호전달계에 미치는 LRE의 영향
NQO-1/Nrf2 경로를 통한 LRE의 항산화 효과
적 요
서 언
치주질환은 구강 내에 상재하는 세균에 의해 자주 발생하고 그 중 Porphyromonas gingivalis가 주요 원인균인 것으로 보고되고 있다(Armitage, 1999; Hajishengallis and Lamont, 2014). 치주질환 병소에서 증식하고 열구상피에 침투하는 그람 음성 혐기성 간균인 P. gingivalis는 여러 염증성 대사산물을 생성함으로써 치주조직에 손상을 입히고 이 과정에서 치주조직의 파괴와 치조골의 재흡수가 유발되어 치아가 상실되기도 한다(Noda et al., 2007; Sreenivasan and Gaffar, 2008). 그람 음성세균 세포벽의 내독소인 lipopolysaccharide (LPS)는 숙주의 면역세포의 자극을 유발하여 염증반응을 유발한다(Graves et al., 2001; Kim et al., 2021; Kocgozlu et al., 2009). 치주조직을 구성하는 세포 중 하나인 인체 치은섬유아세포(human gingival fibroblast)에서 P. gingivalis로부터 분리된 내독소인 LPS는 Toll-like receptor (TLR)와 반응하여 myeloid differentiation primary response gene 88 (MyD88)/nuclear factor-κB (NF-κB) 신호전달 경로를 활성화하여 염증성 매개물질 및 싸이토카인을 생성하는 것으로 보고되어 있으며, 특히 이들 염증성 매개물질 및 싸이토카인들의 활성을 조절하는 것이 치주염 개선에 중요한 과정이라고 할 수 있다(Li et al., 2017; Seo and Jeong, 2020).
Nuclear factor E2-related factor 2 (Nrf2)는 phase II 해독, 항산화효소를 암호화하는 세포 보호 유전자의 발현을 조절하는 주요한 인자로 산화스트레스가 발생할 경우 활성 친전자체(reactiv electrophiles)를 중화시킴으로써 항산화의 역할을 담당하며, antioxidant response element(ARE)에 결합하여 NAD(P)H: quinine oxidoreductase 1(NQO1), hemeoxygenase 1 (HO-1), glutathione reductase 등 항산화 효소들의 발현을 증가시킨다(Kang et al., 2005). 평상시 Nrf2는 세포질에서 Kelch-like ECH-associated protein 1 (Keap1)에 의하여 비활성 되어 있다가 세포가 산화적 손상에 노출되면 Keap1으로부터 떨어져 나와 핵 안으로 이동하여 Maf 단백질과 이량체를 이루고, phase II와 산화방지 유전자의 promoter 영역의 antioxidant response element (ARE)에 결합함으로써 표적유전자의 전사를 조절한다(Lee and Surh, 2005). 항산화 효소 중 NAD(P)H: quinone dehydrogenase (NQO)-1은 세포질 내 존재하며 항산화작용을 통해 세포보호 작용을 하는 효소 중 하나로 퀴논의 대사과정에서 반응성이 높은 세미퀴논이 아니라 독성이 적은 하이드로 퀴논으로 변환을 함으로써 세포보호 능력을 보이는 것으로 알려져 있다(Ross et al., 2000).
연(Nelumbo nucifera)은 인도, 중국, 한국, 일본, 시베리아 지역의 못이나 늪지대에서 자라는 다년생 수초로, 잎의 높이가 1~1.5 m 이며 뿌리가 옆으로 길게 뻗고 원주형으로 마디가 많다(Borsch and Barthlott, 1983; Lim et al., 2020). 뿌리 및 줄기 부분은 식용으로 사용하는 연근(Lotus Root)으로 본초명으로는 우(藕)라고 하며, 예로부터 한방과 민방에서 맛은 달고 떫으며 성질이 차지도 덥지도 않아 죽으로 요리하여 장복하면 어혈을 풀어주며, 신경통이나 류마티즘 및 피로회복에 좋으며, 위장과 폐가 약하거나 출혈성 위궤양 및 위염에 효과가 있다고 알려져 있다(Ko et al., 2006; Ling et al., 2005; Xiao et al., 2005). 연근에 대한 생리활성에 관한 in vitro 연구로 고혈압 강화효과(Park et al., 2005b), 당뇨병 예방효과(Ko et al., 2006; Lee et al., 2001), 스트레스 저하효과(Won et al., 2004), 항암효과 및 신장보호 효과(Cho and Kim, 2003), 항산화 효과(Lee et al., 2006b), 고지혈증 예방효과(Lee et al., 2006a; Park et al., 2005a), 심혈관계 질환 예방효과(Quan, 2002) 등이 보고되어져 있으나, 치주질환 개선에 관한 연구는 아직 보고된 바 없다.
따라서 본 연구에서는 연뿌리(연근) 열수추출물이 치주염 원인균으로 알려져 있는 P. gingivalis의 내독소로 유도된 인체 치은섬유아세포 HGF-1에 미치는 항염증 및 항산화 효과의 생화학적 기전 해석을 조사하여 유의적인 결과를 얻었기에 이를 보고하는 바이다.
재료 및 방법
실험재료 및 추출물 조제
본 실험에 사용한 금은화 시료는 경상북도 영천에서 채취하여 완전 건조한 연뿌리(Lotus Root)를 농업회사법인 주식회사 두손애약초(Yeongcheon-si, Gyeongsangbuk-do, Republic of Korea)에서 구입하여 사용하였다. 연뿌리 열수추출물(water extract of Lotus Root, LRE)을 얻기 위하여 시료 무게의 10배에 해당하는 증류수로 100℃에서 3시간 동안 추출하였다. 열수추출물을 여과지(Whatman No. 3 filter paper, Whatman International Ltd., Maidstone, England)로 여과한 후 용매를 Rotary evaporator (Eyela, A-1000, Tokyo Rikakikai Co., Tokyo, Japan)를 이용하여 농축하고, 각 농축물은 동결 건조하여 분말화시켰다. 이후 열수추출물은 멸균 증류수에 100 ㎎/mL의 농도로 녹이고, Minisartⓡ Syringe filter (0.2 ㎛, Sartorius AG, Weender Landstr. Germany)로 거른 후 -20℃에서 보관하며 실험에 따라 적절하게 희석하여 사용하였다.
High-performance liquid chromatography (HPLC) 분석
HPLC 분석을 위하여 LRE(extract of Lotus Root)를 메탄올로 용해시켜 10 ㎎/mL로 샘플을 제조하였다. HPLC 분석 장비는 Agilent 1200 series (Agilent Technologies, San Jose, CA, USA)이며 Agilent ZORBAX Extend-C18 컬럼 (250 × 4.6 ㎜)을 사용하였다. 시료 주입량은 20 uL로 설정하였고, 0.1% 포름산을 첨가한 물(A)과 아세토니트릴(B)의 두 용매에 기울기를 주어 (B용액:5-100%, in 55 min) 1 mL/min의 유속으로 실험하였다. 크로마토그램의 각 peak는 UV/visible spectrum (200-400 ㎚)에서 확인하였다.
세포배양 및 MTT assay
인체 치은섬유아세포주(human gingival fibroblast) HGF-1 세포는 American Type Culture Collection (ATCC, CRL-2014TM; Rockville, MD, USA)에서 분양받았으며, 10% fetal bovine serum (FBS; Hyclone, South Logan, UT, USA), 100 Unit Penicillin/ Streptomycin (Gibco™)이 포함된 Dulbecco’s modified eagle’s medium (DMEM) 배지를 사용하여 37℃, 5% CO2 조건에서 배양하였다. LRE 처리에 따른 세포생존율 정도를 측정하기 위하여 6-well plate에 HGF-1 세포를 well 당 3×105 cell/well로 분주 후 24시간 동안 배양하고 LRE 시료를 농도별로 처리하여 배양하였다. 그리고 2시간 후 LPS-PG (InvivoGen, San Diego, CA, USA)를 1 ㎍/mL의 농도로 처리하고 다시 22시간 배양하였다. 이후 3-[4,5-dimethylthiazol-2-yl]-2,5 diphenyl tetrazolium bromide (MTT) 시약을 0.5 ㎎/mL 농도가 되게 처리하여 2시간 동안 배양하고, 배지를 제거한 후 DMSO를 2 mL씩 분주하여 생성된 formazan을 모두 녹인 후 ELISA reader (Molecular Devices, CA, USA)로 540 ㎚에서 흡광도를 측정하였다.
Nitric Oxide 생성량 측정
Nitric Oxide (NO)의 농도 측정은 배양액 내의 nitrite 농도를 Griess Reagent (Sigma-Aldrich Co.)를 이용하여 측정하였다. 6-well plate에 HGF-1 세포를 confluent 상태까지 배양하여 LRE 및 LPS-PG를 처리한 후 24시간 후 세포 배양액을 수거하였다. 배양액과 동량의 Griess Reagent를 넣어 반응시키고 ELISA reader로 540 ㎚에서 흡광도를 측정하였다. NO의 함량은 NaNO2 standard curve를 이용하여 시료의 농도를 계산하고 값을 구하여 나타내었다.
Prostaglandin E2와 cytokine 생성량 측정
LPS-PG로 유도된 HGF-1 세포에서 LRE의 농도별 처리에 의한 PGE2 및 TNF-α, IL-1β, IL-6, IL-8의 염증성 cytokine 생성량을 Prostaglandin E2 ELISA kit (Cayman, AnnArbor, Michigan, USA)와 Quantikine ELISA kit (R&D systems, Minneapolis, USA)를 사용하여 측정하였다. 동일한 조건에서 배양된 HGF-1 세포의 배양액을 이용하여 PGE2 및 cytokine의 생성량을 제시된 방법에 따라 처리한 다음 ELISA reader를 이용하여 각각 420 ㎚, 450 ㎚ 파장에서 흡광도를 측정하고 계산하여 나타내었다.
Western blot analysis에 의한 단백질 발현 분석
준비된 세포에 적당량의 lysis buffer [25 mM Tris-Cl (pH 7.5), 250 mM NaCl, 5 mM EDTA, 1% NP-40, 1 mM phenymethylsulfonyl fluoride (PMSF), 5 mM dithiothreitol (DTT)]를 첨가하여 총 단백질을 분리하였다. 동량의 sample을 sodium dodecyl sulphate (SDS)-polyacrylamide gel을 이용하여 전기영동으로 분리한 후, nitrocellulose membrane (Schleicher and Schuell, Keene, NH, USA)으로 electro-blotting에 의해 전이시켰다. 분리된 단백질이 전이된 membrane을 5% skim milk를 처리하여 비특이적인 단백질들에 대한 blocking을 실시하고, 1차 항체를 처리하여 상온에서 2시간 이상 또는 4℃에서 over night 시킨 다음 1차 항체에 맞는 2차 항체를 사용하여 상온에서 1시간 정도 반응시켰다. 반응이 끝난 후 enhanced chemiluminoesence (ECL) solution (Amersham Life Science Corp., Arlington Heights, IL, USA)을 적용시킨 다음 X-ray film에 감광시켜 특정단백질의 발현양을 분석하였다. 본 연구에 사용된 항체는 Santa Cruz Biotechnology (Santa Cruz, CA, USA), Cell Signaling (Beverly, MA, USA) 및 Amersham Life Science Corp.에서 구입하였다.
통계 처리
본 연구의 모든 실험결과는 3회 실시한 독립적인 실험을 통해 얻은 값을 평균±표준편차로 나타내었으며, Graph Pad Prism 6 (Graph Pad Software Inc., San Diego, CA, USA)을 이용하여 one-way analysis of variance (ANOVA) test 실시한 후 Tukey test로 사후 검증하여 유의적 차이를 판단하였다.
결과 및 고찰
추출물 조제 및 HPLC 분석
LRE를 얻기 위하여 시료 무게 (180 g)의 20배에 해당하는 증류수로 100℃에서 2시간 동안 추출하였다. 열수추출물을 여과지로 여과한 후 용매를 Rotary evaporator를 이용하여 농축하고, 농축물은 동결 건조하여 분말화하였다. 열수추출 및 동결 건조 결과 27.06%의 추출 수율로 본 실험에서 사용할 LRE (48.7 g)를 얻을 수 있었다. HPLC chromatogram을 통해 LRE의 성분을 확인하였다(Fig. 1). 최근 연구에 의하면 연뿌리 추출물에 함유되어 있는 생리활성 물질로 flavonoid 화합물(kaempferol, quercetin, isoquercetin), polyphenol 화합물(flavonoids, tannic acid 등), alkaloid (dehydronuciferine, liensine, isoliensine, neferine 등) 등이 보고되어 있다(Bae et al., 2008; Jang et al., 2017; Kim et al., 2010; Lee et al., 2007). 또한 생리활성 연구로 항암효과, 신장보호 효과 및 고지혈증 예방효과 등 다양한 연구가 보고되어져 있다(Jeong et al., 2010; Park et al., 2005a; Que et al., 2006). 하지만 연뿌리 추출물에 대한 치주염 개선의 연구는 아직 보고된 바가 없어 본 연구에서는 연뿌리 추출물이 치주염 원인균으로 알려진 LPS-PG로 유도된 치은섬유아세포 HGF-1에 미치는 항염증 및 항산화 효과의 분자생물학적 기전에 대해 연구를 수행하였다.
세포생존에 미치는 LRE 및 LPS-PG의 영향
LRE 및 LPS-PG 처리에 따른 인체 치은섬유아세포주 HGF-1 세포의 생존에 영향을 미치는지를 확인하기 위하여 20, 40, 80 ㎍/mL 농도의 LRE를 2시간 동안 처리한 후 LPS-PG (1 ㎍/mL)를 22시간 동안 처리하였다. 그리고 MTT assay로 세포 생존율을 분석한 결과 본 실험에 사용한 농도의 범위에서는 세포 독성이 나타나지 않는 것을 확인할 수 있었으며, 이후 실험조건으로 설정하여 진행하였다(Fig. 2).

Fig. 2.
Effects of LRE and LPS-PG on the cell viability of HGF-1 cells. The cells were treated with the indicated concentrations of LRE alone or pretreated with LRE for 2 h before LPS-PG (1 μg/mL) treatment. After 24 h, cell viability was assessed using an MTT assay. Data are expressed as the means ± standard deviation of the three independent experiments (N.S., no significance).
iNOS 발현 및 NO의 생성에 미치는 LRE의 영향
NO는 매우 반응성이 큰 생체 생성분자로서 효소인 nitric oxide synthase (NOS)에 의해 L-arginine이 L-citrulline으로 합성될 때 생성된다(Guha and Mackman, 2001). Inducible NOS (iNOS)는 평소에 발현되지 않다가 전염증성 cytokine이나 LPS 등에 의해 자극을 받으면 대식세포에서 과량 발현되면서 많은 양의 NO를 생성하게 되고, 이는 염증을 유발하여 조직의 손상을 가져오는 것으로 알려져 있다(Wang et al., 2002; Yoon et al., 2015). 따라서 LRE 처리에 의한 NO 생성 정도를 측정하기 위하여 치주조직을 구성하는 세포 중 하나인 HGF-1 세포를 치주질환 원인균인 포필로모나스 진지발리스(Porphyromonas gingivalis)의 내독소인 LPS-PG로 자극시킨 후, NO의 생성과 iNOS 단백질 발현 양상을 확인하였다. 그 결과 Fig. 3A에서 볼 수 있듯이 LPS-PG를 단독으로 처리하였을 때 NO가 현저하게 증가하였고, LRE 처리 시 농도 의존적으로 감소하였다.

Fig. 3.
Inhibition of NO and PGE2 production by LRE in LPS-PG-stimulated HGF-1 cells. The cells were pretreated with the indicated concentrations of LRE for 2 h prior to incubation with LPS-PG (1 μg/mL) for 24 h. The levels of NO (A) and PGE2 (B) in culture media were measured by Griess assay and a commercial ELISA kit, respectively. Each value indicates the mean ± SD and is representative of the results obtained from three independent experiments. (C, D, E and F) Cell lysates were prepared for Western blot analysis, with antibodies specific for murine iNOS and COX-2, and for an ECL detection system. The experiment was repeated three times and similar results were obtained. Actin was used as the internal controls for the Western blot analysis, respectively. The significance was determined by the Student's t-test (*p < 0.05, compared with control; #p < 0.05, compared with LPS-PG).
COX-2 발현 및 PGE2의 생성에 미치는 LRE의 영향
Prostanoid는 생체 항상성 유지에 필요하지만, 과량의 prostanoid 생성은 NO와 비슷하게 염증반응을 가속화시켜 다양한 염증성 질병을 야기시키고(Needleman and Isakson, 1997; Ren and Torres, 2009), 과도한 COX-2의 발현은 PGE2 생성을 증가시킨다. 이러한 선행연구들을 근거하여 LPS-PG로 유도된 HGF-1 세포에서 PGE2 생성 및 COX-2 단백질 발현양상을 확인하였다. 그 결과 LPS-PG를 단독으로 처리하였을 때 현저하게 증가된 PGE2 생성이 LRE를 처리하였을 때 농도 의존적으로 감소되었으며, COX-2 발현 양상 역시 유의하게 억제되는 것을 확인할 수 있었다(Fig. 3B).
염증성 사이토카인의 생성에 미치는 LRE의 영향
세포가 병원체 등의 감염에 의해 비정상적으로 활성화되면 iNOS에 의한 NO 생성과 COX-2에 의한 PGE2와 같은 염증매개 인자의 생성 증가와 함께 염증성 사이토카인의 생성 또한 증가한다(Feghali and Wright, 1997). 따라서 본 연구에서는 LPS-PG에 의한 TNF-α, IL-1β, IL-6 및 IL-8과 같은 대표적인 염증성 사이토카인의 생성에 미치는 LRE의 영향을 조사하였다. 본 연구의 결과에 의하면 LPS-PG 단독 처리에 의해 염증성 싸이토카인의 생성이 정상군에 비하여 현저하게 증가하였다. 그러나 LRE의 다양한 농도(20, 40 및 80 ㎍/mL)로 전처리한 군에서는 처리 농도 의존적으로 LPS-PG에 의해 증가된 TNF-α, IL-1β 및 IL-6의 생성이 억제되었으나 IL-8의 생성 억제에는 아무런 영향을 미치지 않았다(Fig. 4).
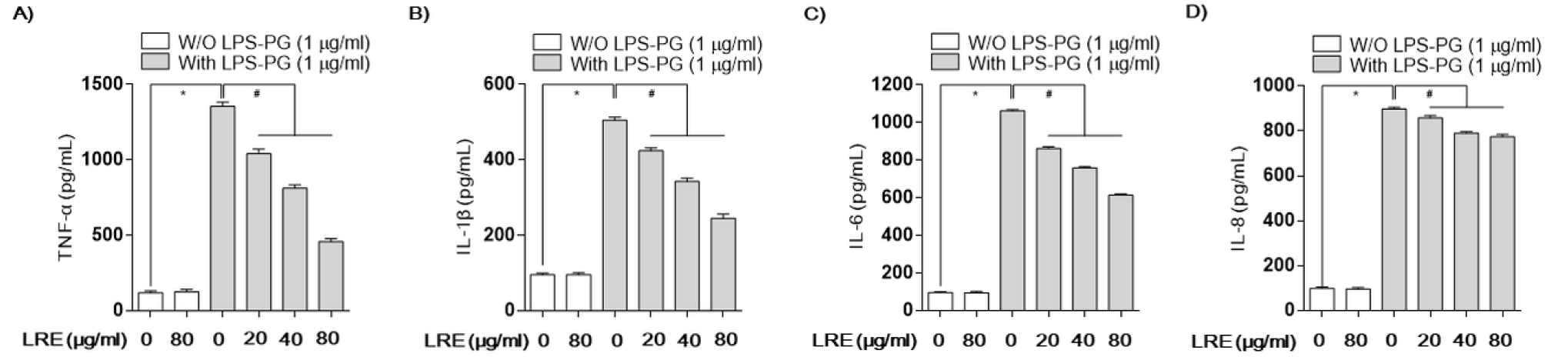
Fig. 4.
Effects of LRE on LPS-PG--stimulated cytokines production in HGF-1 cells. Cells were pre-treated with the indicated concentrations of LRE 2 h prior to incubation with LPS-PG (1 μg/mL). After incubation for 24 h, the levels of TNF-α (A), IL-1β (B), IL-6 (C) and IL-8 (D) present in the supernatants were measured using ELISA kits. Each value is presented as the mean ± standard deviation and is representative of results obtained from four independent experiments. The significance was determined by the Student's t-test (*p < 0.05, compared with control; #p < 0.05, compared with LPS-PG).
NF-κB 신호전달계에 미치는 LRE의 영향
LPS-PG에 의해 유도된 iNOS와 COX-2의 과발현은 염증 전사인자인 NF-κB에 의해 매개된다. 이 염증 전사인자는 세포질 내에서 불활성의 형태로 존재하다가 NF-κB의 subunit 중 p65가 인산화되어 활성화되면 핵 내로 이동하여 염증매개 인자들의 합성을 위한 유전자를 전사하게 된다(Fujihara et al., 2003). 본 실험에서는 LRE가 LPS-PG로 유도된 NF-κB의 구성단백질인 p65의 인산화를 western blot으로 분석하였다. 그 결과 Fig. 5B에서 보는 바와 같이 LPS-PG에 의해 유도된 p65의 인산화가 LRE에 의해 농도 의존적으로 감소하는 것을 확인할 수 있었다. 또한 NF-κB의 발현 증가는 TLR4 및 myeloid differentiation factor 88 (Myd88)의 증가를 동반하여 TLR4 신호계의 활성에 따른 p65의 인산화되어 핵 내로 이동하여 염증매개 인자들의 합성을 위한 전사 활성이 증가되었을 것으로 추정된다(Fig. 5).
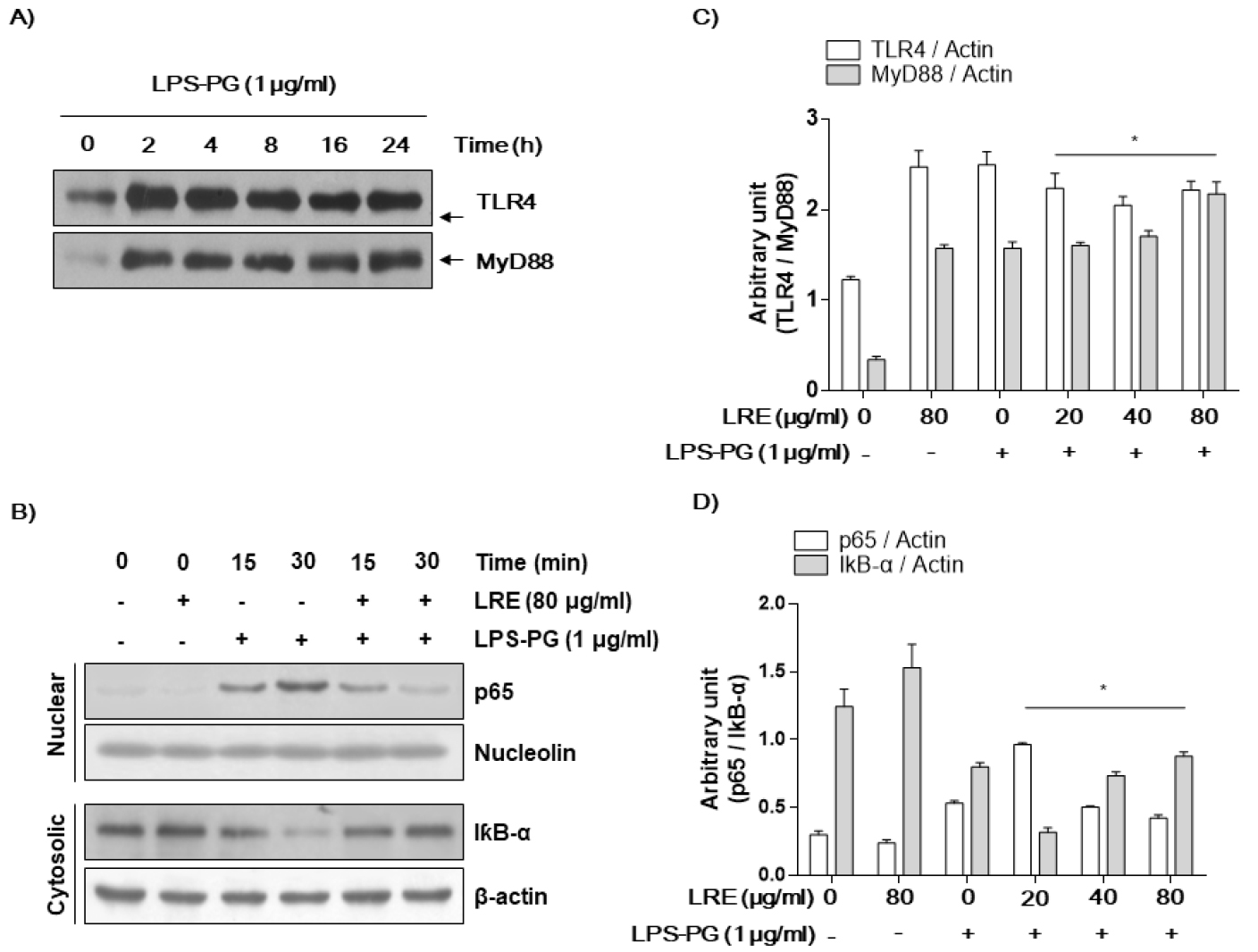
Fig. 5.
Effects of LRE on the LPS-PG-induced expression of TLR4 and NF-κB in HGF-1 cells. After 1 μg/mL LPS-PG treatment with or without 80 μg/mL LRE for the indicated times, the nuclear and cytosolic proteins were isolated, and the expression of TRL4/MyD88 (A and C) and NF-κB/IκBα (B and D) was determined by Western blot analysis using an enhanced chemiluminescence (ECL) detection system. Nucleolin and β-actin were used as internal controls for the nuclear and cytosolic fractions, respectively.
NQO-1/Nrf2 경로를 통한 LRE의 항산화 효과
제독효소인 2상 효소(phase II enzyme)의 발현 유도에 의해 염증이 억제된다는 선행연구들을 바탕으로 본 실험에서도 2상 효소 중 하나인 NAD(P)H quinone dehydrogenase (NQO)-1의 발현을 분석하였다(Yang et al., 2015). Fig. 6에서 보는 바와 같이 LPS-PG에 의해 감소되었던 NQO-1 유전자는 LRE 처리에 의하여 농도 의존적으로 증가하는 것을 확인할 수 있었다. 또한 2상 효소의 전사인자인 Nrf2의 활성 또한 농도 의존적으로 유도 되는 것을 확인하였다. 본 연구의 결과 LRE는 LPS-PG에 의해 유도된 HGF-1 세포에서 TLR4/Myd88/NF-κB의 발현 조절을 통하여 염증 매개물질 및 염증성 싸이토카인 생성을 억제하고, Nrf2의 활성 유도를 통해 NQO-1의 발현 증가를 유도함으로써 항염증 및 항산화 효능이 있음을 확인하였다.

Fig. 6.
Effects of LRE on protein expression of NQO1 and Nrf2 in LPS-PG-stimulated HGF-1 cells. Protein expression levels of NQO1 and Nrf2 by LRE were analyzed by western blot analysis. All signals were normalized to protein levels of Actin, an internal control, and expressed as a ratio. Data represent the mean ± SD of triplicate experiments. Actin was used as the internal controls for the Western blot analysis, respectively.
적 요
치주조직에 존재하는 주요한 세포의 한 형태인 인체 치은섬유아세포는 다양한 구강유해세균으로부터 염증이 유발되어지며, 그중 대표적으로 치주염 원인균인 P. gingivalis의 내독소인 LPS-PG로부터 염증성 자극에 반응하여 다양한 염증매개 물질을 분비한다. 본 연구에서는 치주염을 일으키는 주요한 원인균 중 하나인 P. gingivalis로 부터 분리한 LPS-PG를 이용하여 인체 치은섬유아세포주인 HGF-1 세포에 염증을 유도한 후 LRE에 대한 항염증 및 항산화 효과를 분석하였다. 실험 결과, LRE는 LPS-PG 유도에 따라 iNOS에 의한 NO 생성과 COX-2에 의한 PGE2와 같은 염증 매개 인자의 발현 및 생성 억제와 함께 염증성 싸이토카인(TNF-α, IL-1β 및 IL-6)의 생성 또한 억제하였다. 신호전달계에서 염증성 전사인자의 발현 경로를 확인하기 위하여 TLR4/Myd88/NF-κB의 활성을 확인한 결과, LRE 처리에 따라 농도 의존적으로 억제되는 것을 확인하였다. 또한 산화 환원 효소로 항염증효과를 나타내는 것으로 알려진 2상 효소 중 하나인 NQO-1과 이의 전사인자인 Nrf2를 분석 한 결과 LRE 처리에 의해 효소의 활성이 높아지는 것을 확인할 수 있었다. 결론적으로 LRE는 TLR4/Myd88/NF-κB 신호전달 경로를 억제하고 NQO1/Nrf2 활성을 유도함으로써 HGF-1 세포에서 LPS-PG에 의해 유도된 염증을 억제하는 것으로 사료되며, 향후 LRE는 식‧의약품 소재 개발에서 치주질환 개선의 가능성이 있는 후보물질이 될 수 있을 것으로 사료된다.