서 언
식물 종자의 발아는 수분 흡수를 통해 자엽 또는 배유에 저장되어 있는 단백질이 가수분해됨으로서 에너지를 얻고, 이러한 에너지를 이용하여 세포분열을 촉진함으로써 유근의 생장을 유도하여 발아하게 된다(George et al., 1987). 이러한 식물종자의 발아는 배의 유근이 신장생장을 통해 종피를 뚫고 나왔을 때를 말하고, 기계적인 상처와 같은 물리적 처리는 수분흡수와 산소공급을 원활히 하여 발아를 촉진시키기도 한다(Choi et al ., 2019; Hsiao et al ., 1983). 또한 식물호르몬의 일종인 GA3는 종자의 휴면을 타파함으로써 발아를 촉진하는 것으로 알려져 있고(Hsiao, 1979; Choi et al., 2019), 유근의 초기 신장생장에서 영양분 역할을 하는 자엽 또는 배유도 매우 중요한 역할을 하는 것으로 알려져 있다(Choi et al., 2019; Webb, 1982).
식물에서 인공종자에 대한 연구는 식물의 세포배양을 통해 체세포배가 생산된 이후 Murashige et al. (1977)에 의해 “synseeds”라는 용어로 처음 언급되었으며, 당근의 체세포배를 Polyethylene oxide (Polyox WSRN 750)에 혼합하여 “Wafer”로 만든 다음 탈수와 수분 재공급과정을 통해 체세포배가 발아할 수 있음을 보여주었다(Kitto and Janick, 1985). 이러한 연구를 바탕으로 Pinus radiata 배 배양을 통해 얻은 체세포배의 인공종자 생산을 위한 실용화 연구(Teasdale and Buxton, 1986)와 미국의 Plant Genetic사에서는 체세포배에 alginic acid와 같은 천연의 hydrogel을 encapsulation하여 인공종자 생산을 시도하였다(Redenbaugh et al ., 1984). 이후 체세포배로부터 식물체를 대량생산하기 위한 실용적 기술로서 인공종자(artificial seeds)라 불리게 되었고(Gray et al., 1991), 최근에는 인공종자를 실용화하기 위해서는 기내배양을 통해서 생산되는 체세포배의 질(quality)이 매우 좋아야 하며, 상업적으로도 매우 가치가 있어야 한다고 강조하고 있다(Ara et al ., 2000). 그러나 체세포배는 접합자배와 비교했을 때 종피와 배유가 없고, 특히 자엽의 발달이 미숙하기 때문에 인공종자를 만들었을 때 발아율이 낮아지게 되는 문제점이 있다. 대표적으로 대두와 같은 접합자 배의 자엽이 발달된 콩과식물의 체세포배(Kerns et al., 1986; Kitto and Janick, 1985)에서는 발아율이 아주 낮아지는데, 이는 체세포배의 자엽이 접합자 배의 자엽에 비해 매우 미숙하게 발달되어 있어서 발아에 필요한 영양분이 충분하지 못하기 때문인 것으로 알려져 있다(Choi et al., 1994, Choi et al., 2002; Choi and Kwon, 2013a, Choi and Kwon, 2013b; Kantayos and Bae, 2019). 이와 같이 많은 식물로부터 체세포배 발생을 통한 식물체 재분화와 이를 산업화하기 위한 연구로서 식물체 대량 생산과 인공종자화를 위해서는 영양분 공급원으로서 자엽의 역할을 할 수 있는 최적의 영양분 조합에 대한 연구가 선행 되어야 할 것이다.
따라서 본 연구에서는 식물의 발아과정에서 영양 공급원 역할을 하는 자엽의 영향과 영양공급원으로서의 자엽의 역할을 대체할 수 있는 최적의 영양분 조합을 이해하기 위하여 자엽이 잘 발달되어 있는 사과 접합자 배를 이용하여 자엽이 미치는 발아율을 조사하였고, 자엽이 제거된 접합자배에 여러 가지 영양분 조합을 첨가하여 encapsulation화한 인공종자의 발아율을 조사하였기에 보고하고자 한다.
재료 및 방법
실험재료
본 실험에 사용된 사과(Malus pumila var, domestica)종자는 Choi et al. (2019)에 의해 서술된 방법에 따라 15년생 사과나무로부터 11월중에 채취 하였다. 종자의 휴면타파를 위하여 냉장고에 1달 이상 보관하였고, 종자의 생중량이 55.0-60.0 ㎎사이의 것을 선별하여 실험재료로 사용하였다.
실험방법
식물종자로부터 자엽 제거와 자엽이 제거된 종자에 영양분 처리함으로써 발아율에 어떠한 영향을 미치는지 알아보기 위하여(Choi et al., 2019)에 의해 서술된 방법을 따라 다음과 같이 수행하였다. 사과종자를 70% alcohol로 1분간, 그리고 1% sodium hypochlorite용액으로 15분간 표면 살균한 후 멸균수로 3-5회 수세하였다. 살균된 종자로부터 무균상태에서 종피를 벗겨 자엽을 제거하지 않은 정상배(WCE), 1/4제거한 배(3/4CE), 1/2제거한 배(1/2CE), 3/4제거한 배(1/4CE), 그리고 완전히 제거한 배(NCE)로 나누어 사용하였다. 각 배의 발아율에 대한 영양분 효과를 알아보기 위하여 대조구로 2% alginic acid (A)와 처리구로 2% alginic acid+MS (Murashige and Skoog, 1962)기본용액(A+MS), 2% alginic acid+3% sucrose (A+Su), 2% alginic acid+ 80 ㎎/L GA3 (A+GA3), 2% alginic acid+MS+3% sucrose (A+ MS+Su), 2% alginic acid+MS+80 ㎎/L GA3 (A+MS+GA3), 2% alginic acid+80 ㎎/L GA3+3% sucrose (A+GA3+Su)로 제조하여 처리하였다. 인공종자는 각 영양분이 포함된 2% alginic acid (Sigma-Aldrich, CAS No. 9005-38-3)를 7.5 g/L 염화칼슘 용액에서 10분간 회전시키면서 encapsulation시켜 제조하였다. 직경 9 ㎝의 페트리디쉬에 멸균수 5 mL로 적신 멸균 filter paper를 깔고 인공종자 20개씩 넣고 발아를 유도하였다. 모든 배양환경은 24 ± 1℃에서 18시간 광주기(40 ㎛ m-2 s-1) 조건으로 6일 동안 무균 배양하면서 발아율을 조사하였다. 인공종자의 발아기준은 유근이 알진산 인공종피를 뚫고 나와 1 ㎝ 이상 자랐을 때를 발아된 것으로 판단하였고, 모든 실험은 3회 반복 수행하였다.
결과 및 고찰
많은 식물로부터 체세포배 발생을 통한 식물체 재분화와 이를 산업화하기 위한 유식물체의 대량생산 및 인공종자화 등의 연구에서 선행되어야 할 중요한 연구는 체세포배의 발아초기에 미숙하게 발달된 자엽의 역할과 정상 형태의 자엽이 형성될 수 있는 배양 조건을 규명하는 일이다(Choi et al., 1994, Choi et al., 2002; Choi and Kwon, 2013a, Choi and Kwon, 2013b). 사과종자의 발아율에는 기계적 상처와 같은 물리적 요인과 영양원으로써 이용되는 배유나 자엽도 발아율에 중요하게 작용할 수 있다(Choi et al., 2019). 특히 사과의 경우 자엽을 부분적으로 제거 하였을 때 유근 초기생장에 심각한 영향을 주어 발아율이 감소된 것으로 보고되었다(Choi et al ., 2019). 이와 같이 기내에서 자엽의 미성숙 또는 비정상적인 발달의 빈도가 높게 나타나는 체세포배(Choi and Kwon, 2013a; Choi and Kwon, 2013b)와 유사하게 사과 접합자배의 자엽을 부분적으로 제거한 후 여러 조합의 영양분이 포함되게 2% alginic acid로 encapsulation하여 인공종자를 제조한 후 발아율을 조사하였다. 자엽을 제거하지 않은 정상적인 배의 인공종자에서는 82.31%의 발아율을 보였고(Fig. 1A1), 영양분이 첨가된 처리구(A+MS, A+Su, A+GA3, A+MS+Su, A+MS+GA3, A+Su+GA3)에서는 모두 100%의 발아율을 보였다. 자엽 1/4을 제거한 인공종자(3/4 CE)의 경우 영양분이 없는 2% alginic acid에서는 76.43%로 낮아졌고(Fig. 1A2), A+MS에서는 91.72%, A+Su에서는 96.38%로 약간 회복되었고, 나머지 처리구(A+GA3, A+MS+Su, A+MS+GA3, A+Su+GA3)에서는 100%의 발아율을 보였다. 자엽 1/2을 제거한 인공종자(1/2 CE)의 경우 영양분이 없는 2% alginic acid에서는 55.81%로 더욱 낮아졌고(Fig. 1A3), A+MS처리구에서 68.91%, A+Su에서 72.21%로, A+GA3에서 78.21%로, A+MS+Su에서 77.19%로, A+MS+GA3에서 98.14% 그리고 A+Su+GA3에서 98.74%로 측정되어 1/2자엽이 제거되어 55.81%로 떨어진 발아율을 A+MS+GA3와 A+Su+GA3영양분을 첨가함으로서 100%에 가깝게 회복되는 것으로 나타났다. 그리고 자엽을 3/4 제거한 인공종자의 경우 2% alginic acid에서는 46.81%로 더욱 낮아졌고(Fig. 1A4, B), 낮아진 발아율은 A+MS에서 53.74%로, A+Su에서 61.91%, A+GA3에서 75.21%(Fig. 1C), A+MS+Su에서 73.41%, A+MS+GA3에서 88.75%(Fig. 1D) 그리고 A+Su+GA3에서 83.74%로 회복되었고, 자엽을 완전히 제거한 인공종자(NCE)에서는 2% alginic acid에서는 24.44%로 더욱 감소되었으며(Fig. 1A5), A+MS에서 39.42%, A+Su에서 44.78%, A+GA3에서 60.19%, A+MS+Su에서 55.72%, A+MS+GA3에서 82.45% 그리고 A+Su+GA3에서 77.81%로 상당히 회복되는 것으로 나타났다(Table 1).
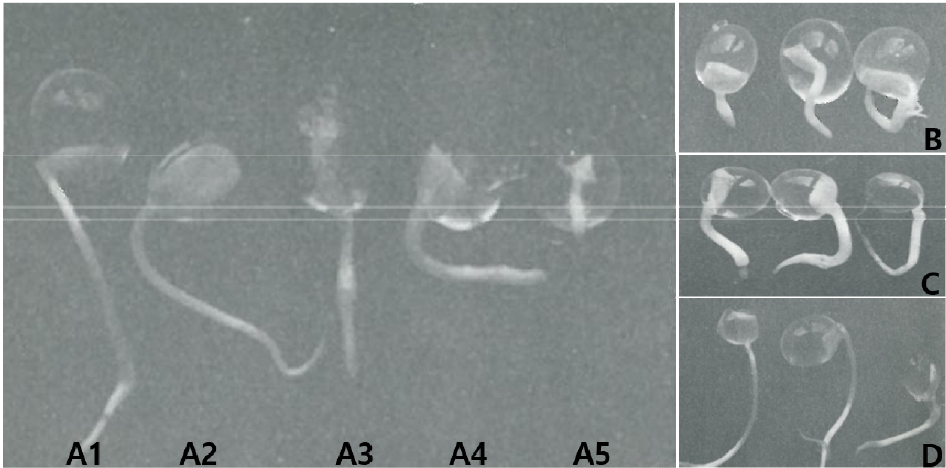
Fig. 1
The root growth (> 1 ㎝) of artificial seeds by encapsulation zygotic embryos with whole cotyledon (WCE, A1), with 3/4 cotyledon (3/4CE, A2), with 1/2 cotyledon (1/2 CE, A3), with 1/4 cotyledon (1/4 CE, A4), without cotyledon (NCE, A5) in 2% alginic acid, and with 1/4 cotyledon (1/4 CE) in 2% alginic acid (B) containing with 80 ㎎/L GA3 (C), and containing with MS solution and 80 ㎎/L GA3 (D) for 6 days.
Table 1
The percentage (%) of root length (> 1 ㎝) from artificial seeds of embryo with whole cotyledon (WCE), of embryo with 3/4 cotyledon (3/4 CE), of embryo with 1/2 cotyledon (1/2 CE), of embryo with 1/4 cotyledon (1/4 CE), of embryo without cotyledon (NCE) which were encapsulated by alginic acid containing MS solution, 3% sucrose and/or GA3
특히 영양분과 GA3처리에 의한 발아된 유근은 2% alginic acid단독에서 보다 뚜렷한 길이생장을 보였으며, 유근의 두께는 MS용액과 GA3혼합처리 하였을 때 가늘고 길게 자라는 현상을 보였다(Fig. 1B, C, D). 이와 같이 접합자 배에서 부분적 자엽 제거는 발아율 감소에 중요한 요인이 될 수 있음을 보여주었고, 이는 자엽의 미성숙 발달과 비정상 형태의 자엽을 갖는 체세포배에서 발아율이 낮은 이유를 설명할 수 있는 결과라 생각되며, 부분적 자엽의 제거에 의해 낮아진 인공종자의 발아율은 영양분과 호르몬 조합 처리에 의해 상당히 회복될 수 있음을 보여주어 인공종자 개발에 적용할 수 있을 것으로 판단된다.
이러한 결과는 Zamia floridana 의 유근의 초기 신장생장에서 megagametophyte가 영양분 공급원으로 매우 중요하게 작용하며(Webb, 1982), 자성 배우체 추출물이 전나무 배 배양에서 효과적이다는 연구결과(Marion and Zaerr, 1981), 그리고 자엽제거 및 기계적 상처가 사과 종자 발아에 있어서 중요한 역할을 한다는 연구 결과 등(Choi et al., 2019)과 매우 유사한 경향을 보여주었다. 이와 같이 접합자배의 초기 생장에서 MS용액, sucrose 그리고 GA3 등은 사과 인공종자발아에 중요한 역할을 하며, 이러한 결과는 자엽이 미숙하게 발달되는 체세포배의 인공종자화 연구에 중요한 자료로 활용될 수 있을 것으로 판단되며, 향후 영양분외에도 세포분열과 세포신장에 중요한 역할을 하는 auxin과 cytokinin의 발아 초기에 대한 체계적인 연구가 진행되어야 할 것으로 판단된다.
적 요
2% 알진산으로 캡슐화하여 만든 사과 인공종자의 발아 연구를 위하여 자엽을 부분적으로 제거한 후 영양분과 지베렐린을 단독 또는 조합처리한 알진산으로 캡슐화하여 발아율을 측정하였다. 3/4 자엽 배(3/4 CE), 1/2 자엽 배(1/2 CE), 1/4 자엽 배(1/4 CE), 그리고 자엽을 완전히 제거한 배(NCE)로 만든 인공종자는 정상배로 만든 인공종자의 발아율 82.31%에 비하여 최대 24.44%까지 감소하였으며, 그 감소한 발아율은 MS영양분과 지베렐린 처리에 의해 상당히 회복되었다. 특히, 알진산 단독에서 1/2 자엽을 갖는 인공종자의 낮아진 발아율(55.81%)은 3% sucrose와 80 ㎎/L 지베렐린 조합처리에 의해 98.74%까지 증가하였다. 자엽이 없는 인공종자의 경우 낮아진 발아율(24.44%)은 MS용액과 80 ㎎/L 지베렐린 조합처리에서 82.45%까지 회복되었다. 이러한 결과는 배의 발아율이 자엽의 부분적 제거에 의해 억제되었고, 그 감소된 발아율은 영양분과 지베렐린 처리에 의해 상당히 회복될 수 있음을 보여 주었다.




