서 언
재료 및 방법
실험재료
추출물 제조
MTT assay
Griess assay
Neutral red assay
SDS-PAGE and Western blot analysis
Reverse transcriptase-polymerase chain reaction (RT-PCR)
통계분석
결과 및 고찰
산돌배 열매추출물의 대식세포 활성화 유도
TLR2와 TLR4가 산돌배 열매추출물이 처리된 대식세포에서 면역증진 인자 생성에 미치는 영향
MAPKs 신호전달이 산돌배 열매추출물이 처리된 대식세포에서 면역증진 인자 생성에 미치는 영향
적 요
서 언
면역은 외부 병원체로부터 야기되는 질병을 보호하는 중요한 생체방어시스템으로, COVID-19의 유행으로 바이러스 감염 퇴치에 있어 면역반응의 기능성과 효율성이 중요하게 여겨지고 있다(Alagawany et al., 2021). 인체에 존재하는 다양한 면역세포 중, 선천성 면역반응에서 중요한 역할을 하는 대식세포는 포식작용을 통해 외부 병원체로부터 인체를 보호하며, nitric oxide (NO), inducible nitric oxide synthase (iNOS), interleukin-1β (IL-1β), interleukin-6 (IL-6) 그리고 tumor necrosis factor-α (TNF-α)등의 면역조절인자를 분비하여 후천성 면역세포인 T-세포와 B-세포를 활성화시킨다고 알려져 있다(Duque and Descoteaux, 2014; Tosi, 2005). 그리하여, 대식세포가 선천성 면역반응뿐만 아니라 후천성 면역반응에도 관여하기 때문에 대식세포의 활성화는 외부 병원체로부터 야기되는 질병을 근원적으로 차단할 수 있다고 여겨지고 있다(Mills and Ley, 2014; Mills et al., 2015).
장미과(Rosaceae) 배나무속(Pyrus)에 속하는 배나무는 한국배, 중국배, 그리고 서양배로 구분되어 재배되고 있다(Kim et al., 2020). 배나무 열매는 진해, 항염, 이뇨작용이 있어 한국과 중국에서 전통 민속 의약으로 사용되고 있다(Lee et al., 2011). 현재 한국에 자생하고 있는 배나무는 콩배(Pyrus calleryana), 돌배(Pyrus pyrifolia) 및 산돌배(Pyrus ussuriensis)가 있으며, 산돌배는 예로부터 식용뿐만 아니라 토사, 개선, 해열 등의 약재로 사용되어 온 전통 생물자원이다(Kim et al., 2020). 산돌배의 열매는 기침, 통풍 및 류마티스 관절염 완화에 효과적이라고 보고되고 있다(Kim et al., 2019). 게다가, 산돌배는 강력한 항산화 활성과 항염증 활성이 있다고 알려져 있다(Li et al., 2014; Qu et al., 2016). 그러나 현재까지 산돌배의 면역증진 관련 연구는 전무한 실정이다. 그리하여 본 연구에서는 산돌배 열매의 면역증진활성을 대식세포 활성화 유도를 통해 검증하였다.
재료 및 방법
실험재료
마우스 대식세포인 RAW264.7세포 배양을 위한 배지인 DMEM/F-12는 Lonza (Morristown, NJ, USA)에서 구매하였다. 3-(4,5-dimethylthizaol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT), C29 (TLR2 억제제), TAK-242 (TLR4 억제제), PD98059 (ERK1/2 억제제), SB203580 (p38 억제제) 및 SP600125 (JNK 억제제)는 Sigma-Aldrich (St. Louis, MO, USA)사에서 구입하였다. 그리고 Western blot 분석을 위한 일차 항체와 이차 항체들은 Cell Signaling Technology (Danvers, MA, USA)에서 구입하였다.
추출물 제조
본 연구의 시료인 산돌배(Pyrus ussuriensis var. hakunensis (Nakai) T.B. Lee) 열매는 국립산림과학원 산림약용자원연구소에서 식물학적 동정 후 제공받았다. 동결건조 후 분쇄된 산돌배 열매 20 g을 400 mL 증류수에 침지한 후 15℃에서 250 rpm으로 교반하면서 3일 동안 추출하였다. 3일 후 15,000 rmp에서 10분간 원심분리하여 산돌배 열매 물추출물을 회수한 후 동결건조하여 최종 산돌배 열매 물추출 시료 (PUF)를 얻었다. 동결건조 된 추출물은 -80℃의 냉동고에 보관하면서 연구를 위한 시료로 사용되었다.
MTT assay
본 연구에서 사용된 마우스 대식세포 RAW264.7은 American Type Culture Collection (Manassas, VA, USA)에서 구입하였고, 세포는 10% FBS, 100 U/mL penicillin과 100 ㎍/mL streptomycin이 포함된 DMEM/F-12 배지로 37℃, 5% CO2 하에서 배양되었다. 산돌배 열매추출물의 RAW264.7세포에 대한 세포 생존률은 MTT assay로 측정하였다(Seo and Jeong, 2020). RAW264.7세포를 96-well plate에 well 당 2 × 105 cells로 배양하여 세포가 well에 90%이상 찼을 때, 산돌배 열매추출물을 농도별 처리하고 24시간 동안 배양시켰다. 24시간 후, 각 well에 MTT 용액(1 ㎎/mL)을 50 μL씩 첨가하고 4시간 반응시킨 후, 상등액을 제거하고 DMSO를 100 μL씩 각well에 첨가하여 녹인 후 UV/Visible spectrophotometer (Xma-3000PC, Human Corporation Co., Seoul, Korea)를 이용하여 570 ㎚에서 흡광도를 측정하였다.
Griess assay
산돌배 열매추출물의 RAW264.7세포에서 nitric oxide (NO) 생성에 미치는 영향은 Griess assay로 측정하였다(Seo and Jeong, 2020). RAW264.7세포를 96-well plate에 well 당 2 × 105 cells로 배양하여 세포가 well에 90%이상 찼을 때, 산돌배 열매추출물을 농도별 처리하고 24시간 동안 배양시켰다. 24시간 후, 세포배양액과 Griess 시약(Sigma-Aldrich, St. Louis, MO, USA)을 1:1 비율로 희석하여 상온에서 15분간 반응시킨 후, UV/Visible spectrophotometer (Xma-3000PC, Human Corporation Co., Seoul, Korea)를 이용하여 540 ㎚에서 흡광도를 측정하였다.
Neutral red assay
산돌배 열매추출물의 RAW264.7세포의 포식작용에 대한 영향은 neutral red assay로 측정하였다. RAW264.7세포를 12-well plate에 well 당 1 × 106 cells로 배양하여 세포가 well에 90% 이상 찼을 때, 산돌배 열매추출물을 농도별 처리하고 24시간 동안 배양시켰다. 24시간 후 세포배양액을 제거하고 100 μL의 0.1% neutral red 용액(Sigma-Aldrich, St. Louis, MO, USA)으로 37℃에서 3시간 동안 세포를 염색시켰다. 3시간 후, 각 well에 lysis buffer (ethanol/acetic acid = 1:1) 200 μL를 첨가하여 세포로 흡수된 neutral red를 용출시켜 UV/Visible spectrophotometer (Xma-3000PC, Human Corporation Co., Seoul, Korea)를 이용하여 540 ㎚에서 흡광도를 측정하였다.
SDS-PAGE and Western blot analysis
세포로부터 단백질을 추출하기 위해, 처리 후 세포를 4℃에서 유지된 1 × phosphate-buffered saline (PBS)로 2회 세척한 후, protease inhibitor cocktail (Sigma-Aldrich Co.)과 phosphatase inhibitor cocktail (Sigma-Aldrich Co.)이 포함된 radioimmunoprecipitation buffer (Boston Bio Products, Ashland, MA, USA)를 4℃에서 30분간 처리하여 단백질을 추출하였다. 추출된 단백질은 Bicinchoninic acid protein assay (Pierce Biotechnology Inc., Waltham, MA, USA)로 정량분석 후, 동일량의 단백질을 10% SDS-acrylamide gel로 전기영동하고 PVDF membrane (Bio-Rad, Hercules, CA, USA)에 이동시킨 후 5% non-fat dry milk로 상온에서 1시간 동안 blocking 하였다. 1시간 후, 1차 항체를 5% non-fat dry milk에 용해시켜 4℃에서 16시간 동안 반응시킨 후 membrane을 0.05% tween-20이 포함된 tris-buffered saline (TBS-T)로 5분간 3회 세척하였다. 그 후 2차 항체는 5% non-fat dry milk에 용해시켜 membrane에 상온에서 1시간 처리하였고, TBS-T로 5분간 3회 세척 후 membrane은 ECL western blotting substrate (Amersham Biosciences Co., Little Chalfont, England)를 이용하여 단백질을 확인하였다.
Reverse transcriptase-polymerase chain reaction (RT-PCR)
세포에서 RNA를 추출하기 위해서 세포를 4℃에서 유지된 1 × PBS로 2회 세척한 후, RNeasy Mini kit (QIAGEN GmbH., Hilden, Germany)를 이용하여 total RNA를 추출하였다. 1 ㎍의 total RNA를 Verso cDNA synthesis kit (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 cDNA를 합성하였다. PCR은 PCR Master Mix Kit (Promega Co., Madison, WI, USA)를 이용하여 수행되었고, 사용된 primer는 Table 1과 같다.
Table 1.
Sequence of oligonucleotide primers used for RT-PCR
통계분석
모든 결과는 3 회 반복 측정 후 평균 ± 표준편차로 나타내었고, 처리간 유의성은 Student’s t-test로 검증하여 p-value 값이 0.05 미만일 때 통계적으로 유의하다고 판정하였다(Microsoft Exel 2010, Microsoft, Redmond, WA, USA).
결과 및 고찰
산돌배 열매추출물의 대식세포 활성화 유도
COVID-19가 성행하고 있는 요즘, 인체의 면역증진에 대한 관심이 높아지고 있다. 그리하여 우리는 인체의 면역증진 활성이 있는 천연물 소재를 탐색하기 위해 돌배나무 열매의 대식세포 활성화 유도에 대한 효과를 분석하였다. 외부 병원체에 의해 활성화된 대식세포에서 분비되는 NO는 직접적으로 외부병원체를 파괴하는 것으로 알려져 있다(Foley and O’Farrell, 2003; Nathan and Shiloh, 2000). IL-1β는 대식세포의 항원 제시 활성과 T-세포의 생존능을 증가시키고, 다양한 선천성 면역세포의 활성화를 유도한다고 알려져 있다(Seillet et al., 2014). IL-6는 T-세포와 B-세포의 분화를 촉진 시키고, 대식세포의 포식작용을 활성화하는데 관여하는 것으로 여겨지고 있다(Neurath, 2014; Scheller et al., 2011; Wang et al., 2018). 그리고 TNF-α는 대식세포의 포식작용을 유도하여 외부 병원체를 제거한다고 보고되고 있다(Barbara et al., 1996). 이처럼 대식세포는 선천성 면역반응과 후천성 면역반응을 강화해 외부 병원체로부터 인체를 보호하는 데 중요한 역할을 한다. 따라서 대식세포 활성화를 통해 NO, iNOS, IL-1β, IL-6 및 TNF-α와 같은 면역증진 인자의 분비를 증가시키는 천연물은 잠재적인 면역증진 활성을 갖는 것으로 간주되고 있다.
마우스 대식세포인 RAW264.7 세포에 산돌배 열매추출물(PUF)을 처리하고 24시간 후, 대식세포에서 분비되는 면역증진인자를 측정한 결과, 를 측정한 결과, 산돌배 열매추출물이 처리된 RAW264.7세포에서 NO, iNOS, IL-1β, IL-6 및 TNF-α의 생성이 증가하는 것으로 나타났다(Fig. 1A and 1B). 대식세포의 면역증진 인자의 생성 증가는 대식세포의 포식작용 활성화를 의미하기 때문에, neutral red staining을 통해 산돌배 열매추출물이 대식세포의 포식작용을 활성화하는지 확인하였다. 그 결과, 산돌배 열매추출물이 처리된 RAW264.7세포에서 neutral red의 흡수가 증가하였고, 이는 산돌배 열매추출물이 대식세포의 활성화를 유도한다는 것을 나타낸다(Fig. 1C). 비록 활성화된 대식세포에서 분비되는 면역증진 인자가 신체의 면역체계를 강화하는 것으로 알려져 있으나, 과도한 면역증진 인자의 생성은 대식세포에 세포독성을 유발하는 것으로 보고되고 있다. 그리하여 산돌배 열매추출물에 의한 RAW264.7세포의 세포독성을 평가한 결과, 산돌배 열매추출물은 RAW264.7세포의 세포생존능을 증가시키는 것으로 나타났다(Fig. 1D). 본 결과를 미루어 볼 때, 산돌배 열매추출물은 대식세포의 면역증진 인자의 발현을 유도하여 인체의 면역시스템을 강화시킬 수 있는 것으로 판단된다.

Fig. 1.
Effect of PUF on macrophage activation in RAW264.7 cells. RAW264.7 cells were treated with PUF for 24 h. NO level (A), mRNA level (B), phagocytic activity (C) and cell viability (D) were measured by Griess assay, RT-PCR, neutral red assay and MTT assay, respectively. *P < 0.05 compared to the cells without the treatment.
TLR2와 TLR4가 산돌배 열매추출물이 처리된 대식세포에서 면역증진 인자 생성에 미치는 영향
외부 병원체의 병원체 관련 분자 패턴(Pathogen-associated molecular patterns)을 인식하는 수용체 중 하는 대식세포의 toll-like receptors (TLRs)은 면역증진 인자를 분비하여 선천성 면역반응을 개시하고, 항원 특이적 면역반응인 후천성 면역반응에도 관여한다고 보고되고 있다(Janeway and Medzhitov, 2002). 그리하여, TLRs는 외부 병원체를 제거하는데 필수적이라고 여겨지고 있다(Kawasaki and Kawai, 2014). 최근 TLRs 중 TLR2와 TLR4는 면역 보조제 개발의 중요한 표적으로 활용되고 있다(Toussi and Massari, 2014). TLR4를 자극하는 lipopolysaccharide (LPS)는 강력한 면역자극 활성을 가지고 있어 백신 임상연구의 면역 보조제로의 연구가 수행되었으나, LPS의 독성으로 인해 사용이 제한되고 있다(Toussi and Massari, 2014). 그리하여, 대식세포에서 산돌배 열매추출물에 의한 면역증진 인자생성에 TLR2와 TLR4가 관여하는지 평가하기 위해, RAW264.7 세포에 TLR2 억제제인 C29와 TLR4 억제제인 TAK-242를 2시간 전처리하고 산돌배를 24시간 병용 처리한 후 면역증진인자의 생성을 측정하였다. 그 결과, TAK-242가 처리된 RAW264.7세포에서 산돌배 열매추출물에 의한 NO, iNOS, IL-1β, IL-6 및 TNF-α의 생성이 주목할만 하게 억제되는 것으로 나타났다(Fig. 2A and 2B). 게다가, 산돌배 열매추출물에 의한 NO, iNOS, 그리고 TNF-α의 생성이 C29의 처리에 의해 다소 감소하는 것으로 나타났다(Fig. 2A and 2B). 볼 결과를 미루어 볼 때, 산돌배 열매추출물은 TLR2와 TLR4를 자극하여 면역증진 인자의 생성을 유도하기 때문에, 산돌배 열매추출물은 면역보조제 개발을 위한 천연소재로 사용될 수 있을 것으로 판단된다.
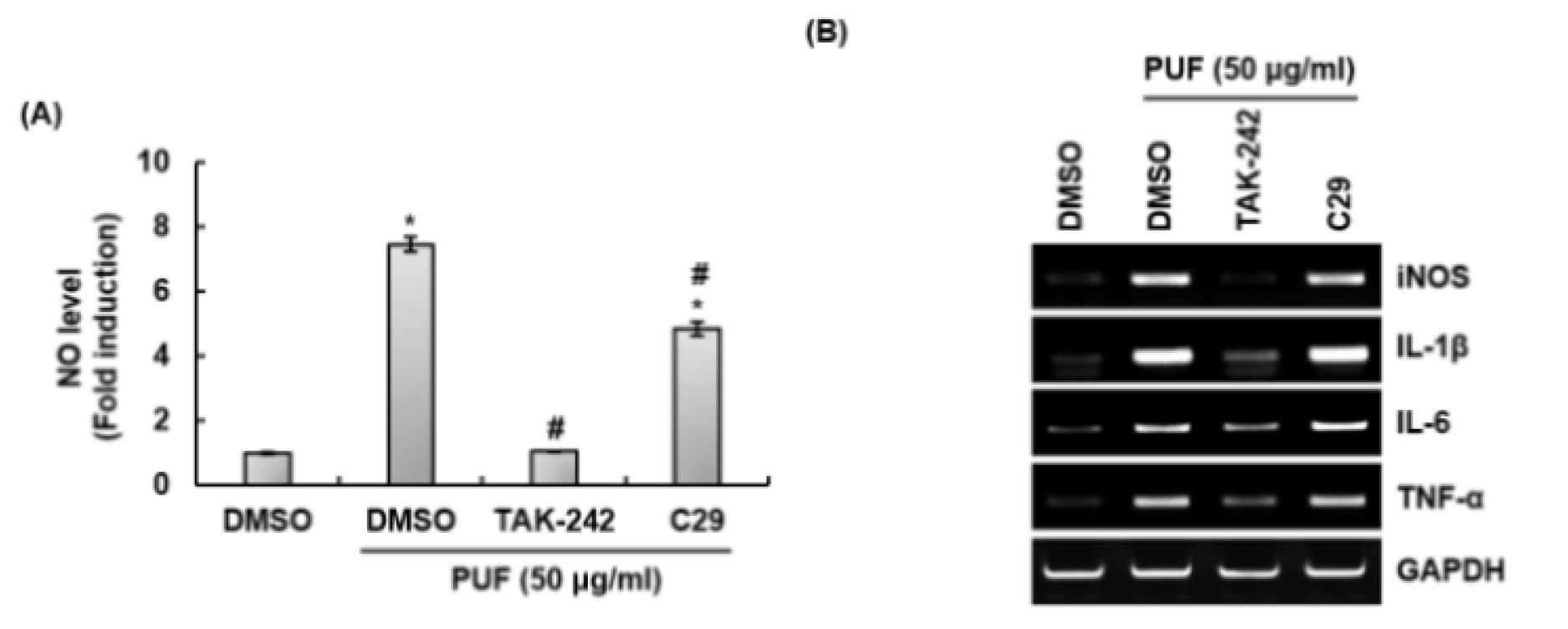
Fig. 2.
Effect of TLR2 and TLR4 on the production of immune enhancing factors in PUF-treated RAW264.7 cells. RAW264.7 cells were pretreated with C29 (TLR2 inhibitor, 100 μM) or TAK-242 (TLR4 inhibitor, 5 μM) for 2 h and co-treated with PUF (50 ㎍/mL) for 24 h. NO level (A) and mRNA level (B) were measured by Griess assay and RT-PCR, respectively. *P < 0.05 compared to the cells without the treatment. #P < 0.05 compared to the cells with PUF alone.
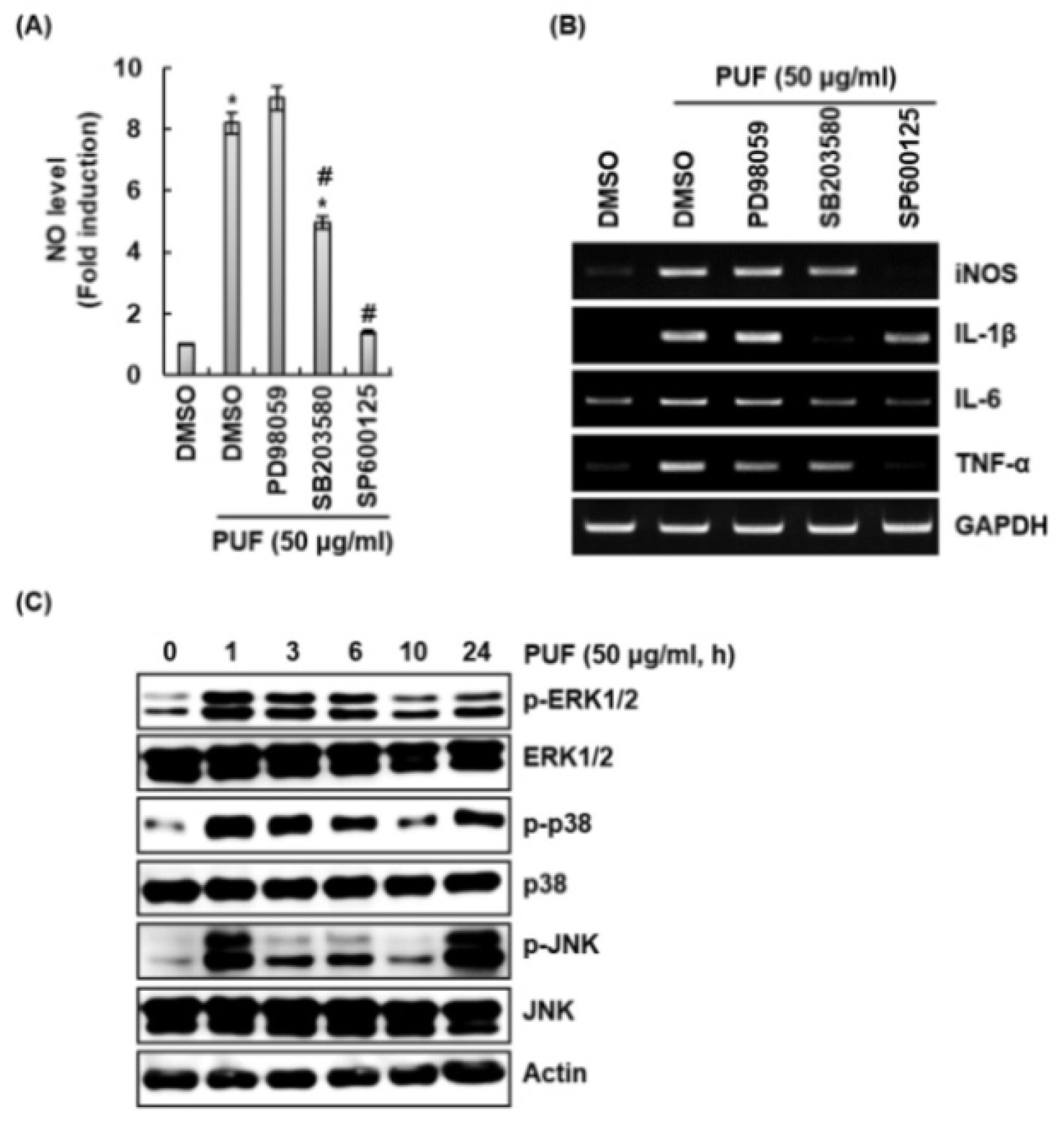
MAPKs 신호전달이 산돌배 열매추출물이 처리된 대식세포에서 면역증진 인자 생성에 미치는 영향
Mitogen-activated protein kinases (MAPKs) 신호전달 활성화는 대식세포의 면역반응 개시와 TLRs 신호에 의한 후천성 면역반응의 준비 및 조절에 관여하는 것으로 보고되고 있다(Reiling et al., 2001; Zhang et al., 2013). MAPKs 신호전달은 extracellular signal-regulated kinases 1/2 (ERK1/2), p38 그리고 c-Jun N-terminal kinases (JNK)로 구성되어 있으며(Wada and Penninger, 2004), 동시에 또는 독립적으로 활성화되어 대식세포에서 NO, iNOS, IL-1β, IL-6 및 TNF-α와 같은 면역증진 인자의 생성에 관여한다고 알려져 있다(Lee et al., 1994; Nick et al., 1996). 그리하여 MAPKs 신호전달이 산돌배 열매추출물에 의한 면역증진 인자 생성에 미치는 영향을 조사하기 위해, RAW264.7세포에 MAPKs 신호전달 억제제를 2시간 전처리하고 산돌배 열매추출물을 24시간 병용처리 한 후 면역증진 인자의 생성을 측정하였다. 산돌배 열매추출물에 의해 생성되는 NO, iNOS, IL-1β 그리고 IL-6는 SB203580에 의한 p38 억제와 SP6001250에 의한 JNK 억제에 의해 감소되는 것으로 나타났다(Fig. 3A and 3B). 산돌배 열매추출물에 의해 생성되는 TNF-α는 PD98059에 의한 ERK1/2 억제, SB203580에 의한 p38 억제와 SP6001250에 의한 JNK 억제에 의해 감소되는 것으로 나타났다(Fig. 3B). 게다가, 산돌배 열매추출물은 ERK1/2, p38 및 JNK의 인산화를 유도하였고, 이는 산돌배 열매추출물이 MAPKs 신호전달을 활성화시키는 것을 의미한다(Fig. 3C). 본 결과를 미루어 볼 때, ERK1/2, p38 및 JNK가 산돌배 열매추출물에 의한 면역증진 인자 생성에 독립적으로 작용하지만 MAPKs 신호전달이 산돌배 열매추출물 매개 면역증진 인자 생성에 관여하는 것으로 판단된다.