서 언
재료 및 방법
시약 및 재료
추출물 제조
분석시료 조제
기기분석조건
세포배양 및 분화
세포생존율 측정
Triglyceride 생성량 측정
통계분석
결과 및 고찰
땅콩 및 땅콩새싹 추출물 내 화합물 정량 분석
땅콩 및 땅콩새싹 추출물의 지방세포분화 억제활성평가
적 요
서 언
땅콩(Arachis hypogaea)은 장미목 콩과에 속하는 1년생 식물이며 땅속에서 자라는 종자를 주로 식용한다. 땅콩은 국내 연간 소비량이 약 40,000 톤에 이르는 단백질과 지방이 풍부한 주요한 식품자원으로서 우리나라에서는 중부이남지역에서 재배되고 있다(Park and Park, 2002). 땅콩에 함유되어 있는 대표적인 페놀성 성분으로는 resveratrol (Fig. 1)이 있으며(Lee et al., 2003), resveratrol의 생리활성으로는 항비만(Chen et al., 2011; Springer and Moco, 2019), 항염증(Zhang et al., 2019), 항산화(Lastra and Villegas, 2007), 항암(Rauf et al., 2018), 심혈관보호(Bonnefont-Rousselot, 2016), 뇌신경 보호(Lopez et al., 2015) 등이 알려져 있다. 발아는 활성 및 영양성분을 증가시키기 위해 자주 사용되는 방법이다(Lim et al., 2020). 최근에는 땅콩을 발아시킨 땅콩새싹에 대한 항산화와 피부미백(Yoon, 2016), 숙취해소(Kim and Jin, 2016), 배변 촉진(Seo et al., 2013), 항염증(Lee et al., 2019) 등에 대한 보고가 잇따르고 있다. 특히 땅콩새싹에는 resveratrol 함량이 특이적으로 증가되며, aspartic acid (Fig. 1) 함량 역시 높다고 보고된 바 있으나(Adhikari et al., 2018; Kang et al., 2010) 이들 연구는 주로 메탄올 추출물에 대한 분석결과로 식품 산업에서 원료제조에 주로 쓰이는 추출용매인 열수 및 발효주정을 이용하여 제조된 추출물에 함유된 resveratrol 및 aspartic acid 함량을 직접적으로 동시 분석하여 비교한 연구는 보고된 바가 없다. 따라서 본 연구에서는 땅콩과 땅콩새싹을 식용 가능한 용매인 열수와 발효주정을 이용하여 추출물을 제조하고 각각의 추출물의 resveratrol 및 aspartic acid 함량을 UPLC-MS/MS를 이용하여 분석 비교하고 지방세포분화 억제효과를 측정하여 기능성 식품제조를 위한 적정 추출조건을 찾고자 하였다.
재료 및 방법
시약 및 재료
땅콩은 2019년 9월 전북 고창군 고창읍 지역에서 생산된 볶지 않은 속껍질 포함 생땅콩(kernel with testa)을 산지구입하여 사용하였고 땅콩새싹(sprout)은 땅콩을 7일간 수경재배하여 발아시킨 전체를 사용하였다. Resveratrol과 aspartic acid는 Sigma-Aldrich (St. Louis, MO, USA) 사로부터 구입하여 사용하였다. Formic acid (FA) 또한 Sigma-Aldrich 사에서 구매하였고 정량 분석에 사용한 물과 메탄올은 LCMS 등급을 Merck (Darmstadt, Germany)사에서 구매하여 사용하였다. 추출물을 여과하기 위한 0.2 ㎛ PVDF 필터는 Whatman (Maidstone, UK) 사로부터 구입하여 사용하였다.
추출물 제조
땅콩과 땅콩새싹을 건조 후 파쇄 하고 70% 발효주정과 증류수를 사용하여 각각 50℃와 100℃에서 3시간씩 2번 반복하여 환류추출 하였다. 얻어진 상등액을 여과 후 감압농축 및 동결건조 하여 제조된 고형 추출물을 -20℃에 보관하면서 실험시료로 사용하였다.
분석시료 조제
각 화합물을 50% 메탄올을 가해 4 ㎎/mL가 되도록 표준 원액을 각각 조제하였다. 조제한 두 표준 원액들은 동시 분석을 위해 혼합하여 각 추출물 시료에 대한 검량곡선을 작성하는데 사용하였다. 검량곡선을 위한 표준용액을 제조하기 위하여 LCMS 등급의 물을 사용하여 희석하였으며 표준용액은 실험 직전에 제조하여 바로 사용되었다.
땅콩과 땅콩새싹 추출물 내 resveratrol과 aspartic acid의 함량을 확인하기 위해 standard addition 방법을 활용하였다. 먼저 정량을 위해 고형 추출물을 centrifugal tube에 계량한 뒤, 추출물의 농도가 4 ㎎/mL가 되도록 50% 메탄올과 초음파를 가하였다. 제조된 추출물 용액을 주사기 필터(0.2 ㎛, Whatman PTFE syringe filter)로 여과한 뒤, 추출물의 농도가 0.1 ~ 4.0 ㎎/mL가 되도록 물을 사용하여 희석하였다. 이후 희석된 추출물 용액을 198 μL씩 3개의 centrifugal tube에 분취한 뒤, 각 화합물의 농도가 0, 100, 200 ng/mL가 되도록 각각 물 2 μL, 물 1 μL와 20 ㎍/mL 희석된 표준용액 1 μL, 20 ㎍/mL 희석된 표준용액 2 μL을 더하여 vortexing하였다. 제조된 혼합 용액들은 UPLC-MS/MS로 측정하였다.
기기분석조건
본 연구의 모든 화합물 정량 분석 결과는 UPLC 시스템이 결합된 삼중 사중극자 질량분석기(Xevo TQ-MS, Waters, Manchester, U.K.)를 활용해 얻은 데이터에서 추산되었다. 추출물 내 matrix와의 분리를 위해서 Waters사의 ACQUITY UPLC HSS C18 Vanguard Pre-column (1.8 ㎛, 2.1 × 5 ㎜)과 ACQUITY UPLC HSS C18 column (1.8 ㎛, 2.1 × 100 ㎜)을 분석용 column을 사용하였다. 0.1% FA 함유 물과 0.1% FA 함유 메탄올이 각각 이동상 용매 A와 B로 사용되었으며, 모든 시간에서 용매 유속은 0.2 mL/min로 하였다. 표적 화합물들을 matrix와 분리시키기 위해 column oven temperature를 40℃로 유지하였고, 시간 별로 용매 gradient를 바꿔주었다. 시간별 gradient 조건은 Table 1과 같으며 각 시료는 5 μL씩 주입하였다. Resveratrol과 aspartic acid의 intact ionization을 위해 질량분석기의 capillary voltage, source temperature, desolvation temperature, desolvation gas flow rate는 각각 2.9 kV, 150℃, 500℃, 1000 L/Hr로 설정되었다. 측정을 위해 Waters사의 Intellistart software를 통해 두 물질의 multiple reaction monitoring (MRM) 조건을 설정하였다. 두 ion mode에서 MRM 조건을 조사한 결과, aspartic acid에서는 positive ion mode의 m/z 134.05과 74.00이 전구 이온(precursor ion)과 생성 이온(product ion)으로 선택되었으며, 해당 이온들의 측정을 위한 cone voltage와 collision energy는 각각 12 V와 12 V가 선정되었다. Resveratrol의 경우, positive ion mode에서 m/z 229.10과 107.05가 각각 전구 이온과 생성 이온으로 선택되었으며, 해당 이온들을 위한 cone voltage와 collision energy는 각각 24 V와 24 V가 선정되었다. 본 연구에서 제시한 검출한계(Limit of detection, LOD)와 정량한계(Limit of quantitation, LOQ)는 IUPAC에서 제공한 식을 통하여 산출하였다.
Table 1.
The UPLC solvent gradient condition utilized in the present study
| Time (min) | solvent B percentage |
| 0.0~1.0 | 0% B |
| 1.0~16.0 | linear increase from 0% B to 90% B |
| 16.0~17.0 | 90% B |
| 17.0~17.5 | linear decrease from 90% B to 0% B |
| 17.5~22.0 | 0% B |
세포배양 및 분화
마우스 유래 3T3-L1 지방전구세포는 American Type Culture Collection (ATCC, Manassas, VA, USA)으로부터 분양받아 사용하였다. Fetal bovine serum (FBS, Gibco, Grand Island, NY, USA) 10%와 1% Penicillin-Streptomycin (PS, Gibco, Grand Island, NY, USA)가 함유된 DMEM 배지를 사용하여 37℃, 5% CO2 조건에서 배양하였다. 세포를 48 well plate에 키운 후 hormone mixture (10 ㎍/mL insulin, 0.5 μM dexamethasone, 0.5 mM IBMX)를 48시간 동안 처리하였다. 이후 Insulin이 포함된 DMEM 배지로 교환하고 땅콩과 땅콩새싹 추출시료를 8일간 처리하면서 adipocytes로의 분화를 관찰하였다.
세포생존율 측정
시료처리가 완료된 후 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) 를 0.5 ㎎/mL 농도로 첨가하고 37℃에서 4시간 동안 배양하였다. MTT solution을 제거 후 DMSO를 200 μL 첨가하고 540 ㎚에서 흡광도를 측정하였다.
Triglyceride 생성량 측정
시료처리가 완료된 세포를 PBS로 2회 세척한 후 3.7% formaldehyde로 고정시켰다. Oil Red O dye와 1시간 동안 배양한 후 isopropanol을 가하고 510 ㎚에서의 흡광도를 측정하였다.
통계분석
실험결과는 평균±표준편차(means±SD)로 표시하였으며 Student’s t-test로 분석하였고 P < 0.05일 때 유의성이 있는 것으로 판단하였다.
결과 및 고찰
땅콩 및 땅콩새싹 추출물 내 화합물 정량 분석
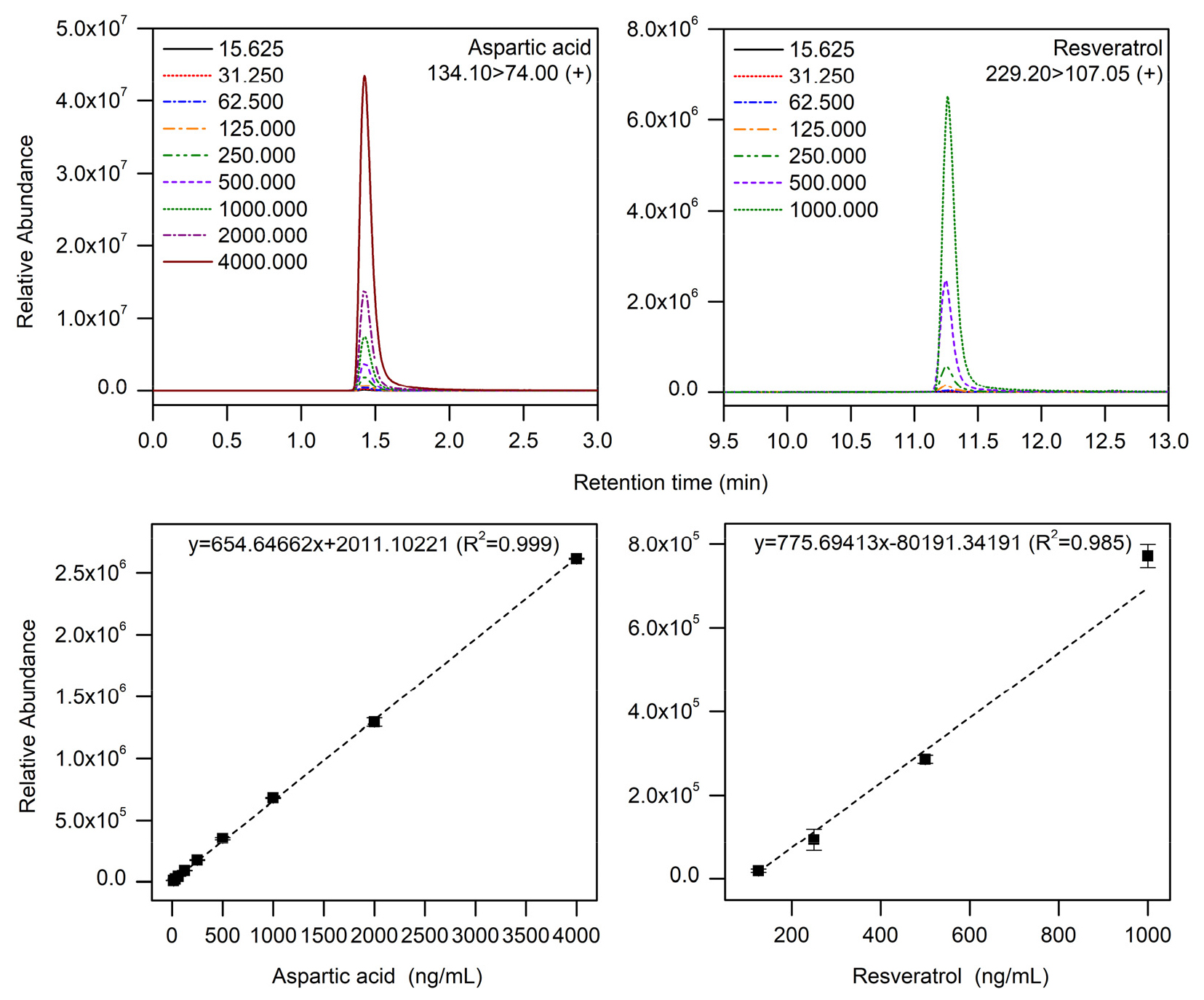
다양한 용매 조건을 시도하여 땅콩 및 땅콩새싹 추출물 내 resveratrol과 aspartic acid 분석에 적합한 UPLC-MS/MS 조건을 수립하였다(Table 2). UPLC 조건을 수립하기에 앞서 각 화합물에 대한 tandem MS 상 생성 이온의 질량-대-전하 비(mass-to-charge ratio, m/z)를 확인하기 위해 positive ion mode에서 제조한 표준 용액을 이용하여 전구 이온 및 생성 이온을 조사하였다. Aspartic acid의 경우, 전구 이온 및 생성 이온이 각각 m/z 134.05 및 m/z 74.00일 때 다른 물질의 방해 없이 높은 감도를 가지며 분석이 가능함을 확인하였다. 또한 resveratrol의 경우, m/z 229.10 및 m/z 107.05에서 전구 이온 및 생성 이온이 관찰됨을 확인하였다. 다음으로 위 MS 조건을 기반으로 두 화합물의 UPLC 조건을 확인하였다. Table 2에 기재된 UPLC-MS/MS 조건으로 15.625 ~ 1000.000 ng/mL 사이의 표준용액을 분석하였을 때, aspartic acid과 resveratrol의 머무름 시간은 각각 1.43분과 11.26분임을 확인하였다(Fig. 2). 이후 제조한 표준 용액들을 해당 머무름 시간 영역에서 측정하여 검량곡선의 직선 범위 및 검출한계(limit of detection, LOD) 값을 조사하였다. Fig. 2와 Table 2에서 볼 수 있듯이, aspartic acid의 경우 약 6.5 ng/mL의 검출한계를 가지며 15.625 ~ 4000.000 ng/mL 안에서 검량곡선의 직선성이 유지되고(R2 = 0.999), resveratrol의 경우 125.000 ~ 1000.000 ng/mL의 직선 범위와 5.0 ng/mL의 검출한계를 가짐을 확인하였다.
Table 2.
UPLC-MS/MS conditions of aspartic acid and resveratrol. All values obtained in this table were obtained by repeating the UPLC-MS/MS experiments three times
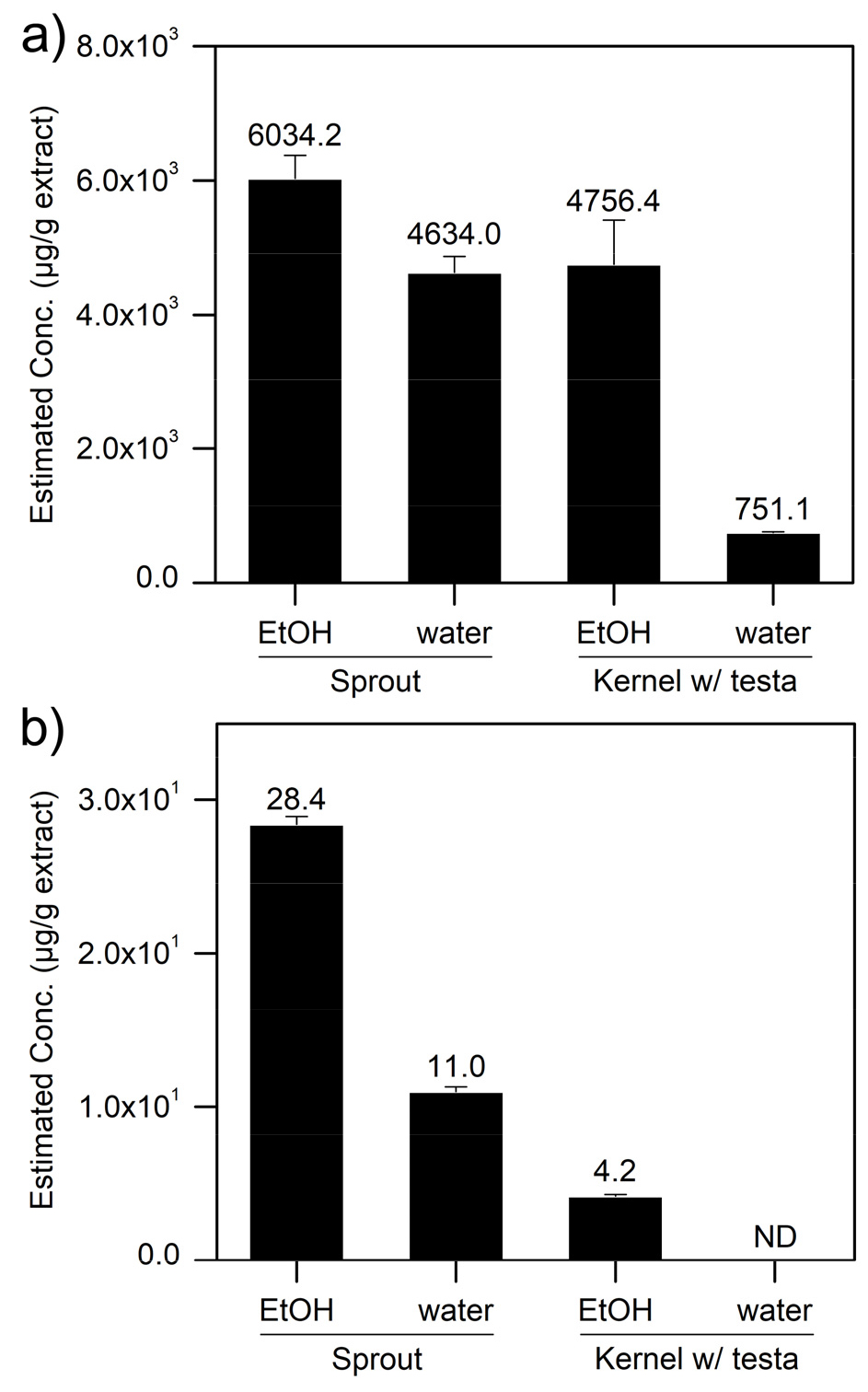
땅콩과 땅콩새싹 고형 추출물 내 aspartic acid와 resveratrol의 함량을 확인하기 위해 본 연구에서는 standard addition 방법을 도입하였다. 분석을 위해 재용해한 추출물 용액에 표준용액을 spike하여 추출물 용액 내 표적 화합물의 농도 차가 0, 100, 200 ng/mL이 되도록 추출물 용액을 조성하고 각 용액을 UPLC-MS/MS로 측정하였다. 전체 추출물의 농도는 추출물 용액 내 각 화합물의 농도에 알맞게 0.1 ~ 4.0 ㎎/mL 사이에서 조정하였다. 측정결과 Fig. 3에서 볼 수 있듯이 두 화합물들의 머무름 시간이 추출용매 그리고 원물의 추출 부위에 관계없이 모두 표준용액의 머무름 시간과 동일함을 확인하였다. 다음으로 표준용액을 첨가한 추출물 용액들 사이의 농도 차를 이용하여 각 땅콩 추출물 용액 내 aspartic acid와 resveratrol의 농도를 추정해 보았다. Fig. 4에서 볼 수 있듯이 모든 땅콩과 땅콩새싹 추출물에서 aspartic acid가 존재하며 751.1 ~ 6034.2 ㎍/g 함량을 가짐을 확인하였다. Aspartic acid와 달리 resveratrol의 경우 땅콩의 열수 추출물에서는 관찰되지 않았으며, 나머지 세 시료에서 resveratrol은 4.2 ~ 28.4 ㎍/g 추출물 농도로 존재함을 확인하였다(Fig. 4). 두 화합물 모두 땅콩새싹의 주정 추출물에서 가장 농도가 높았으며, 원물 추출 부위에 관계없이 두 화합물 모두 열수 추출에 비해 주정 추출물에서의 함량이 높았다. Aspartic acid의 경우 열수 추출에 비해 주정 추출물에서 1.3 ~ 6.3배 많이 추출되었으며, resveratrol의 경우 주정 추출물에서 2.6배 더 많이 추출되었다. Chiou et al. (1997), 그리고 Kang et al. (2010)은 땅콩이 발아함에 따라 aspartic acid의 함량이 증가됨을 보고한 바 있다. 또한 기존 연구들에서 땅콩에서 보다 땅콩새싹에서 더 높은 resveratrol 함량을 가지며, 땅콩에서 0.08-7.84 ㎍/g 그리고 땅콩새싹에서 11.7-19.9 ㎍/g의 농도로 존재한다고 보고된 바 있다(Chukwumah et al., 2007, Chukwumah et al., 2012; Wang et al., 2005). 이러한 보고와 일치하게 본 연구에서도 땅콩새싹의 aspartic acid와 resveratrol 함량이 땅콩보다 높은 것을 확인하였다. 따라서 땅콩 보다 땅콩새싹을, 그리고 열수보다 발효주정을 사용해야 두 화합물들의 함량이 높은 추출물을 얻을 수 있을 것이라 판단된다. 또한 추출수율 측면에서도 땅콩보다 땅콩새싹의 추출수율이 높아 산업화에 유리할 것으로 사료된다(Table 3).
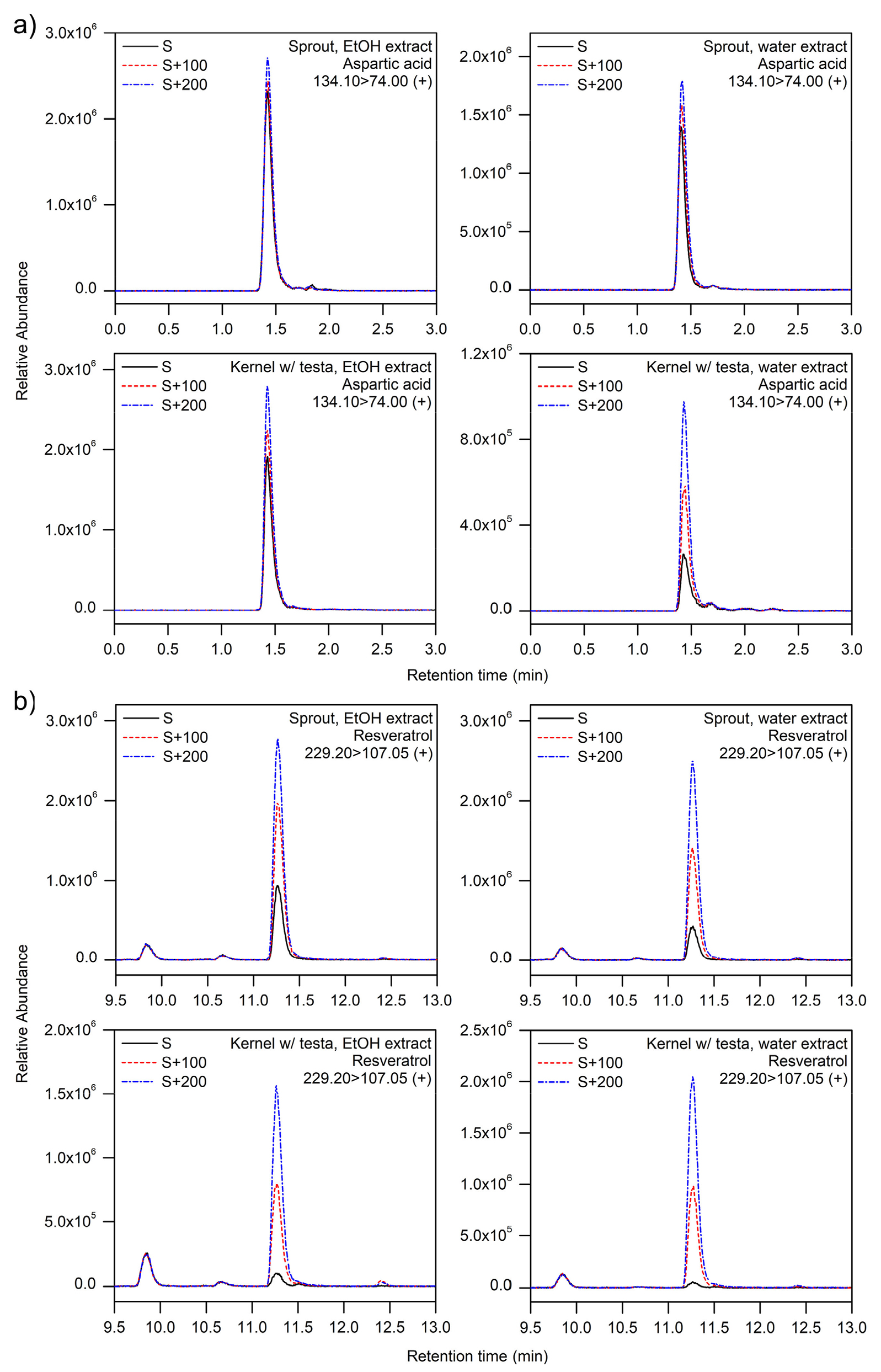
Fig. 3.
UPLC-MS/MS chromatograms of a) aspartic acid and b) resveratrol in the peanut extracts (Arachis hypogaea). ‘S’, ‘S+100’, and ‘S+200’ represent UPLC-MS/MS chromatograms of the sample solution, sample solution with aspartic acid and resveratrol of 100 ng/mL, and sample solution with aspartic acid and resveratrol of 200 ng/mL, respectively.
Table 3.
Extraction yields of peanut and peanut sprout
| Peanut | Water extracts | Fermented ethanol extracts |
| Kernel w/ testa | 8.1% | 12.2% |
| Sprout | 33.0% | 28.1% |
땅콩 및 땅콩새싹 추출물의 지방세포분화 억제활성평가
3T3-L1 세포를 사용하여 땅콩 및 땅콩새싹 주정 추출물의 지방세포분화 억제효과를 측정한 결과는 Fig. 5에 나타내었다. 측정결과 가장 높은 resveratrol 및 aspartic acid 함량을 나타낸 땅콩새싹 주정 추출물이 100 ppm에서 세포독성 없이 20.7%의 지방세포분화억제 효과를 보여 동일 농도의 땅콩 추출물보다 억제활성이 높았다. Kim et al. (2013)과 Kang et al. (2014)은 땅콩새싹 에탄올 추출물이 지방조직에서 peroxisome proliferator-activated receptor (PPAR-γ)의 발현을 억제시키고 지방세포에서의 matrix metalloproteinase-2 (MMP-2)와 matrix metallopeptidase 9 (MMP-9)을 감소시켜 항비만 효과를 나타낸다고 보고한 바 있으며 Chen et al. (2011) 및 Ha et al. (2015)과 Springer and Moco (2019)은 resveratrol이 지방세포분화 및 지방생성을 억제한다고 보고한 바 있어 본 연구의 결과와 일치하는 경향을 나타내었다. 따라서 활성성분의 함량이 높고 식용 가능한 땅콩새싹 주정 추출물은 항비만 등의 기능성 식품소재개발에 활용가능성이 높을 것으로 판단된다.
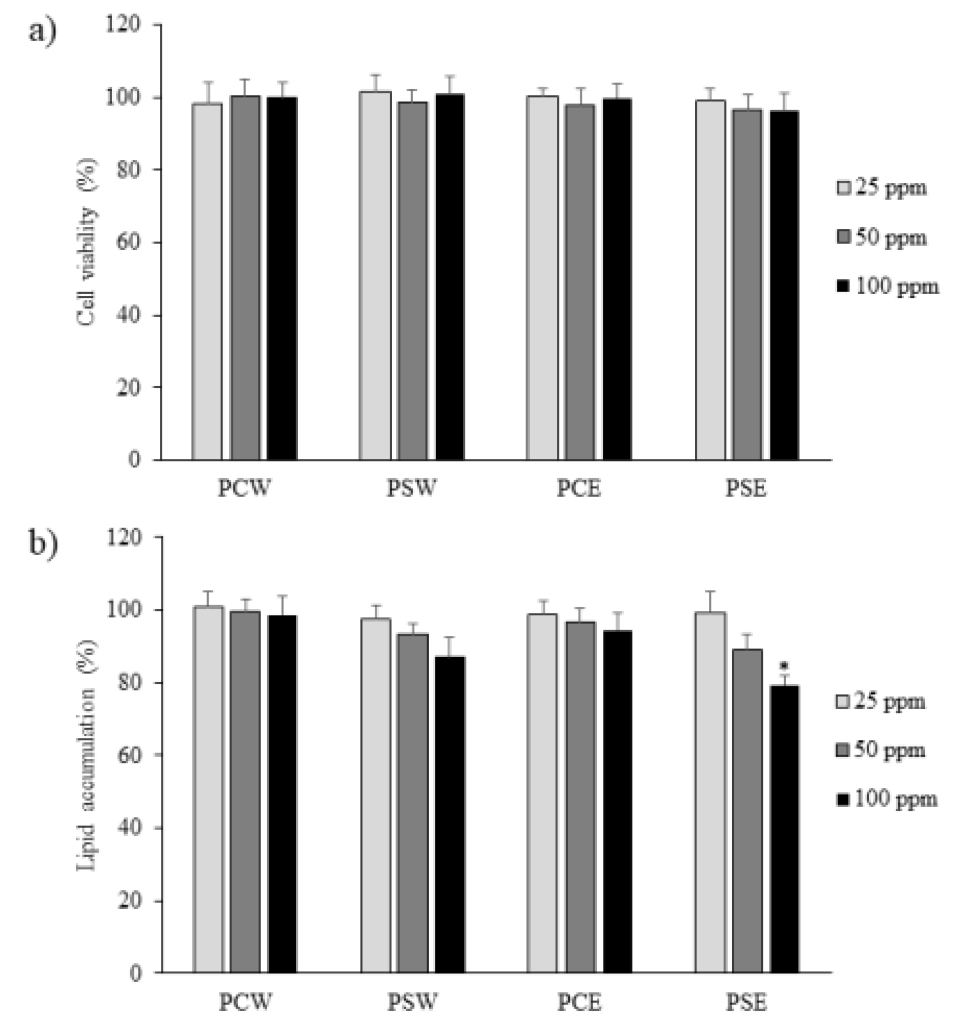
Fig. 5.
Inhibitory effects of peanut extracts on 3T3-L1 cells differentiation. a) Effects on cell viability b) Effects on lipid accumulation. PCW: peanut water extract, PSW: peanut sprout water extract, PCE: peanut fermented ethanol extract, PSE: peanut sprout fermented ethanol extract. *p < 0.05 compared with untreated group.
적 요
식품산업 활용성을 고려하여 땅콩과 땅콩새싹의 열수와 주정 추출물을 제조하고 추출물내 resveratrol과 aspartic acid 함량을 UPLC-MS/MS를 이용하여 분석한 결과 땅콩새싹의 주정추출물이 가장 높은 resveratrol과 aspartic acid 함량을 나타내었다. 또한 땅콩새싹의 주정 추출물은 3T3-L1 세포에 처리시 지방세포분화를 유의적으로 억제하였다. 따라서 땅콩새싹의 주정추출물은 기능성식품소재로 활용 가능성이 높을 것으로 판단된다. 향후 이러한 결과를 바탕으로 땅콩의 발아조건 및 추출시간과 온도에 따른 활성성분 함량을 측정하여 최적의 활성성분 추출조건을 확립하는 연구를 진행할 계획이다.