서 언
재료 및 방법
실험 재료
작약 유박 추출물 제조
총 폴리페놀 및 플라보노이드 함량
항산화 활성
항균 활성
항염증 활성
통계분석
결과 및 고찰
추출용매별 작약 유박 추출물의 수율 비교
작약 유박 추출물의 총 폴리페놀 및 플라보노이드 함량 비교
작약 유박 추출물의 항산화 활성 비교
작약 유박 추출물의 항균 활성 비교
작약 유박 추출물의 항염증 활성 비교
적 요
서 언
화장품 및 식품 분야에서 천연물 기능성 소재에 대한 중요성이 대두됨에 따라 소재 개발 연구가 급증하고 있다. 이러한 연구들은 식물의 전초 뿐만 아니라 줄기, 근경, 꽃 및 종자에 이르기까지 다양한 식물소재가 연구에 활용되고 있다(Alkhalaf et al., 2019; Chan et al., 2012; Jahanban-Esfahlan et al., 2019; Liu et al., 2016). 천연물 소개 개발 연구는 기존에 이용되던 식물 외에도 생리활성이 우수하고 고부가가치 작물로 활용될 수 있는 식물에 대한 관심을 증가시켰다. 또한 나고야의정서에 의한 타국의 유전자원 사용에 대한 규제로 인해 국내 자원식물에 대한 가치는 높아졌으며, 이는 높은 가치를 갖는 국내 자원식물의 활용에 기회가 될 수 있다.
작약(Paeonia lactiflora Pall.)은 미아리아재비과(Ranunculaceae)에 속하는 다년생 초본식물로 작약속(Paeonia spp.)에는 전세계적으로 약 30여 종이 있으며(Lee et al., 2022c), 우리나라에는 작약, 백작약[Paeonia japonica (Makino) Miyabe & Takeda] 및 산작약(Paeonia obovata Maxim.) 등이 자생하고 있다(Kim et al., 2006; Lee et al., 2022b). 작약은 꽃이 크고 화려하여 관상용으로 가치가 높으며 뿌리는 paeoniflorin, albiflorin, oxipaeoniforin 및 benzolipaeoniforin 등의 약효 성분이 포함되어 항산화, 항암 및 항염증 활성이 우수한 약용식물이다(Eo et al., 2021; Shu et al., 2014). 최근에는 식물뿐만 아니라 작약의 종자에서도 항균, 항염증 및 심혈관질환 예방과 같은 건강상의 이점으로 많은 연구가 진행되었다(Wu et al., 2020; Zhao et al., 2016).
종자 내에는 탄수화물, 단백질, 지질과 같은 필수 영양소가 풍부할 뿐만 아니라 폴리페놀, 카로티노이드 및 비타민 등 다양한 생리활성화합물이 함유되어 있다(Karlsen et al., 2016). 이러한 이점으로 인하여 Daucus carota, Hibiscus cannabinus, Momordica charantia, Salvia hispanica, Vitis vinifera와 같은 다양한 종자의 생리활성화합물을 이용한 미백, 항균, 항염증, 항산화, 보습 및 노화방지 등에 대한 효과가 보고되었으며(Dhar et al., 2015; Dias, 2014; Gupta et al., 2020; Tak et al., 2022; Wang et al., 2022), 식품, 의약 및 화장품 산업에서 종자 오일 또는 추출물로 이용되고 있다(Ahangari et al., 2021). 특히 Paeonia species의 종자 오일에는 올레산, 리놀레산, 리놀렌산과 같은 불포화 지방산이 풍부하여 고부가가치 소재로 활용될 수 있다(Liu et al., 2017)
종자로부터 오일을 추출하는 과정은 다양한 방법이 있으며, 모든 오일 추출과정에서 유박이 발생하게 된다. 이전에는 폐기물로 간주되었지만 최근 연구에서는 생리활성 측면에서 유박의 잠재력이 인정받고 있다(Rakita et al., 2023; Sunil et al., 2015). 유박에는 추출되지 않은 단백질, 탄수화물, 미네랄 및 지질이 잔존하며(Ramadan, 2020), 유박에서 추출한 파이토케미칼은 항산화, 항균 및 건강증진 특성을 나타내어 식품, 제약 및 화장품 산업에서 잠재적으로 응용할 수 있다(Nie et al., 2021; Terpinc et al., 2012). 따라서 이를 활용하는 것은 천연물 소재 개발에 있어 새로운 소재를 발견하고, 소재의 재활용적인 측면에서도 큰 이점을 줄 수 있다.
따라서 본 연구는 작약 종자 오일과 유박 추출물의 항산화, 항균 및 항염증 활성을 비교하여 작약 부산물의 잠재적인 효능을 확인하는 것을 목표로 하였다. 이러한 우리의 연구는 작약 종자 유박의 재활용을 통한 지속가능한 농업의 실천과 새로운 천연물 기능성 소재로의 활용 가능성에 대한 정보를 제공하고자 수행되었다.
재료 및 방법
실험 재료
2021년 9월 안동에서 채종한 작약 종자를 상온에서 건조시킨 뒤 49℃ 이하로 설정된 저온압착기(NF-80, Karaerler, Ankara, Turkey)로 추출하여 종자 오일 및 유박을 획득하였다. 추출된 오일은 감압여과펌프(N810, KNF Neuberger, Inc., Freiburg, Germany)와 여과지(Qualitative Filter Paper, Cytiva, Freiburg, Germany)로 불순물을 제거한 뒤 순수한 오일만을 수집하였다. 유박은 분쇄기(Tube Mill Control, IKA Work, Inc., Staufen, Germany)를 사용하여 분쇄하고, -80℃에 보관하면서 추출물 제조에 사용하였다.
작약 유박 추출물 제조
작약 종자 유박(1 g)는 각 80% 에탄올, 80% 메탄올, 80% 아세톤 및 메탄올:아세톤:증류수(7:7:6, v:v:v)를 이용하여 초음파 수조(Power Sonic 510, Emerson Electric Co., Ferguson, MO, USA)에서 30분간 초음파 추출하였다. 각 추출물은 감압여과펌프와 여과지를 사용하여 여과하였으며, 추출 용매를 이용하여 최종 농도를 50 mL로 정량하였다. 각 추출물은 회전감압농축기(Eyela N-1000, Tokyo Rikakikai Co., Tokyo, Japan)로 농축한 뒤, DMSO (dimethyl sulfoxide)로 재용해하여 항균 및 항염증 분석에 사용하였다. 용매에 따른 추출 수율 및 가용성 고형분은 다음과 같이 계산하였다.
총 폴리페놀 및 플라보노이드 함량
총 폴리페놀 함량 분석은 Folin-Ciocalteu (Boussetta et al., 2011) 방법을 변형하여 측정하였다. 시료 0.1 mL에 2% Na2CO3 2 mL를 혼합한 뒤 3분 후 50% F-C시약을 0.1 mL 첨가하여 30분간 암상태로 반응시켰다. 흡광도는 분광광도계(Libra S22, Biochrom Ltd., Cambridge, UK)를 이용하여 750 ㎚에서 측정하였으며, 표준물질로 gallic acid를 사용하여 표준곡선을 계산하였다.
총 플라보노이드 함량 분석은 diethylene glycol colorimetric (Min et al., 2023) 방법에 따라 시료 0.2 mL에 DEG 2 mL 및 1 N NaOH 0.2 mL를 혼합한 뒤 37℃의 항온수조(BW3-10G, JEIO Tech. Co., Ltd., Daejeon, Korea)에서 1시간동안 반응시켰다. 이후 분광광도계를 이용하여 420 ㎚에서 반응물의 흡광도를 측정하였으며, 표준물질로는 quercetin을 사용하여 표준곡선을 계산하였다.
항산화 활성
ABTS radical 소거능은 decolorization assay 방법인 Lee et al. (2022a)의 방법을 응용하여 수행하였다. 2.6 mM potassium persulfate 12.31 mL와 ABTS 50 ㎎을 암조건의 상온에서 24시간 동안 반응시켜 ABTS radical을 형성한 뒤 24시간 후 시약의 흡광도 값이 732 ㎚에서 0.70±0.03이 되도록 농도를 조절하여 사용하였다. 이후 희석된 ABTS용액 950 μL 시료 50 μL를 혼합하여 vortexing하였으며, 암조건의 상온에서 10분 동안 반응시킨 후 분광광도계를 이용하여 732 ㎚에서 흡광도를 측정하였다. 추출물의 ABTS radical 소거활성은 희석농도 별 전자공여능[Electron Donating Ability (EDA), %]은 아래의 식을 참고하여 계산하였으며, EDA를 50% 감소시키는데 필요한 시료의 농도[Reduction concertation of 50% (RC50), ㎎·mL-1]를 확인하였다.
DPPH radical 소거능은 Blois (1958)의 방법을 이용하여 측정하였다. 시료 0.2 mL에 0.2 mM DPPH 용액 0.8 mL를 혼합하여 암실에서 30분 동안 반응시킨 후 분광광도계를 이용하여 517 ㎚에서 흡광도를 조사하였다. ABTS radical 소거활성과 동일한 방법으로 계산하여 RC50으로 나타내었다.
항균 활성
실험에 사용된 균주는 생물자원센터(KCTC, Korean Collection for Type Cultures, Jeongeup, Korea)에서 분양 받은 그람양성균 Escherichia coli와 그람음성균 Staphylococcus aureus를 tryptic soy broth배지에 3일간 37±1℃에서 계대배양한 후 실험에 사용하였다. 항균 활성 agar diffusion법을 이용하여 측정하였으며, O.D.값이 1.0으로 조절된 미생물 배양액을 tryptic soy agar에 1% 농도로 접종한 뒤, 패트리디쉬(10090, SPL Life Science Co. Ltd., Pocheon, Korea)에 분주하였다. 분주 후 경화된 배지에 40 μL의 시료를 주입한 disc (10614651, Advantec Toyo Roshi International Inc., Utsunomiya, Japan)를 치상하였으며, 이후 4℃에서 1시간동안 반응 후 37℃ incubator (VS-2180C, Vision, Daejeon, Korea)에서 48시간동안 배양하였다. 추출물의 항균 활성은 disc 직경을 포함한 생육 억제환(clear zone, ㎜)의 크기를 배양 후 24 및 48시간에 측정하였다. 추출물의 음성대조군으로 DMSO를 사용하였으며, 양성대조군은 E. coli에서 0.005% triclosan 및 10% lactic acid, S. aureus에서 10% phenoxyethanol 및 5% methylparaben 를 사용하였다.
항염증 활성
한국세포주은행(KCLB, Korean Cell Line Bank, Seoul, Korea)에서 분양 받은 RAW 264.7 대식세포는 100 unit·mL-1 penicillin, 100 ㎍·mL-1 streptomycin 및 10% FBS이 포함된 DMEM 배지를 사용하여 37℃, 5% CO2 조건의 incubator (MCO-170AIC-PE, PHCbi, Osaka, Japan)에서 배양하였다.
이후 추출물의 세포 독성을 확인하기 위하여 MTT [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide] assay를 수행하였다. 96-well plate에 6시간동안 배양한 RAW 264.7 대식세포(1.5×105 cells·well-1)와 10 ㎍·mL-1의 시료를 처리하여 동일한 챔버에서 18시간동안 반응시켰다. 이때, 양성대조군으로는 25 μM의 quercetin을 사용하여 동일하게 실험을 진행하였다. 이후 배지를 제거하고 well당 10 μL의 MTT 용액을 첨가하여 1.5시간동안 반응시켰다. 반응 후 생성된 formazan crystal은 DMSO로 녹여 microplate reader (EPOCH-SN, Agilent, Santa Clara, CA, USA)를 이용하여 550 ㎚에서 흡광도를 측정하였으며, 정상세포에 대한 세포생존율을 백분율로 표시하였다.
RAW 264.7 세포를 이용한 nitric oxide (NO) 생성 저해는 Lee et al. (2015)의 실험방법을 응용하여 측정하였다. 배양된 RAW 264.7 (1.5×105 cells·well-1)에 추출물(10 ㎍·mL-1)과 LPS (1 ㎍·mL-1)를 처리한 후 18시간 동안 37℃, 5% CO2 incubator에서 배양하였다. 100 μL의 RAW 264.7 대식세포 배양액에 100 μL의 griess 시약을 혼합하여 10분간 반응시켰다. 상기 반응물은 550 ㎚에서 microplate reader를 이용하여 흡광도를 측정하였다. 측정된 흡광도 값을 이용하여 sodium nitrate의 표준곡선으로 NO 생성량을 계산하였다.
통계분석
추출 용매에 따른 수율, 총 폴리페놀 및 플라보노이드 함량 분석 및 항산화 활성 분석 실험은 3회 반복하였으며, 항균 및 항염증 활성 분석은 각 4반복 및 6 반복하여 수행하였다. 모든 실험에서 조사된 모든 측정값들에 대해 평균과 표준오차를 구하였으며, SAS 프로그램(version 9.4, SAS Institute Inc., Cary, NC, USA)을 이용하여 분산분석(one-way ANOVA)을 수행하고, Tukey’s HSD test를 통해 P <0.05 수준에서 유의성을 검정하였다.
결과 및 고찰
추출용매별 작약 유박 추출물의 수율 비교
본 실험에서 작약 유박의 추출은 Teh et al. (2014)의 방법을 참고하여 80% 에탄올, 80% 메탄올, 80% 아세톤 및 MAW를 용매로 하여 진행하였다. 추출용매별 작약 유박 추출물은 22.05-45.14%의 수율을 보였으며, 그 중 80% 아세톤 추출물에서 45.14%로 가장 높은 수율이 나타났다(Table 1). 추출용매별 작약 유박 추출물의 가용성 고형분의 함량은 4.47-9.0 ㎎·mL-1 으로 아세톤> 메탄올> MAW> 에탄올 순으로 확인되었다.
Table 1.
Extraction yield and soluble solid contents of Paeonia lactiflora Pall. cake extract by extraction solvents
| Extraction solvent | Extraction yield (%) | Soluble solid (㎎·mL-1) |
| 80% Ethanol | 22.05 ± 1.304by | 4.47 ± 0.240b |
| 80% Methanol | 27.11 ± 1.719b | 5.47 ± 0.353b |
| 80% Acetone | 45.14 ± 4.121a | 9.00 ± 0.808a |
| M:A:Wz | 26.17 ± 0.982b | 5.27 ± 0.176b |
작약 유박 추출물의 총 폴리페놀 및 플라보노이드 함량 비교
작약 유박 추출물의 총 폴리페놀 및 플라보노이드 함량은 작약 종자 오일에 비해 유의적으로 높았으며, 추출 용매에 따른 차이를 나타냈다(Fig. 1). 추출 용매별 작약 유박의 폴리페놀 함량은 35.23-40.25 ㎎ GAE·g-1이었으며, 특히, 아세톤(40.25 ㎎ GAE·g-1) 및 MAW (39.02 ㎎ GAE·g-1) 추출물에서 다른 처리구에 비해 유의적으로 높은 폴리페놀 함량을 보였다(Fig. 1A). 총 플라보노이드 함량 분석 결과, 작약 종자 오일, 에탄올, 메탄올, 아세톤 및 MAW 추출물에서 각 2.45, 4.17, 5.67, 7.16 및 6.49 ㎎ QE·g-1으로 측정되었으며, 총 폴리페놀 함량과 동일하게 아세톤 및 MAW 추출물에서 유의적으로 높은 플라보노이드 함량을 나타냈다(Fig. 1B). 항산화 화합물의 함량은 식물 부위에 따라 차이를 보일 수 있으며, 수용성 페놀은 내부조직(과육, 종자의 배 및 배유) 보다 외부조직(과피 및 종피)에 더 높은 농도로 존재한다(Sultana et al., 2009). 본 연구 결과에 따르면 기존의 종자 오일의 추출 과정은 종피에 존재하는 항산화 물질이 충분히 추출되지 않았을 가능성이 있다. 따라서 종자 유박이 다양한 바이오헬스 응용 분야에 활용될 수 있는 풍부한 파이토케미칼 공급원의 역할을 할 수 있음을 시사한다. 그러나 항산화 물질의 함량은 추출에 사용되는 용매의 극성에 따라 달라질 수 있으므로 적합한 용매를 선정하는 것이 요구된다(Phuyal et al., 2020). 작약 유박 추출물은 용매에 따라 총 폴리페놀 및 플라보노이드 함량에서 차이를 보였다. 이는 각 용매의 극성 정도에 따라 항산화 물질을 추출하는데 있어 상이한 결과를 나타낸 것으로 생각된다.

Fig. 1.
Total polyphenol (A) and flavonoid (B) contents of Paeonia lactiflora Pall. seeds oil and cake depending on the extraction solvents. Different letters indicate a significant difference using Tukey’s HSD test at P < 0.05 (n = 3). ACE, acetone; PSO, P. lactiflora seed oil; EtOH, ethanol; MAW, methanol:acetone:distilled-water (7:7:6); MeOH, methanol.
작약 유박 추출물의 항산화 활성 비교
항산화 활성을 확인하기 위해 ABTS 및 DPPH radical 소거능을 측정하였다. ABTS radical 소거능 측정 결과, 작약 종자 오일에 비해 유박 추출물의 항산화 활성이 약 31.8-87.6배 우수하였으며, 추출 용매에 따른 차이는 없었다(Fig. 2A). 추출 용매별 유박 추출물의 DPPH radical 소거활성은 아세톤(RC50, 2.27 ㎎·L-1) > MAW (RC50, 3.49 ㎎·L-1) > 메탄올(RC50, 4.77 ㎎·L-1) > 에탄올(RC50, 6.23 ㎎·L-1) 순으로 높은 활성을 보였으며, 모든 유박 추출물은 작약 종자 오일(RC50, 13.13 ㎎·mL-1)에 비해 유의적으로 높은 활성을 보였다. 본 연구에서ABTS 및 DPPH radical 소거능 모두 작약 종자 오일에 비해 높은 활성을 보였는데, 이러한 결과는 폴리페놀 및 플라보노이드 함량의 결과와 일치하였다. 식물과 과일의 항산화 능력은 다양한 파이토케미칼과 관련이 있으며, 특히 플라보노이드를 비롯한 페놀성 화합물은 항산화 효과와 함께 많은 생리활성을 나타내는 것으로 알려져 있다(Zheng and Wang, 2001). 따라서 유박 추출물의 radical 소거능은 작약 종자 오일에 비해 높은 총 폴리페놀 및 플라보노이드 함량에 기인한 것일 수 있다. 또한 이전 연구에서 종자 유박은 다양한 극성의 항산화 화합물이 존재하며, 이는 추출 용매에 따라 항산화 능력의 차이를 보인다고 보고된 바 있다(Zhou and Yu, 2004). 마찬가지로 작약 유박 추출물의 DPPH radical 소거능은 용매에 따른 차이를 보였는데, 이는 각 추출 용매의 극성 차이로 인해 추출된 항산화 화합물이 달라 항산화 능력에 영향을 준 것으로 생각된다.

Fig. 2.
ABTS (A) and DPPH (B) radical scavenging of Paeonia lactiflora Pall. seeds oil and cake depending on the extraction solvents. Different letters indicate a significant difference using Tukey’s HSD test at P < 0.05 (n = 3). ACE, acetone; PSO, P. lactiflora seed oil; EtOH, ethanol; MAW, methanol:acetone:distilled-water (7:7:6); MeOH, methanol.
작약 유박 추출물의 항균 활성 비교
이 연구에서 공시균으로 사용된 E. coil 및 S. aureus에 대한 작약 유박 추출물의 항균효과를 확인할 수 있었다(Fig. 3). 그 중 에탄올 추출물(24시간: 13.41 ㎜ 및 48시간: 13.14 ㎜)은 다른 처리구와 비교하여 E.coil에 대한 유의미한 항균효과를 나타냈으며, 합성항균제인 트리클로산 (24시간: 13.29 ㎜ 및 48시간: 12.91 ㎜) 보다 유의적으로 우수한 생육억제 활성을 나타냈다(Fig. 3A). S. aureus에 대한 작약 유박 추출물은 추출용매에 관계없이 항균효과를 보였으며, 추출용매에 관계없이 합성항균제인 페녹시에탄올 보다 높은 억제율이 조사되었다(Fig. 3B). 작약 유박 추출물은 E. coil 및 S. aureus에 대한 항균활성에서 추출 용매에 따른 유의적인 차이를 보였지만, 두 균주에서 모두 작약 종자 오일 보다 우수한 활성을 나타냈다. 이전 연구에서 작약 추출물은 Bacillus anthracis, B. subtilis, Candida albicans, S. aureus, Streptococcus muntans 및 Clostridium perfringens에 대한 항균 효과가 나타났다(Boo et al., 2011; Lu et al., 2022; Park et al., 2007). Choi and Kang (2022)의 연구에 따르면 작약 추출물에 포함된 폴리페놀 및 플라보노이드가 균에서 생성된 radical을 소거하여 항균활성을 나타냈다. 본 연구 결과, 작약 종자 오일에 비해 유박 추출물의 높은 총 폴리페놀 및 플라보노이드 함량으로 인해 항균 활성에도 효과적인 것으로 판단된다. 이러한 이유로 작약 종자 오일에 비해 유박 추출물은 천연 항균제로서 잠재적인 이용가능성을 시사한다.
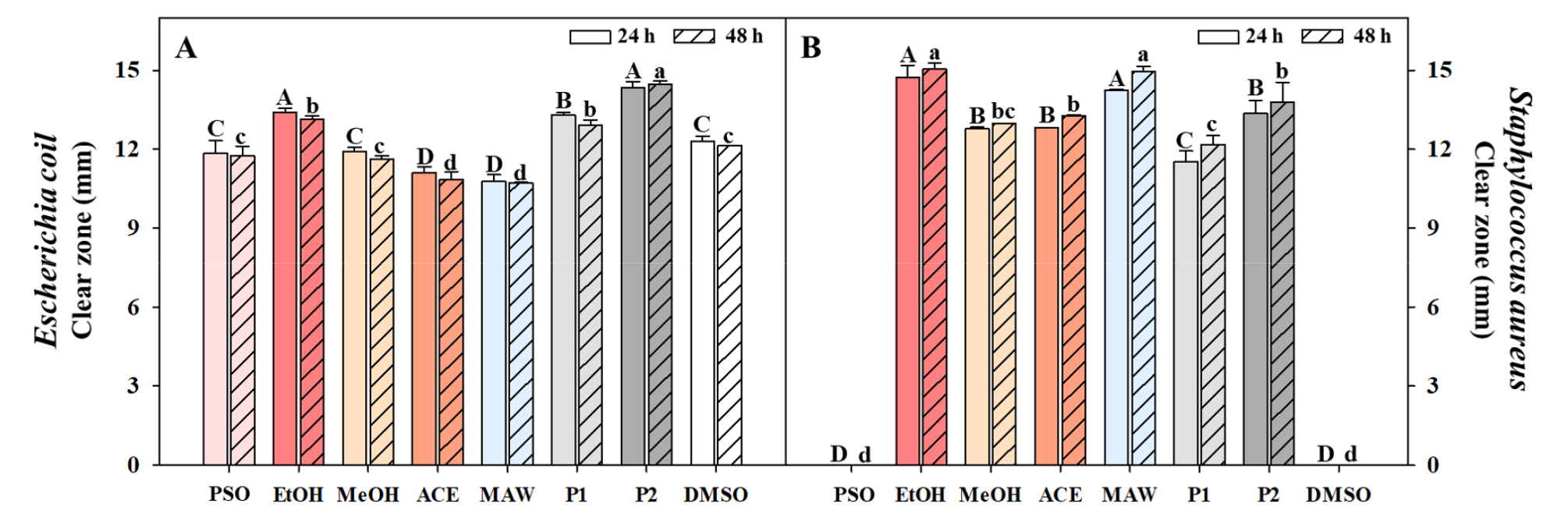
Fig. 3.
Antibacterial activity of Paeonia lactiflora Pall. seeds oil and cake depending on the extraction solvent. Different letters indicate a significant difference using Tukey’s HSD test at P < 0.05 (n = 4). ACE, acetone; PSO, P. lactiflora seed oil; EtOH, ethanol; MAW, methanol:acetone:distilled-water (7:7:6); MeOH, methanol.
작약 유박 추출물의 항염증 활성 비교
RAW 264.7 대식세포에 대한 추출 용매별 작약 유박 추출물의 세포독성을 확인하기 위해 MTT assay를 수행하였다. 유박 추출물을 10 ㎍·mL-1 농도로 처리한 결과, 모든 처리구에서 80% 이상의 cell viability가 확인되어 세포독성이 없는 것으로 간주하였다(Fig. 4A). 따라서 독성이 나타나지 않는 10 ㎍·mL-1로 농도를 설정하고, NO 생성 저해 효과를 확인하였다. NO는 염증매개 인자로, LPS나 pro-inflammatory cytokine 등 외부자극으로 inducible NOS (iNOS)가 발현되어 염증을 유발하는 것으로 알려져 있다(Azab et al., 2016; Lee et al., 2015). 본 연구에서 LPS를 처리시 정상세포의 경우 NO 생성량이 9 μM에서 42 μM로 크게 증가하였으나 작약 유박 추출물은 NO 생성을 유의하게 억제하였다(Fig. 4B). LPS 처리구는 LPS를 처리하지 않은 세포보다 NO의 생성량이 증가하였는데, 이는 LPS가 산화적 스트레스를 유발한다는 보고와 일치하였다(Paranhu et al., 2002; Wang and Mazza, 2002). 최근에는 작약의 주성분인 paeoniflorin은 LPS로 자극된 RAW 264.7 대식세포에서 NO와 Prostaglandin E2 (PGE2)의 생성을 억제하는 효과가 있는 것으로 밝혀져 작약이 항염증 소재로서 큰 잠재력을 보였다(Xin et al., 2019).
이러한 작약 종자 및 유박의 다양한 생리학적 효능은 기존의 약용하던 뿌리의 효과와 유사하였다. 전통적인 약용부위인 뿌리는 한 번 채집하기 위해서는 3년 이상의 성숙한 뿌리를 이용하며(Choung, 2002), 채취할 때 식물을 손상시키거나 심할 경우 전체적으로 이용할 수 없으며(Tong et al., 2021), 다시 재배하기 위해 많은 시간이 소요된다. 따라서 항산화, 항균 및 항염증에 효과적인 작약 종자 바이오헬스 소재로 이용하면 매년 종자를 채종할 수 있으며, 더불어 종자 뿐만 아니라 종자유 추출 후 남은 유박의 활용을 통해 지속가능한 농업을 실천할 수 있다.

Fig. 4.
Effect of Paeonia lactiflora Pall. seeds oil and cake extract on cell viability and NO production in LPS-induced RAW 264.7 cells. Different letters indicate a significant difference using Tukey’s HSD test at P < 0.05 (n = 6). ACE, acetone; PSO, P. lactiflora seed oil; EtOH, ethanol; MAW, methanol:acetone:distilled-water (7:7:6); MeOH, methanol; QCT, 25 µM quercetin.
적 요
본 연구에서는 작약(Paeonia lactiflora Pall.) 종자 오일과 유박의 생리활성의 비교를 통해 작약 종자 유박 활용에 가능성을 평가하고자 수행되었다. 작약 종자 유박 추출물의 추출 수율은 22-45%로 추출용매에 따른 차이를 보였다. 총 폴리페놀 및 플라보노이드와 radical소거능은 오일보다 유박 추출물에서 유의하게 높았다. 작약 유박 추출물의 항균활성은 양성대조군에 비해 우수하였으며, 이는 48시간까지 지속되었다. 또한 LPS로 유도된 염증 반응은 유박 추출물 처리시 현저하게 감소하여 작약 종자 유박의 항염증 활성이 입증되었다. 본 연구를 통해 작약 종자 오일 뿐만 아니라 유박 추출물의 우수한 항산화, 항균 및 항염증 활성을 나타내어 바이오헬스 소재로서 작약 종자 유박의 활용 가능성이 확인되었다.


