서 언
재료 및 방법
시약 및 재료
홍삼추출물 제조
진세노사이드 함량 분석
실험동물 및 식이
사이토카인 분석
혈장 LC-tandem mass spectrometry (MS/MS) 분석
생체이용율
통계분석
결 과
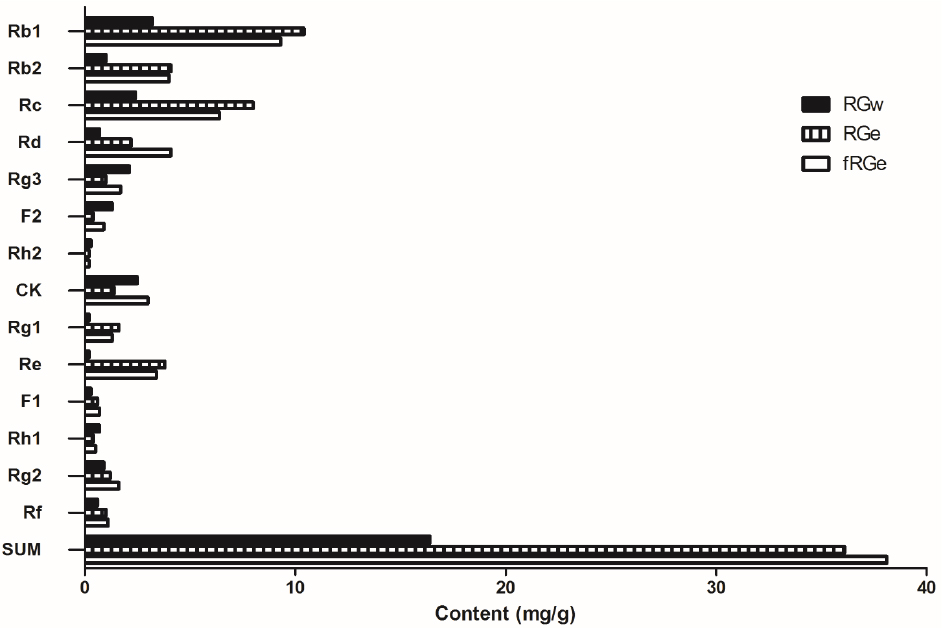
진세노사이드 함량 및 마우스 식이량
혈중 진세노사이드 흡수량(AUC, Area under the plasma level-time curve)
RGw, RGe, fRGe 식이 그룹에서 총진세노사이드 함량분석
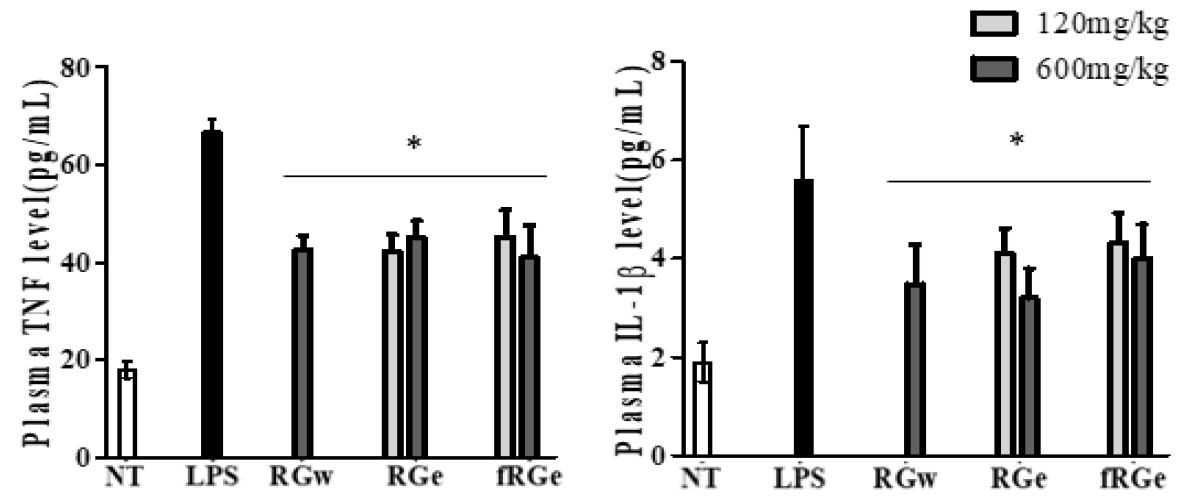
TNF, IL-1β 함량분석
혈중 최고 농도(Cmax) 비교
고 찰
적 요
서 언
인삼은 동양의학에서 가장 널리 활용되는 의약 소재중 하나로, 생체기능의 허약증상을 개선하고, 면역을 증진시키는 효과가 알려져 있다(Cho, 2009). 이러한 인삼은 사람의 체질적 특성에 따라 두통, 발열 등의 부작용이 나타나기도 한다. 이러한 인삼을 증숙하여 활용함으로써 그 효능을 유지하면서도 부작용을 감약시키고자 한 것이 바로 홍삼이다. 포제된 홍삼은 더 많은 질환에 응용할 수 있게 되어 약의 범용성을 증대하였고, 건강기능식품으로서 산업분야에서도 적용이 용이하게 되었다. 인삼과 홍삼은 같은 기원의 약재이지만 가공과정에서 새로운 성분이 생성되거나 기존 성분이 감소한다는 결과가 보고되고 있다(Ahn, 2015; Choi et al., 1981). 인삼의 주요성분으로는 protopanaxadiol인 Rb1, Rb2, Rc, Rd, Rg3, F2, compound K (CK) 등이 있고 protopanaxatriol인 Re, Rg1, Rg2, Rh1, F1 등이 알려져 있다(Her et al., 2012; Nam and Yang, 2009).
홍삼은 추출 및 제조 방식과 조건 그리고 사용된 용매에 따라서 진세노사이드의 용출 함량이 상이하며, 추출 시간 및 온도, 추출 용매의 종류에 의해서 구성성분 및 함량변화가 크다고 보고되고 있다(Choi et al., 2016; Kim et al., 2021; Lee et al., 2013). 특정 온도 및 추출시간에서 조사포닌의 함량이 급격이 증가하는 경향을 나타내기도 하며(Li et al., 2009), Rb1과 같은 특정 진세노사이드는 물 대신 주정을 용매로 사용하여 추출하였을 때 함량이 더 높게 나타나는 것으로 보고된 바 있다(Kim et al., 2021).
홍삼이 효능을 나타내기 위해서는 장내에서의 흡수여부가 매우 중요하다. 일반적으로 홍삼을 섭취한 경우 장내미생물에 의해 당이 분리되고, 비당부인 triterpene사포닌 aglycone의 함량이 증가하면서 흡수가 증가하게 된다. 장내미생물에 의한 천연물 성분들의 생물전환의 정도는 체질과 식습관에 따라 상당한 차이를 보인다(Akao et al., 1998; Hasegawa et al., 2000; Shim et al., 2014; Wakabayashi et al., 1997). 대황의 미생물 대사체인sennoside 의 경우 장내미생물을 자극함으로써 변비등 분변활동을 도와주는 것으로 알려져 있으며, 황금의 baicalin, 지모의 timosaponin 등의 장내미생물 대사에 의한 대사체 연구결과가 보고되어 있다(Trinh, 2011).
홍삼 진세노사이드의 흡수량을 높이기 위한 다양한 방법들이 개발되어왔으며(Park, 2019), 대표적인 방법은 발효기술을 이용한 발효홍삼 제조기법이다. 추출한 홍삼에 유산균을 이용하여 제조한 발효홍삼은 유효성분 혹은 진세노사이드 함량을 증가시키고 흡수량을 높여줄 뿐 아니라 유산균이 생성하는 유용한 생리활성 물질을 동시에 섭취할 수 있는 장점이 있어 산업계에서 연구가 활발히 진행되고 있다(Choi et al., 2019; Kim et al., 2019; Lee et al., 2015; Zhang et al., 2020). 또한 Bifidobacterium과 같은 특정 유산균으로 발효한 홍삼은 선택적으로 Rd와 같은 특정한 진세노사이드만 증가하기도 하는 등 홍삼의 다양한 발효기술이 연구되고 있다(Kim et al. 2018). 그러나 발효홍삼과 추출 용매의 차이에 의한 홍삼의 흡수량의 비교는 아직 미비하여 추가적인 연구가 더 필요한 실정이다.
따라서 본 연구에서는 홍삼 추출용매의 차이에 따른 총 진세노사이드 TG (Rb1 + Rd + Rg1 + F2 + Rg3 + compound K)의 흡수율 및 흡수량 변화를 확인하고, 홍삼 및 발효홍삼의 섭취에 의한 생체에서의 염증반응과 관련된 사이토카인의 변화를 확인함으로서 홍삼 진세노사이드의 흡수율과 생리적인 반응의 연관성을 확인하고자 한다.
재료 및 방법
시약 및 재료
홍삼 추출물의 진세노사이드 분석은 각 진세노사이드가 동일농도로 혼합된 진세노사이드 지표 혼합물을 활용하여 분석하였다. 진세노사이드 Rb1, Rb2, Rc, Rd, Re, Rf, Rg1지표 혼합물은 Sigma-Aldrich (St. Louis, MO, USA)에서, Rf, Rh1, Rh2, F1, F2, Rg3, CK는 Ambo Research Institute (Daejeon, Korea)에서 구입하여 이용하였다. Digitoxin, Formic acid는 Sigma- Aldrich (St. Louis, MO, USA)을 사용하였고, Acetonitrile, methanol은 J.T. Baker (Phillipsburg, NJ, USA)에서 구입하였다. 그 외의 시약은 특급 혹은 HPLC grade를 사용하였다.
실험에 사용한 홍삼은 ㈜hy에서 기증받은 시료를 사용하였으며, 시료의 확증표본은 ㈜hy연구소(확증표본 fRG-0002)에 보관중이다.
홍삼추출물 제조
홍삼 추출물은 홍삼 열수 추출물(RGw), 홍삼 주정 추출물(RGe), 발효홍삼 추출물(fRGe)를 제조하여 이용하였다. RGw는 홍삼 원물을 정제수를 1:10의 비율로 혼합하여 18 시간 동안 90℃에서 3회 가열추출 하였다. 추출된 시료를 67 brix까지 진공농축 한 뒤 90℃에서 60분간 살균하여 제조하였다. RGe는 홍삼원물을 50%의 주정(발효주정, 대한주정판매주식회사)을 사용하여 18시간동안 3회 가열추출 후 추출된 시료를 67 brix까지 농축 및 살균하는 과정을 거쳐 제조하였다. fRGe는 기존 보고된 방식을 응용하여 사용하였다(Kim et al., 2018). 간략하게 ㈜hy로부터 유산균을 받아서 46℃에 24시간동안 배양한 뒤 90℃에서 15분간 가열하여 실활시킨 후에 67 brix까지 농축하여 이용하였다.
진세노사이드 함량 분석
진세노사이드 함량 분석을 위해 지표물질을 메탄올에 녹여 100 ㎍/mL의 농도로 조제하였다. 각각의 홍삼 추출물 시료는 3분간 vortex하여 PTFE filter (0.2 ㎛)로 여과 후 메탄올로 희석하여 0.06 g/mL의 농도로 조제하였다. 진세노사이드 함량 분석을 위하여 Agilent 1290 infinity HPLC system과 Agilent 1290 Infinity Diode Array Detector를 사용하였다. 이동상으로는 Distilled water (solvent A), Acetonitrile (Solvent B)를 사용하였다. Gradient elution modem를 사용하였으며, 유속은 1.0 mL/min로 설정하였다. 컬럼은 Shiseido C18 (4.6 X 250 ㎜, 5 ㎛)컬럼을 사용하였다. 검출기 파장은 203 ㎚로 설정하였다. HPLC gradient elution 조건은 Table 1에 나타내었다.
Table 1.
HPLC gradient elution condition for analysis of ginsenoside contents
| Time (min) | A% | B% | Flow rate (mL/min) |
| 0.0 | 80 | 20 | 1.0 |
| 5.0 | 88 | 20 | 1.0 |
| 20.0 | 77 | 23 | 1.0 |
| 25.0 | 70 | 30 | 1.0 |
| 45.0 | 60 | 40 | 1.0 |
| 55.0 | 50 | 50 | 1.0 |
| 68.0 | 20 | 80 | 1.0 |
| 70.0 | 80 | 20 | 1.0 |
| 75.0 | 80 | 20 | 1.0 |
실험동물 및 식이
실험에 사용한 Balb/c 마우스(male)는 19-21 g 사이인 개체를 ㈜오리엔트바이오(Korea)로부터 구입하여 사용하였다. 사육실 온도는 20-22℃, 습도는 50 ± 10%가 되도록 유지하였고, 명암은 12시간 주기로 자동 조절하였다. 본 동물실험은 ㈜KPC (Korea)의 동물실험윤리위원회(IACU C)의 승인을 받아 수행하였다(승인번호 P202023). 1주간의 적응기간을 거친 후 5일간 하루 1회씩 홍삼 혹은 발효홍삼을 농도별로 투여하였다. 그룹 및 식이 농도로는 무처리군(NT), LPS유도군(LPS 30 ㎎/㎏), RGw 식이군(600 ㎎/㎏), RGe 식이군(120, 600 ㎎/㎏) 그리고 fRGe 식이군(120, 600 ㎎/㎏)으로 구성하였고, 그룹별 12마리를 이용하였다. 시험군은 홍삼의 건강기능식품 기준 규격을 준용하여 이를 FDA에서 제시한 방법을 토대로 환산하여 결정하였다(U.S.FDA., 2005). 각 시험군별 투여량은 Table 2에 나타내었다. 혈액시료는 경구 투여 후 하룻동안 섭취제한을 한 뒤, 0시간, 1시간, 4시간, 12시간 그리고 24 시간에 경정맥채혈을 통해 회당 약 150 μL씩 채혈하였고, 10 μL (5unit)의 heparin 처리된 1.5 mL 튜브에 넣고 4℃에서 12,000 rpm으로 2분간 원심분리하여 혈장을 분리하였고, -70℃에 보관하였다.
Table 2.
Changes of ginsenoside contents by processing methods
| Ginsenosides | Red Ginseng Extracts (600 ㎎/㎏) | ||
| RGwz | RGez | fRGez | |
| Rb1 | 1.92 | 6.24 | 5.58 |
| Rb2 | 0.6 | 2.46 | 2.4 |
| Rc | 1.44 | 4.8 | 3.84 |
| Rd | 0.42 | 1.32 | 2.46 |
| Rg3 | 1.26 | 0.6 | 1.02 |
| F2 | 0.78 | 0.24 | 0.54 |
| Rh2 | 0.18 | 0.12 | 0.12 |
| CK | 1.5 | 0.84 | 1.8 |
| Rg1 | 0.12 | 0.96 | 0.78 |
| Re | 0.12 | 2.28 | 2.04 |
| F1 | 0.18 | 0.36 | 0.42 |
| Rh1 | 0.42 | 0.24 | 0.3 |
| Rg2 | 0.54 | 0.72 | 0.96 |
| TG*y | 9.48 | 21.18 | 22.26 |
사이토카인 분석
분리된 혈장의 사이토카인 분석을 위하여 IL-1β 및 TNF Elisa kit (BD Bioscience, USA)를 이용하여 측정하였다. 측정 방법은 제조사의 매뉴얼을 따랐다. 각 사이토카인의 anti- mouse antibody가 코팅된 96well plate에 혈장을 1~2시간 반응한 뒤, Biotinylated anti-mouse antibody 및 Streptavidin- horseradish peroxidase conjugate 용액을 넣고 1시간동안 상온에서 반응하였다. Tetramethylbenzidine (TMB)용액과 Hydrogen peroxide 용액을 1:1 비율로 혼합한 용액으로 30분간 암실에서 반응하고 1M의 H3PO4 용액으로 반응을 멈춘 뒤 450 ㎚의 파장값으로 흡광도를 측정하여 계산하였다.
혈장 LC-tandem mass spectrometry (MS/MS) 분석
LC-MS/MS분석은 기존 보고된 방식을 응용 및 변형하여 사용하였다(Kim et al., 2015). 약 40 μL의 혈장 샘플을 100 ng/mL의 IS (digoxin)이 포함된 80 μL의 acetonitrile과 혼합하여 단백질을 침전하였다. 그 후 13,200 rpm으로 5분간 원심분리 한 뒤 상층액을 LC용 vial로 이송하였다. 초 고성능 액체 크로마토그래피(UPLC, ultra-performance liquid chromatography)- MS/MS 시스템은 Agilent 6470 triple-quadrupole mass spectrometer (Agilent Technologies, Palo Alto, CA, USA)가 장착된 Agilent 1290 Infinity HPLC 시스템을 이용하였다. 분리에 사용된 HPLC용 컬럼은 Acquity UPLC® BEH C18 (2.1 × 50 ㎜, 1.7 ㎛; Waters Technologies Ireland Ltd.) 를 사용하였고, 컬럼 오븐을 통해 온도는 40℃를 유지하였다. HPLC 이동상은 0.1% formic acid 가 포함된 증류수를 용매A로, 0.1% formic acid가 포함된 Acetonitrile을 용매B로 사용하였다. Gradient elution 조건은 Table 3에 나타내었다. 각 진세노사이드는 ESI (Electrospray ionization)를 이용하여 이온화하였으며, multiple reaction monitoring (MRM) mode를 이용하여 검출하였다. 0.4 mL/분의 유속으로 농도구배 프로그램을 사용하였으며, 10 psi의 압력으로 유지하였다.
Table 3.
HPLC gradient elution condition for analysis of ginsenoside separation
| Time (min) | A% | B% | Flow rate (mL/min) |
| 0.0 | 90 | 10 | 0.4 |
| 0.5 | 90 | 10 | 0.4 |
| 1.0 | 40 | 60 | 0.4 |
| 2.0 | 40 | 60 | 0.4 |
| 2.1 | 10 | 90 | 0.4 |
| 3.0 | 10 | 90 | 0.4 |
| 3.1 | 90 | 10 | 0.4 |
| 5.0 | 90 | 10 | 0.4 |
생체이용율
The Phoenix WinNonlin Enterprise program (버전 2.1; Pharsight Inc., St. Louis, MO, USA)을 사용하여 Cmax (혈중 최고 농도)를 확인하였고, AUCt (Area under the plasma level- time curve, 시간별 혈중농도 곡하면적) 등은 Linear and log-linear trapezoidal rule을 사용하여 계산하였다.
통계분석
모든 실험결과값의 평균과 표준오차는 GraphPad Prism8 (GraphPad Software Inc., San Diego, CA, USA)를 이용하여 계산하였다. 실험군 사이의 차이는 unpaired t-test 를 실시한 후 p<0.05의 유의수준에서 Duncan’s test를 실시하여 검증하였다.
결 과
진세노사이드 함량 및 마우스 식이량
RGw, RGe 및 fRGe의 추출 용매에 따른 진세노사이드 함량을 Table 2과 Fig. 1에 나타내었다. 추출된 농축액의 g당 총 진세노사이드 함량은 RGw 보다 RGe에서 더 증가하는 것으로 확인하였고, 극성이 높은 진세노사이드 Rb1, Rc, Rd, Re에서 추출용매의 변화에 따른 진세노사이드 함량변화를 나타내었다. Rd, CK의 경우 fRGe추출물과 RGe 추출물에서 높은 함량 차이를 나타내었다.
혈중 진세노사이드 흡수량(AUC, Area under the plasma level-time curve)
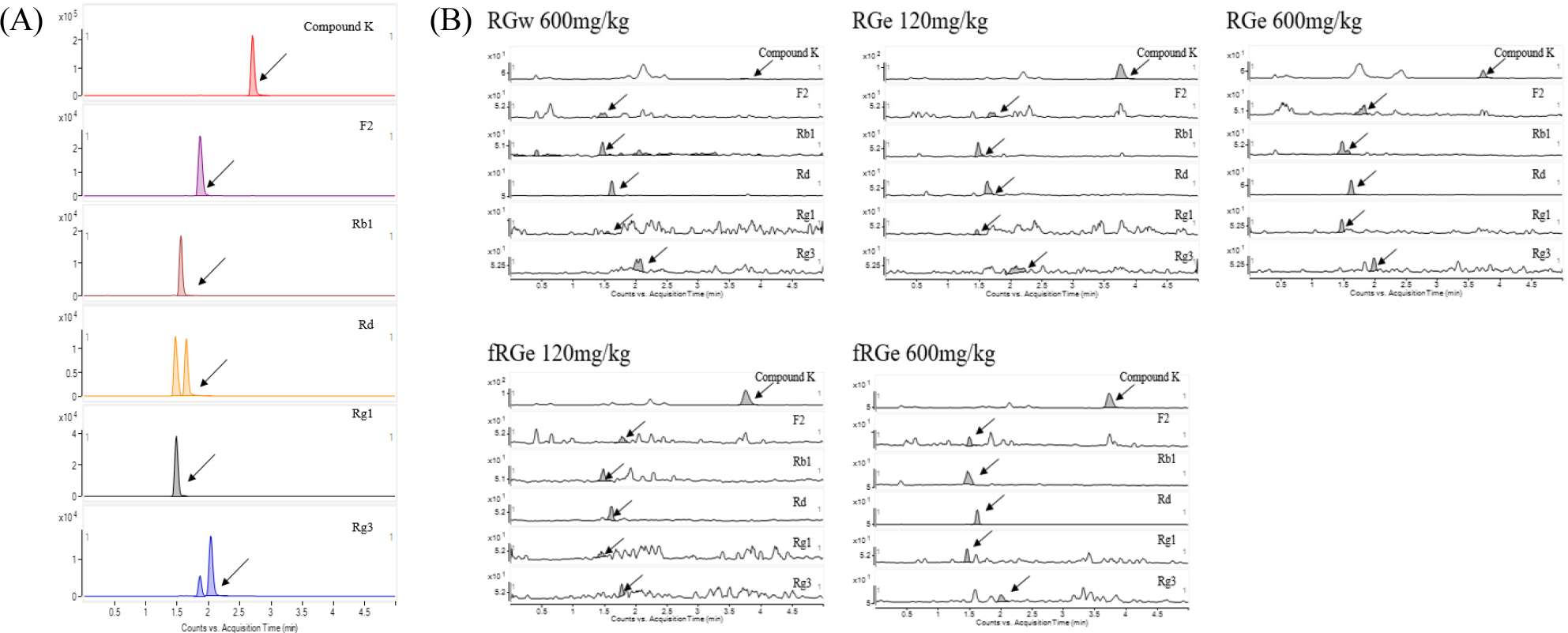
마우스에 RGw, RGe, fRGe을 투여하고, 진세노사이드의 혈중농도를 LC-tandem mass spectrometry (MS/MS)를 통하여 측정하였다(Fig. 2). 마우스의 혈장 진세노사이드 흡수량은 진세노사이드의 검출 농도 및 시간을 고려하여 Trapezoidal Rule을 통해 AUC를 계산하였고, 각 진세노사이드 AUC를 계산한 후 합산하여 총 진세노사이드TG 및 진세노사이드 Rb1, Rd의 함량을 확인하였다(Fig. 3, Table 4). 진세노사이드 Rb1의 RGw 600 ㎎/kg, RGe 120㎎/㎏, 600 ㎎/㎏, 그리고 fRGe 120㎎/㎏, 600 ㎎/㎏의 흡수량은 각각 21.93 ± 14.68 ng·h/mL, 87.10 ± 28.81 ng·h/mL, 275.21 ± 110.04 ng·h/mL, 105.78 ± 30.22 ng·h/mL, 그리고 404.91 ± 162.57 ng·h/mL였으며, 진세노사이드 Rd의 흡수량은 각각 8.86 ± 5.4 ng·h/mL, 13.93 ± 9.95 ng·h/mL, 56.86 ± 7.25 ng·h/mL, 25.58 ± 11.72 ng·h/mL, 그리고 121.89 ± 33.55 ng·h/mL로 확인되었다. RGw 600 ㎎/㎏, RGe 120 ㎎/㎏, 600 ㎎/㎏, 그리고 fRGe 120 ㎎/㎏, 600 ㎎/㎏의 총 진세노사이드 TG 흡수량은 각각 42.12 ± 9.57 ng·h/mL, 108.28 ± 10.88 ng·h/mL, 321.45 ± 54.5 ng·h/mL, 139.01 ± 10.62 ng·h/mL, 그리고 537.39 ± 93.49 ng·h/mL로 확인되었다. 더불어 fRGe와 RGe AUC의 변화는 유의적 차이를 나타내고 있음을 확인하였다. 진세노사이드의 혈장에서 검출량은 fRGe600 ㎎/㎏을 식이한 경우에서 가장 높은 혈액 흡수량을 나타내었고, 진세노사이드 함량이 높은 RGw보다 RGe를 식이한 시험군에서 혈액내 진세노사이드 검출량이 더욱 높게 나타남을 확인하였다.
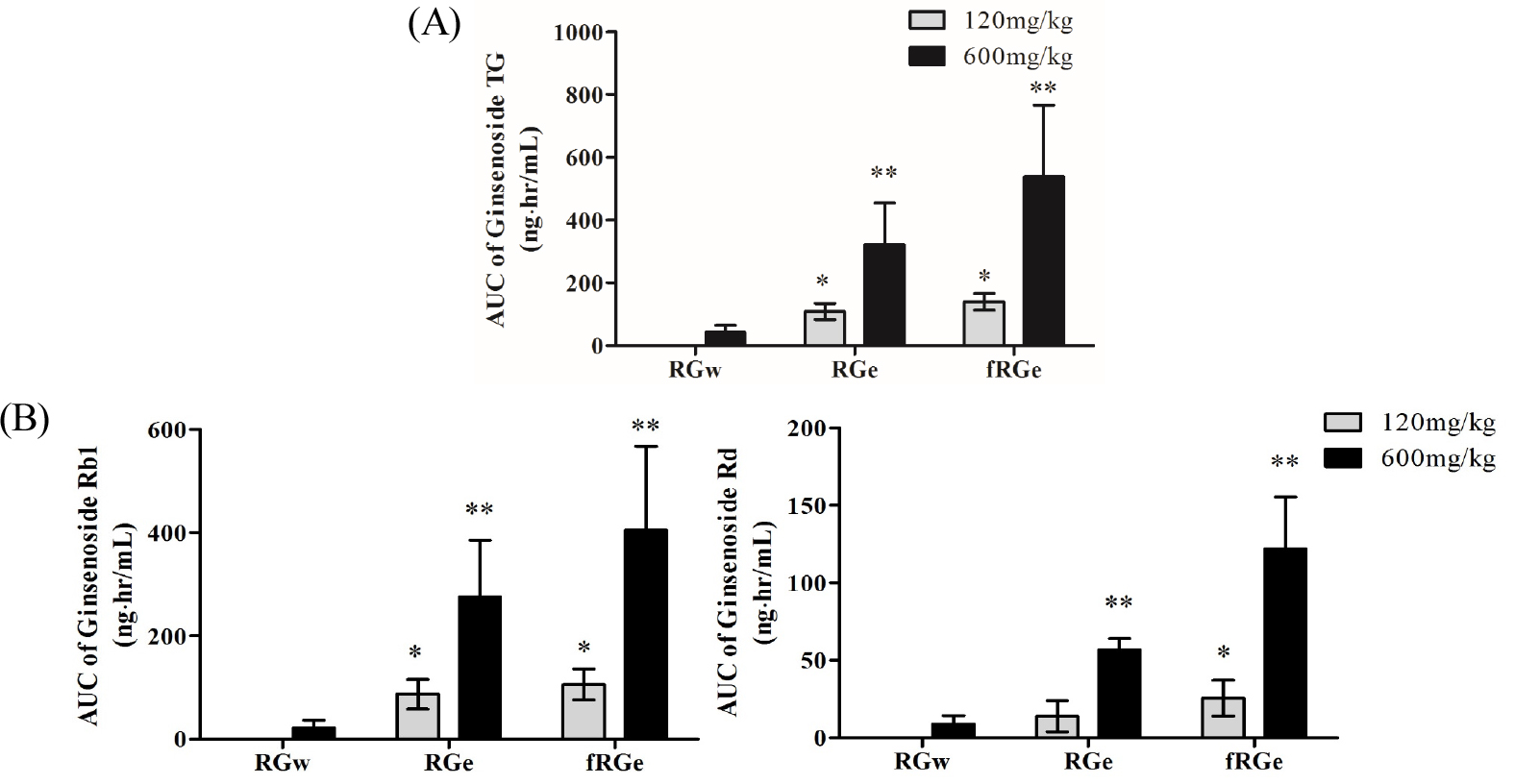
Fig. 3.
(A) The AUC (Area under the plasma level-time curve) value of ginsenosides TG and (B) ginsenosides Rb1 and Rd in mice after oral administration of RGw, RGe and fRGe. The ethanol-extracted of red ginseng (RGe and fRGe) showed a higher amount of ginsenosides absorbed into the plasma per dose of the extract than the water-extracts (RGw) and fRGe showed higher than RGe. Statistical analyses were processed by unpaired Student’s t-test. Data are represented as mean ± standard error of means (SEM). *p < 0.05., **p < 0.01 compared to RGw (600 ㎎/㎏).
Table 4.
Area under the plasma level-time curve (AUC) of ginsenoside Rb1 and Rd contents in serum of mice after RGw, RGe and fRGe was administered orally 120 ㎎ and 600 ㎎/㎏
|
Ginsenosides (ng·h/mL) |
RGwz 600 ㎎/㎏ | RGez | fRGez | |||
| 120 ㎎/㎏ | 600 ㎎/㎏ | 120 ㎎/㎏ | 600 ㎎/㎏ | |||
| Rb1 | 21.93 " 14.68 | 87.10 " 28.81 | 275.21 " 110.04 | 105.78 " 30.22 | 404.91 " 162.57 | |
| Rd | 8.86 " 5.4 | 13.93 " 9.95 | 56.86 " 7.25 | 25.58 " 11.72 | 121.89 " 33.55 | |
RGw, RGe, fRGe 식이 그룹에서 총진세노사이드 함량분석
추출방법 및 발효유무에 따른 홍삼을 식이한 마우스의 혈액에서 흡수된 진세노사이드의 차이를 확인하기 위하여 LC-MS/MS장비를 통해 마우스 혈장 샘플분석을 진행하였다. 각각의 혈장 샘플은 모두 Acetonitrile을 통하여 단백질 침전을 진행하였으며 동일한 용량을 분석 후 지시약에 맞춰 농도를 정량하였다. RGe 및 fRGe를 식이하였을 때 RGw 식이군 대비 동일시간 혈중 진세노사이드 농도가 높게 측정되었으며, RGe식이군 보다 fRGe 식이군 그래프가 동일시간대비 더 높은 농도에서 측정되었다(Fig. 4).
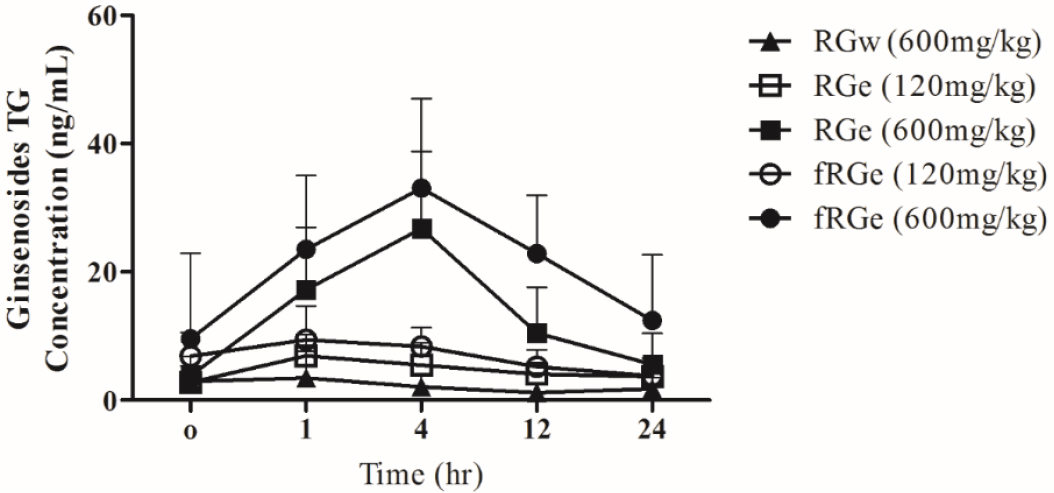
Fig. 4.
Mean plasma concentration-time profile of ginsenosides TG in mice after the oral administration of red ginseng (RG) water extract (RGw), ethanol-extracted RG (RGe) and fermentated RG extract (fRGe). The fermented red ginseng (fRGe) showed a higher concentration absorbed into the plasma dose than ethanol-extracted or water extracted red ginseng (RGe and RGw). Statistical analyses were processed by unpaired Student’s t-test. Data are represented as mean ± standard error of means (SEM). *p < 0.05., **p < 0.01 compared to RGw (600 ㎎/㎏).
TNF, IL-1β 함량분석
흡수한 진세노사이드에 의한 혈중 염증 면역반응과 관련된 싸이토카인의 활성 변화를 확인 한 결과, fRGe는 RGe, RGw에 비해 Tumor necrosis factor (TNF), Interleukin 1 beta (IL-1β)의 활성이 상대적으로 높게 나타남을 확인하였으나 유의적인 차이는 나타나지 않음을 확인하였고, 염증 유도군인 LPS와 비교시에는 fRGe, RGe, RGw 모두에서 유의적인 차이가 존재함을 확인하였다(Fig. 5).
혈중 최고 농도(Cmax) 비교
RGw 및 RGe, fRGe을 식이한 마우스의 혈장 진세노사이드를 비교한 후 각각의 혈중 최고 농도(Cmax)를 비교분석하였다(Fig. 6, Table 5). 대부분 진세노사이드는 모두 RGw보다 RGe 및 fRGe을 섭취하였을 때 Cmax값이 더 높게 확인되었는데 특히 Rb1, Rd 진세노사이드는 동일 용량 및 저농도로 섭취하였을 경우에도 Cmax 값이 RGe뿐만 아니라 fRGe에서도 유의적인 차이를 나타내며 더 높게 나타남을 확인하였다(p <0.05 or 0.01). RGw 600 ㎎/㎏, RGe 및 fRGe 120 ㎎/㎏, 600 ㎎/㎏으로 식이하였을때 진세노사이드 Rb1의 Cmax 값은 각각 3.67 ± 3.34 ng/mL, 6.79 ± 2.08 ng/mL, 23.27 ± 8.81 ng/mL, 8.61 ± 1.89 ng/mL, 그리고 25.51 ± 7.29 ng/mL 였으며, Rd의 Cmax 값은 각각 1.16 ± 0.36 ng/mL, 1.61 ± 1.08 ng/mL, 4.67 ± 1.24 ng/mL, 2.88 ± 1.14 ng/mL, 그리고 8.61 ± 4.11 ng/mL였다.
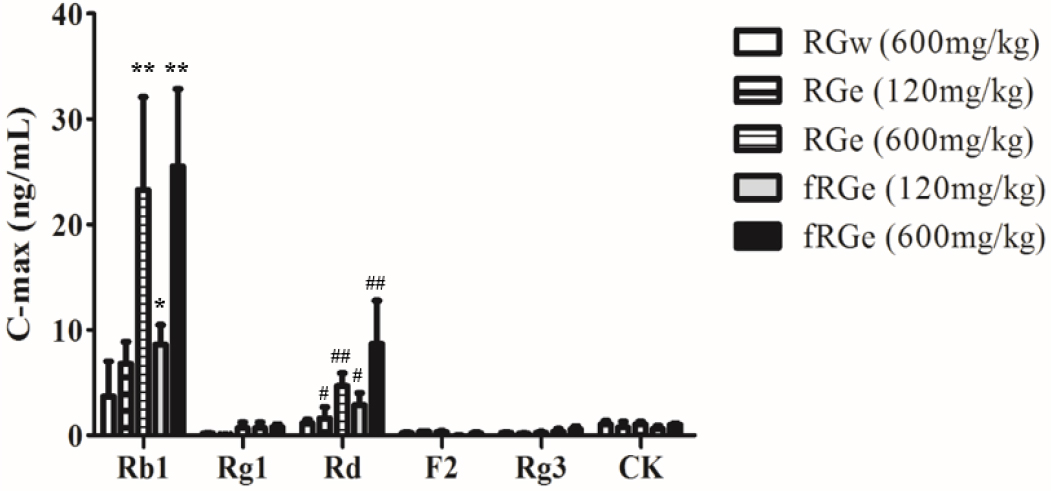
Fig. 6.
Cmax values of ginsenosides of serum in mice after the oral administration of red ginseng (RG) water extract (RGw), ethanol-extracted RG (RGe) and fermentated RG extract (fRGe). Statistical analyses were processed by unpaired Student’s t-test. Data are represented as mean ± standard error of means (SEM). *p < 0.05., **p < 0.01 compared to RGw (600 ㎎/㎏) Rb1 ginsenoside and #p < 0.05., ##p < 0.01 compared to RGw (600 ㎎/㎏) Rd ginsenoside.
Table 5.
Cmax values of ginsenosides of serum in mice after RGw, RGe and fRGe was administered orally 120 ㎎ and 600 ㎎/㎏
| Ginsenosides |
RGwz 600 ㎎/㎏ | RGez | fRGez | |||
| 120 ㎎/㎏ | 600 ㎎/㎏ | 120 ㎎/㎏ | 600 ㎎/㎏ | |||
| Rb1 | 3.67 " 3.34 | 6.79 " 2.08 | 23.27 " 8.81 | 8.61 " 1.89 | 25.51 " 7.29 | |
| Rg1 | 0.1 " 0.15 | 0.07 " 0.03 | 0.68 " 0.56 | 0.06 " 0.02 | 0.8 " 0.28 | |
| Rd | 1.16 " 0.36 | 1.61 " 1.08 | 4.67 " 1.24 | 2.88 " 1.14 | 8.61 " 4.11 | |
| F2 | 0.22 " 0.08 | 0.03 " 0.02 | 0.3 " 0.12 | 0.03 " 0.01 | 0.19 " 0.12 | |
| Rg3 | 0.24 " 0.09 | 0.15 " 0.07 | 0.25 " 0.11 | 0.28 " 0.19 | 0.44 " 0.19 | |
| CK | 1.05 " 0.35 | 0.74 " 0.59 | 1.04 " 0.27 | 0.63 " 0.29 | 1.01 " 0.14 | |
고 찰
홍삼은 항당뇨, 항염증, 항암, 항알러지 효능과 다양한 기능성이 밝혀지고 있다(Kim et al., 2018). 최근의 많은 연구를 통해 홍삼의 다양한 효능이 대표적인 성분인 진세노사이드에 기인함이 밝혀지고 있다(Ko et al., 2003). 이러한 유용한 효과를 갖는 진세노사이드의 생체이용율은 Bifidobacterium, Lactobacillus와 같은 장내미생물의 구성에 의존하고 있다(Park, 2019). 홍삼에 함유하고 있는 주요 진세노사이드는 Rb1, Rb2, Rc 및 Rg1 등은 고분자 이면서 극성이 높은 진세노사이드이다. 이 진세노사이드들은 그 자체 성분으로 생체이용율이 낮다. 그러나, 소화관에 서식하는 장내미생물의 의해 전환되는 비극성 진세노사이드들은 생체이용율이 높다. 그러므로, 홍삼의 생리활성은 진세노사이들을 전환하여 생체이용율을 높여주는 장내미생물의 존재에 의존한다 (Shim et al., 2014). 기존 연구에 의하면 Rb1은 위장에서 흡수가 쉽지 않고 CK의 형태로 대사되어 흡수된다고 보고되고 있다(Akao et al., 1998). Kim et al. (2018) 등의 발표에 의하면, 진세노사이드 Rb1, Rc 등을 섭취한 마우스의 혈액중에서 진세노사이드 Rd, CK 등을 검출하였다. 이 같은 연구결과를 종합해보면, Protopanaxadiol (PPD)계열의 진세노사이드는 장내미생물에 의해 Rb1, Rc 등은 진세노사이드 Rd, F2, CK 등을 전환된다. 이 같은 장내미생물에 의한 진세노사이드의 전환활성은 장내미생물을 구성하는 장내세균의 종류와 수에 따라 상당한 차이를 보이며, 이 장내미생물 구성은 사람의 체질, 식습관, 생활환경 등에 따라 차이가 있다(Akao et al., 1998; Shim et al., 2014).
이러한 한계를 극복하고자 미리 극성이 높은 고분자 진세노사이드를 극성이 낮은 저분자 진세노사이드로 전환하는 가공 방법이 활발히 연구되고 있다. 열을 가하거나 산을 첨가하는 물리적, 화학적 방법도 사용되고 있지만 유산균 혹은 미생물을 통한 생물전환 기술은 물리/화학적인 방법보다 장점이 있다. 극성이 높은 진세노사이드를 유산균이 발효하여 극성이 낮은 진세노사이드로 전환하여 흡수율을 높일 뿐 아니라 유산균이 갖는 유익한 효과를 동시에 기대할 수 있다는 점이다. 또한 유산균으로 홍삼을 발효하였을 때 진세노사이드 함량을 높일 수 있다는 점이다. 특히 본 연구에 사용된 fRGe은 기존 연구결과에서 진세노사이드 Rd, F2 및 Compound K 등 PPD계열 진세노사이드의 흡수에 효과적임을 확인된 바 있다(Kim et al., 2018; Kim et al., 2019). 따라서 본 연구에서는 기존 연구된 진세노사이드 Rd, F2, Rg3 및 Compound K와 추가로 Rb1, Rg1을 포함하여 6종의 혈중 총 진세노사이드 TG의 흡수율을 중점적으로 분석하였다. RGw, RGe 및 fRGe 진세노사이드 함량을 측정하였을때, RGe 및 fRGe에서 진세노사이드 Rb1 및 Rd의 함량이 RGw보다 증가하는 것을 확인하였으며 특히 Rd의 경우 fRGe에서 함량의 증가가 더 큰 것을 확인하였다. 동물실험에서 RGw은 600 ㎎/㎏으로, RGe은 120 ㎎/㎏ 및 600 ㎎/㎏으로, fRGe은 120 ㎎/㎏ 및 600 ㎎/㎏으로 식이하였으며, 각각 섭취하는 진세노사이드량은 RGw 600 ㎎/㎏군에서는 9.84㎎/㎏, RGe 120 ㎎/㎏ 및 600 ㎎/㎏ 군에서는 각각 4.33 ㎎/㎏ 및 21.66 ㎎/㎏ 이었다. fRGe을 섭취한 진세노사이드량은 120 ㎎/㎏ 및 600 ㎎/㎏군에서 각각 4.57 ㎎/㎏ 및 22.86 ㎎/㎏ 이었다. 따라서 동일한 농도인 600 ㎎/㎏군 간에도 추출용매 및 발효유무에 따라서 섭취하는 진세노사이드량은 달랐으며, fRGe을 투여하는 경우가 RGw 대비 약 2배의 진세노사이드를 마우스에게 공급됨을 확인하였다. 또한 120 ㎎/㎏으로 RGe 및 fRGe을 식이하였을 때, RGw대비 약 5배 적은 양의 홍삼을 섭취하게 되지만 진세노사이드 함량은 2배정도 차이가 나는 것을 확인할 수 있었다.
Cmax (혈중 최고 검출 농도)값을 확인하였을 때 600 ㎎/㎏ 투여군 간에는 진세노사이드 Rb1 및 Rd 에서 fRGe을 섭취하였을 때 각각 25.51 ± 7.29 ng/mL, 그리고 8.69 ± 4.11 ng/mL 가장 높았다(RGw은 각각 3.67 ± 3.34 ng/mL, 그리고 1.16 ± 0.36 ng/mL, RGe 은 각각 23.27 ± 8.81 ng/mL 그리고 4.67 ± 1.24 ng/mL이었다).
이번 실험에서 측정된 총 진세노사이드 TG는 RGw 600 ㎎/㎏ 투여군이 42.12 ± 9.57 ㎎/㎏, RGe 120 ㎎/㎏ 및 600 ㎎/㎏ 투여군이 각각 108.28 ± 10.88 ㎎/㎏ 및 321.45 ± 54.5 ㎎/㎏, fRGe 120 ㎎/㎏ 및 600 ㎎/㎏ 식이군이 각각 139.01 ± 10.62 ㎎/㎏ 및 537.34 ± 93.49 ㎎/㎏를 투여한 것으로 확인되었다. 홍삼 600㎎/㎏ 투여한 군간 비교에서는 RGw 투여군 보다 RGe에서 모두 높은 혈액 검출량을 확인하였으며, RGe 120 ㎎/㎏으로 투여한 군은 발효유무에 관계없이 600 ㎎/㎏의 RGw 투여군보다 2~3배의 진세노사이드 검출량을 확인하였으며, fRGe을 투여하였을 때는 혈액 검출량이 더 높았다. fRGe는 홍삼발효를 통해 진세노사이드Rd 및 CK의 함량이 높은 홍삼으로 알려져 있다(Kim et al., 2018). 기존 연구에 의하면 인삼 사포닌이 체내로 잘 흡수되기 위해서는 가수분해 형태의 극성이 낮은 진세노사이드 대사로 전환되어야 흡수가 더 잘된다고 보고하고 있다(Kim et al,, 2018). 이 과정에서 발효홍삼을 섭취하게 되면 미생물이나 유산균이 진세노사이드의 구조를 극성이 낮은 사포닌으로 가수분해하여 체내 흡수가 용이하게 전환될 뿐만 아니라 미생물에 의해 생성된 2차 진세노사이드 및 당류, 섬유질 및 프리바이오틱스들이 흡수율을 향상시킨다고 보고되었다(Zhang et al., 2020). 따라서 이러한 연구결과를 통해 발효홍삼을 섭취하였을 때 일반적으로 발효하지 않은 홍삼을 섭취했을 때보다 생체이용율(AUC값)이 증가하는 것을 확인하였다. 더불어 RGw보다 RGe의 총 진세노사이드 TG의 생체이용율이 높음을 확인하였고, fRGe은 RGe 보다 총 진세노사이드 TG의 생체이용율이 더 효과적임을 확인하였다. 홍삼의 진세노사이드는 다양한 연구를 통해 염증개선, 항산화 등의 다양한 효과를 나타내고 있으며(Kim et al., 2017; Saba et al., 2018), 이를 토대로 발효홍삼 진세노사이드의 우수한 흡수 효과는 홍삼 및 발효홍삼의 기능성을 설명할 수 있는 중요한 연구결과로 활용될 수 있을 것으로 판단된다.
선행 연구결과에서 fRGe을 섭취하였을 때, RGw을 섭취한 사람 보다 Rd 및 CK등 진세노사이드가 인체내 흡수율이 높은 것을 확인하였다(Kim et al., 2019). 이번 연구를 통해 fRGe를 식이한 그룹에서 진세노사이드 Rd 및 CK를 포함한 총 진세노사이드 TG의 흡수량이 높은 것을 확인함으로써 인체에서 또한 동일한 효과가 나타날 것으로 예측된다.
적 요
본 연구에서는 발효홍삼과 발효하지 않은 홍삼을 BALB/c mouse에 경구투여한 후 혈청을 채취하여 주요 진세노사이드 생체이용율을 LC-MS/MS이용하여 분석하였다. 또한 이들의 항염효과를 IL-1β, TNF 정량분석을 통해 비교하였다.
홍삼을 발효하였을 때, Rd를 포함한 전체적인 총 진세노사이드 함량이 증가하는 것을 확인하였으며, 마우스에게 투여하였을 총 진세노사이드 TG 의 혈액 검출량 AUC 또한 발효홍삼을 섭취하였을 때 높은 것을 확인하였다. Cmax값 또한 동일하게 발효홍삼을 섭취하였을 때 증가하는 것을 확인하였다. 염증지표를 확인 하였을때 유도군과 비교하여 IL-1β, TNF의 감소효과는 확인하였으나 그룹간의 유의적 차이는 발생하지 않았다. 이상의 연구결과로 probiotics가 발효홍삼의 ginsenoside 생체이용율을 향상시키는 중요한 요인임을 확인하였고, 이는 probiotics를 이용한 천연물 발효제제의 적용 확장과 그 산업적 활용성 증대에 기여할 수 있을 것으로 사료된다.