서 언
재료 및 방법
시험재료 및 돌연변이원
출현율과 생존율 조사
우량계통 생육특성 조사
품질 및 프락토올리고당 분석
통계 분석
결과 및 고찰
관아의 출현율과 생존율
초기세대(M1) 생육특성
돌연변이 후대(M8) 우량계통의 생육특성
돌연변이 후대 계통의 프락토올리고당 함량
적 요
서 언
야콘(Smallanthus sonchifolius [Poepp. & Endl.] H. Robinson)은 대표적인 ‘천연 프락토올리고당’을 가진 작물이며, ‘땅속의 과일(Peruvian ground apple)’로 불릴 만큼 아삭아삭하고 달콤한 맛을 낸다(Kim et al., 2011). 원시 야콘은 S. macroscyphus와 S. riparius 교배로 이루어졌으며, 관련 종은 8배체(58개 염색체)로 이질 배수성을 나타내어 주로 종자로 번식하지 않고 붉은 구슬 모양의 관아로 영양번식을 한다(Brako and Zarucchi, 1993).
야콘은 유전변이가 적고, 유전자원의 다양성이 부족하여 품종 육성에 어려움을 겪고 있다(Kim et al., 2011). 특히, 국내에서 재배되고 있는 야콘은 괴근의 갈라짐이 6.6~21.9% 범위로 심하고 재배환경과 유전형질에 따라 생산성과 기능성 성분 함량의 차이가 크므로 우수한 형질을 지닌 품종 개발이 필요하다(Kim et al., 2012). 품종 육성의 첫 단계는 다양한 유전변이를 가진 유전자원의 확보이다(Lee et al., 2020). 야콘처럼 자연변이의 발생 빈도가 낮고, 종자번식이 어려운 식물의 경우 영양번식체에 방사선 또는 화학약품을 처리하여 인위적인 변이를 창출하고, 유용 변이체를 선발하는 돌연변이 육종(mutation breeding)이 품종 개발에 주로 활용되고 있다(Kharkwal, 2012; Misra et al., 2003; Sivasankar et al., 2020). 그 중에서도 방사선을 이용한 돌연변이 유도는 방사능 잔류에 대한 안전성이 검증된 감마선, X-선 등의 방사선을 식물 종자나 괴근, 묘목 등에 직접 조사하여, 식물체 일부 유전자의 기능을 없애거나 활성화함으로써 기존의 유전형질을 비교적 용이하게 개량할 수 있는 장점이 있어 작물 육종에 꾸준히 이용되고 있다(Kim et al., 2022; Kimura and Ohta, 1971; Patade and Suprasanna, 2008). 특히 돌연변이원으로 방사선을 처리한 경우를 방사선 육종(radiation breeding)이라고 한다. 방사선 육종은 돌연변이원 유도에 가장 많이 사용되고 있는데(Ulukapi and Nasircilar, 2015), 콩(Kim et al., 2013), 무궁화(Kim et al., 2015) 등에서 감마선 처리를 통해 육성된 품종이 등록되었으며, 인삼(Lee et al., 2020)에서는 종자개갑률과 종자발달 등의 농업형질을 대상으로 유용 돌연변이체를 유도하기 위한 적정선량이 구명되었다.
이러한 돌연변이원(mutagen)을 이용한 품종육종시 적정 감마선 조사 선량의 구명이 필요하며(Chontira et al., 2005; Misra et al., 2003), M1 세대에서 적정 선량의 결정에는 생존율과 생장률이 주요 선발인자로 이용되고 있다고 하였다(Kang et al., 2013; Yamaguchi et al., 2009). 또한 감마선을 조사한 작물은 초기 세대(M1)에서는 열성으로 나타나거나 구분 키메라(sectorial chimera)일 경우가 많고, 이형접합체(heterozygote)에서는 유의미한 차이를 보이는 표현형이 잘 나타나지 않기 때문에 동형접합(homozygosis)이 일어나는 M2~M3세대, 또는 그 이후 세대에서 선발하는 것이 유리하다고 보고되었다(Shikazono et al., 1998; Yamaguchi et al., 2009).
지금까지 방사선 돌연변이 기술을 활용한 야콘의 품종 육성 연구는 거의 이루어지지 않았다. 따라서 본 연구에서는 유용 돌연변이 유전자원을 확보하기 위해 야콘 관아 또는 새싹에 다양한 선량의 감마선을 조사하였다. 이를 통해 유용 돌연변이체 유도를 위한 적정 선량을 구명하였다(Kang et al., 2007; Kang et al., 2020; Kwon and Won, 1978). 또한 이들 돌연변이체를 계통화하는 일련의 과정을 통해 육성된 후대 우수계통의 수량 관련 형질과 품질 특성을 원종과 비교함으로써 품종화 가능성을 평가하였다.
재료 및 방법
시험재료 및 돌연변이원
시험재료는 야콘을 사용하였으며, 감마선(gamma ray/radiation, γ선)은 구근식물에서 주로 사용하고 있는 저선량(<1 kGy 이하)으로 처리하였다(Kwon and Won, 1978). 야콘 관아는 싹이 1∼2 ㎝ 나온 새싹 그룹(Sprout of green bud, SP)과 싹이 나오지 않은 관아 그룹(No Sprout of crown bud, NS)으로 구분하여 각 처리별로 50개체씩 봉투에 넣어 시료명과 조사선량을 명확히 기재한 후 전북 정읍에 위치한 한국원자력연구소 첨단방사선연구소 조사시설에서 일반적인 처리시간에 준하여 24시간 동안 20, 40, 60, 80 Gy의 선량으로 조사하였다(Table 1). 야콘 초기(M1) 세대에서 감마선 선량에 따라 돌연변이 효과가 있는지를 알아보기 위해 출현율과 생육특성을 원종과 비교하였다. M2∼M4까지 6계통 21개체를 선발·수확하고, M5∼M7 세대에서 6계통 6개체를 계통화한 후, 고정도가 높고 원종에 비하여 생육특성이 우수한 계통을 선발하여 세대진전하였으며, M8 세대에서 지상부 특성과 괴근 수량 및 품질 특성을 조사하였다.
Table 1.
Line of crown bud and green bud in yacon with different dose of gamma-ray.
| Treatmentz | Gamma-ray dose | Condition of crown bud | Yacon plant |
|
NS (Crown bud) |
0 Gy 20 Gy 40 Gy 60 Gy 80 Gy |  |  |
|
SP (Green bud) |
0 Gy 20 Gy 40 Gy 60 Gy 80 Gy |  |
출현율과 생존율 조사
야콘 관아는 국립식량과학원 고령지농업연구소(평창) 유리온실에서 시판상토 2호(농우바이오, 수원, 한국)에 심고, 미니 플라스틱 터널을 설치하여 25±5℃로 유지하면서 삽수를 만들었다(Kim et al., 2017). 관아를 심고 상토를 3 ㎝ 정도 복토하였으며, 상토 표면 위로 싹이 나온 것을 출현된 것으로 보고 처리당 50개씩 10일 간격으로 조사하였다. 생존율은 파종 후 50일까지 유식물체가 지표면 위로 출현한 것을 생존한 것으로 판단하고 추세선을 이용하여 LD50 값을 계산하였다.
우량계통 생육특성 조사
야콘 묘의 균일성을 유지하고자 관아(crown bud)를 유리온실에서 3월 상순에 파종하고 온도를 20∼25℃로 유지하면서 30일 동안 싹을 틔웠다. 어린 순의 잎이 2∼3매가 되었을 때, 50공 트레이에 삽목하여 25∼30일간 20∼25℃ 조건에서 육묘하였다. 4월 하순에 묘 정식을 위해 표준시비 시험포장을 준비하였으며, 추비는 하지 않았다. 잡초방지를 위해 5월 상순에 두둑을 30 ㎝로 높게 하고 흑백비닐로 피복하였다. 5월 상·중순에 재식밀도를 100 × 50 ㎝ (기준 2,000주/10a)로 하여 정식하고, 10월 상순에 수확하였다.
수량 검정을 위해 20 m2(2 m × 10 m)의 면적에, 4반복으로 시험을 수행하였다. 주요 생육 특성을 농촌진흥청 농업과학기술 연구조사 분석기준(RDA)에 따라 조사하였다(Kim et al., 2017). 생육 및 생산성과 관련된 농업형질로 지상부의 초장, 줄기수, 엽수, 잎줄기 생체중을 조사하였고, 지하부의 괴근 수량 등을 중점적으로 평가하였다. 지하부 수량은 총수량(지하부 괴근의 전체 무게), 상품수량(101 g 이상으로 병해가 없는 신선한 괴근 무게) 및 관아수량(뿌리에서 관아를 따로 채취한 무게)으로 구분하여 조사하였다. 저장 중 병발생률은 10±2℃ 저온저장고에 괴근을 넣어 3개월간 보관하면서 아래식에 따라 조사하였다.
품질 및 프락토올리고당 분석
야콘 괴근의 유리당과 프락토올리고당을 식품공전(KFDA, 2005)에서 명시된 방법에 준하여 분석하였다. 시료 10 g에 80% 에탄올 50 mL를 가하여 균질기(Ultra-Turrax T25 Basic Homogenizer, IKA Co., Staufen, Germany)에서 9,500 rpm으로 1분간 마쇄하고, 50 mL로 정용한 다음, 여과지(No. 2, Whatman International, Maidstone, UK)로 1차 여과하였다. 유리당과 프락토올리고당 분석을 위해 표준용액과 추출용액을 멤브레인 필터(0.45 ㎛, Milipore, Bedford, MA, USA)로 2차 여과한 후 분석에 사용하였다. 액체크로마토그래프(Waters 2695 HPLC, Waters Co., Milford, MA, USA)에 컬럼(Carbohydrate LC-NH2 Φ4.6 × 250 ㎜, 5 ㎛, Supercosil, Bellefonte, USA)을 장착하고, 30℃ 온도로 유지하였다. 이동상은 아세토니트릴:증류수(acetonitrile:water = 70:30, v/v)를 이용하였으며, 유속은 1.0 mL/min로 하였다. 검출기는 굴절률 검출기(Waters 2414 Refractive Index Detector, Waters, Milford, MA, USA)를 이용하였다. 유리당 표준용액은 글루코스, 프럭토스 및 수크로스(Sigma Aldrich, St. Louis, WA, USA)의 표준품을 사용하였다. 프락토올리고당의 표준용액(Fructooligosaccharides Set, Wako, Osaka, Japan)은 케스토즈(1-kestose = GF2), 니스토즈(nystose = GF3), 프락토푸란노실니스토즈(1F-fructofuranosylnystose = GF4)의 표준품을 사용하였다. 표준물을 합산하여 프락토올리고당 농도를 계산하였다.
통계 분석
발아율, 생존율, 초장, 생체중, 수량 등의 분석결과는 단순선형회귀분석(simple linear regression analysis)으로 LD50 (median lethal dose) 및 RD50 (median reduction dose) 선량을 결정하였다. 통계처리는 SAS package 9.1 (SAS Institute Inc., Cary, NC, USA)과 R version 3.4.4 (The R Foundation for Statistical Computing, Vienna, Austria)를 이용하였다. 유의성 검정을 위하여 던컨의 다중검정(Duncan’s Multiple Range Test, DMRT)을 5% 유의수준에서 분석하였다.
결과 및 고찰
관아의 출현율과 생존율
싹이 나오지 않은 관아(NS)와 새싹이 나온 관아(SP) 두 그룹의 야콘 감마선 20∼80 Gy 처리후 출현율은 Table 1과 Fig. 1과 같다. NS 그룹의 원종 출현율은 90%이었으나 40 Gy 처리시 44%로 감소하였으며, 80 Gy의 높은 선량에서는 20% 이하로 급격히 감소하였다. SP 그룹 처리에서도 원종의 출현율이 95%이였으나 40 Gy 처리시 50%로 감소하였으며, 80 Gy에서는 단지 10%만이 출현하였다. 게다가, NS 또는 SP 그룹 모두 80 Gy의 높은 선량으로 처리된 경우 일부 출현된 식물체도 대부분 생존하지 못하였다. 기존의 연구에서도 높은 선량의 감마선 처리는 출현율과 생존율에 부정적인 영향을 미친다고 하였는데, 이런 현상은 체세포 분열 과정에서 세포 발달을 정지시켜 특정 생장조절 관련 물질의 합성이 억제된 것이 주원인이라고 하였다(Norfadzrin et al., 2007; Omar et al., 2008; Jan et al., 2012). 야콘에서도 고선량 감마선 처리에서 출현율이 떨어지고, 출현된 싹의 경우에도 생육 발달이 저해되며 심한 경우 세포 괴사로 인해 정상적인 생육이 이루어지지 못하는 비슷한 연구결과가 관찰되었다.
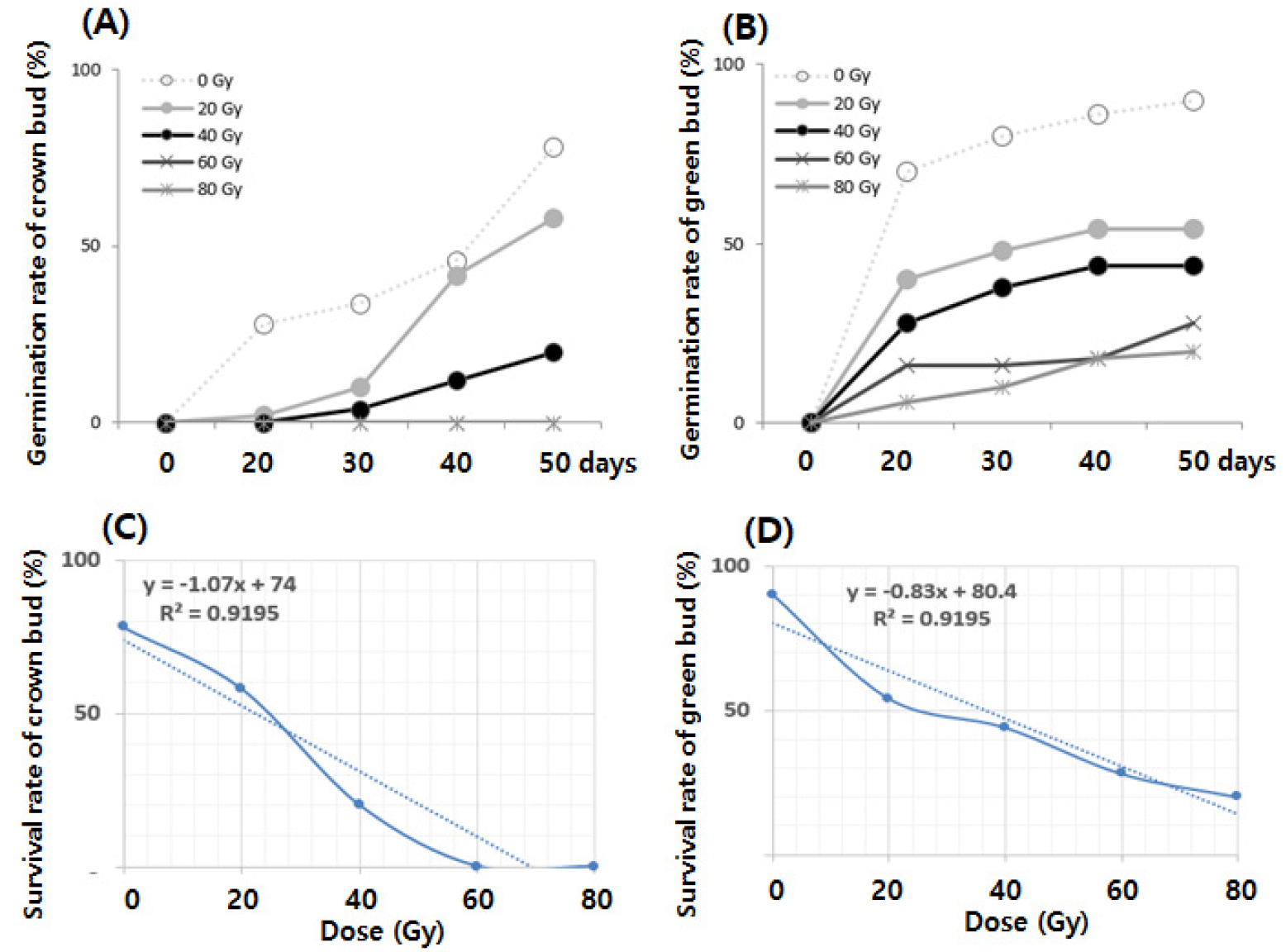
Fig. 1.
Germination and survival rate in yacon with different dose of gamma-ray. (A) germination rate of crown bud; (B) germination rate of green bud; (C) survival rate of crown bud; (D) germination rate of green bud. The median lethal dose (LD50) of yacon crown bud with crown bud and green bud was 22.4 Gy and 36.6 Gy.
고선량의 감마선 처리는 작물 생육에 부정적인 영향을 미치지만, 적정 선량의 처리는 배 발달이나 생육에 긍정적인 영향을 준다고 하였다(Lee et al., 2020). 이러한 유망 돌연변이를 유기하기 위한 기준 값으로 LD50 값이 주로 사용되며, Surakshitha et al. (2017)은 40∼60% 생존율(LD40-60)과 30∼50% 생육 감소율(RD30-50)을 돌연변이 유도를 위한 감마선 처리 선량의 기준이라고 하였다. 또한 Yamaguchi et al. (2009)은 생존율이 급속히 감소하기 시작하는 지점이 유전적 배경의 큰 변화없이 유용 돌연변이체를 얻을 수 있는 적정 선량의 기준이라고 하였다.
본 연구에서도 돌연변이 육종의 기초자료로 활용하고자 단순선형회귀분석으로 추정한 LD50 선량은 NS 그룹이 22.4 Gy, SP 그룹이 36.6 Gy인 것으로 생존율 감소현상이 나타났으며, 40 Gy 처리에서 생육의 급격한 감소를 보이므로 감마선 20∼40 Gy가 야콘의 유용 돌연변이체 유기를 위한 적정 선량인 것으로 판단되었다.
초기세대(M1) 생육특성
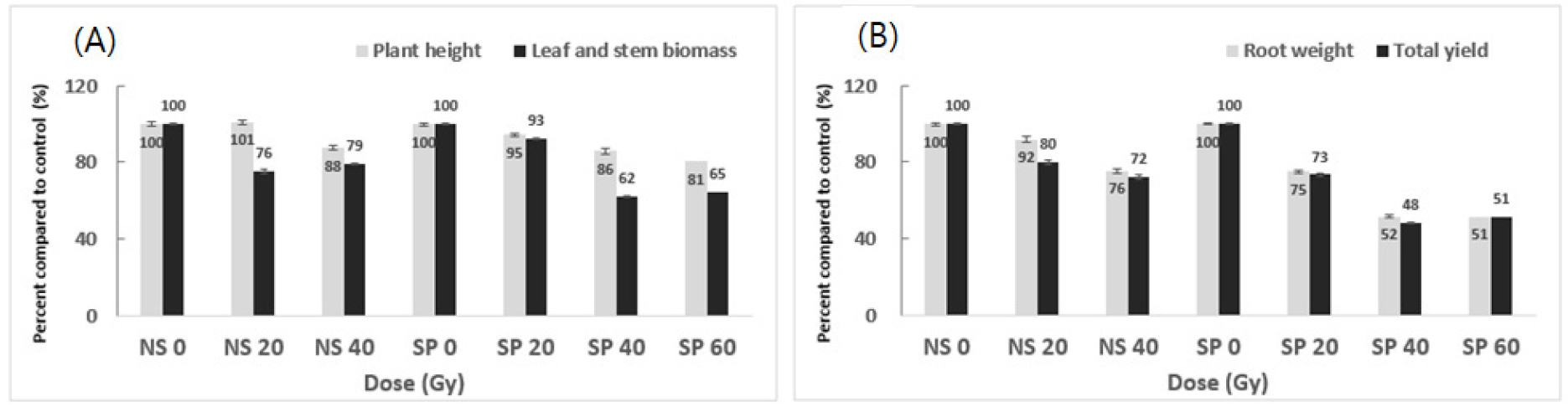
싹이 나오지 않은 관아(NS)와 새싹이 나온 관아(SP)에 감마선 20∼60 Gy를 처리하여 출현한 식물체의 지상부 생육은 원종과 유의미한 차이를 나타내었고, 선량에 따라 차이를 보였다(Fig. 2a). NS 그룹의 20 Gy 처리는 지상부 생육이 원종과 큰 차이가 없었으나, 40 Gy 처리에서는 초장과 잎줄기 무게가 원종보다 감소하였다. 감마선 40 Gy 이상으로 처리된 SP 그룹의 식물체도 원종과 확연한 차이를 보였는데, 선량이 높아짐에 따라 초장과 잎줄기 무게가 유의미하게 감소하였다.
감마선 처리는 야콘 식물체의 지하부 발달에도 영향을 주는 것으로 조사되었다(Fig. 2b). NS 그룹의 20 Gy 처리는 괴근수량이 원종과 비슷한 경향이었으나 40 Gy로 처리한 경우는 괴근수량이 유의미하게 감소하였다. 이러한 경향은 NS 그룹보다 SP 그룹에서 뚜렷하였는데, SP 그룹에서 40 Gy로 처리된 식물체는 괴근수량이 원종 대비 48% 감소하였다.
감마선으로 유기된 야콘 돌연변이 계통의 주요 특성을 요약하면, 지상부는 초장이 작아지고 잎줄기 무게가 감소하여 밀식적응성이 높은 식물 형태로 변화되었으며, 지하부는 열근 현상이 뚜렷이 감소하여 품질 특성이 개선되었다.
생장 요소별로 측정된 값을 단순선형회귀분석으로 원종의 생장과 비교하여 50 %가 저해된 RD50 선량을 추정한 결과(Fig. 3), 초장 151.3 Gy, 지상부중 73.7 Gy, 지하부중 53.0 Gy, 총수량 45.8 Gy, 상품수량 44.4 Gy, 열근 98.4 Gy로 각 항목별로 다르게 나타났다.
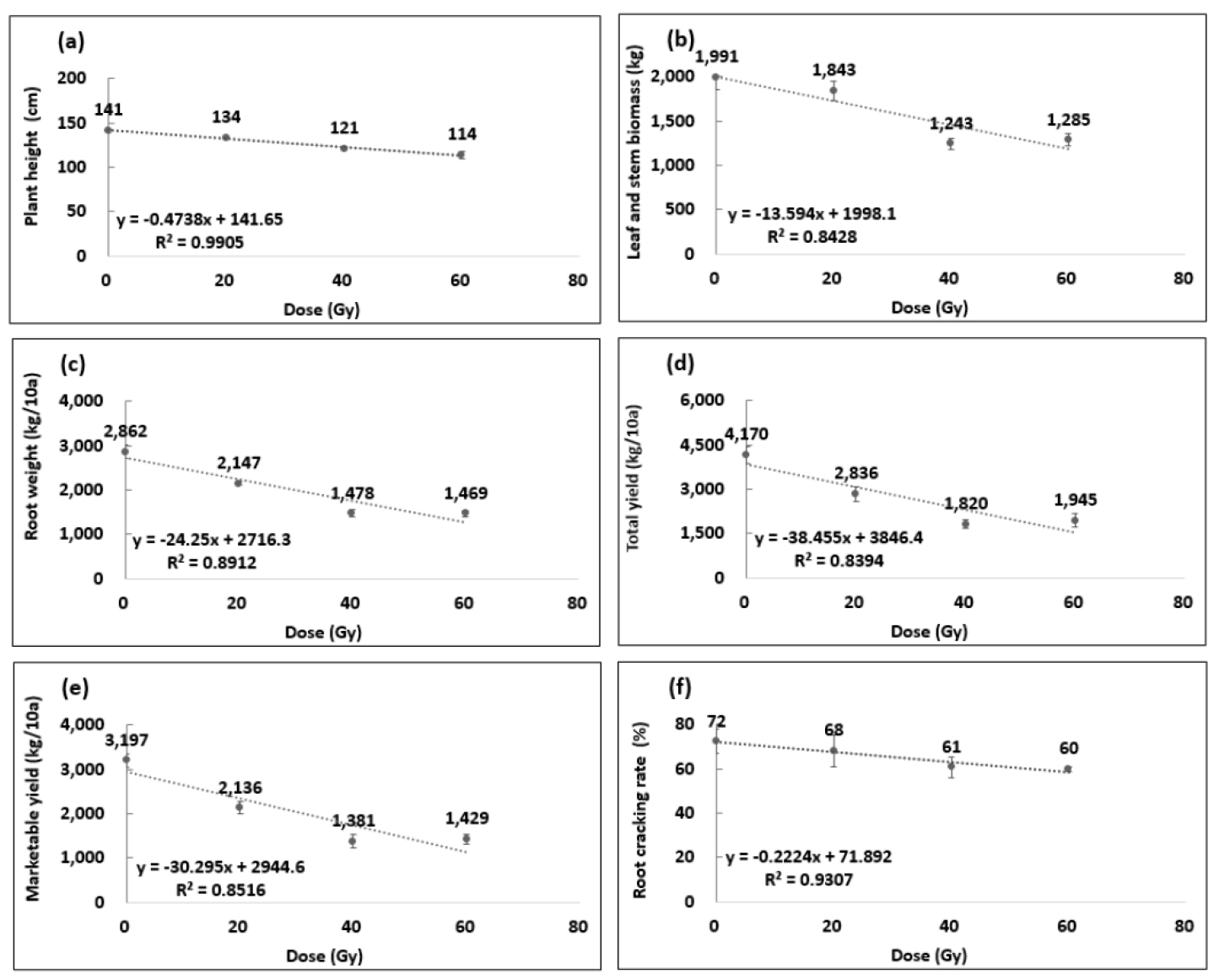
Fig. 3.
RD50 values for (A) plant height leaf; (B) stem biomass; (C) root weight; (D) total yield; (E) marketable yield; and (F) root cracking rate in yacon with different dose of gamma-ray after 5 month after planting. Duncan’s multiple range test at 5% level, Error bars indicated±S.E. (n = 4). The median reduction dose (RD50) of yacon with green bud of plant height, leaf and stem biomass, root weight, total yield, marketable yield, and root cracking rate was 151.3, 73.7, 53.0, 45.8, 44.4 and 98.4 Gy.
RD50 선량을 비교하면 지상부의 초장과 생체중은 73.7∼151.3 Gy로 높은 선량을 요구하였고, 지하부의 지하부중과 수량은 상대적으로 낮은 수준인 44.4∼53.0 Gy가 필요하였다. 열근 감소에는 98.9 Gy의 높은 수준의 선량이 요구되었다. 또한, 강력한 열근 감소를 위해 높은 선량을 처리할 경우 수량 감소가 동반된다는 사실을 확인하였다. 돌연변이 유도를 위한 방사선의 적정 조사선량의 결정 방법 중 M1 세대에서는 단순히 발아율을 조사하는 것보다 생육감소가 30∼50%, 생존율 40∼60%를 나타내는 정도가 적정하다고 보고되었으며(Chontira et al., 2005; Yonezawa and Yamagata, 1977), 이전 연구결과를 바탕으로 20∼40 Gy의 선량이 야콘의 돌연변이체 유도를 위해 적정한 것으로 판단되었다. 그러나 감마선 20∼80 Gy 조사 개체에서 수확된 괴근의 형태적 변이 차이가 확연하게 관찰되지 않은 점과 식물체의 유전적 변이는 LD50 선량과 RD50 선량 보다 낮은 선량에서도 유발된다는 연구 결과(Yamaguchi et al., 2009)를 반영하면 추후 후기세대에서 나타나는 변이에 대한 평가가 필요하다고 볼 수 있다(Misra et al., 2003; Ryu et al., 2016; Shikazono et al., 1998). 이는 LD50이 벼(Oryza sativa)는 300 Gy, 귀리(Avena sativa)는 392 Gy로 식물의 종 또는 품종간에 차이가 있음을 알 수 있으며, 이러한 차이의 원인은 염색체 등 다양하다고 보고되었다(Ryu et al., 2016; Yamaguchi et al., 2009). 이런 감마선 처리에 따른 표현형의 변화는 돌연변이에 의한 것일 수도 있지만 세포의 손상에 의한 생리ㆍ화학적 반응의 결과일 수 있으므로 후대에 이러한 변화가 유전되는지에 대한 세밀한 관찰도 필요할 것으로 판단된다.
돌연변이 후대(M8) 우량계통의 생육특성
감마선 처리를 한 NS 또는 SP 그룹 후대 야콘 계통의 생육조사 결과는 Table 2와 같다. 돌연변이 후대 계통의 지상부에서 초장은 원종과 비슷하거나 감소하는 경향을 보였으나, 줄기수, 엽수, 잎줄기 무게 등의 형질은 원종보다 증가하였다. 야콘 NS 그룹의 후대 계통의 초장은 20 Gy과 40 Gy 처리에서 158~168 ㎝로 원종과 비슷하거나 감소하였다. SP 그룹에서도 초장은 원종(147 ㎝)에 비해 SP 40 (130 ㎝) 과 SP 60 (143 ㎝) 처리에서 감소하는 경향이었다.
Table 2.
Morphological and ecological traits of yacon in M8 generation.
| Treatmentz | Gamma-ray dose |
Plant height (㎝) |
No. of branch (plant) |
No. of leaf (plant) |
Leaf and stem biomass (㎏/plant) |
| NS | 0 Gy | 168 ay | 7.5 c | 212 ab | 2,238 bc |
| 20 Gy | 158 ab | 8.8 bc | 216 ab | 2,753 a | |
| 40 Gy | 168 a | 10.0 ab | 293 ab | 2,938 a | |
| SP | 0 Gy | 147 b | 10.5 ab | 165 b | 2,835 a |
| 40 Gy | 130 c | 11.5 a | 144 b | 1,954 c | |
| 60 Gy | 143 bc | 11.0 a | 196 b | 2,571 ab | |
| Statics | p-value | 8.29*** | 5.43NS | 3.33*** | 5.34** |
분지수와 엽수는 NS와 SP 그룹에서 모두 원종 대비 약간 증가하였으나 통계적인 유의차는 없었다. 잎줄기 생체중은 원종의 2,238 ㎏에 비해 NS 20 Gy과 NS 40 Gy 처리에서 각각 2,753 ㎏, 2,938 ㎏으로 유의하게 증가하였다. SP 그룹의 경우에는 잎줄기 생체중이 원종(2,835 ㎏)에 비해 SP 40 Gy과 SP 60 Gy 처리에서 각각 1,954 ㎏, 2,751 ㎏으로 감소하였다.
벼의 경우 재래종 녹미(생동찰벼)에 감마선 200 Gy를 조사하여 출수가 빠르고 초장이 작아 재배안정성이 강화된 품종을 육성하였는데(Kang et al., 2020), 본 연구의 야콘 후대 계통에서도 초장이 작고, 생체중이 감소한 밀식적응성이 높은 돌연변이체가 선발되어 유망 품종으로의 개발이 가능할 것으로 기대되었다.
감마선 처리는 후대 계통의 지하부 발달에도 큰 영향을 미쳤다(Table 3). 괴근의 총수량은 NS 그룹의 20 Gy 처리에서 4,300 ㎏/10a, 40 Gy 처리에서 4,251 ㎏/10a으로 원종 3,817 ㎏/10a에 비해 각각 12.7%, 11.4% 증수되었다. SP 그룹에서도 40 Gy 처리에서 3,039 ㎏/10a, 60 Gy에서 2,683 ㎏/10a로 원종 2,458 ㎏/10a 대비 각각 23.6%, 9.2% 증수된 것으로 나타났다. 상품수량은 SP 40 Gy 처리에서만 통계적인 유의성이 확인되었으며, 관아수량은 처리간에 유의미한 차이가 없었다.
Table 3.
Agricultural production yield of yacon in M8 generation.
| Treatmentz | Gamma-ray dose |
Total yield (㎏/10a) |
Marketable yield (㎏/10a) |
Crown bud yield (㎏/10a) |
| NS | 0 Gy | 3,817 bcy | 3,163 ab | 69 a |
| 20 Gy | 4,300 a | 3,812 ab | 79 a | |
| 40 Gy | 4,251 a | 3,756 ab | 106 a | |
| SP | 0 Gy | 2,458 c | 1,753 c | 120 a |
| 40 Gy | 3,039 bc | 2,394 bc | 92 a | |
| 60 Gy | 2,683 b | 1,945 c | 132 a | |
| Statics | p-value | 7.26*** | 10.33*** | 1.26NS |
한국원자력연구원에서는 돌연변이 처리를 통해 수량성과 내도복성이 개량된 ‘원청벼’, ‘원평벼’ 등 벼 품종 개발에 성공하였다(Kang et al., 2020). 이러한 사례를 고려해 볼 때, 본 연구에서 육성된 야콘의 괴근 수량성이 증가된 후대 계통은 지역적응성 등 추가적인 연구를 통해 우수 품종으로 개발이 가능할 것으로 판단되었다.
한편, 야콘은 저장중에 무름병, 잿빛곰팡이병이 주로 관찰되는데(Kim et al., 2010), 저장 2개월 경과 후 병 발생률을 보면(Fig. 4), NS 그룹의 경우 원종 55.0%에 비해 20 Gy에서 32.5%, 40 Gy에서 40.0%로 각각 40.9%, 27.3% 감소되었다. SP 그룹은 원종의 병발생률이 60.0%인데 비해 40 Gy은 52.5%, 60 Gy은 50.0%로 각각 12.5%, 16.7% 감소되었다. 그러나 저장 3개월 후에는 병 발생률의 유의미한 차이가 없었다.
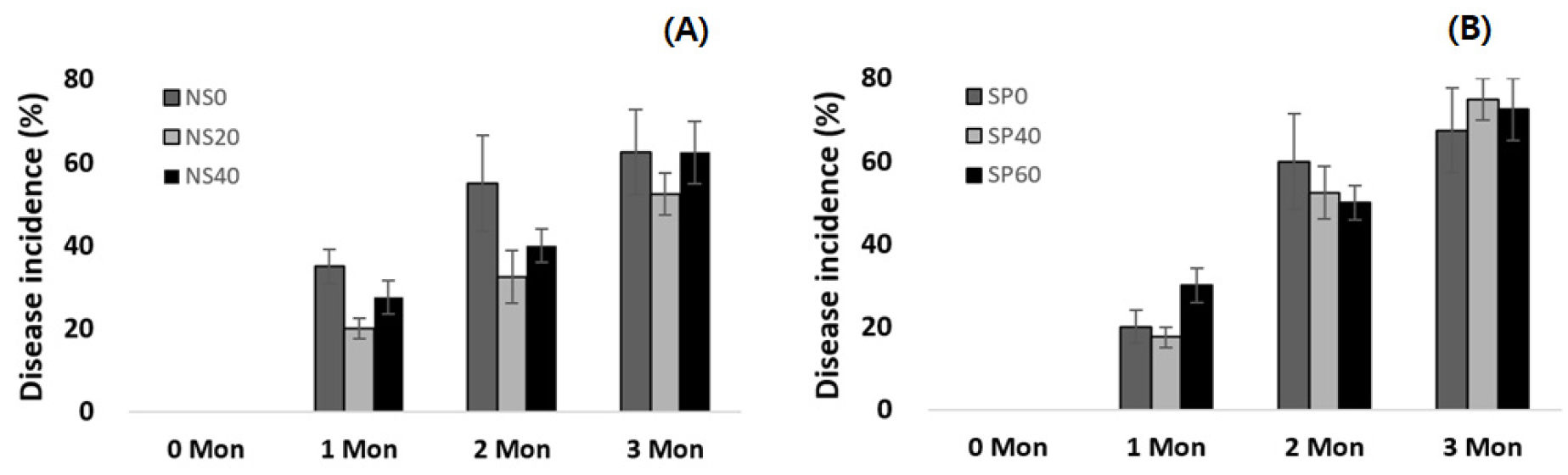
Fig. 4.
Change in disease incidence of yacon storage in M8 generation. Gamma-ray treatment with different dose: (A) No Sprout of crown bud (NS); (B) Sprout of green bud (SP). NS0, Positive control of NS group; NS20, NS 20 Gy; NS 40, NS 40 Gy; SP0, Positive control of SP group; SP20, SP 20 Gy; SP60, SP 60 Gy.
돌연변이 후대 계통의 프락토올리고당 함량
야콘 돌연변이 계통의 괴근 당함량을 분석한 결과, 생체중 100 g 당 글루코스 0.40∼1.19 g, 프럭토스 0.4∼1.1 g, 수크로스 0.4∼0.9 g, 프락토올리고당 4.8∼8.1 g이 함유되어 있었다(Table 4, Fig. 5). 감마선 처리시 NS 그룹에서는 원종 대비 글루코스와 수크로스 함량이 증가하였으나 SP 그룹에서는 글루코스와 수크로스 함량이 오히려 감소하였다. 프락토올리고당 함량은 원종 5.1%에 비해 NS 그룹의 20 Gy (6.1%) 처리는 1.0%, 40 Gy (5.5%) 처리는 0.4% 높았으며, 수크로스 함량은 원종이 0.4%인데 비해 20 Gy (0.6%) 처리는 0.2%, 40 Gy (0.9%) 처리는 0.5% 높았다. SP 그룹의 경우 모든 처리에서 프락토올리고당 함량이 증가하였는데, 특히 40 Gy 처리 계통이 8.1%로 가장 많은 함량을 보였다.
Table 4.
Free sugar and fructo-oligosaccharides content of tuberous root yacon in M8 generation.
| Treatmentz |
Gamma-ray dose | Free sugar (%) |
Fructo-oligosaccharides (%) |
Sugar content (°Brix) | ||
| Fructose | Glucose | Sucrose | ||||
| NS | 0 Gy | 0.6 bcdy | 0.7 b | 0.4 b | 5.1 c | 13.7 a |
| 20 Gy | 0.7 bc | 0.7 b | 0.6 b | 6.1 b | 10.8 bc | |
| 40 Gy | 0.5 d | 1.1 a | 0.9 a | 5.5 bc | 11.6 bc | |
| SP | 0 Gy | 0.9 abc | 1.0 a | 0.6 b | 4.8 c | 10.5 c |
| 40 Gy | 0.4 d | 0.4 c | 0.4 b | 8.1 a | 11.7 bc | |
| 60 Gy | 1.1 a | 0.8 b | 0.5 b | 6.4 b | 10.9 bc | |
| p-value | 13.8*** | 21.81*** | 8.87*** | 17.64*** | 13.63*** | |
야콘에는 프럭토스, 글루코스, 수크로스, 이눌린 및 프락토올리고당 등이 함유되어 있으며(Goto et al., 1995), 이 중 프락토올리고당이 약 3∼10% 정도로 대부분을 차지한다고 보고되었다(Itaya et al., 2002; Kim et al., 2017). 본 연구에서 SP 그룹에 40 Gy를 처리하여 육성된 후대계통은 프락토올리고당과 수크로스 함량이 모두 증가되어 프리바이오틱스 등 기능성 식품소재로도 활용가치가 높을 것으로 기대된다.
적 요
야콘(Smallanthus sonchifolius [Poepp. & Endl.] H. Robinson)은 아삭아삭하고 달콤한 맛을 내는 프락토올리고당을 가진 작물이다. 그러나 괴근의 갈라짐이 심해 재배안전성과 기능성이 우수한 품종 개발이 필요하다. 본 연구에서는 다양한 선량의 감마선을 조사하여 유용 돌연변이체를 유도, 선발, 고정, 계통화하는 일련의 과정을 통해 육성된 후대 우수계통의 수량 및 품질 특성을 원종과 비교함으로써 품종화 가능성을 평가하였다. 야콘은 감마선 22.4∼36.6 Gy가 유용 돌연변이체 유기를 위한 적정 선량인 것으로 나타났다. 돌연변이 초기 세대(M1)의 지상부는 초장과 잎줄기 무게가 감소하여 밀식적응성이 높은 초형으로 변화되었으며, 지하부는 열근 현상이 감소하여 품질 특성이 개선되었다. 돌연변이 후대 계통의 초장은 원종과 비슷하거나 감소하는 경향을 보였으나 줄기수, 엽수, 잎줄기 무게 등의 형질은 원종보다 증가하는 것으로 조사되었다. 괴근 총수량은 싹이 나오지 않은 관아에 20 Gy를 처리한 계통에서 4,300 ㎏/10a, 40 Gy 처리에서는 4,251 ㎏/10a으로 원종(3,817 ㎏/10a)에 비해 각각 12.7%, 11.4% 증수되어 생산성이 높은 우수계통으로 판단되었다. 또한, 새싹이 나온 관아에 40 Gy 를 처리하여 육성된 후대계통은 프락토올리고당과 수크로스 함량이 모두 증가되어 우수계통으로 판단되었다. 따라서, 싹이 나오지 않은 관아에 20 Gy와 40 Gy를 처리하여 육성된 후대계통은 괴근의 갈라짐이 적고 생산성이 높으면서 저장 중 병 발생률이 낮아 장기저장이 가능하고, 프락토올리고당 함량이 높아 프리바이오틱스 등 기능성 식품소재로도 활용가치가 높을 것으로 기대된다.