서 언
재료 및 방법
시험 장소
콩씨스트선충 검정 및 밀도 조사
시험포 구획과 재배
콩 수량구성요소 및 수량 조사
결 과
씨스트선충의 검정
콩씨스트선충의 밀도와 콩의 수량구성요소 비교
콩씨스트선충의 밀도와 콩의 수량 변화
콩씨스트선충의 초기 밀도와 수확 후 밀도 비교
고 찰
적 요
서 언
콩은 우리나라를 포함한 중국 동북부지역이 기원지로 주요 단백질 공급원으로서 오랫동안 재배되어져 왔으며, 우리나라 콩 재배 역사는 울산 다운동과 진주 남강 유역의 신석기 유적지에서 발견된 탄화콩에 근거하여 기원전 약 2,720년에서 2,380년부터 재배되어 온 것으로 추정된다(Chun et al., 2019; Lee et al., 2011). 콩의 국내 재배면적은 2019년 5만 8천 ha로 2017년 이후 논 이용 밭작물 재배가 활발해지면서 증가하고 있으며, 생산량은 약 6천 9백톤으로 국내 시장 규모는 1조 5천억원 가량이다(Kang et al., 2021; Kim et al., 2021).
콩의 주요 수량 감소 원인으로는 균핵마름병, 모마름병 등이 있으나 콩씨스트선충(Heterodera glycines)이 가장 큰 피해를 주는 것으로 알려져 있다(Allen et al., 2017). 일반적으로 콩씨스트선충에 감염이 되면 생육저하와 황화 증상이 나타나며, 기저부의 뿌리는 짧고 어두운색을 띄며 뿌리혹박테리아의 양이 줄어드는 것으로 알려져있다(Endo and Sasser, 1958; Ichinohe, 1959). 미국에서는 콩씨스트선충에 의해 약 20 ~ 30% 수량감소가 발생했으며, 피해증상 없이도 10% 이상의 수량감소를 일으키는 것으로 보고되었다(Noel, 1992; Young, 1996).
씨스트선충은 딱딱한 큐티클층으로 보호되어 있어 건조와 고온 등 불량환경에 저항력이 강해 약제에 의한 방제가 매우 어렵고, 국내에서 재배되는 콩 품종에는 저항성이 없어 피해 경감이 쉽지 않다(Kim et al., 2013). 국내에서는 콩씨스트선충과 반짝이콩씨스트선충이 분포하는데(Kang et al., 2016), 콩 재배 농가의 약 40%에서 씨스트선충이 발생하며, 콩씨스트선충이 반짝이콩씨스트선충(H. sojae)보다 약 2.3배 정도 더 많이 분포하는 것으로 알려져있다(Kang et al., 2021).
콩씨스트선충과 관련된 국내 연구는 콩 재배지의 씨스트선충의 분포와 관련된 내용이 대부분이며, 재배포장에서 콩씨스트선충에 의한 수량감소 연구는 1980년대 이후 거의 없는 실정이다(Choi and Choi, 1983). 따라서 본 연구는 국내 콩 재배포장에서 토양 내 콩씨스트선충 밀도에 따른 콩의 수량구성요소와 수확량의 차이를 밝혀 전국적 피해를 예측하고 적절한 방제 대책을 수립하기 위한 기초자료로 활용하고자 수행하였다.
재료 및 방법
시험 장소
2018년 콩 재배지의 씨스트선충 발생조사 자료를 기반으로 콩씨스트선충(H. glycines)만이 감염되어 있는 농가포장을 선정하고자 하였으며, 밀도에 따른 콩 수량성 검정을 위하여 밀도 구배가 필요하였다. 농가 포장 내 구역별로 씨스트선충의 밀도를 확인한 결과, 저밀도(2 ~ 5개 씨스트/토양 100 ㎤), 중밀도(19 ~ 22개 씨스트/토양 100 ㎤), 고밀도(41 ~ 63개 씨스트/토양 100 ㎤)로 분포하고 있어 시험을 수행하기에 적당하였다. 농가 포장은 충청남도 당진시 신평면 금천리(N 36.88717, E 126.77060)로 재배 품종은 청자5호를 이용하여 2019년 시험을 수행하였다.
콩씨스트선충 검정 및 밀도 조사
시험장소를 선정하기부터 수확기의 콩씨스트선충의 밀도 조사는 체법으로 수행하였다(Kang et al., 2016). 시험 포장의 구획별 토양 시료를 채취하여 골고루 잘 섞은 다음 토양 100 ㎤를 정량하고, 약 10 L의 물에 넣고 토양 현탁액을 만들어 20, 60 mesh 체에 빠르게 통과시켰다. 60 mesh 체 위의 남은 찌꺼기를 정사각형 ‘씨스트 계수 접시’(100 ㎜ x 15 ㎜, Falcon grid dish, USA)에 넣고 콩씨스트선충의 씨스트 수를 20× 배율의 실체현미경(MZ12, Leica, Germany) 하에서 계수하였다. 콩씨스트선충의 알은 씨스트를 분리한 후 tissue grinder (Pyrex, Corning, NY)를 이용하여 분쇄하고 이를 500 mesh 체를 이용하여 분리된 알과 유충을 획득한 후 1 mL씩 60 ㎜ Petri dish에 넣어 20× 배율의 실체현미경(MZ12, Leica, Germany) 하에서 밀도를 조사하였다. 또한 콩씨스트선충의 단독 감염 여부 확인은 Iwahori 방법을 이용하여 씨스트의 DNA를 추출하여 qPCR을 수행하였다(Iwahori et al., 2000). qPCR은 콩씨스트선충 동정용으로 미토콘드리아 DNA의 COⅠ 유전자 영역의 primer set인 HGF1 (5'-GGTTTAGTTAGATTAACTATC-3')과 HGR1 (5'-TAGTAGCTGCACTAAAATAC-3')을 사용하였다(Ko et al., 2019).
시험포 구획과 재배
시험포를 토양 내 콩씨스트선충의 밀도에 따라 35개의 구획으로 나누었으며, 콩은 기계직파로 6월 21일에 파종하여 재식거리는 25 ㎝로 주당 2본씩 재배하였다. 화학농약과 제초제는 사용하지 않고 잡초가 무성한 시기에는 손제초를 수행하였으며, 노린재류와 나방류 방제를 위해 콩 재배 농가 주변에 집합페로몬트랩을 설치하였다. 11월 12일에 수확하였으며, 기타 재배 관리는 농촌진흥청 표준재배법(RDA, 2002)에 준하여 수행하였다.
콩 수량구성요소 및 수량 조사
시험포의 정지 상태를 고려하여 1 ㎡ 격자를 이용하여 격자 이내의 콩을 수확한 후 흰색 방충망에 넣어 비가림막 시설에서 14일간 자연건조 시킨 다음 초장, 협수, 립수, 백립중 등을 측정하였다. 콩의 수량은 단위면적으로 환산하여 분석하였고, 선충의 밀도와 수량구성요소와의 상관 및 수량 관계 분석에는 통계소프트웨어인 R을 이용하여 회귀분석을 하였다.
결 과
씨스트선충의 검정
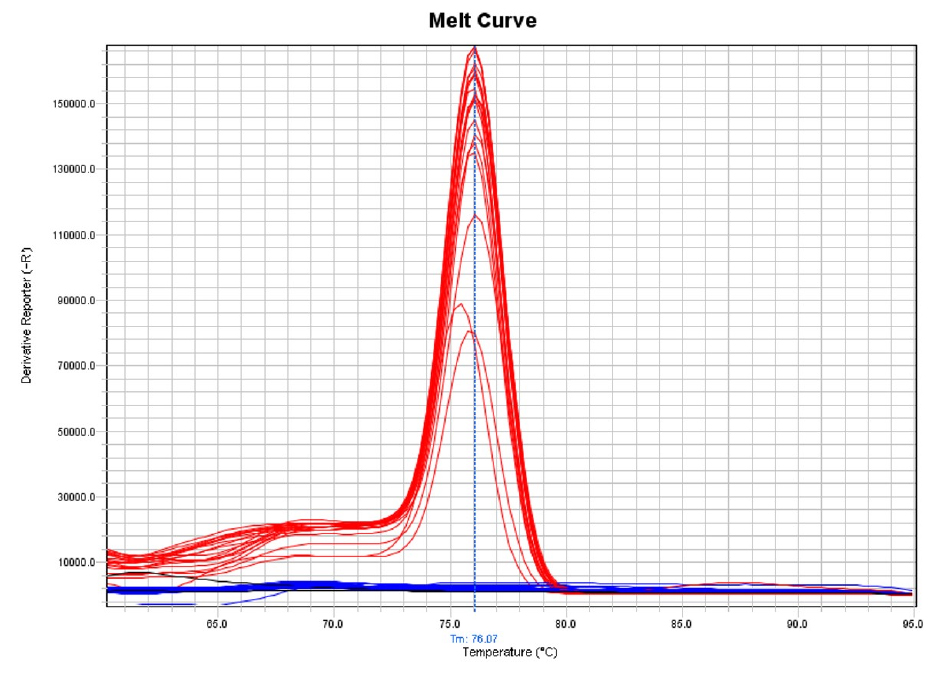
콩 씨스트선충 종 특이 프라이머를 이용하여 qPCR을 수행한 결과, 시험포에서는 콩씨스트선충(H. glycines)만 검출되었다(Fig. 1). 포장 내 35구역의 초기 콩씨스트선충 밀도는 토양 100 ㎤ 당 최저 2개부터 최대 143개로 다양한 밀도 구배가 있어 밀도에 따른 콩의 수량성 검정 시험 결과 도출에 적합하였다.
콩씨스트선충의 밀도와 콩의 수량구성요소 비교
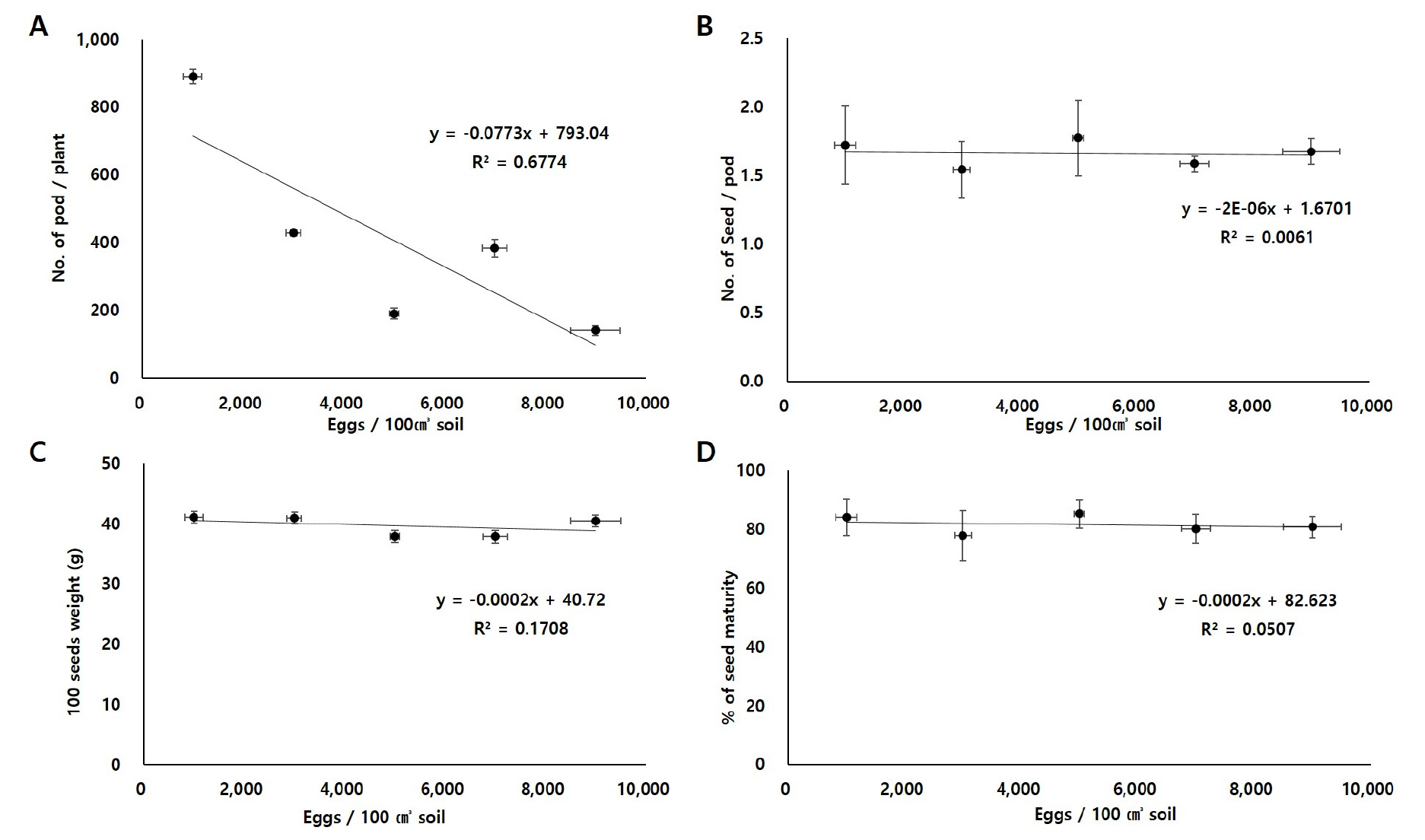
콩씨스트선충 초기 밀도에 따른 구획별로 협수, 협당 립수, 백립중, 등숙율을 분석하였다. 콩 개체당 협수는 콩씨스트선충 알의 밀도가 높을수록 크게 감소하는 것으로 나타났다(Fig. 2A). 회귀식 y = -0.0773x+793.04 (R2=0.6774)에 따라 콩씨스트선충 초기 알 밀도에 따른 콩 개체당 협수는 선형 관계를 보였다. 그러나 회귀분석 결과 F값이 0.14로 콩씨스트선충 초기 알 밀도에 따른 콩 개체당 협수는 95% 신뢰수준에서 유의미한 값을 보이지는 않았다.
콩씨스트선충 알 밀도에 따른 백립중, 등숙률을 분석한 결과, 밀도가 높을수록 낮아지는 경향을 보였으나 95% 신뢰수준에서 유의미한 결과를 보이지 않았다(Fig. 2C and 2D). 협당 립수는 콩씨스트선충 밀도에 따른 유의차가 인정되지 않았다(Fig. 2B).
콩씨스트선충의 밀도와 콩의 수량 변화
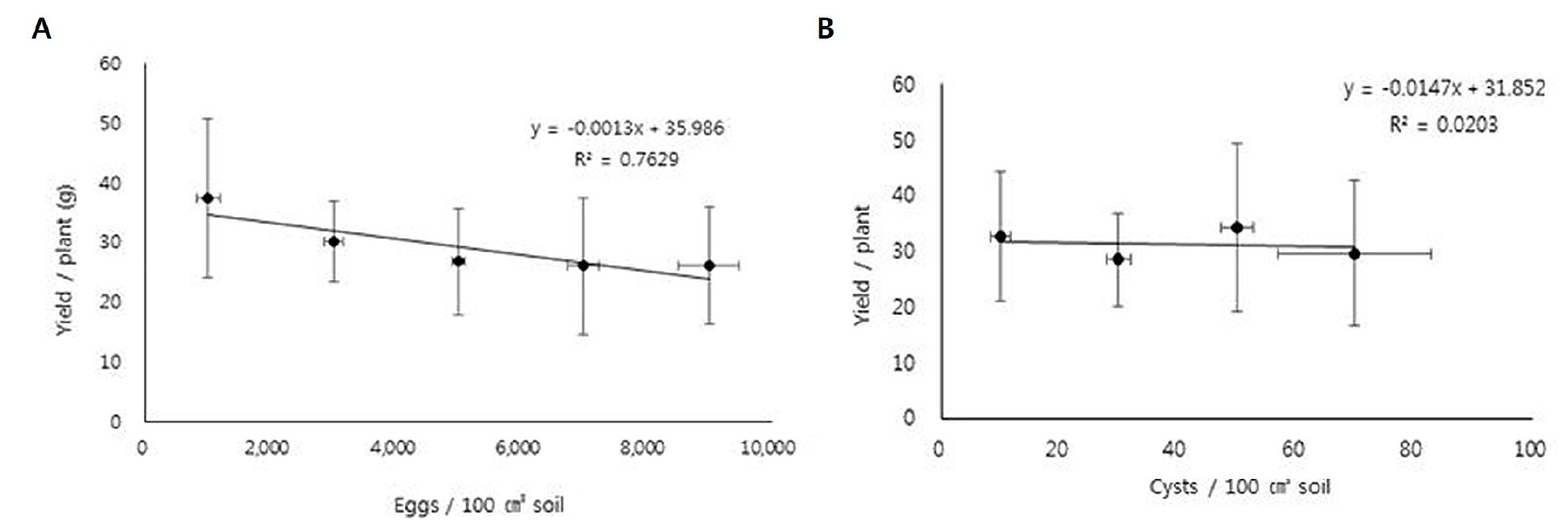
콩씨스트선충 알의 초기 밀도에 따른 콩 개체당 수량(Yield/Plant)을 토대로 10 a (1,000 ㎡) 당 평균 수량을 조사한 결과는 Table 1과 같다. 씨스트선충 밀도가 증가할수록 10 a 당 수량이 크게 감소하는 경향을 보였다. 콩의 수량은 초기 알 밀도가 높을수록 크게 감소하는 것으로 나타났으며(Fig. 3A), 회귀분석 결과에서도 F값이 0.044로 95% 신뢰수준에서 유의미한 값을 보였고, 회귀식(y = -0.0013x+35.986, R2=0.7629)에 따라 콩씨스트선충 초기 알 밀도(x)가 증가하면 콩 수확량(y)이 감소하는 것으로 나타났다. 콩씨스트선충의 알과 씨스트의 초기 밀도에 따른 콩의 수량을 비교한 결과, 초기 알 밀도에 따른 결과와는 달리 씨스트의 초기 밀도는 95% 신뢰수준에서 유의미한 값을 보이지 않았다(Fig. 3B).
Table 1.
Yields of soybean cultivar ‘Cheongja5ho’ by initial density of Heterodera glycines
| Initial density (Eggs / 100 ㎤ soil) | Number of plot | Soybean yield (㎏/10a) |
| 0 - 1,999 | 14 | 341 ± 33.8 |
| 2,000 - 3,999 | 7 | 274 ± 25.4 |
| 4,000 - 5,999 | 4 | 245 ± 46.8 |
| 6,000 - 7,999 | 7 | 238 ± 42.4 |
| 8,000 < | 3 | 238 ± 63.1 |
콩씨스트선충의 초기 밀도와 수확 후 밀도 비교
콩씨스트선충 알의 초기 밀도에 따른 수확기 콩씨스트선충 알의 증식 정도를 분석하였을 때, 알 증식률은 초기 알 밀도가 낮을수록 높은 경향을 나타냈다(Table 2).
Table 2.
Reproductivity of eggs according to the initial density
고 찰
본 연구는 국내 포장에서 콩 품종 청자5호의 콩씨스트선충의 밀도별 수량 변이를 알아보고자 수행하였으며, 청자5호는 밀양181호와 YS1886을 교배조합으로 하여 2017년 육성되었고 수량은 10 a당 343 ㎏이다. 토양 내 초기 알의 밀도가 높을수록 피해가 증가하였고 알의 밀도가 2,000개 이상일 때부터 수량이 20% 이상 급격하게 감소하였다. 콩씨스트선충의 1개 씨스트 내에는 최소 200개 이상의 알이 들어 있으며(Han et al., 2020), 파종 전 토양 100 ㎤ 당 씨스트의 수가 4개가 넘을 경우 콩의 수량이 감소하기 시작한다는 국내 연구결과와, 미국의 일리노이(240개 알/토양 100 ㎤), 오하이오(80개 알/토양 100 ㎤), 미주리(200개 알/토양 100 ㎤)에서의 콩의 피해 한계 밀도 연구결과와 비슷한 양상을 보였다(Han and Cho, 1980; Niblack, 2005).
본 연구 결과 씨스트 개체수가 63개인 구역의 알의 수는 10,005개였고, 씨스트 개체수가 62개인 구역의 알의 수는 1,100개로 구역별로 비슷한 씨스트 개체 수라도 알의 수는 많은 차이를 보였다. 콩 파종 초기 씨스트선충의 씨스트의 밀도보다 알의 밀도가 콩의 수확량에 더욱 큰 영향을 주는 것은 씨스트 내의 알이 기주가 존재할 때 매년 약 50%씩 부화하기 때문에 씨스트 내의 알의 수가 각기 다르기 때문이다(Wright et al., 2019; Zheng and Ferris, 1991). 따라서, 씨스트선충에 의한 콩의 수량 감소 예측을 위해서는 토양 내 씨스트 개체수보다 알 수를 이용하는 것이 더욱 정확할 것으로 판단된다.
또한, 콩의 수량구성요소가 정해지는 결정적인 시기는 개화기(R2) ~ 착화기(R3) 사이 또는 종실이 발육을 시작하여 10 ~ 12일 후에 종료되는 시기이다(Board et al., 1995; Jiang and Egli, 1995). 착화기(R3)에 세균성점무늬병 인공접종시 중위엽의 광합성 엽면적 감소로 콩의 수량감소가 최대로 나타났으며(Park and Lim, 1986), 중위엽을 제거하였을 때 상위엽과 하위엽 제거 시 보다 수량감소가 더욱 심하게 나타났다(Johnston and Rendleton, 1968).
Asmus와 Ferraz (2002)는 씨스트선충 접종 후 29일까지는 콩의 광합성율이 증가하다 58일까지 급격히 감소하고 91일까지는 서서히 감소하며 수확기 엽면적은 초기 선충의 밀도가 높을수록 무처리 대비 최대 71% 까지 감소한다고 하였다(Asmus and Ferraz, 2002). 따라서, 콩씨스트선충이 기주에 대한 반응을 시작하고 1회의 생활사를 수행하는데 약 23일이 소요되며(Lauritis et al., 1983; Young, 1992), 청자5호의 개화기인 8월 3일경은 씨스트선충의 생활사가 가장 활발한 파종 후 약 63일로 수량구성요소 결정 시기인 착화기에 피해가 가장 심할 것으로 판단되며 이로 인한 수량 감소가 나타나는 것으로 추정된다.
국내 콩 재배지의 씨스트선충의 분포는 약 40%로 토양 100 ㎤ 당 씨스트의 밀도는 약 60개, 유충은 약 100마리였다(Kang et al., 2021). 씨스트 속 알의 수가 최소 50개로 가정하면 알의 수는 3000개 이상으로 콩씨스트선충 감염 포장에서의 수량 감소는 20% 이상이 될 것으로 예측할 수 있다. 2013년 국내 75개의 콩 품종에 대해 콩씨스트선충 저항성 검정을 실시한 결과 저항성 품종은 하나도 없었고(Kim et al., 2013), 청자5호의 경우 2017년 육성되어 저항성 검정에 포함되지 않았으나 본 연구 결과 감수성 품종으로 나타나 국내에 많이 재배되고 있는 대원, 대망 등과 함께 콩씨스트선충으로 인한 피해가 심각할 것으로 판단된다. 따라서, 콩 가해 씨스트선충에 대한 저항성 품종 육성 연구가 더욱 필요하며, 다양한 방제 연구가 수행되어져야 한다.
적 요
본 연구는 토양 내 콩씨스트선충(Heterodera glycines)의 초기 밀도에 따른 콩의 수량구성요소 및 수량에 미치는 영향을 규명하기 위하여 실시하였다. 재배포를 35개의 구역을 나누고 콩씨스트선충의 파종 전 토양 내 씨스트 밀도와 알 밀도를 조사하였으며, 수확기 콩의 초장, 협수, 립수, 백립중을 비교 분석하였다. 초기 씨스트의 밀도보다 씨스트 내 알의 밀도가 수량에 더욱 큰 영향을 미쳤으며, 초기 알 밀도가 높을수록 협수와 수량이 초기 알 밀도가 높을수록 감소하는 경향을 보였고 토양 100 ㎤ 당 알의 밀도가 2,000개 이상일 때부터 수량이 20% 이상 급격하게 감소하였다. 본 연구결과를 통하여 콩 재배 시 콩씨스트선충에 의한 피해를 예측할 수 있으며, 국내 콩 재배지의 약 40%가 감염되어 있는 콩씨스트선충에 대한 저항성 품종 육성을 포함한 다양한 방제방법 연구가 필요하다.