서 언
꼬리풀속(Pseudolysimachion)은 현삼과(Scrophulariaceae)에 속하는 분류군으로(KNA, 2020), 북반구의 유라시아부터 일부 남반구 지역까지 약 500종이 넓게 분포하며, 습지와 반사막, 고산, 초원 등 다양한 자연 서식처에 분포하고 있다(Albach et al., 2005). 꼬리풀속은 꽃이 아름다우며 개화 기간이 길고 정원에서의 관리와 교잡이 용이하여 최근 정원 식물로서 주목받고 있다(Hawke, 2010). 우리나라에 자생하는 꼬리풀속 식물은 23분류군이며, 그중 봉래꼬리풀(Pseudolysimachion kiusianum var. diamantiacum (Nakai) T.Yamaz.), 부산꼬리풀(Pseudolysimachion pusanensis Y.N.Lee) 등 4분류군이 특산식물로 보고되어 있다(Chung et al., 2017; KPNI, 2023).
봉래꼬리풀은 다년생 초본식물로서 초장은 20 ㎝ 정도로 자라고, 7-8월에 개화한다. 연한 보라색의 꽃이 줄기 끝에 총상꽃차례로 달려 관상적 가치가 뛰어나 조경 분야에 활용이 가능한 주요 식물 자원으로 여겨진다(Lee, 2003). 봉래꼬리풀은 강원도 설악산과 금강산에만 자생하는 특산식물(endemic plants)이며(Chung et al., 2017), 제한된 분포범위와 적은 개체수 및 남획의 위협 등으로 산림청 지정 멸종위기종(Critically Endangered, CR)으로 관리되고 있다(Lee, 2008). 또한 고산성으로 극히 제한된 분포범위를 지니는 봉래꼬리풀은 기후 변화에 특히 취약하여 기후변화 취약종으로 여겨진다(KFS, 2010). 최근 자생종을 활용한 DMZ 불모지 관리 및 복원에 관한 연구가 진행되고 있으며, 봉래꼬리풀도 복원 소재식물로서 활용하려는 시도가 이루어지고 있다(Choi et al., 2020; Kim et al., 2021). 이에 유용자원 활용 및 희귀·특산식물 보존을 위해 봉래꼬리풀의 종자 번식 기술 수립이 시급한 실정이다.
봉래꼬리풀은 다른 자생 꼬리풀속에 비해 휴면이 깊어 발아율이 낮으므로 종자 번식에 어려움이 있다(Song et al., 2019). 종자휴면은 식물의 생존전략 중 하나로, 처한 환경이 생육에 적합하지 않을 경우 발아를 억제하고, 생육에 적합한 환경 조건 하에서는 발아와 생육을 시작하게 하여 생존률을 높인다(Baskin and Baskin, 1998; Fenner and Thompson, 2005; Suh et al., 2022). 종자휴면은 크게 5가지 종류가 보고되어 있으며 생리적 휴면, 형태적 휴면, 형태·생리적 휴면, 물리적 휴면, 조합 휴면으로 이루어져 있다(Baskin and Baskin, 2004). 형태적 휴면은 탈리 시점에 종자가 미숙배 상태로, 배가 일정 크기 이상 자라야 발아 가능하며 적절한 조건에서 30일 이내에 배의 신장과 발아가 이루어질 경우를 말한다. 반면 형태적 휴면과 생리적 휴면이 복합적으로 작용하는 형태·생리적 휴면은 발아 기간이 더 오래 걸리거나 전처리를 해야만 배가 신장하고 발아되는 경우를 말한다(Baskin and Baskin, 2004).
봉래꼬리풀 종자는 형태적 휴면과 형태·생리적휴면(morphophysiological dormancy)을 함께 보이며, 전처리하지 않으면 50% 미만의 낮은 발아율을 보인다고 보고되었다(Kim et al., 2021; Song et al., 2019). 봉래꼬리풀 종자는 미성숙 배를 가진 것으로 알려져 있는데(Song et al., 2019), 미숙배로 분류된 종자는 배가 일정 크기 이상 자라야 발아할 수 있다(Baskin and Baskin, 2004). 형태·생리적휴면은 배의 발달온도가 0-10℃인 complex-type과 15-20℃인 simple-type으로 나눌 수 있으며(Baskin and Baskin 1998, 2004; Geneve, 2003), 봉래꼬리풀은 상대적으로 고온인 20-25℃ 범위에서 배가 발달하는 simple-type으로 보고된 바 있다(Song et al., 2019). 저온층적 처리 또는 지베렐린(GA3) 처리, prechiling 처리 시에는 봉래꼬리풀 종자의 발아율이 향상되어 종자 전처리가 휴면타파에 효과가 있음이 알려졌다(Choi and Kwak, 2017; Song et al., 2019). 하지만 아직까지 봉래꼬리풀 종자의 휴면타파를 위한 전처리 방법으로 지베렐린(GA3) 처리와 저온 처리 외에 다른 처리 방법은 연구된 바가 없다.
종자의 휴면타파와 발아율 향상을 위한 전처리 방법은 다양하게 연구되어왔으며(Argerich et al., 1989), 그 중 priming 처리는 발아 증진과 발아 소요일수 단축, 균일성 향상 등에 효과적이어서 널리 이용되고 있다(Bradford, 1986; Taylor and Harman, 2003). Priming은 종자를 삼투 용액에 침지함으로써 종자가 수분을 흡수하게 하여 생리적 발아를 유도시키는 것으로 삼투제의 종류 및 농도(Dahal et al., 1990; Suzuki et al., 1990), 처리 기간 및 온도(Atherton and Farooque, 1983; Bodsworth and Bewley, 1981; Ely and Heydecker, 1981; Khan, 1992; Smith and Cobb, 1991) 등에 영향을 받는다. Priming 물질로는 유기 및 무기물질이 널리 사용되어왔는데(Bradford et al., 1988; Taylor and Harman, 2003), 국내에서는 둥글레, 지치, 쇠무릎, 양파 등 다양한 종자의 발아 촉진에 효과가 있다고 보고된 바 있다(Chang and Lee, 2007; Cho et al., 2006; Kim et al., 2014, 2015).
이에 본 연구는 봉래꼬리풀 종자에 대한 최적의 priming 처리 방법을 알아보기 위하여 옥신(IAA), 지베렐린(GA3), 키네틴(kinetin), 질산칼륨(KNO3), 염화칼륨(KCl) 처리가 발아에 미치는 영향을 평가하였다.
재료 및 방법
공시 재료
실험에 공시한 봉래꼬리풀(Pseudolysimachion kiusianum var. diamantiacum (Nakai) T.Yamaz.) 종자는 국립DMZ자생식물원에서 저장 중이던 종자를 사용하였다. 봉래꼬리풀 종자는 국립DMZ자생식물원 희귀특산원에서 관리중인 개체들로부터 2021년에 채종 및 건조되었고, 온도 4℃, 상대습도 40%로 1년간 저장된 것을 정선하여 발아 검정에 사용하였다. 정선한 종자는 증류수에 24시간 동안 암조건으로 침지한 다음, 소독을 위해 70% ethanol에 1분간 침지 후 증류수로 세척, 다시 1% NaOCl 용액에 10분간 침지 후 증류수로 세척하였다. 이후 Petri dish에 여과지(Whatman No.1, GE Healthcare, Buckinghamshire, UK) 2매를 놓고 증류수를 공급한 다음 종자를 25립씩 처리별로 치상하였다. 발아 검정은 처리당 25립씩 4반복으로 진행하였고, 종자가 건조되는 것을 방지하기 위해 Parafilm으로 Petri dish를 밀봉하였다.
종자 배양 조건
발아 검정은 온도가 일정하게 유지되는 항온기(DS-11BPL, Dasol ltd, Korea)를 이용하였다. DS-11BPL은 내부에 광원이 설치되어 있지 않아 내부 상단부에 LED 형광등(GA2-15, RealLED, Korea)을 설치한 다음, 일장을 조절하기 위해 타임스위치 어댑터(SJP-CP16J, SEOJUN Electric, Korea)를 장착하였다. 이를 이용해 12시간의 광주기를 주었으며, 이때의 광도는 100±2 μmol·m-2·s-1이었다. 검정 동안 종자에 오염이 발생할 경우, 1% NaOCl 용액에 10분간 침지하여 오염을 방지하였고, 지속적으로 오염이 발생하여 부패한 종자는 검정 도중에 제거하였다. 발아의 기준은 유근이 종피를 뚫고 1 ㎜ 이상 돌출된 종자를 발아한 것으로 간주하였고, 하루 간격으로 총 20일 동안 조사하였다. 이후 조사 결과를 바탕으로 최종 발아율(G), 평균발아일수(Mean germination time; MGT), 발아균일도(Germination uniformity; GU), 발아세(Germination speed; GS)를 아래의 식을 이용하여 산출하였다(Kwon et al., 2020).
발아 온도 조건
온도 조건에 따른 봉래꼬리풀 종자의 초기 발아 양상을 알아보고자 항온기의 온도 조건을 15℃, 20℃ 그리고 25℃로 하였으며, 광조건은 명조건과 암조건을 구분하여 발아 경향을 조사하였다. 명조건은 전술한 것과 동일한 방법으로 진행하였고, 암조건은 Petri dish를 Aluminum foil로 감싸 광을 차단하여 배양하였다.
생장조절제 및 무기염류 처리
봉래꼬리풀 종자의 발아율 향상을 위해 소독이 완료된 종자에 생장조절제와 무기염류를 전처리하였다. 생장조절제는 옥신(IAA), 지베렐린(GA3)과 키네틴(kinetin)을 사용하였고, 무기염류는 질산칼륨(KNO3)과 염화칼륨(KCl)을 사용하였다. IAA와 GA3의 처리 농도는 100, 200, 500 ㎎·L-1, kinetin의 처리 농도는 10, 20, 40 ㎎·L-1, KNO3의 처리 농도는 10, 20, 40 mM, KCl의 처리 농도는 100, 200, 300 mM로 하였다. 용액이 종자에 충분히 침투할 수 있도록 종자를 각각의 용액에 24시간 동안 암조건으로 침지한 다음, 침지가 끝난 종자는 증류수로 세척하여 Petri dish에 동일한 방법으로 치상하였다. 이후 20℃와 25℃의 항온 조건에서 배양하였으며, 20일 동안 발아율을 매일 조사하였다.
통계처리
봉래꼬리풀 종자의 발아 적온 실험, 전처리 실험에 대한 발아 특성의 차이를 SPSS 프로그램(version 12.0, IBM Inc., USA)으로 분산분석(ANOVA)하였고, Scheffe’s multiple range test (p < 0.05)로 각 처리구간의 통계적 유의성을 검정하였다.
결 과
봉래꼬리풀 종자의 발아 특성
광조건을 달리하여 봉래꼬리풀 종자의 발아 특성을 조사한 결과, 암조건에서는 전혀 발아하지 않았다(Fig. 1b). 명조건에서 온도에 따른 봉래꼬리풀 종자의 발아 특성을 조사한 결과, 봉래꼬리풀 종자는 20℃와 25℃에서 1주일 만에 발아가 시작되었고 15℃에서는 18일이 경과했을 때 발아가 처음 관찰되었다(Fig. 1a). 25℃에서는 7일 차에 발아가 처음 관찰된 이래로 발아율이 완만하게 증가하여 2주 차부터는 큰 변화가 나타나지 않았다. 한편 20℃에서는 첫 발아가 25℃와 동일한 날에 관찰되었으나 발아율의 완만한 증가는 10일 차부터 나타났고 2주 차부터는 큰 변화가 나타나지 않았다. 봉래꼬리풀 종자의 최종 발아율은 15℃에서 2.0±1.3%, 20℃에서 18.0±6.0%, 그리고 25℃에서는 22±3.5%로 온도 구배 간 유의미한 차이가 나타났다. 봉래꼬리풀 종자의 온도별 평균발아일수를 살펴보면 15℃에서 18.0±0.0일로 나타났고, 20℃는 11.1±1.0일, 그리고 25℃에서는 9.7±1.3일로 나타났다. 봉래꼬리풀 종자의 온도별 발아세는 15℃에서 0.1±0.0, 20℃에서 0.4±0.2, 그리고 25℃에서 0.6±0.1로 나타났다. 따라서 봉래꼬리풀의 종자 발아를 위한 최적의 온도 조건은 20-25℃ 범위인 것으로 판단하며, 이는 선행연구 결과와 일치하였다(Song et al., 2019). 또한 봉래꼬리풀 종자는 명조건에서 휴면성이 타파되는 광발아성 종자로 판단한다.
생장조절제 및 무기염류 처리 결과
봉래꼬리풀 종자의 휴면타파 및 발아율 향상을 위해 생장조절제(IAA, GA3, kinetin)와 무기염류(KNO3, KCl)를 농도별로 처리하였고, 20℃에서의 발아 특성을 관찰하였다(Table 1). IAA를 농도별로 전처리한 결과에서는 최종 발아율이 전처리하지 않은 무처리구와 유의미한 차이가 없었다. 또한, 평균발아일수, 발아균일도, 그리고 발아세 모두 무처리구와 유의미한 차이가 나타나지 않았다. GA3를 농도별로 전처리한 결과 최종 발아율이 세 처리구에서 모두 무처리구보다 높게 나타났다. GA3처리구간 유의성도 인정되어 100 ㎎·L-1 처리보다 200 ㎎·L-1에서, 200 ㎎·L-1 처리보다 500 ㎎·L-1에서 더 발아율이 높게 나타났다. GA3처리구의 평균발아일수와 발아균일도는 무처리구와 유의미한 차이가 나타나지 않았다. GA3처리구의 발아세는 세 처리구 모두 무처리구에 비해 현저히 높게 나타났고, 처리구간 유의성도 인정되어 농도가 높아질수록 발아세가 더 높게 나타났다. Kinetin을 농도별로 전처리한 결과에서는 최종 발아율을 비롯해 평균발아일수, 발아균일도, 그리고 발아세 모두 무처리구와 유의미한 차이를 보이지 않았다. KNO3을 농도별로 전처리한 결과에서는 10 mM과 20 mM 처리구의 최종 발아율이 무처리구와 유의미한 차이를 보이지 않았으나 40 mM 처리구의 최종 발아율은 무처리구에 비해 증가한 것으로 나타났다. KNO3 처리에 따른 평균발아일수와 발아균일도는 무처리구와 유의미한 차이가 나타나지 않았으나 발아세는 무처리구에 비해 증가한 것으로 나타났다. KCl을 농도별로 전처리한 결과에서는 100 mM과 200 mM 처리구의 최종 발아율이 무처리구와 유의미한 차이를 보이지 않았으나, 300 mM 처리구의 최종 발아율은 무처리구에 비해 증가한 것으로 나타났다. KCl 처리에 따른 평균발아일수와 발아균일도는 무처리구와 유의미한 차이가 나타나지 않았으나 발아세는 300 mM 처리구만 무처리구에 비해 증가한 것으로 나타났다.
Table 1.
Germination rate, mean germination time, germination uniformity, and germination speed of Pseudolysimachion kiusianum var. diamantiacum seeds pretreated with IAA, GA3, kinetin, KNO3, and KCl at 20℃
|
Treatment (20℃) |
Final germination rate (%) |
Mean germination time (day) | Germination uniformity | Germination speed |
| dH2O | 18 ± 6.0cz | 11.1 ± 1.0a | 3.2 ± 1.9a | 0.4 ± 0.2c |
| IAA 100 ㎎·L-1 | 16 ± 8.5c | 12.2 ± 1.8a | 8.6 ± 6.1a | 0.4 ± 0.2c |
| IAA 200 ㎎·L-1 | 19 ± 3.3c | 10.8 ± 1.3a | 5.1 ± 3.7a | 0.5 ± 0.1c |
| IAA 500 ㎎·L-1 | 18 ± 2.0c | 11.0 ± 0.8a | 7.1 ± 3.7a | 0.4 ± 0.1c |
| GA3 100 ㎎·L-1 | 41 ± 3.3bc | 10.4 ± 0.7a | 8.1 ± 2.7a | 0.8 ± 0.5bc |
| GA3 200 ㎎·L-1 | 63 ± 9.5ab | 9.8 ± 0.4a | 7.1 ± 2.6a | 1.7 ± 0.3ab |
| GA3 500 ㎎·L-1 | 75 ± 6.6a | 10.3 ± 0.6a | 8.3 ± 4.4a | 1.9 ± 0.1a |
| Kinetin 10 ㎎·L-1 | 16 ± 8.9c | 11.1 ± 0.9a | 19.2 ± 3.0a | 0.4 ± 0.2c |
| Kinetin 20 ㎎·L-1 | 26 ± 9.8c | 10.1 ± 1.2a | 4.0 ± 0.8a | 0.7 ± 0.3c |
| Kinetin 40 ㎎·L-1 | 22 ± 6.0c | 10.3 ± 0.6a | 4.1 ± 1.1a | 0.5 ± 0.1c |
| KNO3 10 mM | 30 ± 3.5c | 9.9 ± 0.4a | 7.1 ± 1.2a | 0.8 ± 0.1bc |
| KNO3 20 mM | 30 ± 6.6c | 10.5 ± 0.9a | 10.0 ± 5.4a | 0.8 ± 0.1bc |
| KNO3 40 mM | 35 ± 9.1bc | 9.9 ± 0.8a | 7.0 ± 3.3a | 0.9 ± 0.2 ac |
| KCl 100 mM | 19 ± 5.2c | 11.8 ± 0.9a | 8.8 ± 6.4a | 0.4 ± 0.1c |
| KCl 200 mM | 26 ± 9.4c | 11.9 ± 0.8a | 4.5 ± 2.6a | 0.6 ± 0.3c |
| KCl 300 mM | 32 ± 9.2bc | 10.9 ± 0.6a | 4.4 ± 3.1a | 0.8 ± 0.3bc |
다음으로는 25℃ 조건에서 농도별 생장조절제(IAA, GA3, kinetin)와 무기염류(KNO3, KCl)가 봉래꼬리풀의 종자 발아 특성에 미치는 영향을 살펴보았다(Table 2). IAA를 농도별로 전처리한 결과에서는 최종 발아율이 전처리하지 않은 무처리구와 유의미한 차이가 없었다. 또한, 평균발아일수, 발아균일도 그리고 발아세 모두 무처리구와 유의미한 차이가 나타나지 않았다. GA3를 농도별로 전처리한 결과에서는 최종 발아율이 세 처리구 모두 무처리구보다 높게 나타났고, 100 ㎎·L-1과 200 ㎎·L-1의 최종 발아율은 서로 간에 유의미한 차이가 없었다. GA3처리구의 평균발아일수와 발아균일도는 무처리구와 유의미한 차이가 나타나지 않았다. GA3처리구의 발아세는 500 ㎎·L-1 처리구가 무처리구에 비해 현저히 높게 나타났고, 200 ㎎·L-1과 100 ㎎·L-1 처리는 서로 간에 차이가 없었으나 무처리구에 비해서는 유의미하게 증가하였다. Kinetin을 농도별로 전처리한 결과에서는 최종 발아율을 비롯해 평균발아일수, 발아균일도, 그리고 발아세 모두 무처리구와 유의미한 차이를 보이지 않았다. KNO3을 농도별로 전처리한 결과에서는 10 mM과 20 mM 처리구의 최종 발아율이 무처리구와 유의미한 차이를 나타내지 않았으나 40 mM 처리구의 최종 발아율은 무처리구에 비해 유의미하게 증가하였다. KNO3 처리에 따른 평균발아일수와 발아균일도는 무처리구와 유의미한 차이가 나타나지 않았으나 발아세는 40 mM 처리구만이 무처리구에 비해 증가한 것으로 나타났다. KCl을 농도별로 전처리한 결과에서는 100 mM과 200 mM 처리구의 최종 발아율이 무처리구와 유의미한 차이를 보이지 않았으나 300 mM 처리구의 최종 발아율은 무처리구에 비해 증가한 것으로 나타났다. KCl 처리에 따른 평균발아일수와 발아균일도는 무처리구와 유의미한 차이가 나타나지 않았으나 발아세는 300 mM 처리구만 무처리구에 비해 증가한 것으로 나타났다.
Table 2.
Germination rate, mean germination time, germination uniformity, and germination speed of Pseudolysimachion kiusianum var. diamantiacum seeds pretreated with IAA, GA3, kinetin, KNO3, and KCl at 25℃
|
Treatment (25℃) |
Final germination rate (%) |
Mean germination time (day) | Germination uniformity | Germination speed |
| dH2O | 22 ± 3.5bz | 9.7 ± 1.3a | 6.8 ± 5.0a | 0.6 ± 0.1b |
| IAA 100 ㎎·L-1 | 26 ± 9.8b | 9.2 ± 0.6a | 4.8 ± 2.4a | 0.7 ± 0.3b |
| IAA 200 ㎎·L-1 | 31 ± 8.2b | 10.9 ± 1.2a | 5.3 ± 1.0a | 0.8 ± 0.2b |
| IAA 500 ㎎·L-1 | 28 ± 2.8b | 9.6 ± 0.9a | 3.2 ± 2.0a | 0.8 ± 0.1b |
| GA3 100 ㎎·L-1 | 43 ± 5.2ab | 9.3 ± 0.6a | 5.4 ± 1.8a | 1.2 ± 0.1ab |
| GA3 200 ㎎·L-1 | 49 ± 9.1ab | 9.4 ± 0.3a | 4.9 ± 2.6a | 1.4 ± 0.2ab |
| GA3 500 ㎎·L-1 | 69 ± 7.7a | 9.9 ± 0.9a | 8.8 ± 3.1a | 1.9 ± 0.2a |
| Kinetin 10 ㎎·L-1 | 23 ± 7.1b | 9.2 ± 0.6a | 4.9 ± 2.8a | 0.6 ± 0.2b |
| Kinetin 20 ㎎·L-1 | 29 ± 8.7b | 9.5 ± 0.8a | 6.1 ± 3.2a | 0.8 ± 0.2b |
| Kinetin 40 ㎎·L-1 | 25 ± 8.2b | 9.8 ± 0.2a | 9.6 ± 2.7a | 0.7 ± 0.2b |
| KNO3 10 mM | 27 ± 5.9b | 9.6 ± 1.1a | 6.7 ± 3.2a | 0.7 ± 0.2b |
| KNO3 20 mM | 35 ± 3.3b | 9.9 ± 0.5a | 9.1 ± 1.6a | 1.0 ± 0.1b |
| KNO3 40 mM | 41 ± 9.1ab | 8.7 ± 0.2a | 5.1 ± 2.5a | 1.2 ± 0.2ab |
| KCl 100 mM | 31 ± 3.3b | 10.8 ± 0.8a | 7.3 ± 2.2a | 0.8 ± 0.1b |
| KCl 200 mM | 34 ± 4.5b | 9.8 ± 0.3a | 5.3 ± 0.9a | 0.9 ± 0.1b |
| KCl 300 mM | 42 ± 8.7ab | 10.1 ± 0.5a | 12.7 ± 5.6a | 1.2 ± 0.2ab |
고 찰
20℃와 25℃의 온도 환경에서 전처리가 봉래꼬리풀의 종자 발아 특성에 미치는 영향을 종합해보면 다음과 같다. IAA는 종자 내 ABA 함량을 감소시켜 발아 촉진 효과를 나타내며(Ha et al., 2023; Lee et al., 2011), kinetin은 cytokinin의 한 종류로 식물의 세포분열과 종자발아에 영향을 미치는 식물호르몬으로 알려져 있다(Jang et al., 2016). 그러나 IAA와 kinetin은 봉래꼬리풀이 발아하는 데 유의미한 영향을 미치지 못해 효과가 미미한 것으로 확인되었다. GA3는 종자의 휴면을 타파하고 발아를 촉진하는 식물호르몬으로써 cytokinin과 함께 발아를 촉진한다고 알려져 있다(Jang et al., 2016; Kim and Lee, 2013). GA3는 농도와 관계없이 봉래꼬리풀의 최종 발아율과 발아세를 무처리구에 비해 유의미한 수준으로 증가시켰다. 무기염류인 KNO3의 질소화합물은 종자 내로 침투할 수 있어 배에 영양분을 제공하고 휴면성을 감소시킴으로써 종자의 발아 촉진 효과를 나타내며(Nambara et al., 2010), KCl은 priming 효과를 유도하는 대표적인 무기염류 중 하나로 알려져 있다(Yun et al., 2004). KNO3는 농도와 관계없이 봉래꼬리풀의 발아세를 무처리구보다 증가시켰으나, 최종 발아율은 40 mM 농도에서만 증가하였다. KCl의 경우 100 mM과 200 mM 농도 처리는 봉래꼬리풀 발아에 영향을 미치지 못했으나 300 mM 농도 처리는 최종 발아율과 발아세를 무처리구보다 증가시켰다. 한편 본 연구의 모든 화학적 처리는 봉래꼬리풀의 평균발아일수와 발아균일도에 영향을 미치지 못했다. 따라서 위 결과를 통해 봉래꼬리풀 종자의 발아율 향상과 휴면타파를 위한 최적의 처리는 GA3인 것으로 판단하며, KNO3과 KCl의 혼용 처리에 따른 효과도 기대해 볼 수 있을 것으로 생각한다.
형태·생리적휴면 종자는 휴면 깊이에 따라서 non-deep, intermediate, deep으로 구분할 수 있다(Baskin and Baskin, 2004). Non-deep 생리적휴면은 다른 휴면에 비해 비교적 얕은 휴면을 가지며 상온에서의 후숙 처리, GA3 처리 또는 저온 층적처리를 통해 발아를 촉진할 수 있다(Kwon et al., 2020). 봉래꼬리풀 종자는 GA3 처리를 통해 휴면이 타파되는 non-deep 휴면으로 보고된 바 있고(Choi and Kwak, 2017; Song et al., 2019), 본 연구의 결과에서도 KNO3과 KCl이 봉래꼬리풀 종자의 발아율 향상에 효과를 나타냈으나 GA3의 처리가 더 효과적이었다. GA3 처리에 따른 봉래꼬리풀의 초기 발아 양상을 살펴보면 20℃ 온도에서는 세 농도 처리 모두 무처리구보다 하루 앞선 6일 차에 첫 발아가 관찰되었고(Fig. 2a), 25℃ 온도에서는 세 농도 처리 모두 무처리구와 같은 7일 차에 발아가 시작되었다(Fig. 2b). 20℃ 온도에서는 GA3 100 ㎎·L-1 처리구는 무처리구에 비해 발아가 완만하게 증가하였으나 200과 500 ㎎·L-1 처리구는 무처리구에 비해 현저히 높게 증가하는 양상을 보였다. 25℃ 온도에서는 농도와 관계없이 모든 처리구가 무처리구에 비해 발아가 현저히 증가하는 양상을 보였다. GA3 처리를 20℃와 25℃ 온도 조건에서 농도별로 비교해본 결과, 최종 발아율과 발아세에서 처리구간의 유의미한 차이가 나타났다(Fig. 3). 봉래꼬리풀 종자의 최종 발아율은 20℃에서 GA3을 500 ㎎·L-1 처리한 것이 25℃에서 처리한 것보다 높았고, GA3을 200 ㎎·L-1 처리한 것 또한 25℃보다 20℃에서 더 높게 나타났다. 한편 GA3을 100 ㎎·L-1 처리한 것은 두 온도간에 유의미한 차이가 나타나지 않았다. GA3가 처리된 봉래꼬리풀 종자의 평균발아일수와 발아균일도는 온도와 농도에 따른 유의미한 차이가 나타나지 않았다. GA3이 처리된 봉래꼬리풀 종자의 발아세는 온도와 농도에 따른 차이가 나타났는데, 20℃의 200, 500 ㎎·L-1 그리고 25℃의 500 ㎎·L-1 처리구가 다른 처리에 비해 현저히 높게 나타났다.
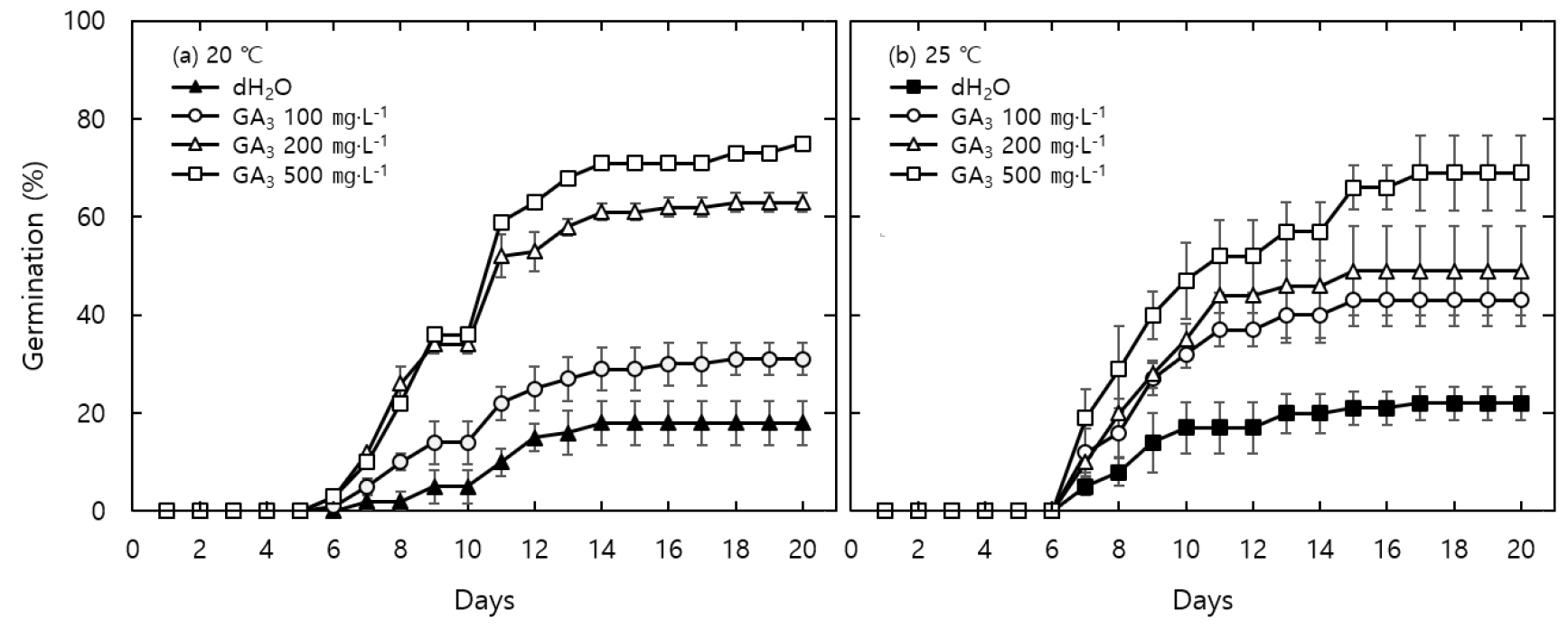
Fig. 2.
Cumulative germination rate from Pseudolysimachion kiusianum var. diamantiacum. pretreated with GA3 and incubated under temperature conditions of (a) 20℃ and (b) 25℃. Concentrations of GA3 were treated at 100, 200, and 500 ㎎·L-1, and significantly increased germination rate compared to the control. Error bar means the standard deviation.

Fig. 3.
(a) Germination rate, (b) mean germination time, (c) germination uniformity and (d) germination speed from Pseudolysimachion kiusianum var. diamantiacum pretreated with GA3 and incubated under temperature conditions of 20℃ and 25℃. Error bar means the standard deviation. Plots with different letters are significantly different (Scheffe’s multiple test, p < 0.05).
결론적으로 봉래꼬리풀 종자는 발아하는데 광이 요구되는 광발아성 종자로 생각되고, 최적 발아온도 범위는 20-25℃인 것으로 판단되었다. 봉래꼬리풀 종자에 GA3를 전처리할 경우 20℃에서 500 ㎎·L-1 이상 처리하는 것이 효과적임을 확인하였다. 비록 GA3에 비해 효과는 떨어졌지만 무기염류 KNO3과 KCl를 이용한 처리에서도 봉래꼬리풀 종자에 대한 발아 촉진 효과를 확인할 수 있었다. 이러한 본 연구의 결과는 조경 분야뿐만 아니라, 복원용 자생식물로 활용 가치가 있는 봉래꼬리풀의 대량증식에 유용한 자료가 될 것이다.
적 요
산림청 지정 희귀·특산식물 봉래꼬리풀(Pseudolysimachion kiusianum var. diamantiacum (Nakai) T.Yamaz.)을 대상으로 광조건, 온도와 전처리에 따른 발아 특성을 조사하였다. 광조건에 따른 발아실험 결과, 봉래꼬리풀은 암조건에서 전혀 발아하지 않는 광발아성 종자로 판단되었다. 봉래꼬리풀의 최적 발아온도는 최종 발아율과 발아세를 고려하여 20-25℃임을 확인하였다. 봉래꼬리풀 종자의 발아율 향상을 위해 생장조절제 3종(IAA, GA3, kinetin)과 무기염류 2종(KNO3, KCl)을 전처리하였다. 생장조절제 IAA와 kinetin은 봉래꼬리풀 종자의 발아율 향상에 유의미한 영향을 미치지 못했다. 반면 GA3는 농도와 관계없이 최종 발아율과 발아세를 유의미한 수준으로 증가시켰고, 특히 20℃에서 500 ㎎·L-1 이상 처리한 것은 무처리구에 비해 4배 이상 효과적이었다. 무기염류 KNO3과 KCl는 저농도에서 봉래꼬리풀 종자에 유의미한 영향을 미치지 못했지만 고농도(각 40 mM, 300 mM) 이상에서는 발아율과 발아세를 무처리구에 비해 1.5배 이상 향상시켰다. 본 연구의 결과는 복원용 자생식물로 활용 가치가 있는 봉래꼬리풀의 대량증식에 유용한 자료가 될 것이다.





