서 언
재료 및 방법
시험재료
유리당 분석
무기성분 분석
유리 아미노산 분석
Ellagic acid 추출용매 조건의 최적화
Ellagic acid 분석법의 유효성 검증
Ellagic acid 분석
통계분석
결과 및 고찰
유리당 분석
무기성분 분석
유리 아미노산 분석
Ellagic acid 추출용매 조건의 최적화
Ellagic acid 분석법의 유효성 검증
Ellagic acid 함량
적 요
서 언
복분자(Rubus coreanus Miquel) 또는 복분자 딸기라 불리는 열매는 장미과(Rosaceae) 산딸기속(Rubus)에 속하는 나무딸기류(rambles) 중 하나로 한국, 중국, 일본 등지에서 자생하며(An and Kim, 2007), 국내산 토종복분자(Rubus coreanus Miquel)는 야생 산딸기를 선별하여 시험재배 후 횡성, 곡성, 광양 등의 일부 지역에서 재배 육성되고 있다(Kim et al., 2014). 현재 국내 복분자 주산지인 전북 고창, 순창 등의 지역에서는 1960년대 말 북미산 R. occidentalis 품종이 도입되어 재배되고 있으며, 중국에서 수입된 화동복분자 품종인 R. chingii와 함께 국내에서 대부분 유통중이다(Lee and Kim, 2018).
대한민국약전에서는 복분자를 ‘복분자딸기 Rubus coreanus Miquel (장미과 Rosaceae)의 채 익지 않은 열매이다’라고 규정(MFDS, 2019a)하고 있으며 한방에서는 미숙과를 복분자(覆盆子)라고 하며 보간신(補肝腎), 이뇨제의 효능이 있고, 정력감퇴, 빈뇨를 치료한다고 알려져 있다(Cha et al., 2001; Shin et al., 2003). 외래종복분자로 알려져 있는 R. occidentalis는 항산화(antioxidation), 식도암(esophageal cancer) 등에 효과가 있는 것으로 보고되었고, 중국의 화동복분자(R. Chingii Hu)는 중국에서 수세기 동안 야뇨증, 요로 치료를 위해 처방되어 왔다고 알려져 있다. 이처럼 같은 복분자라 하더라도 품종에 따라 나타나는 효과도 다르며 성숙도, 추출방법에 따라 유효성분 함량에 차이를 보인다(Kim et al., 2014). 복분자 열매에 존재하는 생리활성 물질 중 ellagic acid는 과일과 채소에 있는 폴리페놀화합물로서 항산화작용과 전립선, 대장암세포, 구강암 등의 항암효과와 콜레스테롤 억제 등의 효과를 나타내는 것으로 알려져 있으며(Kim et al., 2012) 미숙한 복분자에서는 생리활성 물질인 ellagic acid의 함량이 높게 확인되었다. 또한 복분자 열매는 숙성단계에 따라 생리활성 물질에 함량에 차이를 나타낸다고 보고되었으며 미숙과추출물은 완숙과추출물보다 ellagic acid 함량이 5.3배 더 높은 함량을 나타냈다(Choi et al., 2013).
이에 본 연구에서는 국내에서 재배, 유통되고 있는 미숙한 형태에 복분자의 화학적 성분 및 지표성분으로 ellagic acid의 함량을 비교하여 제품개발과 지표성분의 기준설정에 분석법을 확립하고자 하였다.
재료 및 방법
시험재료
본 실험에 사용된 복분자는 미숙과의 형태로서 토종복분자(R. coreanus Miquel)는 광양에서 재배되고 있는 복분자, 외래종 서양복분자(R. occidentalis L.)는 고창에서 재배되고 있는 복분자를 농가에서 채취하여 시험에 사용하였다. 시험에 사용한 시료를 NCBI의 BLAST 상동성 검색결과 시험에 사용된 R. coreanus의 ITS 염기서열(AY818196, FJ472906, EF034123)과 98% 이상 일치하였으며, R. occidentalis의 염기서열(AF055758)과도 일치 하였다. 유전자분석과 시험에 사용된 토종복분자와 서양복분자시료는 한국인삼공사 분석연구소에서 보관하고 있다. 그 밖의 시료는 경동약령시장과 금산약령시장으로부터 구매하였으며 국내유통 복분자는 재배지역이 서로 다른 국내산 복분자 6점과 고창에서 재배되는 외래종 서양복분자를 포함하여 총 7점으로 하였고, 수입산(중국) 복분자는 7점의 시료로 하였다. 각 시료는 광양 토종복분자, 고창 서양복분자와 국내산 복분자 와 수입산(중국) 복분자의 2그룹씩 각각 나누어 비교실험 하였다. 복분자 시료는 분쇄기로 분말화 한 뒤 100 mesh 체를 통과시켜 균질화하여 사용하였다.
유리당 분석
복분자 함량 분석은 Park et al. (2008)의 방법에 준하여 분석하였으며, 복분자 분말 0.1 g을 정밀히 달아 증류수 10 mL을 넣고 충분히 분산시킨 후 이를 초음파추출기(30분)에서 추출하였다. 추출된 시료는 원심분리기(3,000 rpm, 4℃, 10분) 후 얻어진 상층액을 취하여 적정농도로 희석한 후 0.2 ㎛ membrane syringe filter로 여과한 것을 유리당 분석용액으로 사용하였다. 복분자의 유리당 정량 분석을 위한 표준물질은 Sigma-aldrich에서 제조한 galactose, fructose, glucose, sucrose, lactose, maltose의 6종을 사용하였다. 유리당 기기분석은 PAD (pulsed amperomettric detector)가 연결된 HPAEC (High performance anion-exchange chromatography)를 사용하였다. 컬럼은 CarboPac PA1 (3 ㎜ × 250 ㎜)를 사용하였으며, 이동상 용매 A는 Distilled water, 이동상 용매 B는 250 mM NaOH를 사용하여 1.0 mL/min의 유속으로 시료 주입량은 1.0 µL로 정량 분석하였다.
무기성분 분석
무기성분은 식품첨가물의 기준 및 규격의 일반시험법(MFDS, 2019c)에 준하여 분석하였으며, 복분자 분말을 Bassel에 0.5 g을 정밀히 달아 넣고 증류수 1 mL와 65% 질산 4 mL을 넣고 Ultrawave 에서 220℃ (1500 W, 30분)로 시료를 분해하였다. 분해가 끝난 시료는 냉각시킨 후 증류수를 이용하여 25 mL 정용플라스크에 옮겨 정용하고 이 용액을 분석용액으로 하였다. 분석기기는 ICP-OES를 사용하여 무기성분의 함량을 정량, 분석하였다.
무기성분 분석을 위한 표준용액은 ICP multi-element standard solution Ⅳ을 사용하였다.
유리 아미노산 분석
복분자의 유리 아미노산 함량 분석은 In et al. (2017)의 방법에 준하여 분석하였으며, 복분자 시료를 10 mL conical tube에 시료 0.5 g을 정밀히 달고 증류수 10 mL를 첨가하여 충분히 균질화 한 후 이를 초음파추출기(30분)에서 추출하였다. 추출된 시료는 원심분리기(3,000 rpm, 4℃, 10분) 후 얻어진 상등액을 0.2 ㎛ membrane syringe filter로 여과한 것을 시험용액으로 하였다. 여과한 시험용액 10 μL은 250 μL vial에 넣고 여기에 AccQ-Fluor borate buffer 용액 70 μL를 가해 혼합시킨다. 이 혼합액에 아미노산의 형광 유도체화를 위하여 20 μL Accq-Flour reagent를 가하여 다시 5초간 균질화 하였다. 이 균질화한 혼합용액은 수욕상(55℃,10분)에서 유도체화 시킨 후, 이를 최종 분석시료로 하였다. 분석기기는 Fluorescene Detector가 연결된 Waters 2690 HPLC로 분리, 정량하였다. 이동상용매 A는 AccQ-Tag Eluent A와 초순수를 200 : 800 (v/v) 비율로 혼합 후 pH 4.98 조제하였으며, 이동상용매 B는 Acetonitrile, 이동상용매 C는 증류수를 사용하였다. 컬럼은 Discovery C18 (4.6 ㎜ × 250 ㎜, 5 ㎛)을 이용하였다.
Ellagic acid 추출용매 조건의 최적화
복분자의 생리활성 물질인 ellagic acid의 추출용매조건에 따른 초음파추출법 최적화를 위하여 Lee and Kim (2018)의 용매조건을 참고하여 추출법을 최적화하였다. 복분자 분말 100 ㎎을 15 mL conical tube에 정밀히 달은 후 추출용매 조건은 5 mL dimethyl sulfoxide와 5 mL methanol을 가한 혼합용매 추출, 50% 메탄올 추출, 5% 에탄올을 추출의 각각 용매조건에 따라 30분 동안 초음파 추출하였다. 추출물은 원심분리(3,000 rpm, 4℃, 10분)를 하여 상층액을 취한 후 0.2 ㎛ membrane syringe filter로 여과하여 ellagic acid 분석용 시험용액으로 사용하였다.
Ellagic acid 분석법의 유효성 검증
복분자 중 ellagic acid 성분의 분석법을 검증하기 위하여 식품의약품안전평가원에서 고시한 기능성원료인정을 위한 제출자료 작성 가이드라인(MFDS, 2019b)에 근거하여 분석법 검증을 수행하였다. 분석법의 검증은 특이성(Specificity), 직선성(Linearity), 정밀성(Precision) 및 정확성(Accuracy), 검출한계(Limit of detection) 및 정량한계(Limit of quantification)에 대하여 확인하였다. 특이성(Specificity)은 복분자의 ellagic acid가 표준용액과 비교하여 머무름시간 및 다른 피크의 간섭을 받지 않고 양호하게 분리되는지 확인하였다. 직선성(Linearity)은 ellagic acid의 표준품을 이용하여 7가지 농도(0.48, 4.8, 12.0, 24.0, 48.0, 120.0, 240.0 ㎍/mL) 범위에서 검량선을 작성하고 얻은 결정계수 (R2)를 통하여 양호한 직선성을 나타내는지 확인하였다. 정밀성(Precision)은 반복성과 재현성을 확인하였으며, 반복성은 3가지 시료양(100 ㎎, 250 ㎎, 500 ㎎)에 대해 5회 반복 측정하여 측정값들 사이의 상대표준편차(RSD)를 구하였으며, 재현성은 시험일을 변동요인으로 주어 3일간 측정하여 얻어진 측정값들 사이의 상대표준편차를 구하였다. 반복성과 재현성의 기준은 AOAC 가이드라인(2005)에 근거하여 검증하였다. 정확성(Accuracy)은 복분자 추출물을 농축한 복분자 농축액을 3가지 농도(15.10 ㎍/mL, 30.20 ㎍/mL, 51.63 ㎍/mL)로 첨가하여 5반복 분석 후 회수율을 확인하였고 기준은 AOAC 가이드라인 회수율(2005)에 근거하여 검증하였다. 검출한계(Limit of detection)와 정량한계(Limit of quantification)는 표준용액의 크로마토그램을 이용하여 얻어진 검량선의 기울기와 표준편차에 근거하여 계산하였다. 검출한계(LOD) = 3.3 × σ/S, 정량한계(LOQ) = 10 × σ/S 여기서 σ는 반응의 표준편차를, S는 검량선의 기울기를 말한다.
Ellagic acid 분석
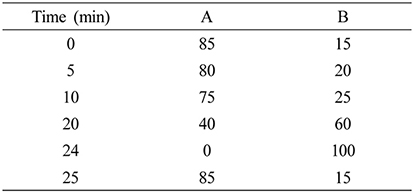
Ellagic acid의 분석에 사용된 표준물질은 ellagic acid (sigma-aldrich)이며, Dimethyl sulfoxide 이용하여 245.0 μg/mL의 농도로 표준용액을 조제한 후 이를 적정농도로 희석하여 표준용액으로 사용하였다. 분석기기는 UV Detector가 연결된 Waters Ailiance HPLC 2695을 사용하였으며, 컬럼은 Osaka SODA CAPCELL PAK C18 (4.6 ㎜ × 250 ㎜)을 사용하였다. 이동상 A는 0.1% formic acid in water, 이동상 B는 0.1% formic acid in Acetonitrile를 사용하여 1.0 mL/min의 유속으로 분석하였다. UV는 254 ㎚ 파장에서 측정하였고, 시료 주입량은 10 µL로 하였다(Table 1).
Table 1.
HPLC analytical condition for analysis of ellagic acid
통계분석
본 시험에서 얻어진 결과는 SPSS 20.0 (Statistical Package for Social Sciences, SPSS Inc, Chicago, USA) program을 사용하여 통계분석을 하였으며, t-test를 이용하여 실험결과의 유의성을 검정하였다(p < 0.05).
결과 및 고찰
유리당 분석
미숙한 형태의 복분자에서는 glucose, fructose 2종이 검출되었으며, sucrose, galactose, lactose, maltose는 검출되지 않았다. 복분자 4그룹 시료의 유리당 함량을 분석한 결과는 Table 2에 나타내었다. 총 유리당의 함량은 토종복분자의 glucose는 19.03 ㎎/g, 서양복분자의 glucose는 16.29 ㎎/g으로 토종복분자의 glucose 함량이 높게 나타났다. 또한 국내산 복분자와 수입산(중국) 복분자의 총 유리당 함량은 각각 27.28 ㎎/g, 21.58 ㎎/g으로 국내산 복분자의 함량이 수입산(중국)에 비해 높게 나타났으며(p < 0.05) 복분자의 유리당 구성비는 glucose가 fructose보다 높은 것을 확인하였다. 이와 같은 결과는 Cha et al. (2001)은 복분자 딸기의 이화학적 특성에 관한 연구에서도 미숙 복분자의 유리당 조성은 glucose와 fructose으로 완숙과로 되어가면서 sucrose가 생성됨을 보고하여 미숙한 복분자의 유리당 구성성분이 본 실험결과와 일치함을 확인하였다.
Table 2.
Free sugar contents of Rubus Fruit (R. coreanus, R. occidentalis, domestic Bokbunja, import Bokbunja) (Unit: ㎎/g, dry basis)
무기성분 분석
복분자의 무기질과 유해 금속함량은 ICP를 이용하여 Na, Ca, K, Mg, Fe, Al, Cu, Zn, Mn, P, Co을 분석하였다. 측정한 결과는 Table 3와 같았다. 전체적으로 K의 함량이 가장 높았고 위해금속인 Co는 검출되지 않았다. 이는 Kim and Shin (2011)은 숙성(미숙과, 중간숙과, 완숙과)에 따른 토종 복분자 딸기의 무기질 함량을 비교한 연구결과에서도 숙성과 관계없이 K 함량이 가장 높았으며, 그 외는 Ca > Mg > P 등의 순으로 조성비가 높다고 보고하여 본 실험의 결과와 유사하였다.
Table 3.
Mineral contents of Rubus Fruit (R. coreanus, R. occidentalis, domestic Bokbunja, import Bokbunja) (Unit: ㎎/100 g, dry basis)
유리 아미노산 분석
복분자의 유리 아미노산 분석은 17종의 아미노산 표준물질을 사용하여 분석하였으며 유리 아미노산 함량을 측정한 결과는 Table 4에 나타내었다. 주요 유리 아미노산으로는 threonine > asparagine > arginine > glutamine 등의 순으로 함유되어 있었으며 cysteine은 검출되지 않았다. 위와 같은 결과는 Lee and Do (2000)에 복분자 열매의 화학성분 및 휘발성 향기성분에 관한 연구에서 가장 적게 함유되어 있는 유리 아미노산으로는 methionine 및 cysteine으로 보고하여 본 실험 결과와 유사한 경향을 보인 반면 함유량이 많은 유리 아미노산으로는 aspartic acid 및 glutamic acid 등의 순으로 본 실험에서 주요 아미노산의 조성결과와는 차이를 보였다. 이는 Kim and Shin (2011)의 연구 결과로 미숙한 복분자의 구성아미노산과 단백질의 농도가 숙성된 복분자보다 높게 확인되었으며, 중간숙과와 완숙과로 과실이 익어감에 따라 아미노산 함량은 감소한다고 보고하여 복분자의 수확시기의 차이에 따른 숙성정도가 아미노산의 조성에 영향을 주는 요인일 것으로 판단되었다.
Table 4.
Free amino acid contents of Rubus Fruit (R. coreanus, R. occidenta-is, domestic Bokbunja, import Bokbunja) (Unit: ㎎/g, dry basis)
Ellagic acid 추출용매 조건의 최적화
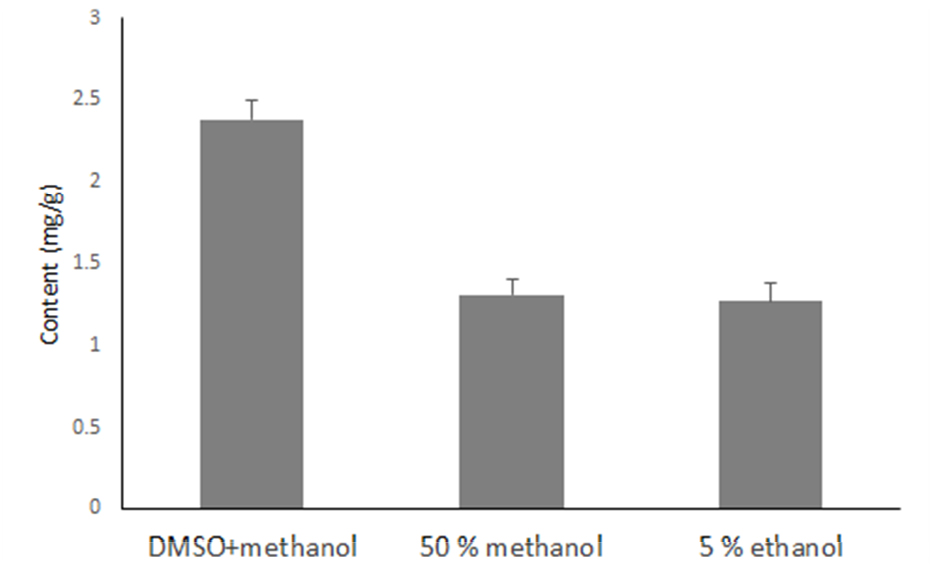
추출용매에 따른 추출효율을 비교한 결과는 Fig. 1에 나타내었다. ellagic acid의 용매별 추출함량은 DMSO (dimethyl sulfoxide)와 methanol을 1 : 1로 첨가하여 추출하였을 경우 2.38 ㎎/g, 50% methanol 1.31 ㎎/g, 5% ethanol 1.27 ㎎/g의 순으로 추출효율이 높은 것을 확인하였다. 이에 본 연구에서는 복분자의 ellagic acid의 추출을 위한 최적의 조건으로 시료 100 ㎎을 정밀히 달은 후 DMSO 5 mL와 methanol 5 mL을 가하여 초음파추출을 30분으로 하는 방법으로 분석에 적용하였다.
Ellagic acid 분석법의 유효성 검증
특이성(Specificity)
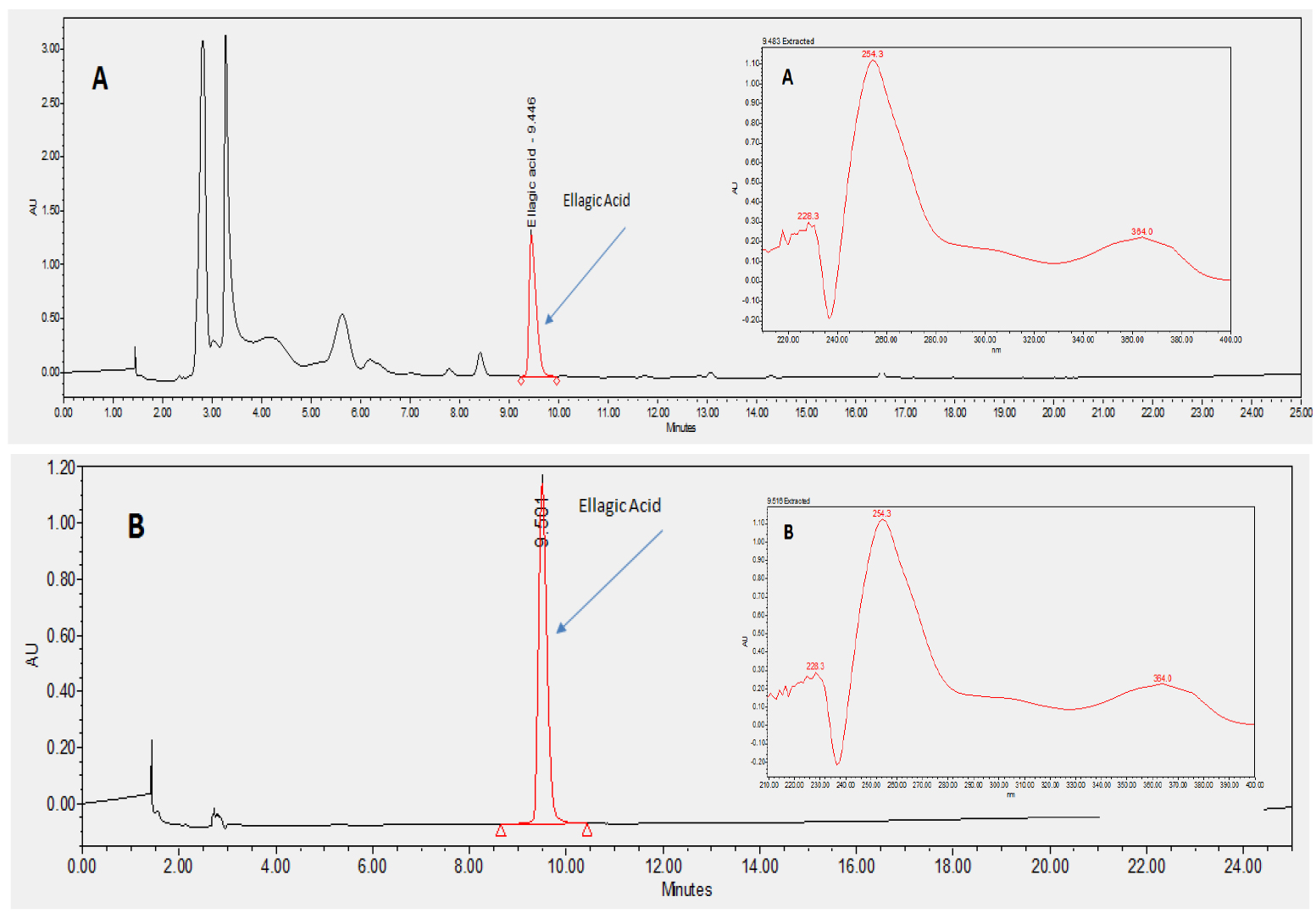
시험용액과 ellagic acid 표준용액에 크로마토그램의 머무름 시간과 UV 흡수파장 스펙트럼을 비교하여 특이성을 확인한 결과 피크의 머무름 시간이 9.5분으로 동일한 것을 확인하였으며, 해당 피크의 UV 흡수파장 스펙트럼 패턴이 서로 일치하는 것을 확인하였다(Fig. 2).
직선성(Linearity), 검출한계(LOD), 정량한계(LOQ)
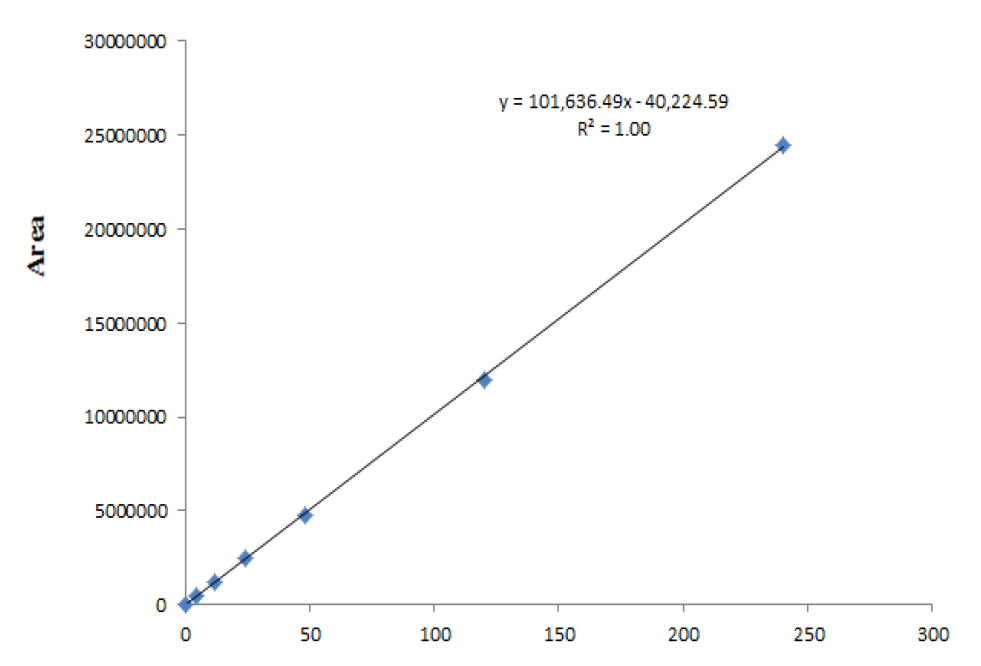
복분자의 성분분석을 위한 ellagic acid 표준물질에 대하여 0.48, 4.8, 12.0, 24.0, 48.0, 120.0, 240.0 μg/mL의 7수준 농도범위에서 검량선을 작성하였으며, 검량선의 결정계수 (r2)가 0.999 이상의 직선성을 나타내었다(Fig. 3). Ellagic acid의 검출한계와 정량한계는 표준용액을 적정 농도로 희석한 뒤 3회 반복 분석하였고, 반응의 표준편차와 검량선의 기울기에 근거하여 계산하였으며, 검출한계(LOD)는 0.49 ㎍/mL, 정량한계(LOQ)는 1.64 ㎍/mL로 설정하였다.
정밀성(Precision)
정밀성은 반복성(Repeatability)과 재현성(Reproducibility)을 확인하였으며, 반복성은 반복성을 시험한 결과 측정값들의 상대표준편차는 0.89%이며(Table 5), 재현성의 상대표준편차는 4.39%로 나타났다(Table 6). 이 결과값은 식품의약품안전평가원에서 고시한 기능성원료인정을 위한 제출자료 작성 가이드라인에 고시된 기준 중 함량이 0.1% (1 ㎎/g)일 때의 기준(반복성: 3% 이내, 재현성: 6% 이내)에 만족하는 결과를 나타내었다.
Table 5.
Precision of ellagic acid contents : intra-day (Unit: ㎎/g)
| Samples | |||
| 100 ㎎ | 250 ㎎ | 500 ㎎ | |
| 1 | 2.71 | 2.68 | 2.68 |
| 2 | 2.73 | 2.68 | 2.69 |
| 3 | 2.69 | 2.70 | 2.69 |
| 4 | 2.69 | 2.72 | 2.68 |
| 5 | 2.65 | 2.69 | 2.69 |
| Mean | 2.61 | 2.62 | 2.64 |
| Stdev | 0.03 | 0.02 | 0.01 |
| RSD(%) | 1.05 | 0.84 | 0.34 |
| Total RSD(%) | 0.89 | ||
Table 6.
Precision of ellagic acid contents : inter-day (Unit: ㎎/g)
| Repetitions | Inter-day | ||
| 0 day | 1 day | 2 day | |
| 1 | 2.68 | 2.67 | 2.69 |
| 2 | 2.69 | 2.56 | 2.72 |
| 3 | 2.69 | 2.66 | 2.55 |
| 4 | 2.68 | 2.68 | 2.78 |
| 5 | 2.69 | 2.61 | 2.26 |
| Mean | 2.69 | 2.64 | 2.60 |
| Total mean | 2.64 | ||
| Total stdev | 0.12 | ||
| RSD(%) | 4.39 | ||
정확성(Accuracy)
회수율 평가를 위하여 표준물질 대신에 복분자 추출물을 농축시킨 복분자 농축액을 첨가하여 시험하였으며, 복분자 농축액의 ellagic acid 농도는 349.66 ㎍/mL였다. 시료 100 ㎎을 정밀히 취한 후 복분자 농축액을 각각 0.5 mL (15.10 ㎍/mL), 1 mL (30.20 ㎍/mL), 1.5 mL (45.30 ㎍/mL)의 3수준으로 첨가하였고, 5회 반복 분석한 후 얻어진 함량의 회수율을 구하였다. 회수율의 결과값은 90.09 ~ 99.73%로 나타났으며(Table 7), 기능성 원료 인정을 위한 제출자료 작성 가이드라인에 고시된 기준(MFDS, 2019b) 중 함량이 0.1% (1 ㎎/g)일 때의 기준(회수율: 90 ~ 108%)에 만족하는 결과를 나타내었다.
Table 7.
Recovery of ellagic acid contents (n=5) (Unit: %)
Ellagic acid 함량
토종복분자, 서양복분자, 국내산 및 수입산(중국) 복분자의 ellagic acid의 함량을 분석한 결과는 Table 8에 나타내었다. ellagic acid의 함량은 토종복분자 2.56 ㎎/g, 서양복분자 3.16 ㎎/g이며, 국내산 복분자 1.69∼5.09 ㎎/g, 수입산(중국) 복분자 2.37∼3.79 ㎎/g의 범위로 확인되었다. 국내산 복분자와 수입산(중국) 복분자의 함량을 평균값으로 비교 할 경우, 각각 2.83 ㎎/g와 2.99 ㎎/g으로 시료간의 유의 차이는 없었다(p < 0.05). 이와 같은 결과는 Lee and Kim (2018)의 중국 재배종 복분자(R. chingii)와 국내 재배종 복분자(R. occidentalis)의 ellagic acid 함량은 차이가 없다고 보고하여 본 실험의 결과와 일치함을 확인하였다.
Table 8.
Ellagic acid contents in dried Rubus Fruit (Unit: ㎎/g)
적 요
본 연구는 국내에서 유통되고 있는 복분자, 서양복분자, 국내산 및 수입산 (중국) 복분자들을 대상으로 유리당, 무기성분, 유리 아미노산의 함량을 분석하여 비교하였으며, 생리활성 물질인 ellagic acid의 분석법을 검증한 후 각각의 시료별 함량을 분석하여 지표성분 기준설정에 활용하고자 하였다. 미숙한 복분자의 유리당 구성은 glucose와 fructose가 확인되었으며, 총 유리당의 함량은 국산 복분자(27.28 ㎎/g)가 수입산(중국) 복분자(21.58 ㎎/g)보다 높게 나타났다. 복분자의 무기성분 조성은 K의 함량이 가장 높았으며, 주요 아미노산은 threonine, asparagine, arginine, glutamine으로 확인되었고 cysteine은 검출되지 않았다. 추출용매별 ellagic acid 함량을 분석한 결과 dimethyl sulfoxide 와 methanol을 1 : 1로 첨가하여 추출하였을 경우 2.38 ㎎/g으로 가장 높게 나타났으며, 복분자, 서양복분자, 국내산 및 수입산(중국) 복분자의 시료 간 ellagic acid의 함량에는 차이가 없음을 확인하였다.