서 언
재료 및 방법
조사지역 및 입지환경조사
식생조사 및 분석
토양이화학성 분석
결과 및 고찰
입지환경 분석
군집구조
상대우점치 분석
종다양성지수 분석
유사도지수 분석
토양이화학성 분석
NMS 분석
보전방안
적 요
서 언
상동나무[Sageretia thea (Oseck) M.C. Johnst.]는 갈매나무과(Rhamnaceae)에 속하는 반상록관목으로 인도, 태국, 베트남, 한국, 중국, 일본 등에 분포하며, 우리나라에서는 제주도 및 남해안의 도서지역 해안가 및 산지에 분포하는 자생식물이다(Choo, 1992). 수고는 1.5~2 m로 나무껍질은 회갈색이고, 일년생가지에 8줄의 능선이 있으며, 끝이 가시로 변한다. 잎은 어긋나고, 달걀형이며, 가장자리에 물결모양의 잔톱니가 있다. 꽃은 10~11월에 노란색으로 핵과의 열매가 다음해 3~4월에 흑자색으로 성숙한다(Korea National Arboretum, 2017).
상동나무는 본초학적으로 거풍약(風藥), 담지해평천약(痰止晐平喘藥), 이기약(理氣藥) 등으로 활용하였고, 민속식물학적으로는 제주도와 남해 도서지역에서 ‘삼동’, ‘삼동낭’, ‘상동낭’이라 부르며 열매를 식용, 약용으로 사용하였다(Chung et al., 2017). 또한, 최근에는 상동나무의 약리학적 연구가 활발히 수행되어 항산화, 항염증, 항비만, 항당뇨, 대장암 및 폐암 세포의 사멸을 유도하는 항암 등의 효과가 밝혀진 바 있다(Kim et al., 2019a, 2019b; Pyo et al., 2020).
최근 세계 각국은 생명산업을 21세기 바이오경제시대를 이끌어갈 핵심 요소로 판단하고 신산업으로 선정하여 이에 대한 방안을 마련하고 있다. 특히, 법적 구속력이 있는 ‘유전자원 접근 및 이익공유(Access to genetic resources and Benefit Sharing: ABS)’에 관한 나고야의정서(Nagoya Protocol) 발효로 인하여 고부가가치 약용자원을 확보하고 자국의 생명자원의 관리체계를 발전시켜 나갈 필요성이 대두되고 있다. 각국에서는 이를 위하여 자생하는 산림식물자원의 전통지식 발굴 및 활용 연구를 적극적으로 권장하고 있으며, 국내에서도 이를 위한 관련법을 시행하여 세계적인 추세에 적극적으로 동참하고 있다(Ahn, 2017; David et al., 2015). 이러한 생명산업의 발달과 함께 다양한 효능을 지닌 약용식물의 부가가치가 높아지면서 불법적인 남획, 수출, 서식지 파괴 등의 문제도 발생하고 있다. 이는 식물의 종다양성을 심각하게 위협하고 있으며, 특히, 서양삼(Panax quinquefolius), 면두설련화(Saussurea laniceps)와 같은 고부가가치 약용식물은 한정된 서식처와 느린 생장속도, 적은 개체수 현황으로 보존이 필요하지만 불법적인 남획과 수출이 빈번하게 발생하여 자생지 내 유전적 다양성이 감소하고 있다(Applequist et al., 2020).
또한, 기후변화는 식물의 생육환경에 영향을 미치는 기온의 상승, 강수량과 강수 패턴의 변화와 같은 물리적 시스템의 변화로 많은 지역에서 육상생물이 위협받을 것으로 전망하고 있으며(IPCC, 2014), 많은 연구에서 식물계절의 변화, 난대성 식물의 서식지 확대, 한대성 식물의 서식지 축소가 예측되고, 이미 유럽의 경우 난대성 식물의 서식지 고도가 확대되었거나 고산식물의 분포지가 쇠퇴하는 것으로 확인되었다(Park et al., 2016; Christophe et al., 2009; Zimmermann et al., 2013).
종다양성의 감소를 해결하는 방법으로는 유용 약용식물의 재배 및 산업화를 통해 자생지를 현지 외 보존하는 방법 등이 제시되고 있고(Costello and Ward, 2006), 구체적인 보전전략과 명확한 증식 재배법 확립을 위해서는 대상종의 자생지 입지·생육환경 특성, 삽목이나 종자의 처리와 같은 연구가 선행되어야 한다(Kim, 2007). 국내에서는 최근 희귀식물을 비롯한 유용 약용식물을 대상으로 직접적인 종자 처리에 관한 연구 이외에도 자생지의 입지·생육환경을 명확히 파악하여 대상종의 현지 외 보존, 대량증식에 적절한 재배지 환경을 적극적으로 구명하고 있다(Boo and Kim, 2020; Kim et al., 2018; Son et al., 2016).
상동나무도 이와 관련하여 삽목묘에 대한 시비처리 연구, 종자 발아특성 연구가 일부 이루어진 바 있으나(Eo et al., 2021; Song et al., 2014, 2015), 본 연구에서는 상동나무의 제주도지역에 한정된 자생지 입지환경과 생육환경의 분포 범위를 넓혀 남해안 도서 지역을 포함하는 국내 자생지의 분포 특성을 조사하였다. 이러한 조사를 통해 상동나무가 분포할 수 있는 적절한 생육환경에 대한 생물적·비생물적 요인을 명확히 구명하고 분석하여 추후 상동나무의 자생지 보존은 물론 대량증식을 위한 적절한 재배지의 선정에 기초자료로 도움이 되고자 한다.
재료 및 방법
조사지역 및 입지환경조사
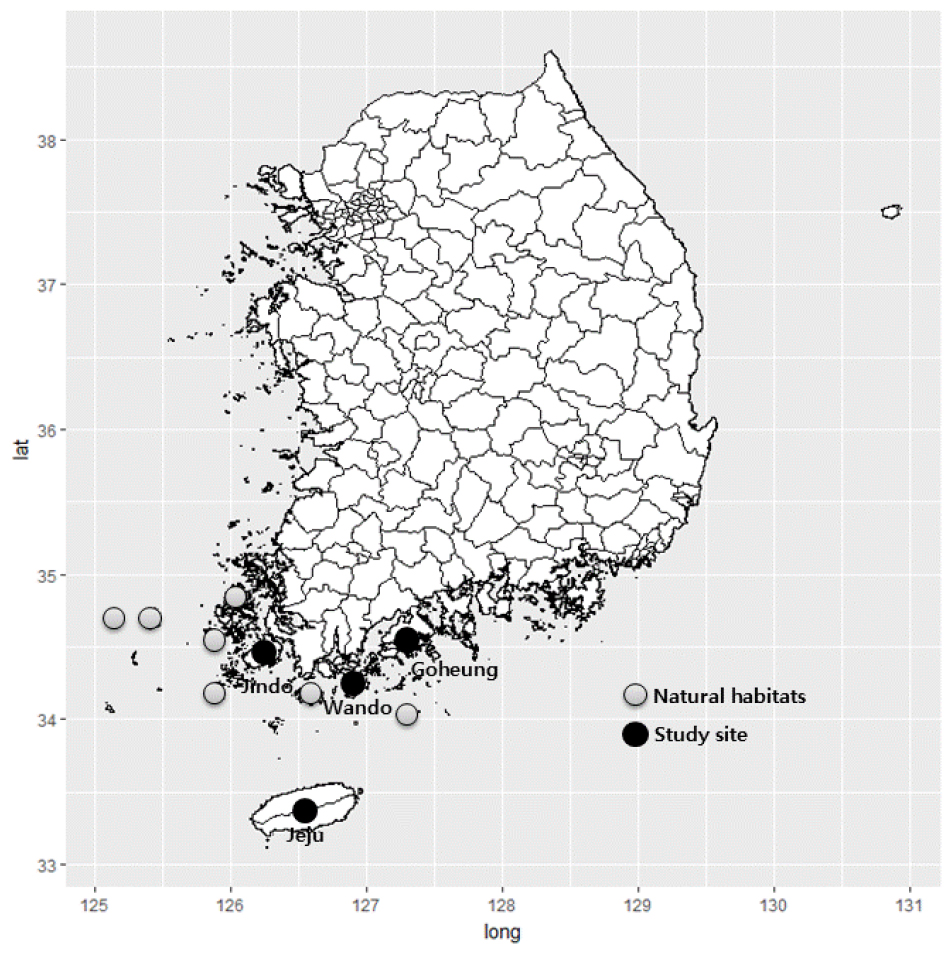
상동나무의 조사대상지역은 문헌자료를 바탕으로 자생지를 조사한 뒤, 조사구는 주요 분포지인 제주, 진도, 완도, 고흥 4개 지역을 대상으로 15개 방형구(10 × 10 m)를 선정하였다(Fig. 1). 자생지 입지환경은 GPS (GPSMAP64S, Garmin, Kansas city, USA)와 순토(Suunto Clino Compass, Suunto, Vantaa, Finland)를 이용하여 위도·경도, 고도, 경사 및 방위를 측정하였으며, 지역별 기상환경은 연평균기온(Annual mean temperature: AMT), 연평균강수량(Mean annual precipitation: MAP), 일조량(Duration of sunshine: SD), 상대습도(Relative humidity: RH)는 지난 30년간의 평년값(1991~2020)을 참고하였다(Korea Meteorological Administration, 2021). 이 중 온량지수(Warmth index: WI) 및 한랭지수(Coldness index: CI)는 Kira (1948)의 방법을 이용하여 산출하였다.
식생조사 및 분석
식생조사는 2020년 3월부터 11월까지 약 9개월간 실시하였으며, 조사지 내 출현식물은 영양기관 및 생식기관의 동정이 용이한 개화·결실기를 중심으로 조사하였다. 출현식물은 표본 채집 및 현지에서 화상자료를 확보하였다. 분류체계는 Engler의 식물분류체계(Melchior, 1964)를, 학명 및 국명은 국가표준식물목록(Korea National Arboretum, 2017)에 준하여 작성하였다. 식물의 동정은 Lee (2003a, 2003b), Kim and Kim (2011)의 식물도감을 참고하여 동정하였다. 확보한 표본 및 화상자료는 국립산림과학원 산림약용자원연구소 표본실(Forest Medicinal Resources Center: FMRC)에 보관하였다.
방형구의 식생조사 방법은 Braun-Blanquet 방법(Braun, 1964)을 따라 실시하였으며, 교목층(8 m 이상), 아교목층(2~8 m), 관목층(0.8~2 m), 초본층(0.8 m이하)으로 수고별로 층위를 나누어 구분하였다. 구분된 층은 식피율과 개체수를 기록하여 층위별로 Curtis and McIntosh (1951)의 중요치(Importance value: IV)를 백분율로 나타낸 상대우점치(Importance percentage: IP)를 산출하였고, 수관의 층위별 가중치를 부여하여 평균상대우점치(Mean Importance Percentage: MIP)를 도출하였다. 층위별 종다양성, 균일성은 Shannon-Weaver 종다양도(H')를 적용하여 최대종다양도(H’max)는 H’max = logS (S는 종수), 균등도(J’)는 J’ = H’/H’max 및 우점도(D)는 D = 1-J’의 식을 이용하였다. 유사도 지수는 Jaccard 계수(1900, 1901, 1908)를 개선한 Sorenson (1948)의 유사도지수(Similarity index: SI) 및 상이도지수(Dissimilarity index: DSI)를 산출하였다. 자생지간 유연관계의 분석은 출현식물의 중요치(IP)를 바탕으로 군집분석을 실시하였으며, 지표종분석(Indicator species analysis: ISA)을 통해 적절한 군락수를 결정하였다. 분석은 PC- ORD v. 6.22 (McCune and Mefford, 2010) 다변량 분석 프로그램을 이용했다. 분석에는 출현빈도가 5% 미만인 종과 이상치(Outlier)를 제외하였다. 식생에 출현한 각 피도값을 이용하여 NMS 분석(Non-metric multi-dimensional scaling: NMS)을 실시하였고, 이는 집단 분포를 가정하기 어려운 생태학적 군집 자료에 흔히 이용하는 분석으로(Cho et al., 2011), 본 연구에서는 이를 통해 상동나무의 지역적 특성을 포함하는 환경요인을 2차원상에 배열하여 나타냈다.
토양이화학성 분석
산림토양은 산림에 자생하는 동·식물의 생명을 유지하고 번식하는데 필요한 물과 양분을 저장하고 공급하는 요인으로 식물의 생육환경 분석에 중요한 역할을 하므로 토양의 이화학적 특성을 조사하였다. 토양은 Litter층을 제거한 10~20 ㎝의 깊이에서 방형구당 3개의 시료를 채취하였다. 토성은 미국 농무부 분류기준인 피펫법(Pippet method), 유기물함량(Organic matter: OM)은 Walkley-Black법, 유효인산(Available phosphate: P2O5)은 Lancaster법, 질소(T-N)는 Kjeldahl법, 치환성양이온(Exchangeable cation: Ex. C)은 1N-NH4OAc (pH 7.0) 침출에 의한 Inductively Coupled Plasma-Optical Emission Spectrometry (ICP-OES, Thermo Fisher, Massachusetts, USA)를 이용하였고, 양이온치환용량(Cation exchange capacity: CEC)은 1N-NH4OAc (pH 7.0) 침출을 통하여 산출하였으며, NH4+, 전질소(Total nitrogen: TN) 함량은 Kjeldhal 증류법으로 산출하였다. 전기전도도(Electric conductivity: EC)와 pH는 채취된 시료를 1:5 (w/w)로 증류수와 희석하여 EC meter (HANNA, HI 98331)와 pH meter (HANNA, HI 99121)로 측정하여 평균치를 산출하였다.
결과 및 고찰
입지환경 분석
상동나무 자생지 4지역 15개소의 입지환경 조사한 결과(Table 1), 자생지의 사면 방위는 북향, 북서향, 북동향, 남향, 남서향, 동향으로 나타나 방위에 큰 영향을 받지 않으나 대체로 북향을 선호하는 것으로 확인되었다. 사면 경사는 5~35°로 가장 가파른 자생지는 10조사구(완도 대신리, 35°), 평균 경사는 약 16°로 전체적으로 완경사지에 주로 분포하는 것을 확인하였다. 해발고는 0~370 m로 조사지역 내 해발고가 가장 높은 지역은 10조사구(완도 대신리, 370 m), 낮은 자생지는 9조사구(진도 금갑리, 0 m)로 확인되었다. 대부분 상층의 발달이 미흡한 해안지역 중심으로 분포하였으며, 일부 낮은 산지의 정상부에 분포하는 것을 확인하였다. 조사지 방형구내 개체수는 3~20개체가 생육하고 있었고, 서귀포 동일리(1), 진도 초사리(8), 금갑리(9) 지역이 20개체로 가장 큰 군락을 이루었으며, 제주 하모리(2), 일과리(6) 지역이 3개체로 조사지역 내 가장 작은 군락을 이루고 있었다(Table 1).
Table 1.
Environmental and vegetation characteristics of surveyed plots
기상자료는 1991년부터 2020년까지의 평년값을 참고하였으며(Table 2), 자생지의 연평균기온(AMT)은 13.7~16.9℃, 평균 14.7℃로 나타났다. 이는 우리나라의 연평균기온인 12.8℃보다 1~4℃ 높은 지역으로 기온연교차가 적은 난온대 식생의 상록활엽수림에 주로 분포하고 있었다. 연평균강수량(MAP)은 1,374.7~ 1,989.6 ㎜, 평균 1,586.3 ㎜로 우리나라 연평균 강수량인 1,306.3 ㎜ 보다 높은 지역에서 주로 분포하는 것을 확인하였다(Korea Meteorological Administration, 2021). 일조량(SD)은 2074.6~ 2195.9 hrs/year, 상대습도(RH) 68.6~69.8%, 온량지수(WI) 110.7~132.7℃, 한랭지수(CI) -6.7~-3.5℃로 확인되었다. 본 연구의 조사지역의 기상환경은 온도지수 및 식물기후와 비교하였을 때, 입지환경의 연평균기온(AMT)은 13~14℃의 등온선 범위보다 높으며(Eom and Kim, 2020), 온량지수(WI), 한랭지수(CI) 또한 전형적인 난온대 식생 분포대의 기후에서 생육하고 있는 것으로 나타났다.
Table 2.
Meteorological data of surveyed districts from 1991 to 2020 in Natural habitats
| Location | AMTz(℃) | MAPy (㎜) | SDx (hrs/year) | RHw (%) | WIv (℃) | CIu (℃) |
| Jeju | 16.9 | 1989.6 | 2074.6 | 69.8 | 132.7 | - |
| Jindo | 13.9 | 1374.7 | - | - | 112.4 | -5.3 |
| Wando | 14.3 | 1531.5 | 2092.4 | 71.6 | 115.2 | -3.5 |
| Goheung | 13.7 | 1449.3 | 2195.9 | 68.6 | 110.7 | -6.7 |
본 연구에서 제주지역 상동나무의 자생지 입지환경은 해안, 방목지, 곶자왈 같은 저지대를 중심으로 분포하고 있었다. 이는 기존의 선행연구에서 알려진 상동나무의 입지환경이 해발고는 낮고, 경사도가 완만하며, 남획과 같은 인위적 행위가 적은 중간 산인 곶자왈에 분포한다는 것과 유사한 경향이 나타났다(Kim, 2004; Kim and Kim, 2011; Kwon et al., 2011; Song et al., 2014). 본 연구에서 새로이 수행한 남해안 도서 지역 자생지 입지환경은 경사가 급하고 고도가 상대적으로 높은 산지의 사면까지인 것으로 확인되어 알려진 자생지보다 다양한 입지환경에서 분포하는 것으로 나타났다.
군집구조
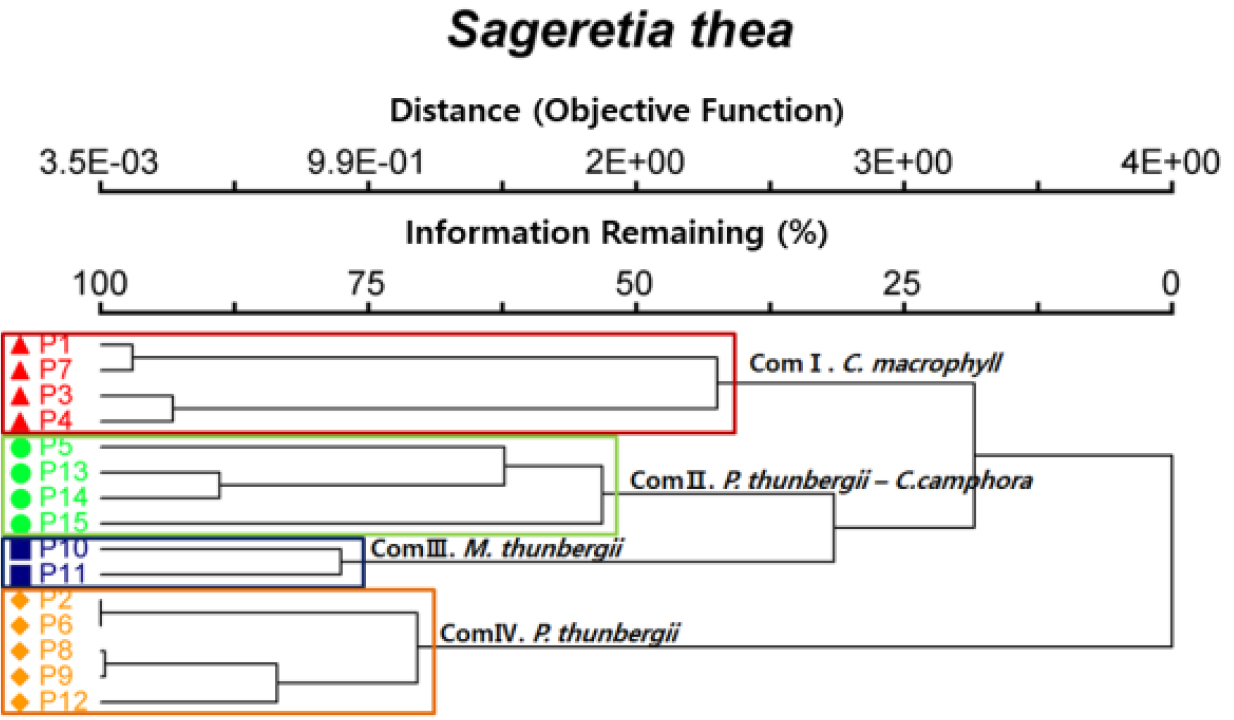
상동나무 자생지의 군집구조 분석은 전체 15개 군락 181분류군 중 5% 이하 출현종을 제외한 111종을 대상으로 PC-ORD v.6.22 (McCune and Mefford, 2010)의 NMS분석을 실시하였다. 군락은 지표종분석(ISA)을 통해 유의한 4개 군집으로 구분되었다(Fig. 2). 1번 군집(Community I)은 곰의말채나무(Cornus macrophylla)가 우점하는 4개 조사구(1, 3, 4, 7), 2번 군집(Community II)은 곰솔(Pinus thunbergii)과 녹나무(Cinnamomum camphora)가 우점하는 4개 조사구(5, 13, 14, 15), 3번 군집(Community III)은 후박나무(Machilus thunbergii)가 우점하는 2개 조사구(10, 11), 4번 군집(Community IV)은 곰솔이 우점하는 5개 조사구(2, 6, 8, 9, 12)로 구분되었다. 상동나무 식생은 우점종에 따라 군락이 구분되었으며, 지역적인 차이도 확인되었다. 곰의말채나무가 우점하는 1번 군집은 제주도 곶자왈 지역으로 나타났으며, 곰솔과 녹나무가 우점하는 2번 군집은 고흥과 제주지역의 해안림, 후박나무가 우점하는 3번 군집은 완도지역, 곰솔이 우점하는 4번 군집은 각 지역의 해안림 일대로 나타났다.
이처럼 상동나무 자생지에서 출현한 식물의 군집구조 분석에 따른 결과에서 우점종은 곰의말채나무, 곰솔, 녹나무, 후박나무로 나타났고, 이러한 수종들은 제주 곶자왈 지역, 난온대 상록활엽수림, 남해안 해안림을 구성하는 주요 수종으로 확인되었다(Ha et al., 2021; Song, 2014; Uyeki, 1941; Yoon et al., 2011). 상동나무의 군집구조에서 확인된 자생지의 군락은 남해안부터 중부 일대까지 다양한 기후대를 보이는 개비자나무(Cephalotaxus koreana), 길마가지나무(Lonicera harae)의 군집구조와 달리 난온대 상록활엽수림의 하층을 구성하는 주요 수종으로 판단된다(Kim et al., 2018; Son et al., 2021).
상대우점치 분석
상동나무 자생지의 군집 및 층위별 상대우점치(I.P.)는 다음과 같이 나타났다(Table 3). 군집 I(C. macrophylla community)에서 교목층을 우점하는 종은 곰의말채나무가 38.97%로 우점종으로 나타났으며, 자귀나무(Albizia julibrissin)와 가래나무(Juglans mandshurica)가 각각 21.71%, 17.78%로 경쟁 관계에 있는 것으로 확인되었다. 아교목층은 종가시나무(Quercus glauca), 참느릅나무(Ulmus parvifolia), 소태나무(Picrasma quassioides) 등이 경쟁관계에 있었으며, 관목층은 상동나무, 쥐똥나무(Ligustrum obtusifolium), 찔레꽃(Rosa multiflora)을 중심으로 다양한 관목이 상재하고 있었다. 교목층은 곰의말채나무가 우점하는 군락으로 기존의 곶자왈 식생 연구의 곰의말채나무 - 때죽나무(Styrax japonica) - 개서어나무(Carpinus tschonoskii) 식생 구조와 차이를 보였다(Song, 2014). 군집 I의 교목층은 자귀나무, 가래나무와 같은 양수성 낙엽활엽수가 발달하였으며, 아교목층에서는 대표적 내음성 수종인 종가시나무가 발달하고 있는 식생 구조로 확인되었다(Kang et al., 2022),
Table 3.
Importance percentage (IP) and mean importance percentage (MIP) of major species in each plant communities
| Community Iz | Community IIy | Community IIIx | Community Ⅳw | ||||||||||||||||||||
| O2v | U2u | S2t | H2s | M2r | O2 | U2 | S2 | H2 | M2 | O2 | U2 | S2 | H2 | M2 | O2 | U2 | S2 | H2 | M2 | ||||
| Machilus thunbergii | 44.61 | 11.15 | |||||||||||||||||||||
| Aralia elata | 4.69 | 1.81 | 1.63 | ||||||||||||||||||||
| Quercus serrata | 13.62 | 4.47 | 4.73 | 2.25 | 0.56 | ||||||||||||||||||
| Pinus thunbergii | 41.71 | 3.47 | 1.12 | 11.58 | 88.26 | 63.84 | 38.03 | ||||||||||||||||
| Ulmus parvifolia | 19.77 | 2.84 | 5.65 | ||||||||||||||||||||
| Zanthoxylum piperitum | 4.62 | 1.16 | |||||||||||||||||||||
| Juglans mandshurica | 17.78 | 4.96 | 5.69 | 18.19 | 4.47 | 5.67 | |||||||||||||||||
| Spodiopogon cotulifer | 4.84 | 1.21 | |||||||||||||||||||||
| Quercus mongolica | 24.25 | 3.61 | 1.86 | 7.43 | |||||||||||||||||||
| Oplismenus undulatifolius | 6.27 | 1.57 | 1.67 | 0.42 | 13.71 | 3.43 | 1.61 | 0.40 | |||||||||||||||
| Lonicera harae | 2.39 | 0.60 | |||||||||||||||||||||
| Cudrania tricuspidata | 3.37 | 0.84 | |||||||||||||||||||||
| Quercus glauca | 22.79 | 5.70 | |||||||||||||||||||||
| Celtis sinensis | 3.26 | 0.82 | |||||||||||||||||||||
| Hedera rhombea | 1.25 | 0.53 | 0.45 | 6.94 | 1.74 | ||||||||||||||||||
| Elsholtzia ciliata | 3.25 | 0.81 | 0.65 | 0.16 | |||||||||||||||||||
| Rhus chinensis | 4.97 | 1.24 | 3.98 | 1.00 | |||||||||||||||||||
| Elaeagnus umbellata | 4.24 | 1.06 | 1.96 | 0.49 | |||||||||||||||||||
| Pittosporum tobira | 3.63 | 0.91 | |||||||||||||||||||||
| Euonymus japonicus | 5.38 | 1.35 | |||||||||||||||||||||
| Lonicera japonica | 3.58 | 1.95 | 1.38 | 1.96 | 1.66 | 0.91 | |||||||||||||||||
| Sageretia thea | 9.67 | 2.42 | 31.78 | 7.95 | 32.55 | 8.14 | 15.59 | 3.90 | |||||||||||||||
| Smilax sieboldii | 3.76 | 0.94 | 1.66 | 0.42 | |||||||||||||||||||
| Ligustrum japonicum | 6.94 | 1.74 | 2.77 | 0.69 | |||||||||||||||||||
| Rosa multiflora | 7.65 | 1.91 | 12.76 | 0.92 | 3.42 | 5.62 | 1.32 | 1.74 | |||||||||||||||
| Commelina communis | 1.54 | 0.39 | 1.24 | 0.31 | 7.93 | 1.98 | |||||||||||||||||
| Camellia japonica | 25.00 | 6.25 | 4.83 | 7.56 | 3.10 | ||||||||||||||||||
| Cinnamomum camphora | 12.50 | 1.72 | 3.56 | 47.35 | 11.84 | ||||||||||||||||||
| Castanopsis sieboldii | 13.24 | 3.31 | 25.00 | 6.25 | 11.74 | 2.94 | |||||||||||||||||
| Calystegia soldanella | 4.95 | 1.24 | 4.76 | 1.19 | |||||||||||||||||||
| Peucedanum japonicum | 0.65 | 0.16 | 1.37 | 0.34 | |||||||||||||||||||
| Rubus crataegifolius | 1.65 | 0.41 | 2.79 | 0.70 | |||||||||||||||||||
| Artemisia indica | 1.58 | 0.40 | 1.88 | 0.47 | 0.65 | 0.16 | |||||||||||||||||
| Picrasma quassioides | 12.65 | 3.16 | 1.76 | 0.44 | |||||||||||||||||||
| Smilax china | 4.26 | 1.07 | 2.47 | 0.62 | 0.66 | 0.17 | |||||||||||||||||
| Albizia julibrissin | 21.71 | 0.68 | 5.60 | 11.73 | 2.93 | ||||||||||||||||||
| Ligustrum obtusifolium | 7.22 | 1.81 | 3.87 | 0.97 | 13.39 | 3.35 | |||||||||||||||||
| Eurya japonica | 6.94 | 1.74 | 5.66 | 1.42 | |||||||||||||||||||
| Cornus macrophylla | 38.97 | 9.74 | 16.44 | 4.11 | 25.00 | 6.25 | |||||||||||||||||
| Ulmus davidiana | 16.66 | 4.17 | 1.14 | 0.29 | |||||||||||||||||||
| Ilex integra | 16.44 | 4.11 | 1.62 | 0.41 | |||||||||||||||||||
| Litsea japonica | 1.22 | 0.31 | 19.77 | 4.94 | |||||||||||||||||||
| Vitex rotundifolia | 5.78 | 1.45 | 1.83 | 0.46 | |||||||||||||||||||
| Zanthoxylum schinifolium | 2.27 | 0.57 | 9.79 | 2.45 | 9.76 | 2.44 | 3.99 | 1.00 | |||||||||||||||
| Viburnum dilatatum | 5.22 | 1.31 | 16.66 | 4.17 | |||||||||||||||||||
| Vitis flexuosa | 2.66 | 0.67 | 2.35 | 0.59 | 3.97 | 0.99 | |||||||||||||||||
| Mallotus japonicus | 7.27 | 1.82 | 4.83 | 1.14 | 1.49 | ||||||||||||||||||
| Cirsium japonicum | 2.63 | 0.66 | 0.92 | 0.23 | 1.37 | 0.34 | |||||||||||||||||
| Vitis coignetiae | 1.72 | 0.43 | 2.77 | 0.69 | 1.14 | 1.31 | 0.61 | ||||||||||||||||
| Rubus parvifolius | 2.86 | 0.72 | 1.15 | 0.29 | 1.14 | 0.29 | |||||||||||||||||
| Others | 21.54 | 14.84 | 23.89 | 80.61 | 35.22 | 0.00 | 0.00 | 21.11 | 82.29 | 25.85 | 18.19 | 28.63 | 14.54 | 73.23 | 33.45 | 0.00 | 0.00 | 27.91 | 77.47 | 26.35 | |||
| Total |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 |
100. 00 | |||
군집 II(P. thunbergii - C. camphora community)는 침활혼효림으로 교목층을 우점하는 종은 곰솔 41.71%, 아교목층을 우점하는 녹나무 47.35%로 두 분류군이 가장 우점하고 있었으며, 감탕나무(Ilex integra), 느릅나무, 가막살나무(Viburnum dilatatum) 등 다양한 종이 경쟁관계에 있는 것으로 확인되었다. 관목층 및 초본층은 상동나무가 31.78%로 가장 우점하고 있었으며, 순비기나무(Vitex rotundifolia), 갯메꽃(Calystegia soldanella), 갯기름나물(Peucedanum japonicum)과 같은 전형적인 해안림 하층으로 확인되었다. 본 군집의 식생구조는 침활혼효림으로 구성된 해안림으로 상동나무가 하층을 우점하는 식생 구조로 확인되었다. 이러한 식생 구조는 난온대 상록활엽수이자 내염성이 강한 녹나무가 침입하여 수관층에 자리를 잡아가며 곰솔과 같은 침엽수가 쇠퇴하는 군집으로 확인되었다(Kang et al., 2022; Shim et al., 2019).
군집 III(M. thunbergii community)의 교목층은 구실잣밤나무(Castanopsis sieboldii) 25.00%, 곰의말채나무25.00%, 가래나무 18.19%, 졸참나무(Quercus serrata) 13.62%가 경쟁 관계에 있었으며, 아교목층인 후박나무가 44.61%로 우점종으로 확인되었다. 관목층과 초본층에서는 상동나무가 32.55%, 8.14%로 하층을 우점하였다. 본 군집은 아교목층에 후박나무가 우점하고, 동백나무(Camellia japonica), 구실잣밤나무 등이 교목층을 구성하는 전형적인 난온대 상록활엽수림으로 확인되었다(Kang et al., 2022).
군집 IV (P. thunbergii community) 군락은 곰솔의 상대우점치가 교목층과 아교목층에서 각각 88.26%, 63.84%로 우점하는 것으로 확인되었다. 관목층은 상동나무 15.59%가 가장 우세하였으며, 초본층의 종다양성은 높게 나타났다. 이는 전형적인 해안사구의 식생 구조와 유사한 군집으로 확인되었다(Chun, 2007).
종다양성지수 분석
상동나무 자생지를 구성하는 출현종의 피도를 통해 Shannon의 종다양성지수(H’), 최대종다양성지수(H’max), 균등도(J’), 우점도(D)를 군집별로 확인한 결과(Table 4), 군집 내에서 군집구조의 복잡성을 나타내는 종다양성지수(H’)는 1.397~1.455 범위로, 평균 1.422로 나타났다. 이는 부산지역 곰솔 해안림의 종다양성지수(0.551~1.435) 비교하였을 때, 상동나무의 식생구조가 곰솔 해안림 식생구조와 유사한 결과를 보였다(Shin et al., 2019). 최대종다양성지수(H’max)는 1.434~1.477 범위로, 평균 1.456로 확인되어 안정적인 군집인지를 판단하는 기준인 종다양성지수(H’)와 최대종다양성지수(H’max)의 차이는 낮은 것으로 판단된다(Pielou, 1975). 군집별 종구성의 균일한 정도를 나타내는 균등도(J’)는 0.972~0.986 범위로, 평균 0.976로 나타났다. 이는 1에 가까운 값으로 다수의 종이 균일한 상태를 이루고 있어 임분의 성숙도가 높은 것으로 생각된다(Brower and Zar, 1977). 군집별로 특정종이 우점하는 정도를 나타내는 우점도(D)는 0.014~0.028 범위로 확인되었으며, 평균 0.024로 나타나 한 종이 우점하는 경향보다는 여러 종이 상재하는 식생 유형을 보이고 있었다.
Table 4.
Species diversity index of species in the investigated plots
| Sites | Species diversity (H’) | Maximum H’ (H’max) | Evenness (J’) | Dominance (D’) |
| Community Iz | 1.455 | 1.477 | 0.986 | 0.014 |
| Community IIy | 1.397 | 1.434 | 0.974 | 0.026 |
| Community IIIx | 1.423 | 1.461 | 0.974 | 0.026 |
| Community IVw | 1.413 | 1.454 | 0.972 | 0.028 |
| Average | 1.422 | 1.456 | 0.976 | 0.024 |
유사도지수 분석
유사도지수(SI)는 군집에 대한 종간 유사도를 비교해 종이나 생물이 살아가는 공간을 나타내는 수치로, 군집 간 20% 미만일 경우에는 이질적인 집단이고, 80% 이상일 때는 서로 동질적인 집단으로 간주한다고 한다(Cox, 1972). 상동나무 자생지 군락 간 유사도지수(SI)를 산출한 결과(Table 6), 군집 I - 군집 II가 42.55%, 군집 I – 군집 III 67.23%, 군집 I – 군집 IV 23.48%로 나타났으며, 군집 II - 군집 III 93.10%, 군집 II - 군집 IV 39.74%, 군집 III - 군집 IV 68.22%로 확인되었다(Table 5).
Table 5.
Similarity index (%) between communities
| Dissimilarity index (%) | |||||
| Community Iz | Community IIy | Community IIIx | Community IVw | ||
| Similarity index (%) | Community I | 57.45 | 32.77 | 76.62 | |
| Community II | 42.55 | 6.90 | 60.26 | ||
| Community III | 67.23 | 93.10 | 31.78 | ||
| Community IV | 23.48 | 39.74 | 68.22 | ||
Table 6.
Soil characteristics in each vegetation community of Sageretia thea
|
Sand (%) |
Silt (%) |
Clay (%) |
pHz [1:5] |
OMy (%) |
TNx (%) |
P2O5 (㎎/㎏) | Exchangeable (cmol+/㎏) |
ECv (ds/m) | ||||||
| K+ | Na+ | Ca2+ | Mg2+ | CECw | ||||||||||
| Com. Iu | Mean | 85.62 | 5.92 | 8.47 | 5.76 | 13.33 | 0.77 | 86.19 | 0.58 | 0.10 | 12.12 | 4.20 | 39.61 | 0.60 |
| S.D.q | 2.42 | 3.72 | 1.30 | 0.28 | 3.52 | 0.22 | 36.12 | 0.34 | 0.08 | 3.62 | 1.82 | 12.74 | 0.35 | |
| Com. IIt | Mean | 65.69 | 18.20 | 16.11 | 5.79 | 5.63 | 0.34 | 138.35 | 0.23 | 0.04 | 7.50 | 2.43 | 15.03 | 0.22 |
| S.D. | 2.61 | 5.77 | 8.32 | 1.18 | 0.67 | 0.06 | 121.40 | 0.03 | 0.01 | 2.81 | 1.37 | 1.30 | 0.05 | |
| Com. IIIs | Mean | 70.36 | 21.36 | 8.28 | 5.28 | 19.33 | 0.97 | 510.03 | 0.60 | 0.06 | 12.47 | 3.14 | 34.54 | 0.63 |
| S.D. | 0.00 | 0.00 | 0.00 | 1.41 | 6.33 | 0.23 | 19.12 | 0.07 | 0.02 | 8.01 | 1.96 | 8.06 | 0.12 | |
| Com. IVr | Mean | 70.49 | 19.59 | 9.92 | 5.98 | 15.22 | 0.68 | 125.35 | 0.58 | 0.10 | 11.53 | 2.55 | 35.33 | 0.41 |
| S.D. | 11.76 | 8.83 | 6.11 | 0.98 | 9.85 | 0.37 | 75.34 | 0.37 | 0.06 | 4.64 | 1.77 | 15.30 | 0.31 | |
| Average | 71.58 | 16.48 | 11.94 | 5.78 | 12.71 | 0.64 | 169.67 | 0.49 | 0.08 | 10.74 | 3.04 | 30.95 | 0.44 | |
군집구조에서 확인된 바와 같이 상동나무의 자생지 생육환경은 난온대 상록활엽수림과 해안 곰솔림, 혼효림 크게 세 군집으로 구분되었다. 군집 I (곰의말채나무 군집) – 군집 IV (곰솔 해안림 군집)는 이질적인 집단으로 나타났으며, 군집 II (곰솔-녹나무 군집) - 군집 III (후박나무 군집)은 동질적인 집단으로 확인되었다.
토양이화학성 분석
상동나무 자생지의 군락별 토양이화학성을 분석한 결과(Table 6), 각 군집 간 토성은 모래, 미사, 점토가 군집 평균 각각 71.58%, 16.48%, 11.94%로 구성되어 있어 전반적으로 모래의 비율이 높은 사양토 및 사질양토로 나타났다. 이는 우리나라 평균 산림토양의 모래, 미사, 점토의 구성비 41.7%, 41.5%, 16.8% 대비 모래의 함량이 많고 미사는 적게 분포하는 사양토로 일반적인 산림토양과는 차이가 있었다(Ministry of Land, Infrastructure and Transport, 2017). 평균 pH의 경우 우리나라 산림토양 평균 pH 5.5와 유사한 경향을 보이고 있었으며, 이는 곶자왈지역 평균 pH 5.6 및 해안지역 평균 pH 5.56과 유사하게 나타나 상동나무는 약산성토양에 자생하는 것으로 확인되었다. 보비력의 지표인 유기물함량(OM)은 13.33~19.33 cmol+/㎏, 전질소함량(TN) 0.34~0.97% 수준으로 우리나라 산림토양 대비 높게 나타났다(Sung et al., 2013). 유효인산(P2O5)은 86.19~ 510.03 ㎎/㎏ 수준으로 상동나무의 생육환경은 비옥도가 높은 토양에서 자생하는 것으로 확인되었다. 치환성양이온은(Ex. C) 일반적인 산림토양과 같이 Ca2+ > Mg2+ > K+ > Na+ 순으로 감소하는 것으로 나타났으며, 양이온치환용량(CEC)은 15.03~39.61 cmol+/㎏로 우리나라 산림토양 평균치 16~20 cmol+/㎏ 수준보다 높게 나타났다. 이는 양이온치환용량(CEC)에 직접적인 영향을 끼치는 유기물함량(OM)이 높았기 때문으로 판단된다(Sung et al., 2013). 토양 내 식물의 염류장애를 판단하는 전기전도도(EC)는 0.22~0.63 ds/m의 범위로 내염성이 강한 곰솔 해안림 토양의 전기전도도(EC) 0.20~0.60 ds/m 수준에서 자생하고 있었다. 이러한 결과는 기존의 제주도, 전라남도 도서지역 상동나무 자생지 전기전도도(EC)와 유사한 경향을 띠고 있어 상동나무는 내염성 및 내조성이 높은 수종이며, 다양한 토양환경에서 적응하는 것으로 판단된다(Kim, 2010; Song et al., 2014). 상기 토양이화학성은 상동나무 생육에 직접적으로 영향을 미치는 구성요소로 자생지의 보존 및 증식에 대한 기초적인 자료로 활용될 수 있다.
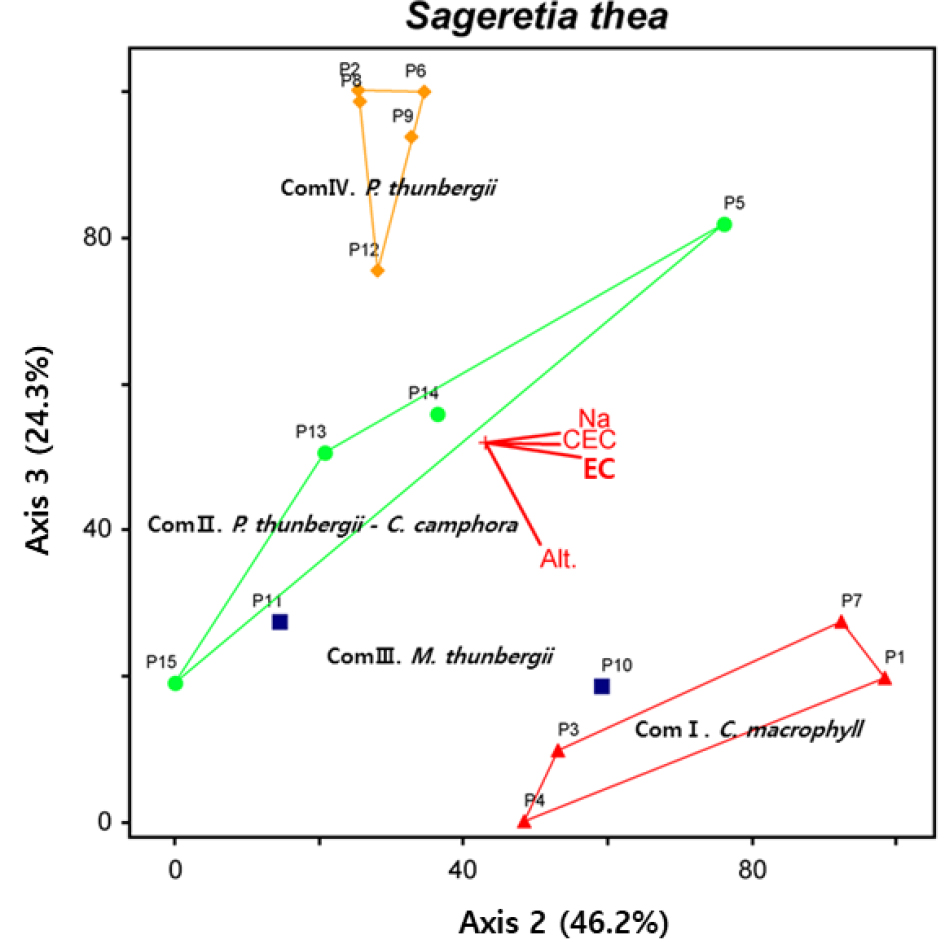
NMS 분석
상동나무 자생지 조사구를 바탕으로 군집, 입지환경 및 토양이화학성의 상관관계를 알아볼 수 있는 NMS 분석을 수행한 결과(Fig. 3), 1축, 2축 및 3축 모두 유의하지만 1축의 설명력이 6.4%로 낮게 나타났고, 2축과 3축의 설명력이 24.3%, 46.2% 확인되었으며, 종합설명력은 76.9%로 분석되었다. 군집을 구분하는 주요 환경인자로는 해발고가 가장 큰 영향을 미치는 것으로 나타났으며, 다음으로 전기전도도, 양이온치환용량, 치환성 나트륨이 주요 요인으로 나타났다. 구분된 군집은 종 구성 수준에서 군집 Ⅰ이 군집 IV와 매우 이질적인 집단으로 나타났으며, 군집 II와 군집 III이 유사한 종 구성을 나타내고 있어 본 연구에서 확인한 유사도 지수와 유사한 경향을 보였다.
상기 연구 결과를 종합하면, 상동나무의 자생지 생육환경은 제주, 남해안 도서 지역의 산지, 해안림, 난온대 상록활엽수림의 다양한 식생 구조의 비옥한 토양에서 자생하는 것으로 확인되었다. 이는 희귀식물인 꼬리진달래(Rhododendron micranthum), 꽃창포(Iris ensata)와 같이 제한된 입지환경에서만 자생하는 수종과 달리 상동나무는 다양한 조건에서 생육이 가능할 것으로 판단된다(Gwon et al., 2019; Kim et al., 2013). 하지만 상동나무가 자생하는 상록활엽수 군집과 곰솔-녹나무 군집, 곰솔 군집의 하층식생인 녹나무, 종가시나무, 구실잣밤나무 등 음수성 상록활엽수와 같은 식생 구조는 점진적으로 동아시아 난온대 기후대의 보편적 우점군락으로 천이할 것이며(Park et al., 2018; Song and Da, 2016), 이에 따라 울폐율이 증가하여 상동나무와 같은 내음성이 약한 관목이 대폭 감소하는 것으로 나타나(Kang et al., 2022), 장기적으로 상동나무의 임내 분포지는 축소될 것으로 판단된다. 상동나무는 높은 내염성과 내조성을 가지는 등 다양한 입지환경에 자생하고, 종자 발아율이 높으며, 분포역의 확산이 용이한 피식산포형에 속하므로 울폐율이 낮은 해안가와 임연부로 이동할 것으로 판단된다(Park et al., 2021; Song et al., 2015). 또한, 기후변화에 따른 서식지의 예측연구에서 상동나무와 서식처가 유사한 송악과 같은 난·온대성 상록활엽수종의 잠재 서식지가 남·서해안을 따라 분포역을 확장할 것으로 예측됨에 따라 상동나무도 이와 유사한 경향을 보일 것으로 판단된다(Park et al., 2016).
보전방안
일반적으로 재배 또는 자생하는 약용식물은 개체수가 많고 서식처의 범위가 다양하여 보전방안의 필요성이 낮은 것으로 인식될 수 있다. 하지만 최근 해수면의 상승, 폭풍, 강우량의 변화 등 기후변화에 적응하지 못하는 많은 식물이 절멸 위험에 노출되고 있으며, 남획과 같은 직접적 요인 등이 이를 가속화하고 있다(Hughes, 2000; Shim et al., 2020; Townsend et al., 2008). 이러한 사례로 과거 제주도에서 쉽게 접할 수 있던 흑오미자(Schisandra repanda)는 맛과 약리 효능으로 인해 무분별한 남획과 기후변화 등으로 서식지를 보호지역으로 설정하였으며, 산림청 희귀식물 CR (Critically Endangered) 등급으로 지정하여 관리하고 있다(Kim et al., 2010; Korea National Arboretum, 2021).
본 조사에서 확인된 상동나무 또한 우리나라 남해안과 제주도 일대 내에서 해안가에서 산지 일대의 다양한 입지환경 범위에서 자생하는 것으로 나타났다. 상동나무는 다양한 입지환경에서의 적응력이 높아 산지의 임연부나 해변 등 접근성이 좋은 지역에서 다수의 개체군을 확인할 수 있었다. 이러한 상동나무는 예로부터 남해안 도서지역, 제주도지역에서 열매를 식·약용으로 이용하였다(Chung et al., 2017). 최근에는 상동나무 열매, 줄기에 대한 다양한 효능이 밝혀지면서 중요성이 점차 높아지는 약용식물로 인식되고 있다. 이로 인하여 상동나무 대한 불법 남획 등으로 자생지에 대한 인위적인 훼손이 우려되는 실정이다.
따라서 유용 약용식물인 상동나무에 대한 보전방안으로는 기존에 이루어진 유·무성 번식 및 증식에 관한 연구와 자생지 입지환경에 관한 연구 등을 수행하여 다양한 보전방안을 제시할 필요가 있다. 생물다양성의 장기적 보전에 가장 좋은 방법은 현지 내 보전(in situ conservation)이 가장 좋은 전략으로 고려된다(Primack, 2004). 구체적인 방법으로 접근성이 용이한 자생지에 대해서는 무분별한 채취를 제한하는 보전방안의 마련이 필요하고, 대표적인 군락지에 대해서는 유전 다양성 보전을 위한 보호펜스 설치 등의 적극적인 보전전략을 수립하는 것도 고려되어야 할 것으로 판단된다. 또한, 현지 외 보전(ex situ conservation) 전략을 통하여 유용 약용식물의 다양한 개체군으로부터 유전 다양성을 확보하여 보전과 대량 증식법을 동시에 확립하는 연구가 필요할 것으로 생각된다. 기초적인 방법으로는 여러 지역에서 확보한 종자를 종자은행에 보관하여 유전 다양성을 보존할 수 있으며(Breman et al., 2021), 이를 기반으로 우수 개체를 선별하여 증식하는 채종원(seed orchard) 및 현지 외 보존원 구축 등의 방법으로 상동나무의 유전 다양성의 확보 및 산업화에 도움이 될 것으로 판단된다.
적 요
본 연구는 국내에 자생하는 상동나무 4지역 15조사구를 대상으로 입지환경과 식생 구조를 분석하여 상동나무의 생육에 적합한 생물·비생물적 요소를 구명하여 합리적인 보존 및 증식에 관한 자료로 활용하고자 수행하였다. 상동나무 자생지는 온·난대 상록활엽수림에 속하며 해발고 0~370 m, 경사 3~35°로 확인되었다. 군집구조는 곰의말채나무, 곰솔-녹나무, 후박나무, 곰솔 군집으로 구분되었다. 종다양성지수는(H’) 1.397~ 1.455, 균등도(J’) 0.972~0.986으로 나타났으며, 우점도(D)는 0.014~0.028로 다양한 종이 경쟁 관계를 가지는 안정적인 임분으로 나타났다. 토양이화학성 분석 결과, 토성은 모래의 비율이 높은 사양토, 사질양토에서 자생하였고, 이화학적 특성은 pH 5.28~5.98로 약산성으로 나타났으며, 유기물함량(OM) 13.33~ 19.33 cmol+/㎏, 전질소함량(TN) 0.34~0.97%, 유효인산(P2O5) 86.19~510.03 ㎎/㎏, 전기전도도(EC) 0.22~63 ds/m, 양이온치환용량(CEC) 및 치환성양이온(Ex. C)은 Ca2+ > Mg2+ > K+ > Na+ 순으로 일반적인 산림토양 대비 비옥도가 높은 토양에서 자생하는 것으로 나타났다. NMS 분석 결과, 상동나무의 군집구조와 환경요인과의 상관관계는 해발고, 전기전도도(EC), 양이온치환용량(CEC), 치환성 Na+이 주요 요인으로 나타났다. 본 연구 결과는 상동나무의 자생지 보존과 산업화 활용을 위한 대량생산 연구에 유용한 정보로 활용이 기대된다.