서 언
재료 및 방법
식물재료
황근 부정근 세포주 유도 및 증식
플라스크 및 생물반응기 현탁배양
시료 추출물의 제조
총 페놀 화합물, 플라보노이드 함량
DPPH radical 소거능
세포 배양 및 생존력 측정, 멜라닌 함량 분석
통계분석
결과 및 고찰
황근 부정근 세포주 유도 및 바이오매스 증식율
황근 부정근의 항산화 효능 스크리닝
황근 부정근의 미백 효능 스크리닝
적 요
서 언
황근(Hibiscus hamabo Sieb. et Zucc.)은 아욱과(Malvaceae)에 속하는 유일한 국내 자생 무궁화속 식물로서 주로 해안지대에서만 서식하는 낙엽성 떨기나무이다(Ahn, 2003). 겨울철 낮은 온도에 매우 약하여 전 세계적으로 한국, 일본, 대만 등지의 일부지역에만 서식지가 분포되어 있으며, 특히 국내에서는 중북부 지방에서 노지 월동이 불가능하여 제주특별자치도, 전라남도 완도 및 고흥지역에 분포한다고 알려져 있다(Chang et al., 2005; Park et al., 2019). 최근 해안가 매립, 인접지역 개발, 도로건설, 항만 건설 등으로 인해 황근의 자생지가 점차 파괴되어 야생 개체가 점차 감소하고 있다. 따라서 우리나라에서는 2012년 자연환경보전법에 의해 환경부 「멸종위기야생생물 II급」 및 한국 적색목록 내 준위협(Near Threatened, NT)으로 지정되어 국내 자생집단에 대한 적절한 보존대책을 필요로 하는 식물이다(Seo et al., 2021).
식물생명공학 기술을 이용한 식물의 세포, 조직, 기관배양은 연중 균일한 바이오매스 대량생산과 고품질 생리활성물질 확보가 가능한 가장 효율적인 방법 중 하나이다(Verpoorte et al., 2002). 이 중 식물 부정근 소재의 배양은 토마토의 뿌리정단부 액체배양을 최초로 하여 산삼, 에키네시아, 하수오, 지치 등의 소재가 연구 및 상용화가 이루어지고 있다(Ho et al., 2021; Lee et al., 2015a; Nosov, 2012; Wu et al., 2018). 생물반응기는 관행적 노지재배, 조직배양법의 단점인 노동력, 생산원가 절감을 위해 주목받는 대량배양시스템으로서, 식물 세포주 배양을 위해 무균 조건의 배지와 공기 공급을 통해 안정적이며 고품질 유지가 가능한 원료 안전성을 도모할 수 있다. 최근 식물세포공장 시스템 개발에 따른 생물반응기 내 온도, 공기공급량, 배지, 생장조절물질, 탄소원, pH 등의 환경조건을 조절법에 따른 소재 연구를 통해 바이오산업 원료 공급 파이프라인 구축이 가능하다(Murthy et al., 2020).
식물 세포주 원료를 이용한 천연물 산업은 항노화, 항산화, 항염증, UV보호, 항주름, 수분공급, 미백, 항알러지 등 피부 자극에 대한 완화효과를 비롯한 다양한 기능성 화장품 연구개발이 주목받고 있다(Georgiev et al., 2018). 2000년대에 들어서 멜라닌 색소 축적에 따른 피부 흑색화의 화학적, 생물학적 기작이 구명됨에 따라 미백 및 항산화에 관한 연구가 연계되어 수행되고 있다(Kligman, 2000). 산화적 스트레스(oxidative stress)는 피부의 노화에 직접적인 영향을 끼치며 지속적인 노출로 인해 체내 자유라디칼(free radical)이 증가하여 노화가 발생한다. 이러한 피부세포 내 자유라디칼에 따른 산화적 스트레스는 멜라닌 합성과정에서 티로시나아제(tyrosinase)를 활성화하여 기미, 주근깨 발생의 원인으로 알려져 있다(Kim et al., 2009). 따라서 피부세포 보호를 위해 식물 세포주 유래 천연소재를 이용한 항산화제, 멜라닌(melanin) 생합성 억제를 통한 피부 미백 등 완화제 개발과 관련된 연구가 이뤄지고 있다(Kim et al., 2020). 이에 따라 식물 세포주 소재 안전성을 기반으로 국내에서는 생약 성분을 기초로 다수의 기능성 향장품 제품이 개발되고 있다.
멸종위기야생생물 황근은 선행연구를 통해 종자 발아, 생태적, 유전적, 내염성, 항균활성 등의 특성에 대해 보고되었지만(Kwon et al., 2016; Ni et al., 2021; Ni et al., 2022; Sakhanokho et al., 2020; Wang et al., 2021; Yuan et al., 2019), 기내도입 후 생물반응기를 이용한 황근 세포주(캘러스, 부정근, 신초 등) 대량증식 체계 구축 및 기능성 향장품 효능 스크리닝에 대한 연구는 보고되지 않았다. 따라서 본 연구에서는 생물반응기, 배지 염 농도 구배를 이용하여 황근 부정근 세포주의 가장 효율적인 대량증식조건을 확인하기 위해 생체중, 건물중, 건물율, 생장율, 상대생장율을 조사하였다. 또한 DPPH 자유 라디칼 소거활성과 멜라닌 함량 스크리닝 분석을 수행하여 항산화, 미백 효능이 있는 기능성 화장품 소재로 활용 가능성을 확인하였다.
재료 및 방법
식물재료
본 연구에 사용된 황근은 환경부로부터 채취 허가를 받은 지역인 제주특별자치도 제주시 구좌읍 평대리 지역 내에 식재된 개체로부터 종자, 지상부 식물체 형태로 채취하였다. (재)제주테크노파크 생물종다양성연구소 제주 특산식물 세포주 은행 배양실에서 채취된 종자와 식물 절편체의 기내 세포주 유도를 위하여 표면을 수세한 후, 50 mL conical tube (Corning, NY, USA)에 종자 50립 또는 절편체 15∼20개체를 넣고 70% 에탄올(ethyl alcohol)로 30초간 소독하였으며, 2% 차아염소산나트륨(sodium hypochlorite) 용액에 15분간 침지시켜 표면살균을 실시하였다. 최종적으로 멸균수로 4-5회 세척한 후 1차 배양배지조건의 페트리디쉬에 치상하였다. 각각의 신초, 뿌리가 전개된 개체는 이로부터 2차 배양배지로 계대배양한 후 부정근 세포주로 재분화시키기 위하여 가장 생육이 좋은 부정근 절편체를 페트리디쉬, 플라스크 및 생물반응기에 8주간 배양 및 증식하여 실험재료로 사용하였다(Fig. 1, Table 1).

Fig. 1.
In vitro culture initiation of adventitious root and from wild seed of H. hamabo. A. Collection site with authorized certification; B. Seed germination in petridish; C. Solid culture (shooting, rooting); D. Liquid culture (250 mL Erlenmeyer flask); E. Liquid culture (5,000 mL air-lift balloon type bioreactor).
Table 1.
Plant materials and culture medium composition of H. hamabo
황근 부정근 세포주 유도 및 증식
황근의 종자 또는 절편체로부터 발아, 재분화시켜 유도된 부정근을 배양 후 증식하기 위해 MS배지(Murashige and Skoog, 1962)를 기본 염으로 각각 다른 3가지 농도(1/2배, 3/4배, 1배)로 배지를 사용하였다. 이에 자당(sucrose) 30 g/L, 고형화를 위한 겔라이트(gelrite or phytagel)를 2.3 g/L 첨가하였으며, 부정근의 유도에 필요한 식물생장조절물질로는 IBA (Indole-3-butyric acid, Duchefa, Haarlem, The Netherlands)를 사용하였다. pH는 5.7-5.8로 조정하였고, 121℃에서 20분간 고압멸균기(WACS-1100, Daihan Scientific, Seoul, Korea)를 사용하여 멸균 후 90 ㎜ 페트리디쉬(SPL Life Sciences, Pocheon, Korea)에 25-30 mL 씩 분주한 것을 배지로 사용하였다. 부정근 배양을 위해 약 2-3 ㎝ 크기의 부정근 절편체를 한 페트리디쉬에 6-8개씩 치상하였으며, 암조건에서 온도는 25 ± 1℃로 유지하여 3-5반복으로 8주간 수행하였다. 치상된 절편체는 배양이 완료된 후 유도 개수, 길이를 조사하여 각 식물생장조절물질 조건 별 부정근 증식 효율을 비교하였다. 최종 선발된 황근 부정근 세포주는 (재)제주테크노파크 생물종다양성연구소 세포주 은행(JBRI-S20-001, 002, 003)에 보존 및 계대배양하였다.
플라스크 및 생물반응기 현탁배양
황근 부정근의 최적 액체 현탁배양 조건을 선발하기 위하여 고체배지에서 유도 및 증식된 부정근 0.4 g (4 g/L)을 취해 MS 염농도를 각각 1/2배, 3/4배, 1배로 조절하고, 3% 자당(sucrose), IBA 2 ㎎/L를 첨가하고 pH를 5.7∼5.8로 조절한 액체배지 100 mL에 접종하였다. 삼각플라스크(Erlenmeyer flask)는 250 mL 크기를 선정하였으며, 배양조건은 8주간 100 rpm, 암조건으로 설정하여 진탕배양하였다. 플라스크에서 현탁배양되어 증식된 황근 부정근은 5,000 mL 규모의 공기부양식 생물반응기(air-lift balloon type bioreactor)에 4 L MS 액체배지(3가지 MS 배지 염농도 처리구, 2 ㎎/L IBA, 30 g/L sucrose, pH 5.8)와 함께 생체중 약 16 g (4 g/L)을 접종하여 배양을 실시하였다. 생물반응기 내 공기 주입량은 조절기(flow meter)를 통해 0.1 vvm (air volume/culture volume/min)으로 조절하였으며, 배양환경은 암조건 하에 8주간 실시하였다. 배양이 완료된 황근 부정근의 증식량을 측정하기 위해 생체중, 건물중, 건물율, 생장율, 상대생장율의 지표를 조사하였다. 황근 부정근 생체중의 경우, 정제수로 수세하여 표면을 깨끗하게 한 후에 흡습지를 이용하여 수분을 충분히 제거하여 측정하였고, 건물중은 부정근 생체를 40℃로 조절한 건조기에서 48시간 건조한 후 측정하였다. 건물율은 최종 수확 및 건조된 부정근의 건물중을 생체중으로 나누어 백분율로 표시하였다.
시료 추출물의 제조
시료 추출물은 황근 부정근 건조물은 분쇄된 분말을 각 10 g씩 취하여 200 mL의 70% 에탄올 및 80℃ 열수를 각각 용매로 하였고, 40℃로 설정된 초음파추출기(JAC-4020P, Hwaseong, Korea)에 부착된 추출용 삼각플라스크를 이용하여 2시간 동안 추출하였다. 추출이 완료된 추출액은 유리 깔때기(glass funnel)에 filter paper (Whatman No.2 110 ㎜, WhatmanTM, Kent, UK)를 이용하여 얻었으며, 20 mL로 정량하여 추출물을 조제하였다. 추출된 시료는 감압농축기(Genevac Inc., NY, USA)를 이용하여 용매를 제거한 후 (재)제주테크노파크 생물종다양성연구소 추출물 은행(JBRI-ES21-013, 014, 015)에 4℃ 조건으로 보관하였다. 황근 부정근의 총 페놀 화합물, 플라보노이드 함량, DPPH 라디칼 소거능, 멜라닌 함량 스크리닝을 위하여 각 추출물을 해당 용매로 용해시킨 후 0.2 ㎛ membrane filter (Advantec MFS Inc., CA, USA)로 제균하여 이용하였다.
총 페놀 화합물, 플라보노이드 함량
총 페놀 화합물 함량은 Folin-Ciocalteu 방법(Folin and Ciocalteu, 1927)에 따라 측정하였다. 황근 부정근의 70% 에탄올 및 열수 추출물과 gallic acid standard solution (Sigma-Aldrich, MO, USA)을 1 ㎎/mL 농도가 되도록 혼합한 후, 2 N인 Folin-Ciocalteu (Sigma-Aldrich, MO, USA) 50 μL를 첨가하였다. 3분 경과 후 2M Na2CO3용액 100 μL를 첨가한 후 증류수 300 μL를 가하여 실온에서 1시간 동안 암상태로 방치한 다음 상등액을 취하여 마이크로플레이트 리더기(Tecan, Salzburg, Austria)를 이용하여 725 ㎚에서 흡광도를 측정하였다. 총 플라보노이드 함량은 colorimetric 방법(Shohael et al., 2005)에 따라 측정하였다. 70% 에탄올 및 열수 추출물과 (+)-catechin standard solution (Sigma-Aldrich, MO, USA)을 1 ㎎/mL 농도로 혼합한 후, 0.4 mL의 증류수를 첨가한 후 5% NaNO2용액 30 μL를 첨가하였다. 5분 경과 후 30 μL의 10% AlCl3용액을 첨가하여 5분간 정치한 다음 1 M NaOH 용액 0.2 mL를 첨가하였다. 혼합액의 총량이 1 mL가 되도록 증류수를 첨가한 다음 마이크로플레이트 리더기를 이용하여 510 ㎚에서 흡광도를 측정하였다. 표준물질 용액의 검량선으로부터 추출액의 총 페놀 화합물과 플라보노이드 함량을 측정하였으며 함량은 ㎎/g DW로 나타내었다.
DPPH radical 소거능
황근의 자유 라디칼 소거능을 조사하기 위해 DPPH (1,1-diphenyl-2-picrylhydrazyl)를 이용한 방법(Brand-Williams et al., 1995)으로 측정하였다. 시료 추출물 0.375 mL와 메탄올에 녹인 200 μM DPPH (Sigma-Aldrich, MO, USA) 0.625 mL를 혼합하여 상온에서 10분간 방치한 후 마이크로플레이트 리더기(Tecan, Salzburg, Austria)를 이용하여 517 ㎚에서 흡광도를 측정하였다. 대조구는 70% 에탄올 또는 3차 증류수와 DPPH 용액을 첨가하여 얻은 값으로 사용하였으며, 표준품은 gallic acid standard solution (Sigma-Aldrich, MO, USA)를 사용하였다. DPPH 법에 의한 항산화 활성의 측정은 시료 첨가구와 대조구의 흡광도차를 백분율로 표시하였다.
세포 배양 및 생존력 측정, 멜라닌 함량 분석
B16F10 마우스 흑색종 세포는 37℃ CO2 조건에서 10% 열에 불활성화된 소태아혈청(Invitrogen, MA, USA)과 1% penicillin-streptomycin (Invitrogen, MA, USA)을 함유한 Dulbecco’s modified Eagle 배지 (Invitrogen, NY, USA)에서 배양하였다. 세포 생존력은 MTT 분석(Thermo Fisher Scientific, NY, USA)을 통해 실시되었다. MTT 용액을 4시간 동안 세포에 첨가한 후, DMSO를 이용하여 formazan 결정을 가용화시킨 후 마이크로플레이트 리더기(Tecan, Salzburg, Austria)를 이용하여 570 ㎚에서의 흡광도를 측정하였다.
멜라닌 함량은 선행연구 방법을 일부 수정하여 수행하였으며, 세포를 48시간 동안 α-MSH의 부재 또는 존재하에 다양한 농도의 샘플로 처리하였다(Hosoi et al., 1985). 원심분리(15,000 rpm, 5분)를 통해 세포를 회수한 후, 펠렛을 1N NaOH 및 10% DMSO에 80℃에서 30분 동안 용해시킨 후, 마이크로플레이트 리더기를 사용하여 475 ㎚에서 흡광도를 측정하였다.
통계분석
각 분석된 데이터의 통계분석은 SAS® Studio (SAS Institute Inc, Cary, NC, USA) program을 이용하여 Duncan의 다중검정(95% 수준)에 의해 처리하였고, 각 처리구별 3회 반복 데이터의 평균 ± 표준오차로 표시하였다.
결과 및 고찰
황근 부정근 세포주 유도 및 바이오매스 증식율
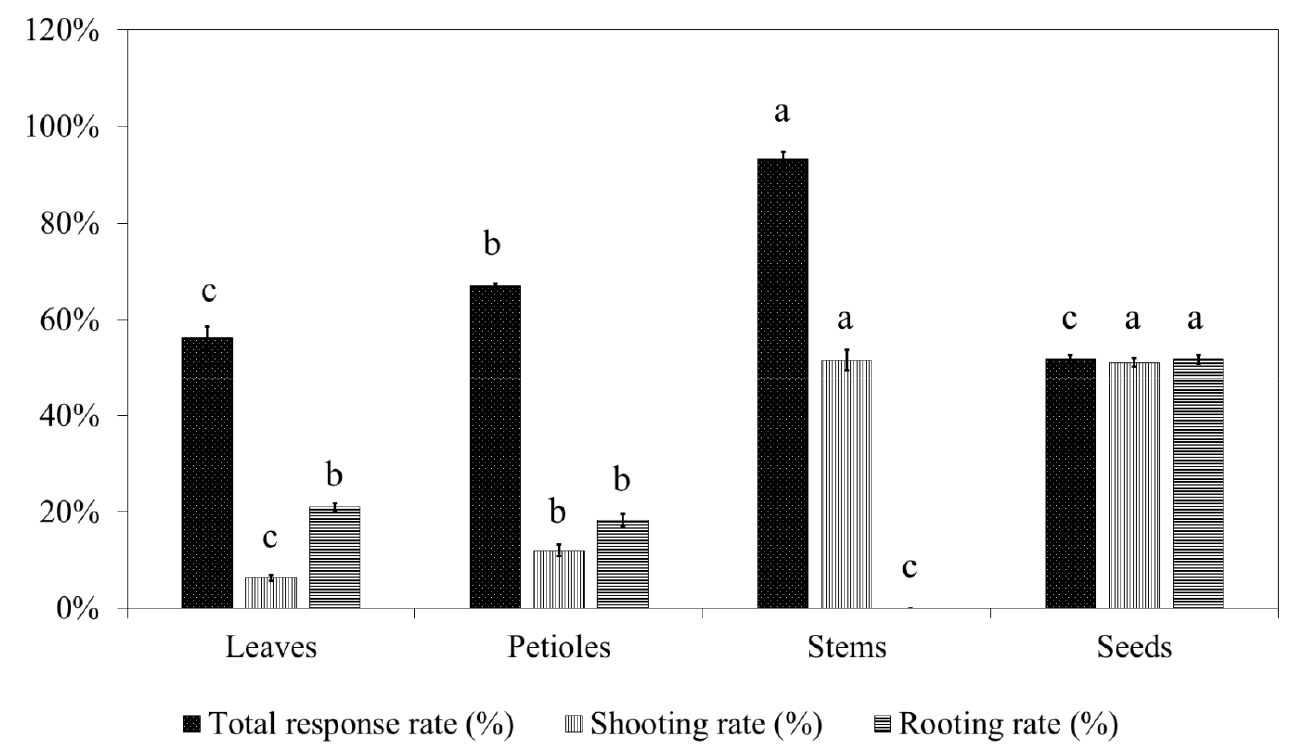
야생 환경에서 채집한 황근을 기내 세포주로 유도하고 재분화 효율을 조사하기 위하여 식물체의 잎, 잎자루, 줄기, 종자로 재료를 달리하여 조사하였다(Fig. 2). 그 결과 반응율은 줄기 절편체에서 93.33%로 가장 높았으나 신초 발생에만 국한되었고, 지상부 신초 발생 및 지하부 뿌리 발근의 전반적인 효율 측면에서는 종자가 51.17∼51.83%로 가장 효율적인 것으로 나타났다. 지상부 절편체인 잎, 잎자루, 줄기에서는 새로운 개체로 재분화되기 위한 반응율은 종자보다 높은 경향성을 띄었으나 배와 배유를 가진 종자에 비해 완전한 식물 개체로 성장하기 위한 단계까지 못 미치는 것을 확인할 수 있었다. 또한 지상부 절편체로부터 신초 및 부정근이 재분화된 개체는 2차 선발 배지로 계대배양 후 증식과정에서 대부분 고사하였다. 따라서 멸종위기야생생물인 황근은 종자를 채종한 후 표면살균하여 기내 발아 후 완전한 식물 개체로 생장하는 것이 가장 효율적인 증식 체계인 것으로 판단된다. 또한 황근 자원의 현지 외 보존(ex situ conservation)방법 중 종자 및 영양체 보존을 통해 간편하면서도 효율적이며 영속적인 보존 및 보전이 병행되어 가능할 것이라 생각된다(Coelho et al., 2020; Souza et al., 2017).
생물반응기에서 옥신(Auxin) 기반 배지 염농도에 따른 황근 부정근 생장을 분석하기 위해 생체중, 건물중, 건물율, 생장율, 상대생장율을 조사하였다(Table 2). MS배지 염농도를 1/2배, 3/4배, 1배로 달리하여 황근 부정근의 바이오매스를 비교한 결과, 1/2MS 염농도에 2 ㎎/mL IBA를 처리한 배지조건에서 1MS 처리구에 비해 생체중 3.65배, 건물중 3.86배, 생장율 4.81배, 상대생장율 2.09배가 높은 것으로 확인하였다. 그러나 건물율은 3/4MS 처리구에서 7.83%로 1/2MS 및 1MS 처리구보다 유의적으로 높은 것으로 측정되었다. 또한 황근 부정근 바이오매스 확보 수율이 가장 높은 1/2 MS, 2 ㎎/L IBA, 30 g/L sucrose 배지조건으로 4회차까지 계대배양한 결과, 생체중은 1회차 대비 104∼110% 증가되는 경향을 보인 반면 건물중 측정에 따른 건물율은 59∼62%로 감소된 것을 확인하였다.
섬오갈피나무, 에키네시아, 서양고추나물 부정근의 경우, 생물반응기에서 배양할 때 1/2MS 이하 농도에서 생장량이 가장 높아 본 연구와 비슷한 결과를 나타내었다(Cui et al., 2010; Lee et al., 2015b; Murthy et al., 2020). 그러나 황기, 땃두릅나무의 부정근은 1MS 이상의 농도가 생장에 가장 적합한 것으로 나타나 본 실험과는 다른 경향을 나타내었다(Wu et al., 2011; Jiang et al., 2015). 이는 생물반응기를 통해 배양되는 부정근 세포주에 공급되는 공기량, 배지 무기물 및 유기물 함량, 삼투몰랄농도(osmolality), 생장조절물질 조절에 의해 기관형성 및 생장에 미치는 영향이 다른 특성 때문인 것으로 보여진다(Amiarouche et al., 1985; George et al., 1988; Hasan et al., 2014; Liu and Zhong, 1997). 이상의 결과를 종합하였을때 황근 부정근 유도, 측근 형성 및 길이 신장 등의 핵심 지표는 MS 농도에 따른 요구도, 자당 투여와 삼투압에 따른 세포 생장 억제 여부, IBA 첨가에 따른 뿌리 근원기 유도 및 생장이 크게 영향을 끼치는 것으로 판단된다.
Table 2.
Effect of medium composition on H. hamabo adventitious root biomass growth characteristics in 5,000 mL bioreactor
zGrowth index (GI) = [Final fresh weight (g) - Initial fresh weight (g)] / Initial fresh weight (g).
황근 부정근의 항산화 효능 스크리닝
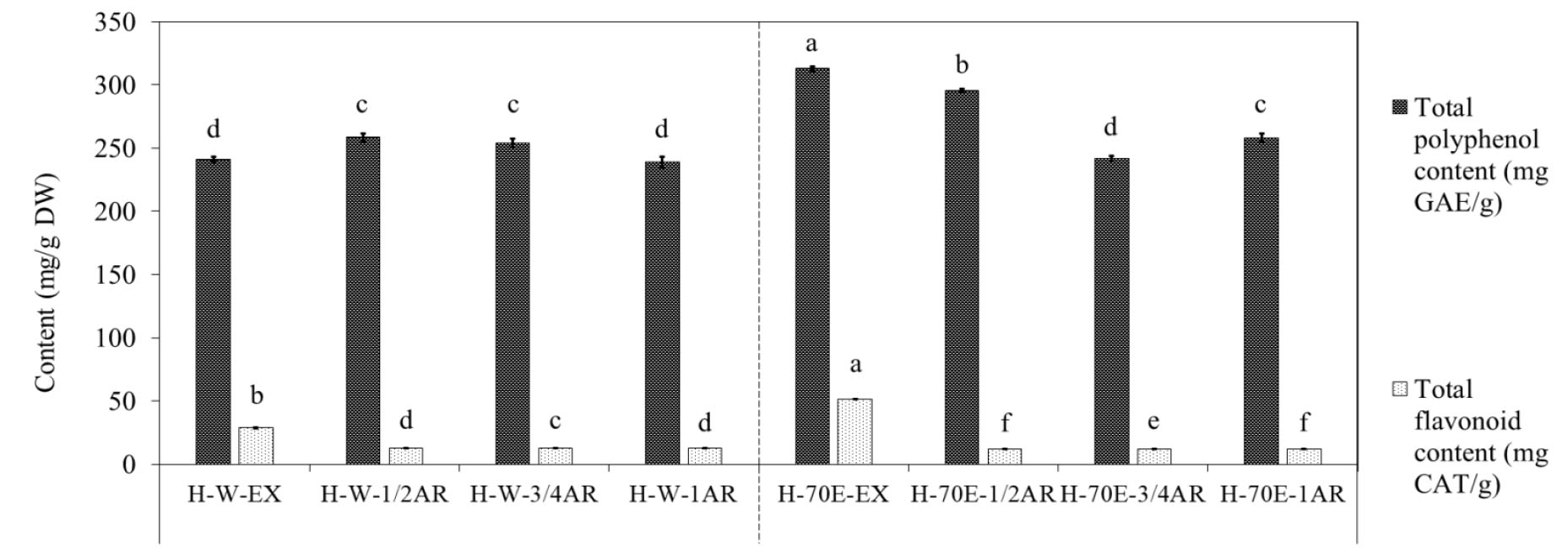
생물반응기에서 배양된 황근 부정근을 수확 및 추출물 제작 후 생리활성물질 축적 및 활성산소 제거능에 따른 항산화 효능을 분석하고자 총 페놀 화합물 함량, 총 플라보노이드 함량, DPPH 자유 라디칼 소거능을 조사하였다. 그 결과, 바이오매스 생장 결과와 연계하여 1/2 MS 염농도, 2 ㎎/L IBA 조건에서 배양된 황근 부정근 70% 에탄올 추출 처리구(H-70E-1/2AR)에서 총 페놀 화합물 함량이 295.50 ㎎/g DW로 야생 황근 70% 에탄올 추출 처리구(H-70E-EX) 함량의 94.45% 수준을 보였다. 그러나 나머지 기내 부정근의 70% 에탄올 추출 및 열수 추출 처리구에서는 76.33∼82.68%로 유의적으로 낮은 함량으로 분석되었다. 그러나 총 플라보노이드 함량의 경우, 야생 황근 70% 에탄올 추출 처리구(H-70E-EX)에서 51.36 ㎎/g DW, 야생 황근 열수 추출 처리구(H-W-EX)에서 28.69 ㎎/g DW 순으로 높게 분석되었으나 모든 기내 부정근 추출 처리구 MS 배지 염 농도와 상관없이 야생에 비해 23.22∼25.16% 수준으로 현저히 낮은 함량을 나타냈다(Fig. 3).
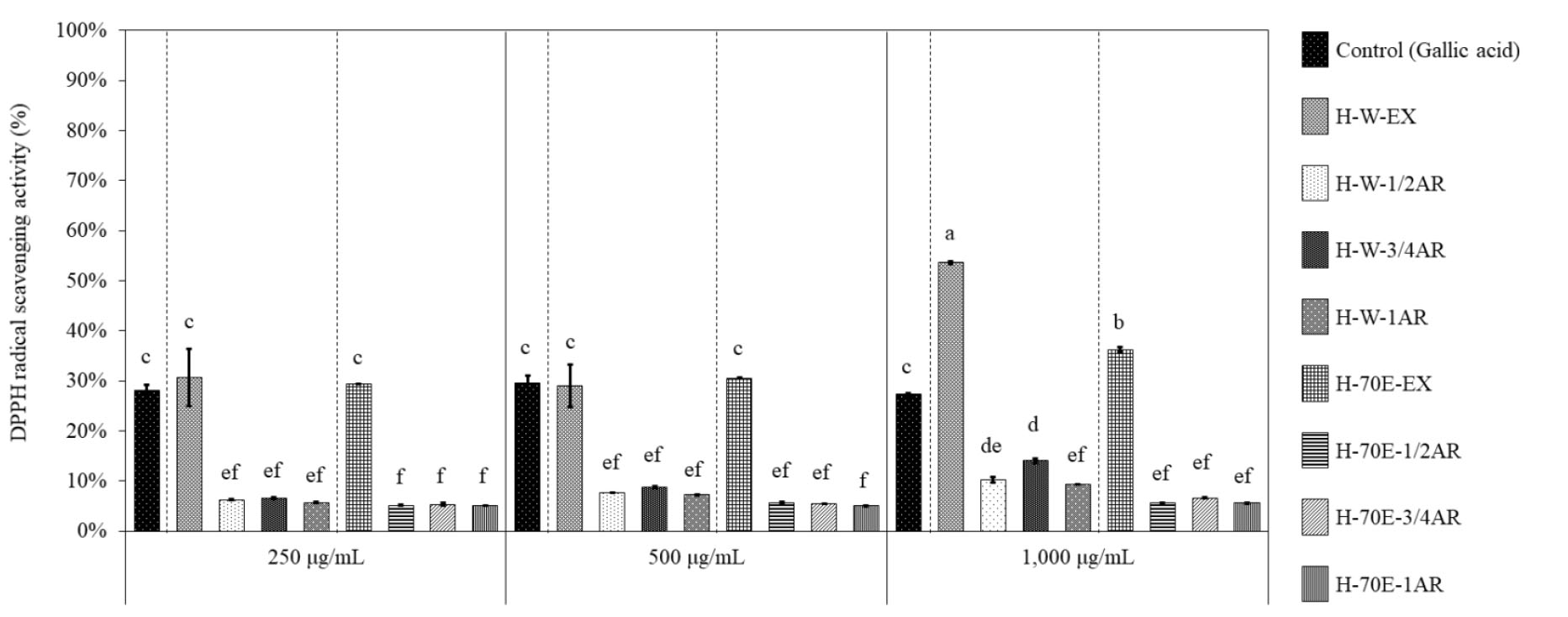
DPPH 자유 라디칼 소거능 분석법은 안정한 자유 라디칼 물질의 발색 원리를 기반으로 하여 간편하게 천연물 항산화 활성 측정이 가능한 방법이다. 본 방법을 통해 항산화능을 확인한 결과, 1,000 ㎍/mL 농도의 야생 황근 추출물의 처리구에서 표준품인 Gallic acid의 27.34%에 대비하여 열수는 1.96배, 70% 에탄올은 1.33배로 비교 우위를 가지는 소거능을 나타냈다. 그러나 기내 조건에서는 1,000 ㎍/mL 농도의 황근 부정근 열수 추출물 처리구에서 각각 10.28% (H-W-1/2AR), 14.05% (H-W-3/4AR), 9.41% (H-W-1AR)으로 상대적으로 낮게 분석되었고 나머지 농도 및 처리구에서는 낮은 활성산소 제거능으로서 유의적으로 큰 차이를 나타내지 않았다(Fig. 4).
식물은 주로 활성산소 등 외부 환경의 산화적 스트레스에 반응하여 방어기작으로서 축적하는 페놀 화합물(phenolics) 및 플라보노이드(flavonoid)는 방향족 벤젠고리와 히드록시 그룹으로 분자구조를 이루고 있으며 주로 약용식물 등에서 항산화, 항염증 등의 생리활성 효능을 가진 2차대사산물이다(Rahmat and Kang, 2019). 일반적으로 생리활성물질 함량 축적과 활성산소 제거능은 스트레스 지표와 직접적으로 연관되어 있으므로 비례관계가 성립된다고 할 수 있다(Heim et al., 2002). 땃두릅나무 부정근에 methyl jasmonate (MeJA)를 처리하였을 때 quercetin, kaempferide 등의 flavonoid 함량 증가와 DPPH IC50 값이 6.2 ㎍/mL로 높은 항산화 효능을 보였으며, 접시꽃 캘러스 추출물 5 ㎎/mL 처리 시 81.51%의 자유 라디칼 소거능이 있다고 보고되었다(Han et al., 2019; Lee et al., 2018). 따라서 황근 부정근 세포주는 배지 염 농도(1/2 MS), 생장조절물질 농도(2 ㎎/L IBA)의 처리를 통해 배양했을 때, 생리활성물질 및 항산화 효능이 정의 상관관계를 보여 가장 적합한 배지조건이라고 판단된다. 또한 부정근에 축적된 페놀 화합물, 플라보노이드 등은 각 생리활성물질의 종류, 구조 등의 차이로 인해 선행연구와 다른 경향을 나타낸 것으로 생각된다. 그러므로 황근 부정근 세포주에 salicylic acid, methyl jasmonate 등의 elicitation 처리, 추출물의 분획, 물질 분리를 통해 특정 지표성분에 따른 천연물 소재 활용에 대한 추가 연구가 필요하다.
황근 부정근의 미백 효능 스크리닝
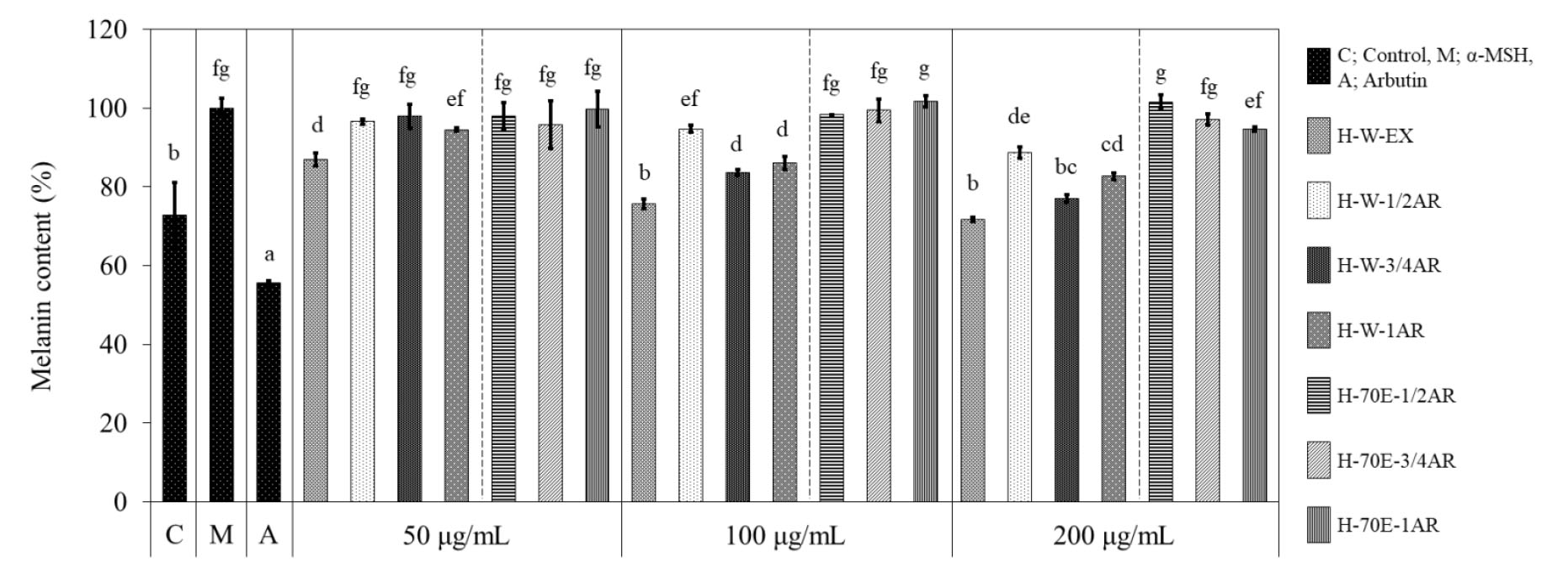
황근 부정근 추출물 처리에 따른 세포 내 α-MSH의 부재 또는 존재 여부를 확인하여 멜라닌 함량을 475 ㎚ 파장대에서 분석하여 미백 효능을 분석하였다. 추출물 200 ㎍/mL 처리하였을 때, 야생 열수 추출물(H-W-EX)에서 71.66%로 가장 좋은 효과를 보였으며 3/4MS 열수 추출물(H-W-3/4AR)은 76.91%, 1MS 열수 추출물(H-W-1AR)은 82.60%, 1/2MS 열수 추출물(H-W-1/2AR) 순으로 높았다(Fig. 5). 이에 반해 70% 에탄올 추출물은 처리 농도에 관계없이 열수 추출물보다 낮은 효과를 나타내었다. 따라서 황근 부정근 세포주의 멜라닌 생성 억제능은 열수로 추출하였을 때 유의적으로 높은 수율을 나타내어 미백 기능성 소재로서의 활용 가능성을 확인하였다.
멜라닌 색소 생합성과 연관되어있는 티로시나아제는 티로신(tyrosine)으로부터 DOPA, DOPA-quinone의 합성 경로를 통해 흑갈색의 멜라닌 색소를 생성하는 효소로써 피부세포 내에 암갈색을 띄는 색소 침착이 되는데 원인 중 하나의 물질로 알려져 있다(Hearing and Jimenez, 1987; Lee et al., 2021). 산삼 부정근(배양근)의 멜라닌 생합성 억제능은 76.3%으로 측정되어 황근 부정근 세포주와의 비슷한 효과를 나타내었으며, 80% 에탄올 추출물 1,000 ㎍/mL 농도 처리 시에 티로시나아제의 41.55% 저해활성이 나타나 미백 기능성 화장품으로의 활용 가능성을 보고하였다(Jeong, 2007; Ko et al., 2018). 또한 접시꽃 캘러스의 10 ㎎/mL 추출물 농도에서 51% 가량, 알로에 베라 부정근은 28.49% 가량의 티로시나아제 활성 저해능이 확인되었다(Kim et al., 2020; Lee et al., 2018). 이상의 결과를 종합하였을 때 황근 부정근 세포주의 생리활성물질은 티로시나아제 억제제로서 피부 멜라닌 색소침착을 예방할 수 있는 미백 기능성 소재 활용 가능성을 시사하고 있다고 판단된다. 따라서 본 연구 결과 및 추가 연구를 통해 황근 부정근 세포주 추출물의 생리활성물질은 항산화 뿐만 피부 미백 기능성 소재로서 관련 제품개발의 이용가치가 높은 원료로 활용될 기초 연구자료가 될 것으로 판단된다.
따라서 본 연구를 통해 제주도 자생 멸종위기야생생물인 황근 개체로부터 재분화된 부정근 세포주를 생물반응기 시스템을 통해 기존 배양방법 대비 효율적인 대량증식체계를 확립하여 서식지 외 보존 및 대량증식의 한계점을 극복하였다. 또한 황근 부정근 소재의 항산화, 미백 효능을 확인하여 기능성 화장품 산업에서 연중 계획적으로 표준화된 원료 생산이 가능한 파이프라인을 마련하였다. 그러므로 추가 기전 연구를 통해 기능성 생리활성물질 탐색, 지표성분 분리, 물질 정량 및 정성분석, 관련 유전자 경로 분석 등 황근 부정근 세포주의 핵심 기능성 2차대사산물 구명이 필요하다고 사료된다.
적 요
황근(Hibiscus hamabo Sieb. et Zucc., 노랑무궁화)은 주로 제주도 전역과 전남 남부지역에 자생하는 우리나라 유일의 야생 무궁화속의 낙엽성 반관목식물이다. 최근 무분별한 자생지 파괴에 따른 개체수 감소로 환경부 지정 한국적색목록 내 멸종위기야생생물 2급으로 지정되어 있다. 선행연구에서는 황근의 종자발아, 생태 및 유전적 특성, 내염성 등이 보고되었다. 따라서 본 연구에서는 생물반응기를 이용하여 황근 부정근의 대량증식, 항산화 및 미백효과를 조사하여 기능성 원료 활용 평가를 실시하였다. 황근 종자 및 식물체는 사전 환경부 채취 허가를 받은 제주시 구좌읍 관내지역에서 채집하였으며, 표면살균 후 MS 등 배지 조성을 조절하여 기내 세포주로 도입하였다. 그 결과, 종자의 전반적인 반응율이 지상부 신초 발생 및 지하부 뿌리 발근 측면에서 51.17∼51.83%로 가장 효율적인 것으로 나타났다. 5,000 mL 생물반응기에서 황근 부정근의 증식에 유리한 배지조건의 경우, 1/2 MS (Murashige and Skoog, 1962), 30 g/L 자당(sucrose), 2 ㎎/L IBA (indole-3-butyric acid)에서 8주 동안 배양한 것임을 확인하였다. 또한 총 페놀 화합물 함량, 총 플라보노이드 함량, DPPH 자유 라디칼 소거능 및 멜라닌 함량 분석을 통해 바이오매스 및 2차대사산물 축적의 연관관계를 비교하였다. 본 연구를 통해 황근 부정근의 대량증식, 항산화 및 미백 효능은 고부가가치 향장품 산업의 고품질 소재개발과 연계하여 추가적인 생리활성물질 연구의 가능성을 시사한다.