서 언
재료 및 방법
실험재료
추출물 제조
세포배양
Oil red O 염색
MTT assay
SDS-PAGE 및 Western blot 분석
Reverse transcriptase-polymerase chain reaction (RT- PCR)
통계분석
결과 및 고찰
산양삼의 HepG-2세포에서 LXR𝛼 agonist에 의해 유도되는 지질 및 중성지질 억제활성
산양삼의 HepG-2세포에서 LXR𝛼 agonist에 의해 유도되는 지질형성 관련 인자 발현 억제활성
산양삼의 AMPK 신호전달 활성화 유도 활성
적 요
서 언
비알코올성 지방간(Non-alcoholic fatty liver disease, NAFLD)은 가장 흔한 만성 간질환으로 비만, 당뇨병 등 대사증후군과 함께 그 유병률이 급격히 증가하고 있다(Goyal et al., 2020). 전 세계적으로 NAFLD의 유병률은 인구의 25%로 추정되고 있으며, 우리나라에서도 NAFLD의 발병률이 꾸준히 증가하여 성인의 유병률은 30.3%로 추정되고 있다(Im et al., 2021; Younossi et al., 2018; Younossi, 2019).
NAFLD는 단순 간 지방증에서 비알코올성 지방간염에 이르는 질병 스펙트럼을 나타내는 간질환으로 간의 비정상적인 지질축적을 특징으로 한다. 간의 비정상적인 지질축적은 지방산 흡수 증가, 지방 생성 증가 또는 지방산 산화 감소로 기인된다고 알려져 있다(Clark, 2006; Koo, 2013). 또한 비만은 인슐린 저항성을 야기하여 간에 지질축적을 유발하여 NAFLD의 진행을 촉진시킨다(Brownin et al., 2004; Koo, 2013). NAFLD의 지속에 의해 유발되는 간 염증은 만성 간염, 간 섬유화, 간경변으로 발전하고 결국 간암으로 진행된다(Koo, 2013). 그리하여 많은 연구자들이 NAFLD 치료제를 개발하려고 시도하였으나 아직까지 승인된 치료제는 없는 실정이다(Pydyn et al., 2020). 비록 NAFLD의 치료를 위해 인슐린 감작제인 티아졸리딘디온 및 메트포르민과 같은 항당뇨제, 셀레늄 및 비타민 C와 같은 항산화제, 아토르바스타틴과 같은 지질강하제, 우르소데옥시콜산과 같은 간보호제를 사용하고 있으나, 그들의 부작용으로 인해 장기적 사용이 불가능한 실정이다(Dujic et al., 2016; Pydyn et al., 2020; Takahashi et al., 2015). 그리하여 부작용이 없는 NAFLD의 치료제 개발을 위해 천연자원에 대한 관심이 높아지고 있다(Bacanli et al., 2019).
산양삼은 사포닌계 물질인 ginsenosides와 그 외에 polyacetylenes, phenolics, acidic polysaccharides, peptides, alkaloid, amino acids 유도체(Kim et al., 1987; Park, 1996) 등 의 유효성분을 포함하는 것으로 알려져 있다. 현재까지 산양삼 효능은 항산화(Kang et al., 2016; Lee et al., 2017), 항암(Kim et al., 2004), 혈중지질개선, 혈당강하, 항당뇨(Kim et al., 2012), 항염증(Lee et al., 2017), 면역 증진(Jung et al., 2019; Kwon and Chung, 2004), 간 보호(Lee et al., 2008) 등이 있는 것으로 알려져 있으며 재배삼에 비해 약리 효능 및 ginsenosides 함량이 높은 것으로 보고되어 효능 또한 뛰어남을 인정받고 있다 (Kim et al., 2020). 본 연구에서는 산양삼의 비알코올성 지방간에 대한 억제활성을 평가하기 위해 산양삼의 LXR agonist에 의한 과도한 지질축적 억제와 그 작용기전을 구명하였다.
재료 및 방법
실험재료
세포배양에 필요한 배지인 DMEM/F-12는 Lonza (Morristown, NJ, USA)에서 구매하였다. 지질축적유도와 지질축적도 확인을 위해 사용된 LXR agonist인 T09013170과 Oil Red O staining solution은 Sigma-Aldrich (St. Louis, MO, USA)에서 구매하였다. Western blot을 위한 분석용 일/이차 항체들은 Cell Signaling Technology (Danvers, MA, USA)에서 구매하였다.
추출물 제조
연구에 사용된 시료는 산양삼은 경북 영주시 풍기읍에 위치한 국립산림과학원 산림약용자원연구소에서 제공받았다. 동결건조 후 분쇄된 산양삼(WSG, 7년근) 1 g을 20 mL 증류수에 침지하여 40℃의 water bath에서 24시간 동안 추출하였다. 추출물은 15,000 rpm에서 20분간 원심분리를 진행하였으며 상등액만을 동결건조하여 산양삼 추출물(WSG)을 제조하였다. WSG (획득수율: 16.8%)는 -80℃의 냉동고에 보관하며 연구를 위한 시료로 사용되었다.
세포배양
본 연구에 사용된 인간 간세포인 HepG-2 세포는 American Type Culture Collection (Manassas, VA, USA)에서 구매하였다. HepG-2 세포는 10% Fetal bovine serum, 100 U/mL penicillin과 100 ㎍/mL streptomycin이 함유된 DMEM/F-12 배지를 이용하여 37℃, 5% CO2 하에서 배양되었다.
Oil red O 염색
HepG-2 세포를 6-well plate에 분주한 후 24시간 배양하였다. 24시간 후 WSG를 2시간 동안 전처리 후 LXR agonist인 T09013170을 처리하고 48시간 배양하였다. 48시간 후 HepG-2 세포를 1 × phosphate-buffered saline (PBS)로 2회 세척 하였다. 실온에서 10% formalin으로 1시간 동안 고정한 후, 증류수로 2회 세척하여 건조한 뒤, 60% isopropanol를 사용하여 5분간 실온에 두었다. 5분 후, HepG-2 세포를 완전히 건조한 다음, 실온에서 60% isopropanol : 40% water 비율로 제조한 Oil Red O 용액을 사용하여 세포를 20분간 염색하였다. 염색 후, 증류수로 5회 세척한 뒤, HepG-2 세포에 염색된 지질 방울을 광학현미경(Olympus, Tokyo, Japan)으로 촬영하였다. 촬영 후, 염색된 지질 방울은 100% isopropanol을 사용해 용출시켜 96-well에 100 μL씩 분주하여 UV/Visible spectrophotometer (Xma- 3000PC, Human Corporation Co., Seoul, Korea)를 이용하여 500 ㎚에서 흡광도를 측정하였다.
MTT assay
WSG의 HepG-2세포에 대한 세포 생존율은 MTT assay로 측정하였다(Seo and Jeong, 2020). HepG-2세포를 96-well plate에 배양하여 세포가 well에 90% 이상 찼을 때, WSG를 농도별 처리하고 24시간 동안 배양시켰다. 24시간 후, 각 well에 MTT 용액(1 ㎎/mL)을 50 μL씩 첨가하고 4시간 반응시킨 후, 상등액을 제거하고 DMSO를 100 μL씩 각well에 첨가하여 녹인 후 UV/ Visible spectrophotometer (Xma-3000PC, Human Corporation Co., Seoul, Korea)를 이용하여 570 ㎚에서 흡광도를 측정하였다.
SDS-PAGE 및 Western blot 분석
세포로부터 단백질을 추출하기 위해, 처리 후 세포를 4℃에서 유지된 1 × phosphate-buffered saline (PBS)로 2회 세척한 후, protease inhibitor cocktail (Sigma-Aldrich Co.)과 phosphatase inhibitor cocktail (Sigma-Aldrich Co.)이 포함된 radioimmunoprecipitation buffer (Boston Bio Products, Ashland, MA, USA)를 4℃에서 30분간 처리하여 단백질을 추출하였다. 추출된 단백질은 Bicinchoninic acid protein assay (Pierce Biotechnology Inc., Waltham, MA, USA)로 정량분석 후, 동일량의 단백질을 10% SDS-acrylamide gel로 전기영동하고 PVDF membrane (Bio-Rad, Hercules, CA, USA)에 이동시킨 후 5% non-fat dry milk로 상온에서 1시간 동안 blocking 하였다. 1시간 후, 1차 항체를 5% non-fat dry milk에 용해시켜 4℃에서 16시간 동안 반응시킨 후 membrane을 0.05% tween-20이 포함된 tris-buffered saline (TBS-T)로 5분간 3회 세척하였다. 그 후 2차 항체는 5% non-fat dry milk에 용해시켜 membrane에 상온에서 1시간 처리하였고, TBS-T로 5분간 3회 세척 후 membrane은 ECL western blotting substrate (Amersham Biosciences Co., Little Chalfont, England)를 이용하여 단백질을 확인하였다.
Reverse transcriptase-polymerase chain reaction (RT- PCR)
세포에서 RNA를 추출하기 위해서 세포를 4℃에서 유지된 1 × PBS로 2회 세척한 후, RNeasy Mini kit (QIAGEN GmbH., Hilden, Germany)를 이용하여 total RNA를 추출하였다. 1 ㎍의 total RNA를 Verso cDNA synthesis kit (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 cDNA를 합성하였다. PCR은 PCR Master Mix Kit (Promega Co., Madison, WI, USA)를 이용하여 수행되었고, 사용된 primer는 Table 1과 같다.
Table 1.
Sequence of oligonucleotide primers used for RT-PCR
통계분석
모든 결과는 3 회 반복 측정 후 평균 ± 표준편차로 나타내었고, 처리간 유의성은 Student’s t-test로 검증하여 p-value 값이 0.05 미만일 때 통계적으로 유의하다고 판정하였다(Microsoft Exel 2010, Microsoft, Redmond, WA, USA).
결과 및 고찰
산양삼의 HepG-2세포에서 LXR𝛼 agonist에 의해 유도되는 지질 및 중성지질 억제활성
산양삼이 간세포 내의 지질축적에 영향을 미치는지 평가하기 위해 간세포인 HepG-2세포에 산양삼과 지질형성 유도제인 T09013170 (LXR agonist)을 처리하고 지질 방울 형성과 중성지질 함량을 Oil-Red O staining과 중성지질 정량 분석으로 측정하였다. 그 결과, T0901317만 처리된 세포에서는 지질 방울 및 중성지질의 축적이 증가하였으나 T0901317 존재 하 산양삼의 처리는 T0901317에 의해 유도되는 간세포 내 지질방울과 중성지질의 축적이 농도 의존적으로 감소하였다(Fig. 1A). 산양삼의 지질방울과 중성지질 축적 억제가 세포독성에 기인한 것으로 확인하기 위해 산양삼이 HepG-2에 독성을 나타내는지 MTT assay로 분석한 결과, 산양삼은 활성범위에서 HepG-2세포에 독성을 나타내지 않았다(Fig. 1B). 본 결과를 미루어 볼 때, 산양삼은 간세포 내 과도한 지질방울 형성 및 중성지질의 축적을 억제하고 이것은 산양삼은 비알코올성 지방간을 억제하는 것을 보여준다.
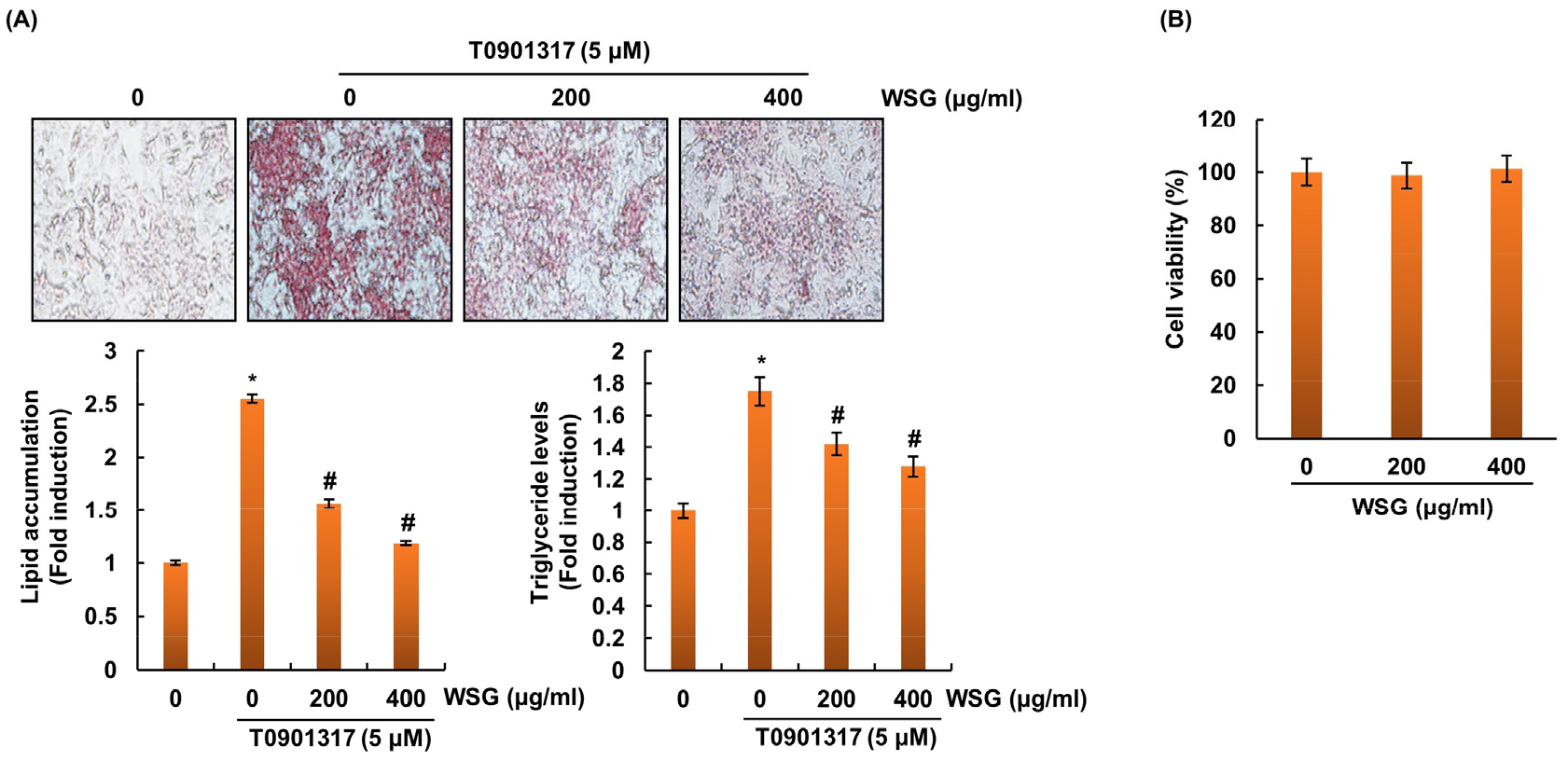
Fig. 1.
Effect of WSG on lipid accumulation in HepG2 cells. (A) Representative images of oil red O stained HepG2 cells. HepG2 cells were pretreated with WSG for 2 h and then with T0901317 (5 μM) for 48 h. The effect of WSG on lipid droplet formation was determined by assessing oil red O staining. Magnification 100×. Intracellular triglyceride contents were measured using a triglyceride assay kit. Graphs are presented as the means ± SDs of triplicate experiments. *p < 0.001 versus vehicle-treated controls; #p < 0.001 versus T0901317. (B) WSG was treated with HepG-2 cells for 24 h. Cell viability was performed using MTT assay.
산양삼의 HepG-2세포에서 LXR𝛼 agonist에 의해 유도되는 지질형성 관련 인자 발현 억제활성
Liver X receptor (LXR)인 LXRα 및 LXRβ는 nuclear receptor family에 속하는 리간드 활성화 전사 인자로 콜레스테롤 및 지질 대사의 주요 조절자로 알려져 있다(Steffensen and Gustafsson, 2004). 간에서 LXR 활성화는 sterol regulatory element-binding protein 1c (SREBP-1c), acetyl-CoA carboxylase (ACC), fatty acid synthase (FAS) 및 stearoyl- coenzyme A desaturase 1 (SCD-1)과 같은 인자의 발현을 유도하여 지질 생성을 촉진한다고 보고되고 있다(Liu et al., 2012). LXR 중 LXRα는 간의 중성지질 축적을 촉진하며, LXRα의 활성화 억제는 비알코올성 지방간을 치료하고 예방하는 주요한 표적인자로 여겨지고 있다(Liu et al., 2012). 그리하여 산양삼이 LXRα 활성제(T0901317)에 의해 유도되는 SREBP-1c의 발현을 억제하는지 검증하였다. 그 결과 산양삼 추출물은 LXRα 활성제(T0901317)의해 유도되는 SREBP-1c의 발현을 농도의존적으로 감소시켰다(Fig. 2A). 또한 SREBP-1c는 지질형성을 유도하는 ACC, FAS 및 SCD-1와 같은 인자의 발현을 유도한다고 알려져 있다(Liu et al., 2012). 그리하여 산양삼이 LXRα 활성제(T0 901317)에 의해 유도되는 ACC, FAS 및 SCD-1의 발현을 억제하는지 검증한 결과, 산양삼은 LXRα 활성제(T0901317)에 의해 유도되는 ACC, FAS 및 SCD-1의 발현을 농도의존적으로 감소시켰다(Fig. 2B). 본 결과를 미루어 볼 때, 산양삼은 LXRα 활성제(T0901317)에 의해 유도되는 SREBP-1c의 발현을 억제하여 지질형성과 관련된 ACC, FAS 및 SCD-1의 발현을 억제하여 간세포 내 지질형성을 억제하는 것으로 판단된다.
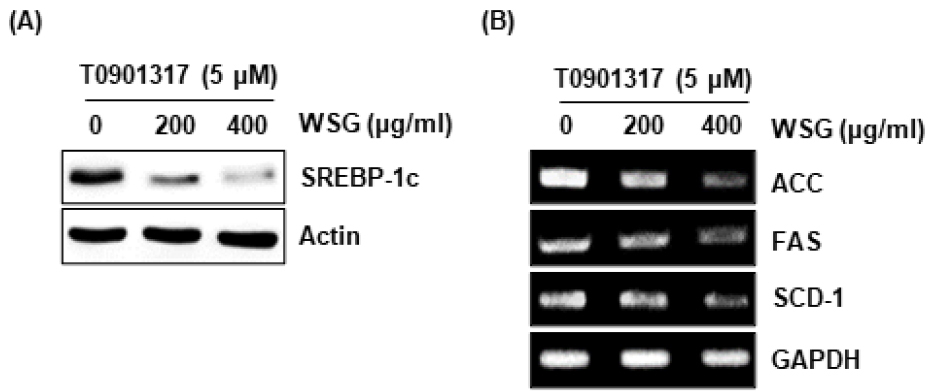
Fig. 2.
Effect of WSG on the expression of SREBP-1c, ACC, FAS and SCD-1 in HepG2 cells. HepG2 cells were pretreated with WSG for 2 h and then with T0901317 (5 μM) for 48 h. (A) SREBP-1c protein level was analyzed using Western blot analysis. (B) The protein levels of ACC, FAS and SCD-1 were analyzed using RT-PCR.
산양삼의 AMPK 신호전달 활성화 유도 활성
AMP-activated protein kinase (AMPK)의 활성화는 간의 지방산 산화를 촉진하고 간 내 지질 형성을 억제하는 것으로 알려져 있다(Bartlett and Eaton, 2004). 간 지질축적에 대한 산양삼의 억제활성과 관련된 분자적 메커니즘을 조사하기 위해 산양삼이 처리된 HepG-2세포에서 AMPK와 AMPK upstream kinase인 LKB1의 활성형인 인산화를 분석하였다. 그 결과, 산양삼은 농도의존적으로 LKB1과 AMPK의 인산화를 촉진시키는 것으로 나타났다(Fig. 3A).
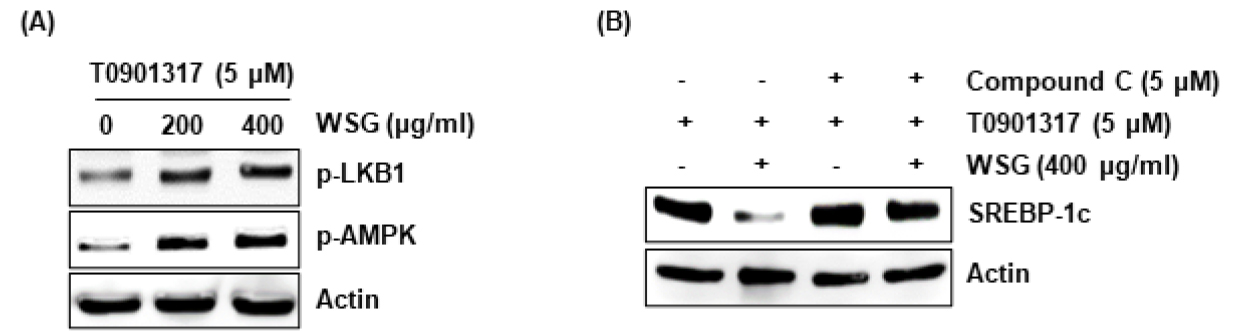
Fig. 3.
Effect of WSG on AMPK signaling pathway in HepG2 cells. (A) HepG2 cells were pretreated with WSG for 2 h and then with T0901317 (5 μM) for 48 h. The protein level was analyzed using Western blot analysis. (B) HepG2 cells were pretreated with WSG and Compound C for 2 h and then with T0901317 (5 μM) for 48 h. The protein level was analyzed using Western blot analysis.
또한 산양삼의 AMPK 활성화가 SREBP-1c의 발현억제에 미치는 영향을 조사하기 위해, AMPK 억제제인 Compound C (CC)를 활용하여 분석한 결과, CC처리가 처리되지 않은 HepG-2에서는 산양삼에 의해 SREBP-1c의 발현이 감소되었으나, CC를 통해 AMPK를 억제하였을 때 산양삼에 의한 SREBP-1c의 발현감소가 억제되었다(Fig. 3B). 본 결과를 미루어 볼 때, 산양삼은 AMPK의 활성화를 유도하여 간세포 내 지질축적을 억제하는 것으로 판단된다.
적 요
간세포 내 LXRα 활성화는 전사조절인자인 SREBP-1c의 발현을 증가시키고, 발현된 SREBP-1c는 핵내로 이동하여 지질형성관련 유전자인 FAS, ACC, SCD-1 등의 프로모토에 결합하여 FAS, ACC, SCD-1을 유도하여 중성지질의 합성을 활성화시켜 비알코올성 지방간을 초래한다. 그러나 산양삼은 LKB1 그리고 연속적으로 AMPK의 활성화을 유도하여 SREBP-1c의 발현 억제를 통해 FAS, ACC, SCD-1의 발현을 감소시켜 간세포 내 지질 및 중성지질의 축적을 억제하는 것으로 판단된다. 본 결과를 미루어 볼 때, 산양삼은 비알코올성 지방간을 예방하기 위한 건강기능성 식품소재로 개발로 활용될 수 있을 것으로 판단된다.




