서 언
재료 및 방법
시약 및 기기
추출 및 분획
유효성분 분리
화합물 구조분석
In vitro Tyrosinase 저해 활성
세포배양 및 세포생존율 측정
멜라닌 생합성량 측정
Tyrosinase 활성 측정
통계처리
결과 및 고찰
유효성분 분리
화합물 구조분석
In vitro Tyrosinase 저해 활성
세포 생존율 측정
Melanin 생합성 저해 활성
Tyrosinase 저해 활성
적 요
서 언
멜라닌(melanin)은 페놀류의 고분자 물질로 흑갈색계열 eumelanin과 적황색계열 pheomelanin으로 구분되며, 자외선으로 인한 피부 세포 보호 및 머리카락, 눈동자 색, 피부색 등을 결정하는 중요한 요소이다(Ando et al., 2012; Yan et al., 2010). 그러나 외부 자극에 의해 과도한 멜라닌 합성은 피부 색소 침착 및 노화를 촉진하며 더 나아가 피부암을 유발하기도 한다. Tyrosinase는 이러한 과정에 밀접한 관련이 있는 효소로 알려져 있다(Cabanes et al., 1994).
멜라닌의 합성은 멜라닌 세포(melanosyte) 내의 멜라노좀(melanosome)에서 일어나며 tyrosinase, tyrosinase related protein-1, dopachrome tautomerase 등의 여러 효소가 관여하는 것으로 보고되어있다(Cabanes et al., 1994; Ishikawa et al., 2007). 타이로신(tyrosine)은 tyrosinase에 의해 DOPA (3,4- dihydroxyphenylalanine)로 전환된 후 dopaquinone으로 산화되는 과정에 작용하며, 산화 및 효소 반응을 통해 DOPA-chrome로 변화되고, dopachrome tautomerase의 작용으로 5,6-dihydroxyindole-2-carboxylic acid (DHICA)으로 전환된다. 최종적으로 tyrosinase related protein-1에 의해서 carboxylated indole quinone으로 산화 과정을 진행하여 흑갈색계열의 유멜라닌(eumelanin)과 적황색계열의 페오멜라닌(pheomelanin)이 생성되어, 피부색 결정에 주된 영향을 미친다(Shosuke, 2003; Slominski et al., 2004; Taylor, 2002).
흰민들레(taraxacum)는 국화과의 다년생 초본으로 한방에서 해열, 두통, 진통, 해독, 항진균, 항산화 및 항염증 활성에 사용되어왔다(Blaschek et al., 1998). 흰민들레 추출물에 대한 생리활성 연구를 통해 항산화(Shahidi et al., 1992), 항균(Lee and Shin, 1991), 항암(Baba et al., 1981; Kim, 1995; Takasaki et al., 1999a, 1999b), 항위염(Lee et al., 1993), 항염 활성(Mascolo, 1987), 미백(Kang and Yoo, 2009) 등이 알려져 있다. 주요 성분으로는 taraxin, inulin, taraxathin, taraxerol, taraxasterol, β-sitsterol, caffeic acid, taraxacine, taraxinic acid, dihydrotaraxinic acid, taraxinic acid β-D-glucoside, Quercetin glycosides, Luteolin 7-O-glucoside, Chrysoeriol 등이 알려져 있다(Choi et al., 2002; Esatbeyoglu et al., 2017; Hausen, 1982; Kang et al., 2000; Williams et al., 1996).
Taraxinic acid는 sesquiterpene lactones 계열의 화합물로 흰민들레에서만 발견되었으며, 현재까지 항암활성 이외에 밝혀진 생리활성은 없다(Choi et al., 2002; Michalska et al., 2020). 많은 연구들이 천연물로부터 새로운 미백 활성 소재를 발굴하기 위하여 tyrosinase 활성 억제 및 melanin 생성 저해 물질 개발에 중점을 두고 있다. 그러나 대부분의 연구가 복분자(Yang, 2000), 밤(Chung, 2001), 와송(Lim et al., 2017), 금잔화(Kim, 2019), 부평초(Kim et al., 2019) 등 추출물을 대상으로 진행되고 있으며, 천연 화합물에 대해서는 부족한 실정이다. 천연 화합물 중에서 tyrosinase 활성 억제 활성이 있는 물질은 kojic acid, arbutin, oxyresveratrol, ferulic acid, isoflavonoids, viscumneoside III, homoflavoyadorinin B, tectorigenin 등이 있으며, 이 중에서 arbutin과 kojic acid만 미백 기능성 제품에 첨가제로 사용되고 있다(Park et al., 2016; Song and Baek, 2020). 본 연구에서는 흰민들레 추출물로부터 taraxinic acid 및 dihydrotaraxinic acid를 분리하였고, tyrosinase 활성 및 melanin 합성에 미치는 영향을 조사하여 기능성 미백 화장품 소재로 이용 가능성을 조사하였다.
재료 및 방법
시약 및 기기
물질 분리 및 확인에 사용한 Octadecyl silica gel (ODS)은 YMC gel ODS-A (12 ㎚ S-75 ㎛)와 HPLC column (YMC, Korea)을 사용하고, 추출 및 분석에 사용된 MeOH, BuOH, DW, Hexane 등의 용매 및 NMR용 CD3OD, dimethyl sulfoxide (DMSO) 용매를 비롯한 시약은 모두 Merck (USA)에서 구입하여 사용하였다. α-melanocyte stimulating hormone (α-MSH), L-3,4-dihydroxyphenylalanin (L-DOPA), ascorbic acid 및 mushroom tyrosinase는 Sigma-Aldrich (USA)에서 구입하였다. 세포배양에 사용된 Dulbecco’s modified Eagle’s medium (DMEM)와 phosphate buffered saline (PBS)은 Welgene (Korea), fetal bovine serum (FBS)과 penicillin/streptomycin는 Gibco BRL (USA)제품을 사용하였으며, WST (4-[3-(4-iodophenyl)- 2-(4-nitrophenyl)-2H-5-tetrazolio]-1,3-benzene disulphonate)는 Daeil Lab Service (Korea)에서 구입하였다.
추출 및 분획
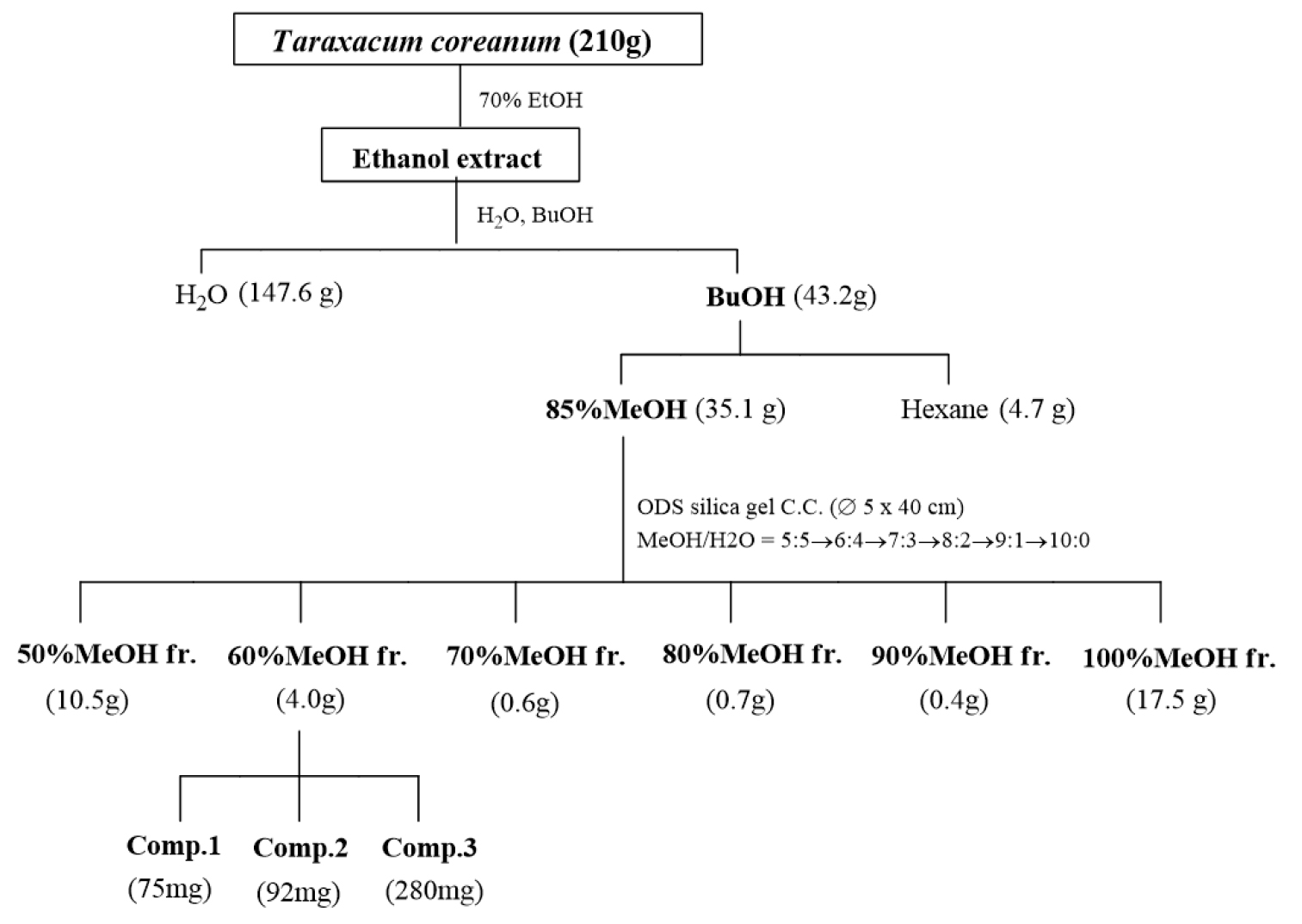
유효성분 분리를 위한 전체적인 분리과정은 Fig. 1에 나타내었다. 실험에 사용된 흰민들레 원료는 제주도 약업상에서 한국산으로 구입하였으며, 건조된 흰민들레는 분쇄기를 이용하여 분말화하였다. 분말 시료 210 g에 70% EtOH 용액을 1 L 가하여 실온에서 24시간 추출한 후 여과지(No. 1, Φ320 ㎜, Advantec)로 여과하는 과정을 2회 반복하였다. 에탄올 추출물은 감압 농축하여 BuOH와 H2O로 분배 추출하였고, 다시 BuOH층을 감압농축 후 85% MeOH과 Hexane으로 분배 추출하였다. 극성 용액층인 85% MeOH에 포함된 물질을 분리하기 위하여 유기층은 농축 후 H2O : MeOH (50:50 → 0:100) 혼합용액을 이용하여 역상 컬럼 크로마토그래피를 수행하여 극성에 따라 6개의 분획을 얻었다. 각층을 40℃에서 감압 농축하여 50% (10.5 g), 60% (4.0 g), 70% (0.6 g), 80% (0.7 g), 90% (0.4 g), 100% MeOH (17.5 g) 분획층을 얻었다.
유효성분 분리
모든 분획층에 대해 tyrosinase 활성을 확인한 후 수용성이면서 분획층 양이 많은 60% MeOH 층을 대상으로 HPLC를 이용하여 유효성분을 분리하였다. 분리조건은 Table 1에 기술하였다. 분리된 화합물의 구조는 A Bruker Advance 400 MHz FT-NMR spectrometer을 이용하여 1H NMR, 13C NMR 및 2D NMR 데이터 분석을 통해 확인하였다. 분자량은 High-resolution FAB mass spectroscopy를 이용하였고, NMR 측정에 DMSO-d6를 사용하였다.
Table 1.
Parameters used for HPLC
| Column | YMC-Triart C18 (250 ㎜ × 10.0 ㎜, particle size 5 ㎛) |
| Flow rate | 1.0 mL/min |
| Column Temperature | 24℃ |
| Detection | Shodex RI-71 |
| Solvent | 50% MeOH with 0.1% formic acid |
화합물 구조분석
60% MeOH 분획층에서 HPLC를 통해 분리한 3종의 화합물 구조를 확인하기 위하여 1D, 2D NMR 데이터를 측정하여 구조분석을 진행하였다. 1H과 13C-Nuclear Magnetic Resonance (NMR) spectra는 400 MHz FT-NMR Spectrometer (Bruker Biospin, AVANCE II 400)를 사용하였고, 1H은 400 MHz 및 13C은 100MHz에서 분석하였다. NMR 측정에 사용된 용매는 DMSO-d6이다.
In vitro Tyrosinase 저해 활성
Tyrosinase 저해 활성은 Tomita et al. (1990)의 방법을 변형하여 측정하였다. 0.1 M Sodium phosphate 완충용액(pH 6.5) 3.2 mL에 시료 100 μL (1 ㎎/mL)과 Mushroom tyrosinase (1100 U/mL) (Sigma aldrich, USA) 50 μL를 첨가하여 혼합한 후 1.5 mM L-Tyrosine (Sigma aldrich, USA) 100 μL를 첨가하였다. 혼합액은 37℃에서 15분 동안 반응시킨 다음 UV/VIS 분광광도계(OPTIZEN POP, Mecasys, KOREA)를 이용하여 475 ㎚에서 흡광도를 측정하였다. 대조군은 시료 대신 0.1 M Sodium phosphate 완충용액(pH 6.5)을 사용하였고 양성대조군 1% ascorbic acid을 사용하였다. Tyrosinase 활성 저해율(%)은 다음 공식에 의하여 구하였다.
A : 시료가 없는 대조군의 475 ㎚에서 흡광도
B : 시료와 효소가 없는 대조군의 475 ㎚에서 흡광도
C : 시료와 효소를 넣은 실험군의 475 ㎚에서 흡광도
D : 효소가 없는 대조군의 475 ㎚에서 흡광도
세포배양 및 세포생존율 측정
B16BL6 멜라닌 형성 세포(Melanocyte)의 배양은 1% penicillin/streptomycin과 10% FBS가 포함된 DMEM을 사용하였으며, 37℃, 5% CO2 incubator에서 배양하였다. 실험에 사용된 시료가 B16BL6 멜라닌 형성 세포의 생존률에 미치는 영향을 조사하기 위해 tetrazolium salt WST가 세포 내 mitochondria의 dehydrogenase와 반응하여 오렌지색의 formazan으로 변하는 반응을 이용하여 확인하였다(Francoeur and Assalian, 1996; Ngamwongsatit et al., 2008). 96-well plate에 B16BL6 멜라닌 형성 세포를 5 × 103 cells/well씩 분주한 후 37℃, 5% CO2 조건의 incubator에서 배양하였다. 시료는 DMSO에 녹인 후 10, 50, 100 ㎍/mL 농도로 배양된 B16BL6 멜라닌 형성 세포에 처리한 후, 37℃, 5% CO2 조건의 incubator에서 24시간 배양하였다. 배양액에 WST 용액을 첨가하고, 37℃에서 30분 동안 반응 후 450 ㎚에서 흡광도를 측정하였다.
멜라닌 생합성량 측정
멜라닌 함량 측정은 Hosoi의 방법을 약간 변형하여 이용하였다(Hosoi et al., 1985). B16BL6 멜라닌 형성 세포는 6-well plate에 5 × 104 cells/well로 분주 후 37℃, 5% CO2 조건의 incubator에서 배양하였다. 멜라닌의 생합성을 유도하기 위하여 시료 및 α-MSH를 첨가하여 37℃, 5% CO2 조건의 incubator에서 48시간 배양하였다. 이후 배지를 제거하고 PBS로 세척 후 cell lysis buffer (0.1 M sodium phosphate buffer, 1% Triton X-100, 0.2 mM Phenylmethylsulfony fluoride)를 첨가하여 세포를 용해시키고, 10,000×g에서 15분간 원심분리하였다. 상층액을 제거 후 10% DMSO가 포함된 1 N NaOH를 처리 후 80℃에서 1시간 동안 반응시켜 pellet을 용해시키고, 405 ㎚에서 흡광도를 측정하였다. 총 단백질량은 Bradford reagent (Bio-Rad, CA, USA)를 이용하여 595 ㎚에서 흡광도 측정을 통해 확인하였다.
Tyrosinase 활성 측정
Tyrosinase의 효소 활성은 기질인 L-DOPA가 dopachrome으로 산화되면서 발생하는 검붉은 색의 변화를 측정하였다. Cell lysis buffer (0.1 M sodium phosphate buffer, 1% Triton X-100, 0.2 mM Phenylmethylsulfony fluoride)를 첨가하여 세포를 용해시킨 후, 10,000×g에서 15분간 원심분리하여 상층액을 확보하고 2 ㎎/mL L-DOPA (0.1 M sodium phosphate buffer (pH 6.8))를 혼합한 후 1시간 동안 37℃에서 배양하였다. 반응이 끝난 후 490 ㎚에서 흡광도를 측정하였고, 총 단백질량은 Bradford reagent (Bio-Rad, Hercules, CA)를 이용하여 595 ㎚에서 흡광도를 측정을 통해 확인하였다.
통계처리
모든 실험은 3회 반복실험을 수행하여 얻어진 결과이며 실험 결과의 평균값과 표준편차로 나타내었다. 통계적 분석은 각 처리구간의 유의성(p < 0.05) 검증을 위해 분산분석(analysis of variance, ANOVA) 후 student’s t-test로 다중비교를 실시하였다.
결과 및 고찰
유효성분 분리
유효성분 분리를 위한 전체적인 분리과정은 Fig. 1에 나타내었다. 추출물 분획은 유기용매 극성 정도에 따라 추출 성분이 다르기 때문에 극성도에 따라 추출 용매 및 분리 용매를 선택하였다. 건조된 후 분말화된 시료를 70% EtOH 용액으로 추출하여 에탄올 추출물 210 g을 확보하였다. 추출물은 BuOH (43.2 g)와 H2O (147.6 g)로 분배 추출하였고, BuOH층은 다시 85% MeOH (35.1 g)과 Hexane (4.7 g)으로 극성에 따라 추출하였다. 85% MeOH (35.1 g)은 H2O : MeOH (50:50 → 0:100) 혼합용액을 이용하여 역상 컬럼 크로마토그래피를 수행하여 극성에 따라 6개의 분획을 얻었다. 각층을 40℃에서 감압 농축하여 50% (10.5 g), 60% (4.0 g), 70% (0.6 g), 80% (0.7 g), 90% (0.4 g), 100% MeOH (17.5 g) 분획층을 얻었다.
각 분획층은 in vitro Tyrosinase 활성을 측정한 결과 모든 층에서 저해 활성이 관찰되었고, 이중에서 60% 분획층(0.4 g)을 대상으로 HPLC를 이용하여 물질 분리를 진행하여 compound 1 (7.5 ㎎), compound 2 (9.2 ㎎), compound 3 (28.0 ㎎) 3종의 화합물을 확보하였다.
화합물 구조분석
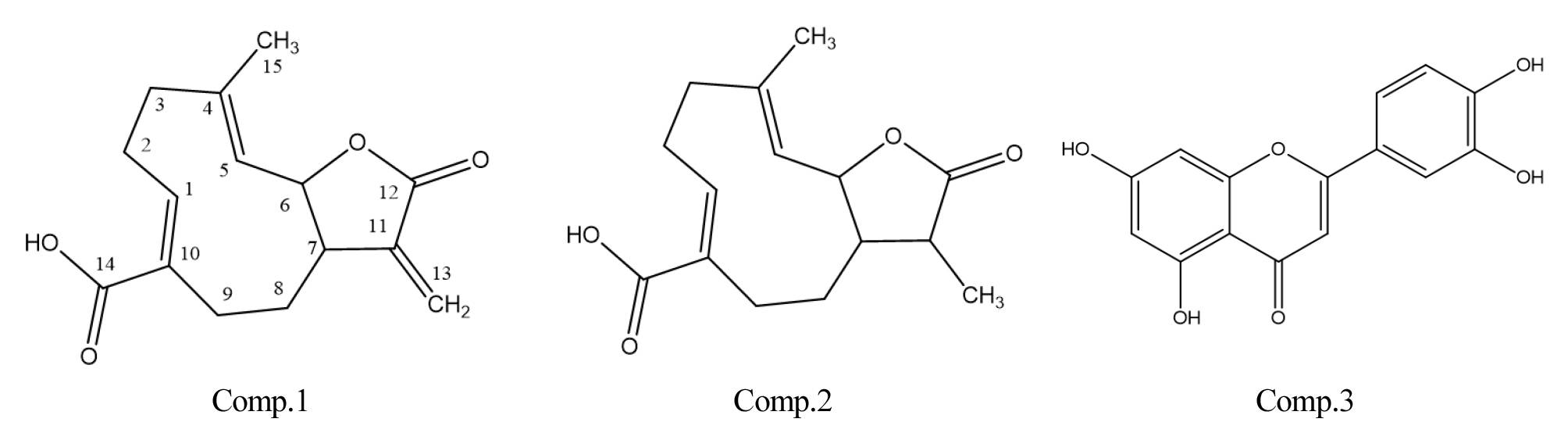
흰민들레 추출물의 60% MeOH 분획층에서 tyrosinase 활성 및 melanin 생성저해 활성을 나타내는 성분을 규명하기 위하여 HPLC를 통해 분리된 3종의 화합물의 구조분석을 진행하였다. 각각의 화합물에 대한 1D 및 2D NMR 데이터를 통해 구조를 예측하였고, 참고문헌(Ahn et al., 2019; Choi et al., 2002; Hausen, 1982)을 통해 3종의 화합물의 구조를 검증하였다. 구조분석 결과 compound 1은 taraxinic acid, compound 2는 dihydrotaraxinic acid, 그리고 compound 3은 luteolin으로 확인하였고, 구조는 Fig. 2에 나타내었다.
Compound 1 (Taraxinic acid)
1H NMR (400 MHz, DMSO-d6): 6.07 (d, 1H, J = 3.6 Hz, H-13), 5.68 (d, 1H, J = 3.6 Hz, H-13), 5.67 (m, 1H, H-1), 5.01 (d, 1H, J = 10.2 Hz, H-5), 4.68 (t, 1H, J = 9.1 Hz, H-6), 3.27, 2.21 (m, 2H, H-2), 2.70 (m, 1H, H-7), 2.25, 2.20 (m, 2H, H-3), 2.69, 2.00 (m, 2H, H-9), 2.13, 1.91 (m, 2H, H-8), 1.55 (s, 3H, H-15); 13C NMR (400MHz, DMSO-d6): 169.9 (C-12), 169.1 (C-14), 145.1 (C-1), 141.9 (C-11), 140.3 (C-4), 131.4 (C-10), 126.0 (C-5), 119.4 (C-13), 81.7 (C-6), 49.2 (C-7), 38.4 (C-3), 36.0 (C-9), 29.6 (C-8), 25.9 (C-2), 16.4 (C-15), HRFABMS(+) m/z 264.1203 (calcd for C15H18O4, m/z 264.1205).
Compound 2 (Dihydrotaraxinic acid)
1H NMR (400 MHz, DMSO-d6): 5.63 (dd, 1H, J = 10.2, 3.5 Hz, H-1), 4.88 (d, 1H, J = 10.2 Hz, H-5), 4.65 (t, 1H, J = 9.1 Hz, H-6), 3.25, 2.17 (m, 2H, H-2), 2.65, 1.97 (m, 2H, H-9), 2.36 (m, 1H, H-11), 2.17, 2.23 (m, 2H, H-3), 1.92 (m, 1H, H-8), 1.72 (m, 1H, H-7), 1.55 (m, 3H, H-15). 1.09 (d, J = 7.0 Hz 3H, H-13); 13C NMR (400MHz, DMSO-d6): 178.3 (C-12), 169.1 (C-14), 145.1 (C-1), 140.5 (C-4), 131.6 (C-10), 126.2 (C-5), 80.9 (C-6), 53.4 (C-7), 41.4 (C-11), 39.4 (C-3), 36.2 (C-9), 29.6 (C-8), 25.9 (C-2), 16.3 (C-15), 12.8 (C-13), HRFABMS(+) m/z 264.1364 (calcd for C15H20O4, m/z 264.1362).
Compound 3 (Luteolin)
1H NMR (400 MHz, DMSO-d6): δ = 6.16 (1H, d, J = 1.9 Hz, H-6), 6.40 (1H, d, J = 1.9 Hz, H-8), 6.63 (1H, s, H-3), 6.85 (1H, d, J = 8.4 Hz, H-5'), 7.37 (1H, d, J = 1.9 Hz, H-2'), 7.40 (1H, dd, J = 1.9, 8.4 Hz, H-6'); HRFABMS(+) m/z 286.0479 (calcd for C15H10O6, m/z 286.0477).
In vitro Tyrosinase 저해 활성
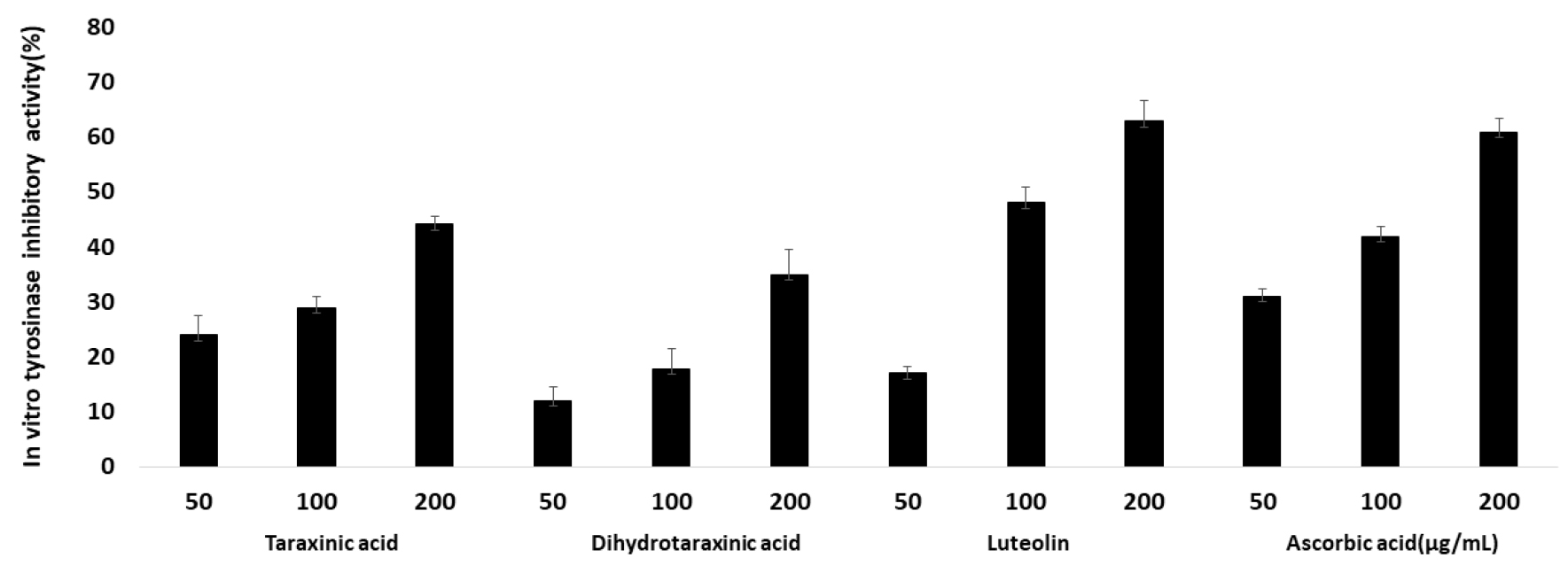
흰민들레 추출물에 대한 tyrosinase 저해 활성은 이전 연구를 통해 약한 활성이 있는 것으로 보고되었으나 유효 활성을 나타내는 단일성분에 대해 규명되지 않았다(Kang and Yoo, 2009). 흰민들레 추출물로부터 분리한 3종의 화합물을 대상으로 tyrosinase 저해 활성을 확인하였다. Taraxinic acid의 경우 50, 100, 200 ㎍/mL 농도로 처리했을 때 24%, 29%, 44%, dihydrotaraxinic acid는 12%, 18%, 35%, luteolin은 17%, 48%, 63%의 tyrosinase 저해 활성을 나타냈다(Fig. 3). 양성대조군인 ascorbic acid의 경우 31%, 42%, 61%의 저해 활성을 보였으며, 100 ㎍/mL 농도 이상에서는 ascorbic acid보다 luteolin의 저해 활성이 높게 나타났다. Taraxinic acid와 dihydrotaraxinic acid 경우 ascorbic acid의 활성보다 낮게 나타났다(Fig. 3).
세포 생존율 측정
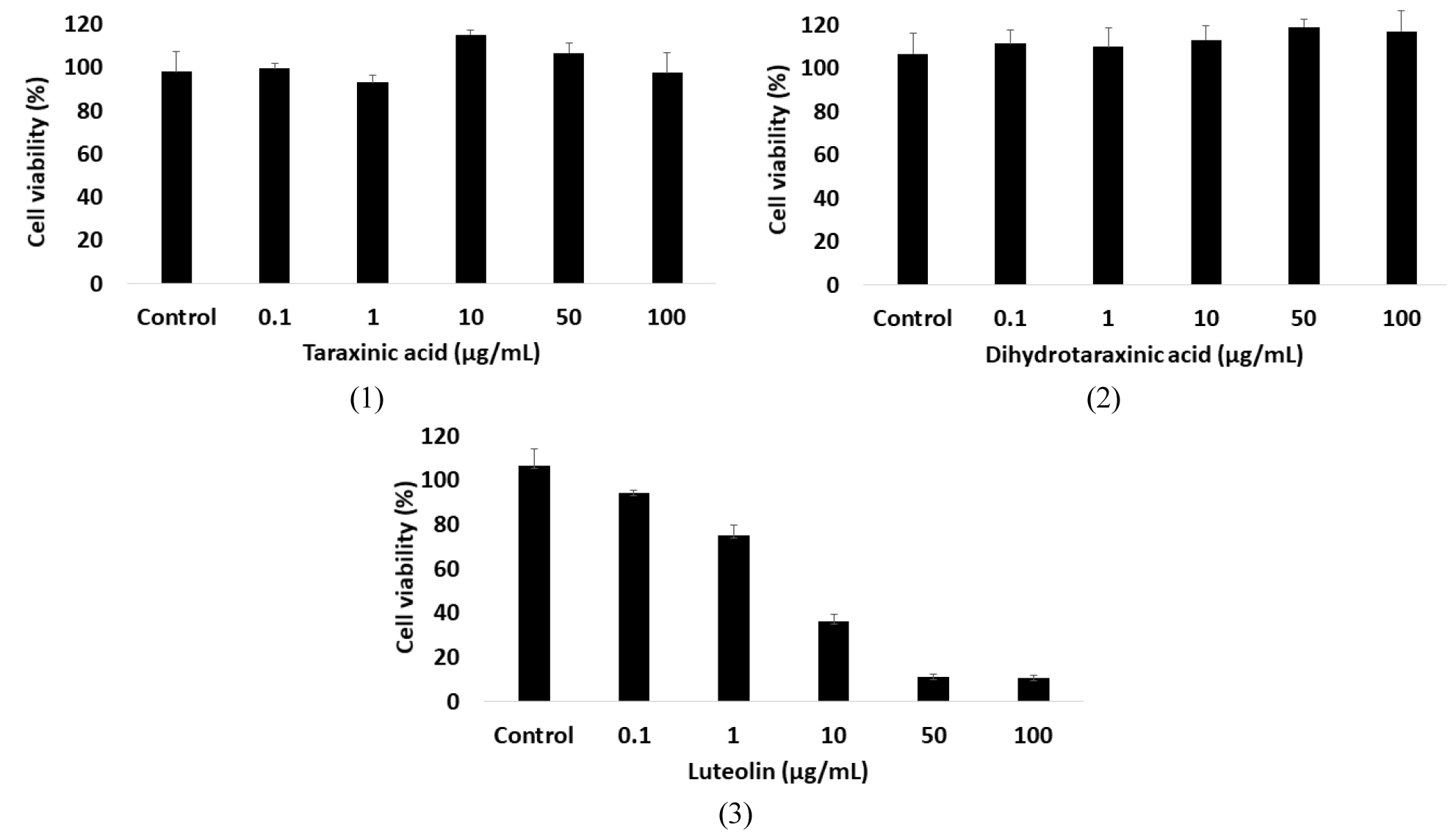
흰민들레로부터 분리된 taraxinic acid, dihydrotaraxinic acid, luteolin이 B16BL6 멜라닌 형성 세포에 미치는 독성을 확인하기 위하여 WST assay를 사용하여 세포 생존율을 확인하였다. Taraxinic acid와 dihydrotaraxinic acid의 농도별 세포 생존율은 100 ㎍/mL까지의 농도에서 무첨가 대조군과 유사한 세포 생존율이 확인되어 B16BL6 멜라닌 형성 세포에 대한 독성은 없는 것으로 확인되었다. 그러나 luteolin의 경우 B16BL6 멜라닌 형성 세포에 대해 높은 세포 독성이 확인되었다(Fig. 4).
Melanin 생합성 저해 활성
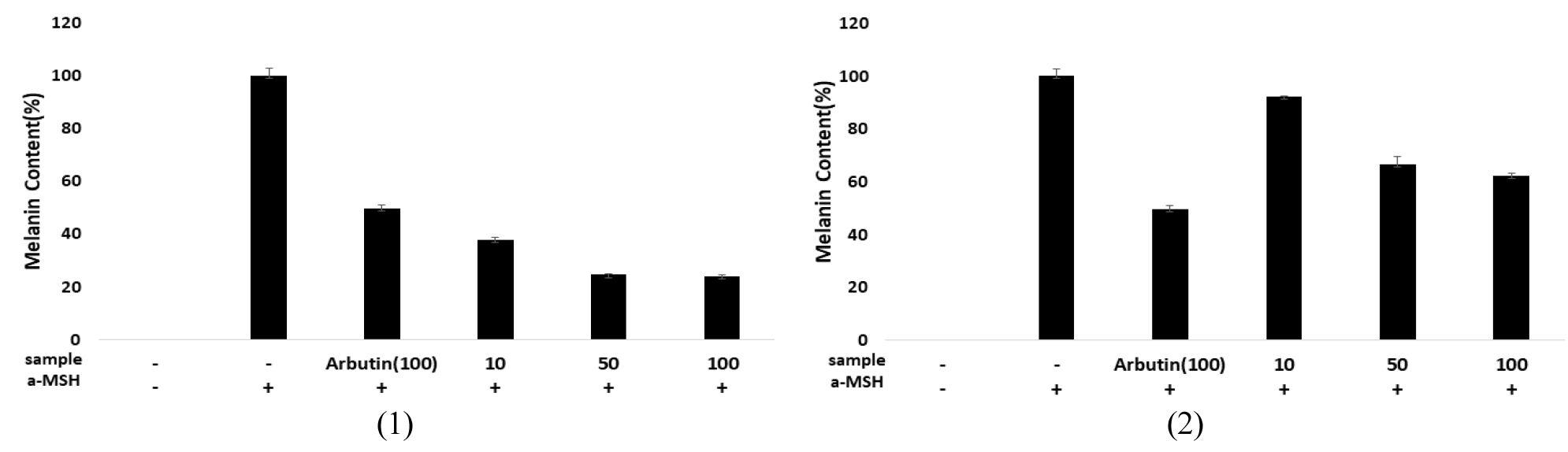
B16BL6 멜라닌 형성 세포를 대상으로 taraxinic acid 및 dihydrotaraxinic acid가 멜라닌 생성에 미치는 영향을 확인하기 위하여 α-MSH (200 nM)를 함께 처리하여 실험을 진행하였다. α-MSH를 단독으로 처리한 대조군(100%)과 비교하였을 때, taraxinic acid 10, 50, 100 ㎍/mL의 농도로 처리한 세포에서 멜라닌 생합성량이 37.8%, 25.5%, 24.0%의 농도 의존적 감소를 나타내었으나 dihydrotaraxinic acid는 92.3%, 66.5%, 62.3%로 감소하는 것으로 나타났다. 양성대조군으로 사용한 arbutin이 100 ㎍/mL에서 49.5%의 멜라닌 생합성량과 비교 분석할 경우, taraxinic acid의 멜라닌 생합성 억제 효과가 arbutin보다 우수한 것을 알 수 있으나, dihydrotaraxinic acid는 arbutin보다 약한 활성을 나타냈다(Fig. 5). 따라서 B16BL6 멜라닌 형성 세포에 α-MSH를 처리하여 멜라닌 생합성 억제율 비교를 통해 taraxinic acid가 세포 내 멜라닌 생합성을 효과적으로 억제하는 것을 확인하였다.
Tyrosinase 저해 활성
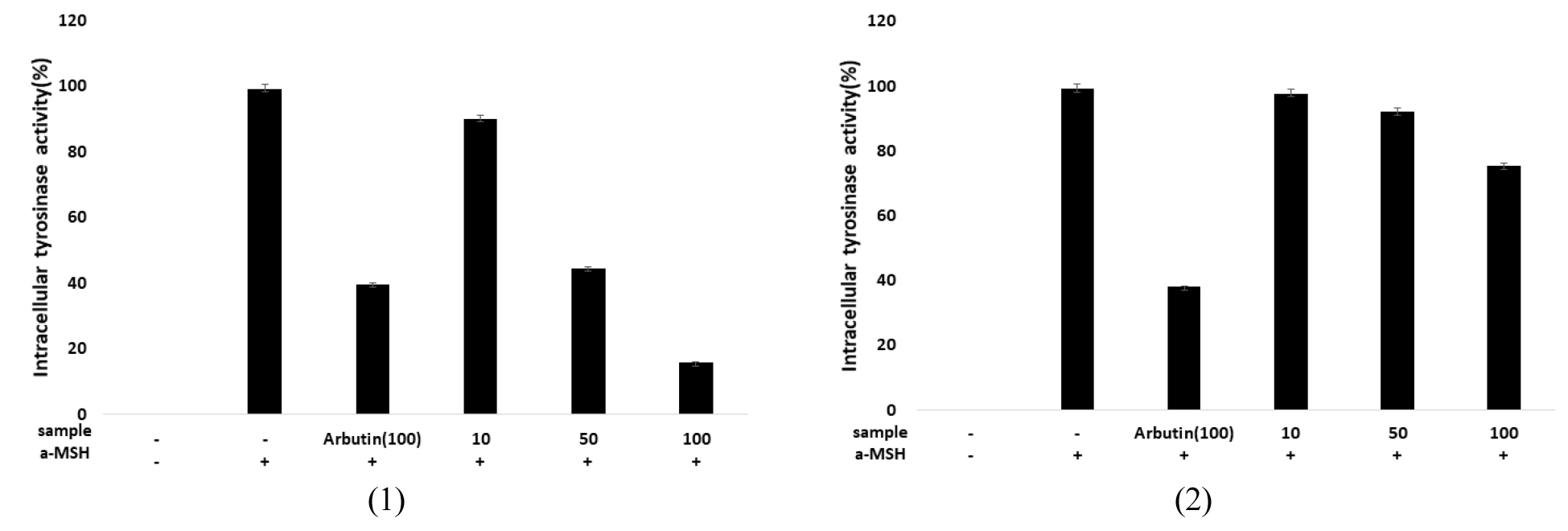
세포 내 미백효과는 tyrosinase 발현 억제 및 tyrosinase의 활성을 감소시켜 melanin 생합성에 미치는 영향을 파악함으로써 확인할 수 있다. B16BL6 멜라닌 형성 세포에 α-MSH를 처리하여 melanin 생합성을 유도한 후, taraxinic acid 및 dihydrotaraxinic acid에 의한 tyrosinase 저해 활성을 측정하였다. α-MSH (200 nM)을 단독 처리한 대조군(100%)과 비교하였을 때, taraxinic acid 10, 50, 100 ㎍/mL의 농도로 처리한 세포군에서 89.9%, 44.5%, 15.8%로 tyrosinase 활성이 농도에 비례하여 억제되었으나 dihydrotaraxinic acid의 경우 97.5%, 91.5%, 75.2%로 taraxinic acid보다 약한 활성을 나타냈다. Arbutin과 tyrosinase의 억제율을 비교하였을 때 taraxinic acid가 2배 이상의 저해 활성을 나타낸 반면, dihydrotaraxinic acid에서는 약한 억제율이 확인되었다(Fig. 6).
민들레 추출물의 tyrosinase 저해 효과에 대해 이미 보고된 바 있으며, 5 ㎎/mL 농도 범위에서는 세포의 생존율에 영향이 없으나 10 ㎎/mL 농도에서는 세포 독성이 있는 것을 확인하였다. B16F1 melanoma 세포를 이용하여 세포 내 멜라닌 생합성 저해 효과는 민들레 추출물 중에서 에틸아세테이트 분획물에서 5 ㎎/mL 농도에서 뚜렷한 저해 활성을 나타냈다(Kang ang Yoo, 2009). 본 실험을 통해 민들레 70% EtOH 추출물이 In vitro tyrosinase 저해 활성을 확인하였고 활성을 나타내는 성분을 규명하기 위하여 HPLC를 이용하여 taraxinic acid, dihydrotaraxinic acid 및 luteolin을 분리하여 tyrosinase 저해 활성을 확인하였다. 3종 모두에서 tyrosinase 저해 활성을 보여 화장품의 미백 원료로서 가능성을 보여주었다. 특히 luteolin은 ascorbic acid보다 뛰어난 저해 활성을 나타냈으며, taraxinic acid 또한 높은 활성을 보여 화장품원료로 개발 가능성을 보였다(Fig. 3). B16BL6 멜라닌 형성 세포에 대한 세포 독성 실험에서 taraxinic acid와 dihydrotaraxinic acid는 100 ㎍/mL 농도에서도 세포 독성을 보이지 않은 반면 luteolin의 경우 높은 세포 독성을 보여 화장품 미백 원료로서 luteolin의 사용은 제한적일 것으로 예상한다(Fig. 4). B16BL6 멜라닌 형성 세포에 대한 세포 내 melanin 생합성 및 tyrosinase 저해 활성의 경우 taraxinic acid와 dihydrotaraxinic acid 모두 저해 활성을 보여 화장품 미백 원료로 충분히 사용 가능할 것으로 예상된다(Fig. 5, Fig. 6). 특히 taraxinic acid는 arbutin과 비교하여 놓은 저해 활성을 보여 화장품의 미백 원료로 활용 가능성이 높다고 생각된다. 현재 개발된 추출물 형태의 화장품 원료의 경우 다양한 물질들이 포함되어 있으며, 각각의 물질들이 가지는 활성의 평균치를 바탕으로 화장품 원료로 사용되고 있어서 화장품 분야 활용에 제한적이다. 민들레 추출물의 경우와 같이 성분에 따른 함량의 차이 및 세포 독성을 나타내는 성분 등으로 인해 화장품 원료로 활용 가능성이 높지 않다. 그러나 각각의 성분을 분리하여 활성에 따라 활용한다면 다양한 천연화장품 원료들이 개발될 것으로 기대되며, 원료로 사용되는 생물자원 활용을 현재보다 향상할 수 있을 것으로 예상한다.
적 요
흰민들레 추출물에서 분리한 taraxinic acid, dihydrotaraxinic acid 및 luteolin를 대상으로 화장품의 미백 소재로서의 이용 가능성을 조사하였다. In vitro tyrosinase 저해 활성은 100 ㎍/mL에서 대조군인 ascorbic acid는 42% 저해 활성을 보였으며, luteolin은 48%, taraxinic acid는 29%, 그리고 dihydrotaraxinic acid는 18%를 보여 luteolin이 가장 높게 나타냈다. Taraxinic acid와 dihydrotaraxinic acid는 100 ㎍/mL 이하의 조건에서 B16BL6 멜라닌 형성 세포의 생존율에 영향을 미치지 않았으나, luteolin은 강한 세포 독성을 나타냈다. Taraxinic acid와 dihydrotaraxinic acid가 세포 생존율에 영향을 미치지 않는 농도 범위(10, 50, 100 ㎍/mL)에서 B16BL6 세포 내 멜라닌 생합성 및 tyrosinase 활성을 확인한 결과 농도 의존적으로 억제하는 것으로 확인되었다. 특히 taraxinic acid는 tyrosinase inhibitor로 알려진 arbutin보다 뛰어난 저해 활성을 나타내어, 천연 기능성 미백 화장품 원료로 사용 가능성이 기대된다.