서 언
재료 및 방법
실험 재료
홉 조직배양의 적정 배지 조건
재분화 식물체의 순화
통계분석
결과 및 고찰
홉 조직배양 시 식물생장조절제 종류와 농도에 따른 재분화 조사
상토 멸균 및 습도 유지기간이 순화에 미치는 영향
적 요
서 언
홉(hop, Humulus lupulus. L.)은 삼과(Cannabaceae)에 속하는 숙근성 다년생 초본 식물이다(Neve, 1991). 홉 식물체는 2n=20의 염색체를 갖는데, XX의 성 염색체를 갖는 암그루와 XY의 성 염색체를 갖는 수그루로 나뉘어지는 자웅이주이다(Shephard et al., 2000). 홉은 수 천년 전부터 중동이나 유럽에서 약초나 술의 원료로 이용되었다(Rossini et al., 2021). 홉은 맥주의 필수 원료로 맥주 특유의 쓴맛 및 향을 부여하고, 방부 효과를 주는 것으로 널리 알려져 있다(Burgess, 1964). 홉의 유효성분인 루풀린 등은 주로 암그루의 열매에 함유되어 있어 맥주 원료로 생산 시에는 암그루만을 대상으로 재배한다(Thomas and Neve, 1976; Zanoil and Zavatti, 2008).
홉은 주로 근삽이나 줄기삽 등 삽목에 의한 영양번식을 통해 개체를 증식시켜 재배한다. 홉에 대한 조직배양 연구는 육종 및 무병묘 증식 차원에서 몇몇 검토가 이루어졌다. Horlemann et al. (2003)은 수 종의 식물생장조절제를 첨가하여 홉 품종 ‘Tettnanger’을 대상으로 기내배양 후, A. tumefaciens을 이용하여 형질전환을 시도하였고, PCR분석으로 외래유전자 도입여부를 검증하였다. Roy et al. (2001)은 홉 품종 ‘H138’을 대상으로 다양한 배지를 만들어 홉 재분화에 적합한 배지를 찾고자 식물생장조절제와 농도를 구성하여 재분화율과 callus 발생정도를 확인하였다. Hirakawa and Tanno (2022)는 홉의 측아를 이용하여 조직배양하였고, 지베렐린을 이용하여 재분화율과 신초 생장을 연구하였다. 국내에서의 홉 조직배양 연구는 Ha et al. (2023)이 6개 품종에서 삽목 증식과 함께 조직배양에 실험을 진행하여 MS 배지에 IAA 0.1 ㎎/L와 TDZ 1 ㎎/L를 첨가하면 다경 유도가 되는 것을 확인하였다. 이렇듯 국내외적으로 몇몇 홉 품종을 대상으로 일부 조직배양 연구가 이루어졌지만 홉 재분화에 영향을 주는 다양한 식물생장조절제 사용과 적정한 농도에 대한 연구는 미흡한 상황이다.
국내 홉 생산은 1970~1980년대에는 자급을 이루었으나 1980년대 말에 외국산 홉이 수입되면서 1992~’93년에 국내 재배 및 연구가 중단되었다(Choi and Shin 1995; Kim, 2020; Lim, 1975). 최근 수제 맥주가 인기를 끌게 되어 국내산 홉의 수요가 증가함에 따라 외국산 홉을 도입하여 재배가 시도되고 있으나 적합 품종 및 안전 재배 기술에 대한 정보 부족으로 어려움을 겪고 있다(Cho et al., 2018; Kim, 2020; Kwon, 2019). 따라서, 본 논문에서는 홉의 국산 신품종 개발 및 무병묘 생산에 필요한 홉의 조직배양 기술에 대해 연구를 진행하였다.
재료 및 방법
실험 재료
본 실험에 사용된 식물 재료는 공주대학교 예산캠퍼스 시험농장에서 재배되고 있는 홉 품종 Cascade로, 2021년과 2022년에 개화하여 암그루로 확인된 식물이다. Cascade는 1972년 USDA-ARS에서 출시하여 전 세계적으로 많이 재배되는 품종이다. 조직배양에 사용되는 식물생장조절제 cytokinin과 auxin의 비율과 농도에 따라서 신초형성과 재분화에 많은 차이가 발생한다는 연구결과에 따라(Panicker et al., 2007), 본 연구에서는 식물생장조절제 종류와 농도에 따른 재분화 차이를 보기 위해 auxin계열 indole-3-acetic acid (IAA, MBcell, Korea)를 사용하였으며, cytokinin계열의 6-(γ,γ-dimethylallylamino) purine (2iP, MBcell, Korea), 6-(4-hydroxy-3-methylbut-2-enylamino) purine (zeatin, MBcell, Korea), 6-benzylaminopurine (BAP, MBcell, Korea)와 thidiazuron (TDZ, MBcell, Korea)를 사용하였다.
홉 조직배양의 적정 배지 조건
조직배양에 사용된 조직은 6~7마디 발생한 신초를 대상으로 정단에서 3마디를 제거한 후 액아를 1 ㎝ 크기로 잘라 이용하였다. 절편은 흐르는 물에 30분 가량 세척하였으며, 클린벤치 안에서 70% 에탄올에 30초간 세척한 후 멸균수로 1회 헹구었다. 그리고, 2% 차아염소산 나트륨에 Tween20 (Tween20, Junsei, Japan)을 미량 첨가하여 20분 동안 멸균하여, 멸균수로 4회 헹구었다. 홉 배양에 사용된 배지는 MS 배지(sucrose 3%, agar 0.8% 및 pH 5.8)를 사용하였으며, 4주 간격으로 동일 조성의 배지로 계대배양을 수행하였다. 배양 환경은 16/8시간의 명암 광주기 및 온도 조건 25±1℃로 이루어졌다. 식물생장조절제는 Roy et al. (2001)의 홉 ‘H138’연구에서 NAA와 IAA 첨가가 홉 조직배양에 미치는 영향을 확인했을 때, IAA 첨가구에서 IAA보다 재분화율이 높았다는 결과에 따라 auxin류 IAA 0.1 ㎎/L를 사용하였다. Cytokinin 종류와 농도에 따른 차이를 관찰하기 위해 2iP, zeatin, BAP, TDZ를 각각 1 ㎎/L, 2 ㎎/L와 3 ㎎/L를 사용하였다. 실험에 사용된 식물생장조절제는 45 ㎛ 크기의 무균 필터를 이용하여 필터링하고, 멸균된 배지를 50℃로 식힌 후 첨가하였다. 식물생장조절제의 종류와 농도에 따른 배양체의 재분화 조사는 배양 5주 후 진행하였다.
재분화 식물체의 순화
재분화 된 홉을 순화시키기 위해 실험을 진행하였다. 순화에 사용한 홉은 뿌리를 멸균수로 세척하여 잔여배지와 callus 등 이물질을 제거하여 사용하였다. 첫번째로 상토 멸균 유무에 따른 순화 생존율을 확인하기 위해 멸균된 상토와 멸균되지 않은 상토가 담긴 배양병에 뿌리 부분을 식재하고, 랩으로 입구를 감싸 배양병의 상대습도를 100%로 맞추어 14일간 실험을 진행하였다. 두번째로 기내 습도 유지기간에 따른 생존율 관찰을 위해 1주일 간격으로 랩의 구멍을 점진적으로 늘려주어 상대습도를 낮추었다. 입구를 감싼 랩을 0일, 7일, 14일, 21일, 28일에 제거하여 화분에 옮겨 심은 뒤 유리온실로 옮겨주었다. 순화실험은 이전단계와 같은 조건인 배양실에서 진행하였으며, 각각 입구를 감싼 랩을 제거한 후 7일차에 생존율을 확인하여 순화성공을 결정하였다.
통계분석
조직배양 실험은 8 개체씩 실험하였으며, 순화 실험은 처리별로 10 개체씩 실험하여 백분율을 구하였다. 통계적 유의성을 검증하기 위해 3반복으로 실험하였다. 통계는 Excel을 이용하여 평균과 표준오차를 구하였으며, SPSS 프로그램(SPSS 20, IBM lnc, USA)을 사용하여 ANOVA 분석과 대응 표본 t-test 하여 통계분석을 진행하였다. 사후검정은 Duncan’s multiple range test로 P <0.05로 진행하였다.
결과 및 고찰
홉 조직배양 시 식물생장조절제 종류와 농도에 따른 재분화 조사
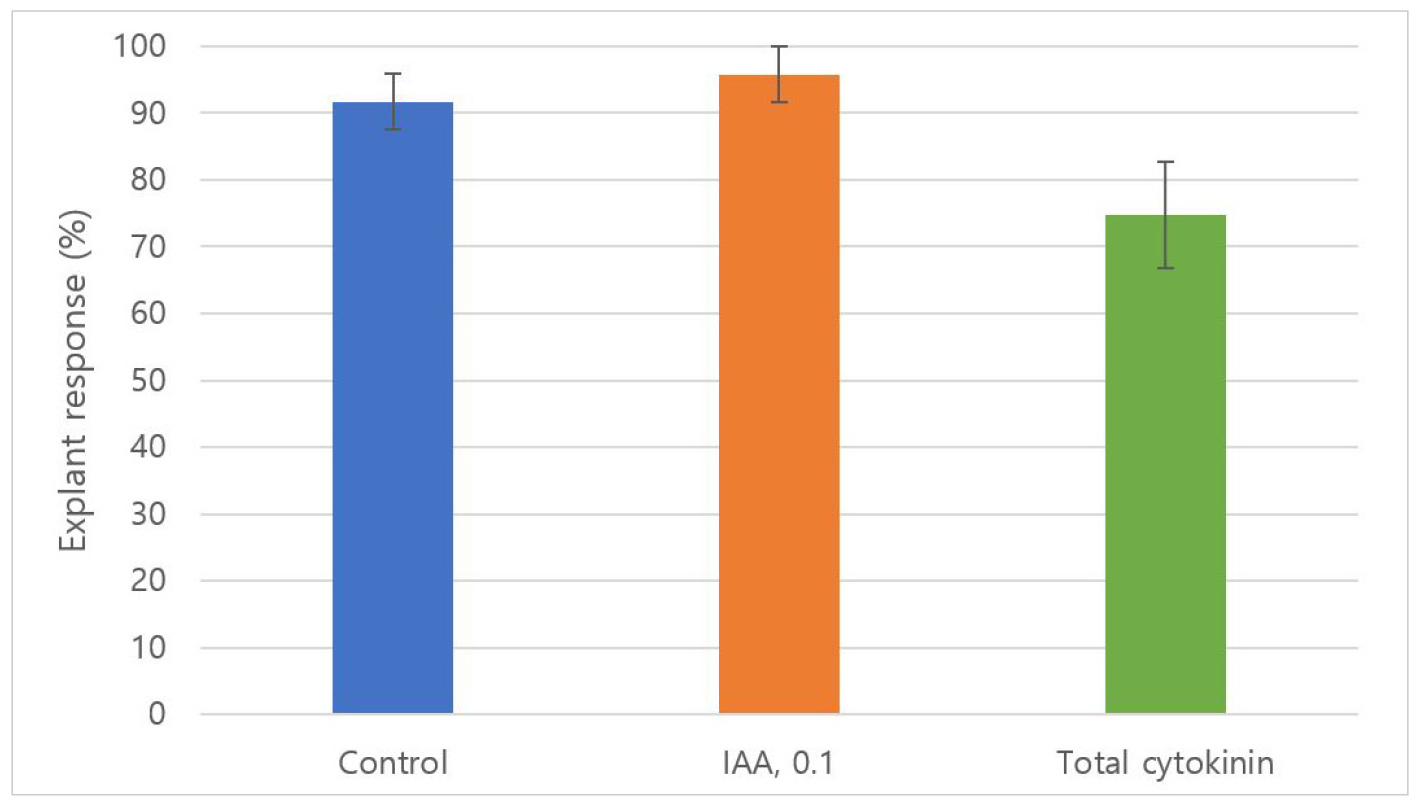
홉 조직배양 시 식물생장조절제 처리에 따른 재분화율은 Fig. 1과 같다. 식물생장조절제를 첨가하지 않은 MS 배지(control)에서 재분화율은 91.7%였으며, IAA 0.1 ㎎/L가 첨가된 배지에서의 재분화율은 95.8%로 control보다 높았다. 반면, auxin과 cytokinin이 함께 첨가된 배지에서 평균 재분화율이 74.7%로 감소하였고, 그 중 IAA 0.1 ㎎/L + 2iP 2 ㎎/L가 첨가된 배지에서 재분화율이 62.5%로 재분화율이 가장 낮았다. IAA 0.1 ㎎/L + BAP 1 ㎎/L가 첨가된 배지에서 재분화율은 control과 동일하게 91.7%로 나타났다(Table 1). 이는 Roy et al. (2001)이 보고한 IAA 0.1 ㎎/L + BAP 1 ㎎/L에서 재분화율이 높게 나타난다는 것과 유사하다.
식물생장조절제를 첨가하지 않았을 때 홉의 초장은 5.7 ㎝이며, IAA 0.1 ㎎/L + BAP 1 ㎎/L에서 6.7 ㎝로 control보다 길었으나 다른 처리에서는 control보다 작았다. 식물생장조절제를 처리하지 않거나 auxin만 첨가할 경우 callus가 발생하지 않았으며, 뿌리 생장이 이루어졌다. 또한, cytokinin처리시 callus가 발생하여 control 과 IAA 처리구에 비해 무게가 증가하였다(Fig. 2, Table 1). 홉 조직배양체의 신초 개수는 control이 2.8개였으며, IAA 0.1 ㎎/L + BAP 1 ㎎/L에서 3.7 개로 증가하였다. TDZ 첨가구는 다른 cytokinin과 차이점을 보였는데, IAA 0.1 ㎎/L + TDZ 1 ㎎/L에서 신초 개수가 6.0 개, 13.3±1.2 개의 마디가 생겼지만, 초장이 0.7 ㎝로 다경 분화에 적합하지만 지상부 생장의 증진 효과는 나타나지 않았다. 이러한 결과는 홉 조직배양 시 식물생장조절제 처리를 하지 않아도 재분화와 지상부 생장은 원활하게 이루어지지만 BAP 1 ㎎/L를 처리한 배지가 신초 형성과 신장에 유리한 것으로 나타났다. 반면 BAP의 농도가 증가함에 따라 신초 형성과 신장이 감소하였는데, 이는 고농도의 BAP가 신초 형성 및 줄기 신장을 억제한다는 기존의 보고와 유사하다(Park et al., 2007). 일반적으로 딸기 등 식물조직배양 기술을 이용해 무병묘를 생산할 경우 체세포 변이 등의 발생 우려 때문에 가급적 배지에 식물생장조절제를 첨가하지 않고 경정 배양하여 1개체의 식물체를 생산하는 경우가 많다(Lee et al., 2010; Nam et al., 2017; Pierik, 1987). 따라서, 본 연구의 결과, 홉의 경우에도 MS 배지에 식물생장조절제를 첨가하지 않고도 식물체 형성이 가능하여 무병묘를 생산하는 것이 가능할 것으로 보인다. 반면, 돌연변이 육종 연구를 하는 경우에는 많은 변이를 유도하기 위하여 callus형성을 통한 식물체나 다경 분화를 시도한다(Pierik, 1987). 홉의 경우에도 callus 형성을 위해서는 IAA 0.1 ㎎/L에 반드시 다른 cytokinin계 식물생장조절제를 첨가해주어야 하며, 다경 유도를 위해서는 TDZ 1 ㎎/L를 IAA와 같이 첨가해주는 것이 더 효율적일 것으로 보인다. 기내조직배양에서 BAP처리는 땅꽈리(Physalis angulata L.)에서 1 ㎎/L BAP처리가 가장 많은 신초를 형성하는데 효과적이었으며(Koh, 2022), 비둘기콩(Cajanus cajan L.)은 2 ㎎/L BAP처리가 다경 유도에 적합하였다(Geetha et al., 1998). 또한, 난초(Cypripedium flavum)에서는 BAP 2.22 μM에서 다경 유도가 촉진한다고 보고하였다(Yan et al., 2006). 반면, 시로미(Empetrum nigrum var. japonicum K. Koch)는 초대배양에서 BAP 사용이 다경 유도에 효과적이지 않았다(Han et al., 2010). 치커리(Cichorium intybus L.)는 TDZ 0.01 ㎎/L와 IAA 1 ㎎/L를 배지에 첨가했을 때 절편체당 최대 35.8개의 신초가 발생하였고(Yucesan et al., 2007), 만형(Vitex trifolia)은 5 μM의 TDZ가 사용된 조건에서 절편체당 22.3 개의 신초가 발생하여 다경 유도가 이루어졌다(Ahmed and Anis, 2012). 본 연구 및 기존 연구결과를 종합해 볼 때 식물 종마다 다경 유도 및 줄기 생장에 효과적인 cytokinin종류와 농도가 다른 것으로 판단된다.
Table 1.
Culture establishment from nodal explants for hop variety cascade.
| PGR, ㎎/L |
Explant response (%) | Callusz |
Stem length (㎝) |
Fresh plant weght (g) |
No. of Shoot |
No. of Total Node |
| Contol | 91.7±4.2 ab | - | 5.7±0.4 ab | 0.18±0.02 d | 2.8±0.5 cd | 10.7±0.8 b |
| IAA, 0.1 | 95.8±4.2 a | - | 4.8±0.4 bcf | 0.13±0.02 e | 2.4±0.0 de | 7.9±0.7 c |
| IAA, 0.1+ 2iP, 1 | 66.7±4.2 bc | ++ | 5.0±0.6 bc | 0.71±0.11 a | 2.0±0.0 def | 6.7±1.2 cde |
| IAA, 0.1+ 2iP, 2 | 62.5±7.2 c | ++ | 4.1±0.2 cde | 0.57±0.05 ab | 1.3±0.3 f | 5.7±0.3 defg |
| IAA, 0.1+ 2iP, 3 | 70.8±8.3 abc | +++ | 2.6±0.3 fg | 0.44±0.04 bc | 1.0±0.0 f | 3.7±0.3 g |
| IAA, 0.1+ Zeatin, 1 | 79.2±15.0 abc | ++ | 3.1±0.2 ef | 0.40±0.04 cd | 1.7±0.3 ef | 4.0±0.6 fg |
| IAA, 0.1+ Zeatin, 2 | 83.3±8.3 abc | ++ | 4.6±0.2 bcd | 0.49±0.04 bc | 1.7±0.3 ef | 7.0±0.6 bc |
| IAA, 0.1+ Zeatin, 3 | 70.8±11.0 abc | +++ | 3.9±0.8 cde | 0.54±0.04 bc | 1.3±0.3 f | 6.3±0.7 cdef |
| IAA, 0.1+ BAP, 1 | 91.7±4.2 ab | + | 6.7±0.4 a | 0.48±0.01 bc | 3.7±0.3 bc | 11.3±0.9 ab |
| IAA, 0.1+ BAP, 2 | 66.7±8.3 bc | ++ | 3.5±0.7 def | 0.41±0.04 bc | 1.0±0.0 f | 5.3±0.3 defg |
| IAA, 0.1+ BAP, 3 | 75.0±14.4 abc | ++ | 1.8±0.2 hg | 0.38±0.06 cd | 1.3±0.3 f | 4.3±0.3 efg |
| IAA, 0.1+ TDZ, 1 | 75.0±0.0 abc | ++ | 0.7±0.0 h | 0.19±0.01 e | 6.0±0.6 a | 13.3±1.2 a |
| IAA, 0.1+ TDZ, 2 | 75.0±7.2 abc | +++ | 0.6±0.1 h | 0.20±0.04 e | 4.0±0.0 b | 5.7±0.7 defg |
| IAA, 0.1+ TDZ, 3 | 79.2±8.3 abc | +++ | 0.5±0.1 h | 0.12±0.07 de | 3.3±0.3 bc | 5.3±0.7 defg |
상토 멸균 및 습도 유지기간이 순화에 미치는 영향
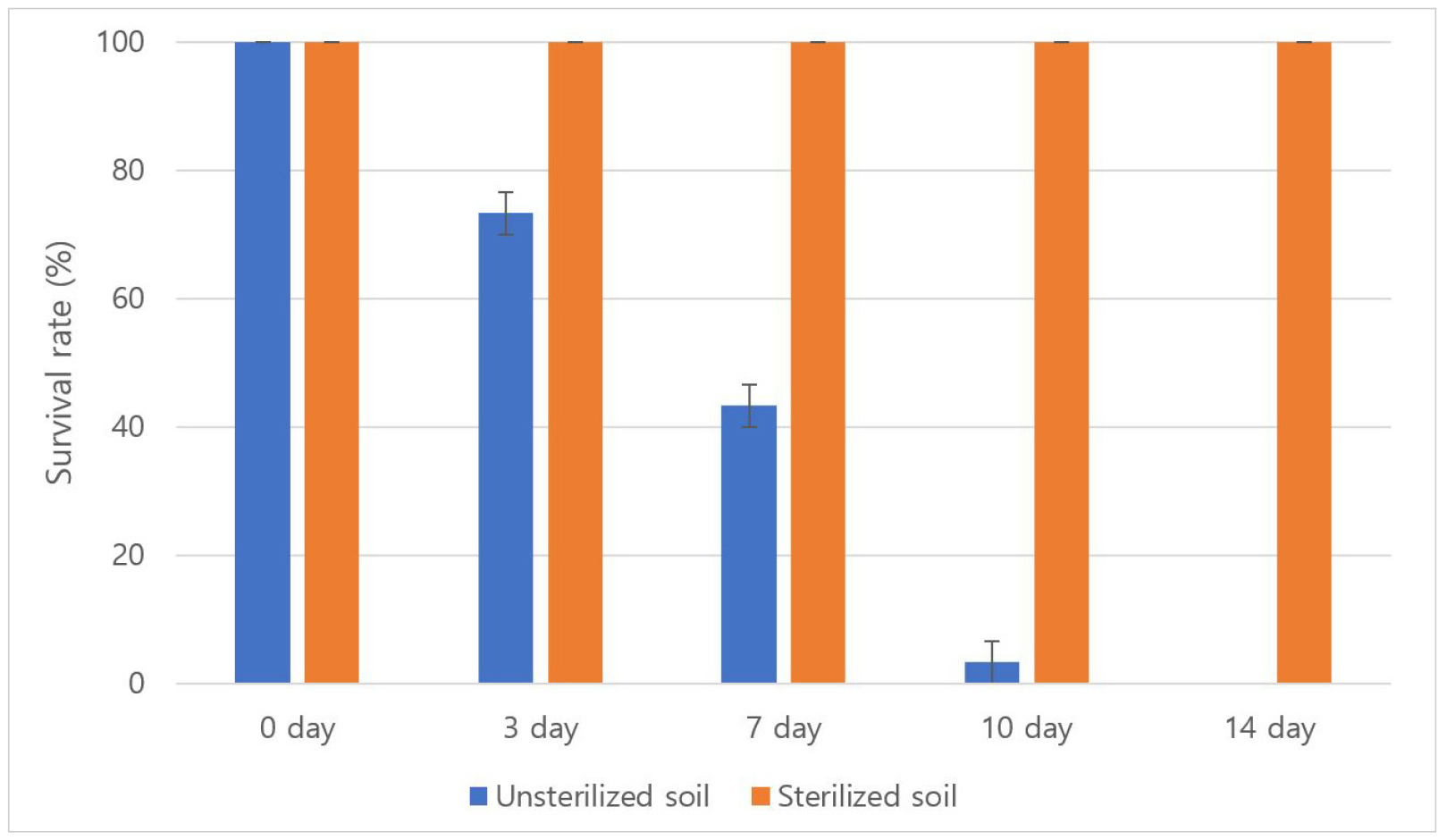
저자들은 전보(Ha et al., 2023) 기내 배양된 홉 식물체를 순화하기 하기 위하여 상토를 채운 포트에 이식을 하고 온실내 순화상에 두면 많은 식물체가 착근을 못하고 죽는 경우가 많았다(결과 미제시). 상토에 존재하는 미생물 등에 의해 식물체가 고사는 것이라고 생각되었으며, 따라서 본 연구에서는 상토 멸균 유무에 따른 순화 생존율을 확인하였다. Fig. 3은 홉 순화 과정을 나타낸 사진이다. 첫번째 순화 실험에서는 3일차에서 멸균하지 않은 상토에 식재한 그룹에서 오염이 발생하였으며(Fig. 3c), 7일차에는 개체들이 모두 고사하였다. 반면 멸균된 상토에 식재한 그룹은 실험 종료시까지 오염된 개체는 발생하지 않았으며(Fig. 4), 상토에 존재하던 미생물 등이 제거되어 오염되지 않았다고 판단된다. 두번째 순화 실험은 멸균된 상토에 식재한 그룹을 대상으로 진행하였다. 입구를 랩으로 막지 않은 것과 입구를 랩으로 감싼 다음 7일 후 제거한 그룹은 모두 고사하였다. 그러나, 14일 후 랩을 제거한 그룹은 20%가 생존하였고, 21일 후와 28일 후 입구를 감싼 랩을 제거하였을 때의 생존율이 90% 정도로 높았다(Fig. 3d, Fig. 5). 즉, 이것은 배양체 순화 시에는 고습도를 유지하는 것이 발근에 유리하기 때문으로 생각된다.
본 연구에서는 세계적으로 많이 재배되는 홉 Cascade의 식물생장조절제에 대한 조직배양 반응을 확인하였다. 이러한 연구 결과는 다른 홉 품종에도 적용하여 각 품종별로 적합한 배지 조성을 찾거나 callus 및 다경 유도를 통한 육종 연구 등 사용자의 필요에 따라 적합한 조직배양 배지 조성을 찾는데 도움이 될 것으로 판단된다. 또한, 홉 조직배양체의 순화 실험을 통해 순화 성공률을 증진시킬 수 있는 것을 확인하였다. 이러한 조직배양 기술을 이용하여 장래 국내 홉 생산체계 구축을 위한 무병묘 증식이나 육종 연구에 기여할 수 있을 것으로 기대된다.

Fig. 3.
The stages of plant tissue culture acclimation. a, b) Soil was placed in the culture bottle and covered with a lid; c) Contamination inside the culture bottle when non-sterilized soil was used; d) In vitro regenerated hop plantlets were successfully acclimatized by gradually enlarging the holes in the wrap.
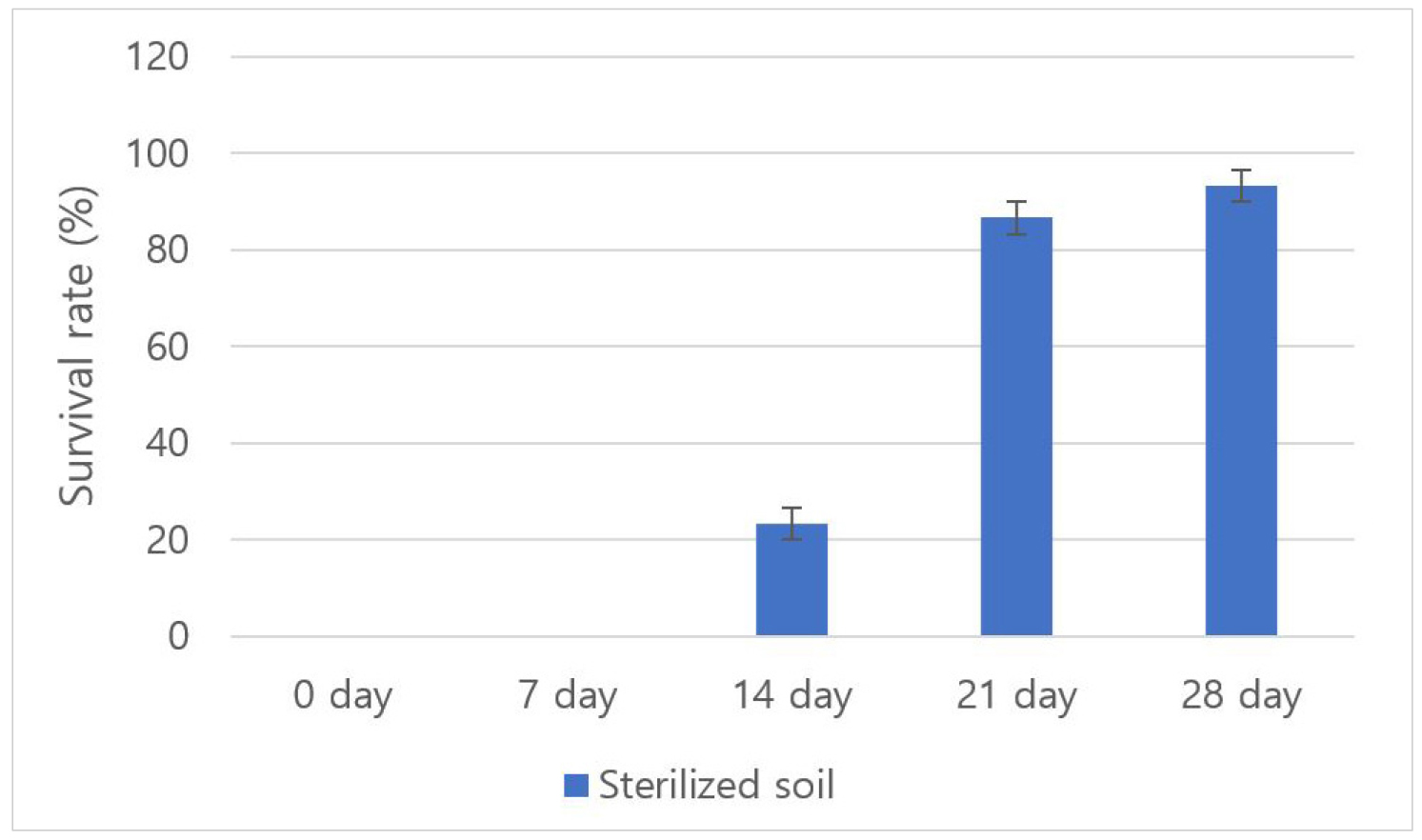
Fig. 5.
Survival rate depending on the differnece in wrapping period of entrance to the culture bottle during acclimatization of hop cultures. When the wrap covering the mouth of the culture bottle was removed at 0 days and 7 days, all hops died in vitro. However, when the wrap was removed after 21 days, more than 86.6% survived.
적 요
홉은 맥주 생산에서 풍미와 쓴 맛을 제공하며 방부제의 역할을 한다. 최근 수제 맥주 호황에 의해 외국의 홉 품종을 도입하여 국내 재배 및 생산을 도모하고 있으나, 효율적인 무병묘 생산에 있어 어려움을 겪고 있다. 이에 따라 본 연구는 홉(Humulus lupulus L.) Cascade 품종을 대상으로 조직배양 기술을 통한 효율적인 기내 증식 방법과 우량묘 생산기술을 개발하고자 수행되었다. 실험에 사용된 식물 생장조절제는 MS 배지에 auxin 계열 IAA와 cytokinin 계열의 2iP, zeatin, BAP, TDZ을 사용하였다. 식물 재료는 신초를 대상으로 정단에서 3마디를 제거하고 사용하였다. 홉 기내배양 시 재분화율은 IAA만 첨가한 조건에서 가장 높았으며, cytokinin을 함께 사용했을 때 보다 약 21% 높았다. 하지만 IAA 0.1 ㎎/L + BAP 1 ㎎/L 조건에서 재분화율이 약 91%로 우세하였다. 초장은 IAA 0.1 ㎎/L + BAP 1 ㎎/L를 사용하는 것이 유리하다. TDZ가 첨가된 배지에서 다경 유도가 이루어졌으며, control이나 IAA만 첨가된 조건의 경우 callus 형성이 이루어지지 않고 지상부와 뿌리 생장이 진행되었다. Cytokinin을 첨가한 배지에서 callus가 형성되며 무게가 증가하였다. 홉 조직배양묘의 순화 시 생존율을 높이기 위한 실험 결과, 배양병에 멸균된 상토를 넣고 상대습도를 100%로 맞추어 준 다음 점진적으로 기내의 상대습도를 낮추어 가며 21일 이후 야외로 나갔을 때 90%의 생존율을 확인하였다. 이러한 연구 결과는 다른 홉 품종에도 적용하여 각 품종별로 적합한 배지 조성을 찾거나 callus 및 다경 유도를 통한 무병묘 증식이나 육종 연구 등 사용자의 필요에 따라 적합한 조직배양 배지 조성을 찾는데 도움이 될 것으로 판단된다.