서 언
재료 및 방법
시약
추출물 제조
세포배양
Nitric oxide (NO) 측정
SDS-PAGE 및 Western blot 분석
통계분석
결과 및 고찰
산양삼 추출물의 p62/SQSTM1 단백질 수준에 미치는 영향
TLR2/4가 산양삼 추출물 매개 p62/SQSTM1 단백질 수준 증가에 미치는 영향
산양삼 추출물 매개 p62/SQSTM1 단백질 수준 증가와 관련 신호전달 분석
산양삼 추출물의 PI3K와 AMPK 신호전달 활성화에 미치는 영향
산양삼 추출물이 Nrf2 단백질 수준에 미치는 영향
적 요
서 언
백신 개발은 전염성 질병 예방과 암 면역 요법에 큰 기여를 한다. 항원과 백신 보조제가 포함된 백신은 인체의 항원 특이 항체 반응을 유도한다(Chou et al., 2020). 백신 개발에 있어 백신 보조제는 후천성 면역세포인 B 세포와 T 세포의 항원 특이적 적응성 면역 반응을 촉진하기 위해 필수적이다(Chou et al., 2020). 초기 면역 반응을 유도하기 위한 현재의 백신 개발 전략은 대식세포와 같은 항원 제시 세포에서 항원 흡수를 촉진하고, 적합한 마이크로환경을 제공하여 항원 제시 세포의 활성화를 촉진하며, 더 나아가 naive T 세포의 effector T 세포 분화를 촉진하는 것이다(Coffman et al., 2010). 현재 임상 응용에서 승인된 부가제인 AS04, MF59 및 Alum은 패턴 인식 수용체와/또는 NLRP3 인플라마좀을 활성화하여 항체 반응과 함께 T 세포 반응을 유도한다고 보고되었다(Leroux-Roels, 2010; Steinhagen et al., 2011; Toussi and Massari, 2014). 최근 연구에서는 대식세포의 자가포식을 자극하여 항원제시세포와 T 세포의 기능을 변화시킴으로써 T 세포 반응을 증강시킬 수 있다는 것이 밝혀졌다(Merkley et al., 2018).
자가포식은 세포 내 병원체나 손상된 세포 구성 요소들이 자가포식 작용에 의해 라이소솜으로 운반되어 분해되는 과정으로 대식세포의 자가포식 유도는 감염 중에 병원체에 대한 주요한 면역 메커니즘이라고 알려져 있다(Levine et al., 2011). 또한, 대식세포의 자가포식 유도는 대식세포의 항원 처리를 증가시키고 T세포의 분화를 유도함으로써 선천성과 적응성 면역 반응 간의 연결을 강화시키는 역할을 한다고 보고되고 있다(Kirkegaard et al., 2004). 이전 연구에서는 자가포식을 증가시키면 항원 제시를 촉진하여 결핵에 대한 백신의 효과를 향상시킬 수 있다고 보고되었다(Chou et al., 2020). 따라서, 자가포식 촉진제는 면역 반응을 증가시키기 위한 잠재적인 백신보조제로의 활용이 가능하다고 알려져 있다(Bah and Vergne, 2017; Flores-Valdez et al., 2018).
산지에서 차광막 등 인공시절을 설치하지 않고 생산되는 삼인 산양삼(Wild-Simulated Ginseng)은 재배삼보다 ginsenoside의 함량이 높고 약리효능이 뛰어나고 알려져 있다(Kim et al., 2020). 다양한 연구를 통해 산양삼은 항산화 활성(Kang et al., 2016; Lee et al., 2017), 항암 활성(Kim et al., 2004), 항비만 활성(Geum et al., 2021), 항염증 활성(Lee et al., 2017), 면역 증진 활성(Geum et al., 2021) 및 항지방간 활성(Park et al., 2023) 등이 있는 것으로 알려져 있다. 산양삼의 면역증진 활성에서 산양삼 추출물은 대식세포의 활성화를 유도하는 것으로 보고되었다(Geum et al., 2021). 그리하여, 본 연구에서는 산양삼의 백신보조제로의 활용가능성을 평가하기 위해, 산양삼의 대식세포에서 자가포식 유도에 미치는 영향을 조사하였다.
재료 및 방법
시약
화학적 억제제인 TAK-242, C29, PD98059, SB203580, SP600125, BAY 11-7082 및 LY294002는 Sigma-Aldrich (St. Louis, MO, USA)에서 구매되었다. 1차 항체(p38, p-JNK, p-IKK, p-IκBα, p62/SQSTM1, Nrf2 또는 β-actin)와 2차 항체(anti-rabbit 또는 anti-mouse)는 Cell Signaling (Beverly, MA, USA)에서 구매하였다.
추출물 제조
산양삼(7년근)은 경북 풍기에 위치한 산림과학원 산림약용자원연구소에서 식물학적 동정 후 제공받았다. 건조 후 분쇄된 7년근 산양삼(10 g)을 200 mL 증류수에 침지한 후 20℃, 40℃ 또는 60℃에서 24시간, 48시간 또는 72시간 동안 침지추출하였다. 그 후 15,000 rpm에서 원심분리한 후 동결건조하여 추출물을 제조하였다.
세포배양
본 연구에 사용된 세포인 마우스 유래 대식세포, RAW264.7 세포는 American Type Culture Collection (Manassas, VA, USA)에서 분양받았다. RAW264.7 세포는 10% FBS, penicillin (100 U/mL), streptomycin (100 ㎍/mL)이 첨가된 DMEM/F-12 배지를 사용하여 배양하였다. 산양삼 추출물(WSG)은 멸균 증류수에 용해시켜 세포에 처리하였다.
Nitric oxide (NO) 측정
산양삼 추출물의 RAW264.7세포에서 nitric oxide (NO) 생성에 미치는 영향은 Griess assay로 측정하였다. RAW264.7세포를 96-well plate에 well 당 2 × 105 cells로 배양하여 세포가 well에 90%이상 찼을 때, 산양삼 추출물을 처리하고 24시간 동안 배양시켰다. 24시간 후, 세포배양액과 Griess 시약 (Sigma-Aldrich, St. Louis, MO, USA)을 1:1 비율로 희석하여 상온에서 15분간 반응시킨 후 UV/Visible spectrophotometer (Xma-3000PC, Human Corporation Co., Seoul, Korea)를 이용하여 540 ㎚에서 흡광도를 측정하였다.
SDS-PAGE 및 Western blot 분석
세포로부터 단백질을 추출하기 위해, 처리 후 세포를 4℃에서 유지된 1 × phosphate-buffered saline (PBS)로 2회 세척한 후, protease inhibitor cocktail (Sigma-Aldrich Co.)과 phosphatase inhibitor cocktail (Sigma-Aldrich Co.)이 포함된 radioimmunoprecipitation buffer (Boston Bio Products, Ashland, MA, USA)를 4℃에서 30분간 처리하여 단백질을 추출하였다. 추출된 단백질은 Bicinchoninic acid protein assay (Pierce Biotechnology Inc., Waltham, MA, USA)로 정량분석 후, 동일량의 단백질을 10% SDS-acrylamide gel로 전기영동하고, PVDF membrane (Bio-Rad, Hercules, CA, USA)에 이동시킨 후 5% non-fat dry milk로 상온에서 1시간 동안 blocking 하였다. 1시간 후, 1차 항체를 5% non-fat dry milk에 용해시켜 4℃에서 16시간 동안 반응시킨 후 membrane을 0.05% tween-20이 포함된 tris-buffered saline (TBS-T)로 5분간 3회 세척하였다. 그 후 2차 항체는 5% non-fat dry milk에 용해시켜 membrane에 상온에서 1시간 처리하였고, TBS-T로 5분간 3회 세척 후 membrane은 ECL western blotting substrate (Amersham Biosciences Co., Little Chalfont, England)를 이용하여 단백질을 확인하였다.
통계분석
모든 결과는 3회 반복 측정 후 평균± 표준편차로 나타내었고, 처리간 유의성은 Student’s t-test로 검증하여 p-value 값이 0.05 미만일 때 통계적으로 유의하다고 판정하였다(Microsoft Exel 2010, Microsoft, Redmond, WA, USA).
결과 및 고찰
산양삼 추출물의 p62/SQSTM1 단백질 수준에 미치는 영향
COVID-19와 같은 바이러스 대유행은 백신 개발의 필요성을 높이고 있다. 백신 개발에서 필수적인 조성물인 백신보조제는 T세포 및 B세포의 항원 특이적인 면역 반응을 증강시키기 위해 사용된다고 알려져 있다(Chou et al., 2020). 백신보조제에 의한 항원 특이적인 면역 반응의 증강은 대식세포의 항원 제시 기능을 활성화하여 이루어진다고 보고되고 있다(Coffman et al., 2010). 대식세포의 주요 면역반응인 포식작용을 통한 병원체 제거, 면역자극인자 분비, 그리고 항원제시 기능은 자가포식과 밀접한 관련이 있으므로(Wu and Lu, 2020), 산양삼의 자가포식 유도 관련 최적 추출조건을 확인하기 위해 온도 및 시간별로 추출된 산양삼 추출물을 RAW264.7세포에 처리한 후 대식세포가 분비하는 대표적 면역자극인자인 NO의 생성을 비교·분석하였다. 그 결과(Fig. 1A) 20℃와 40℃에서 24시간에서 72시간 추출된 산양삼 추출물은 추출온도와 추출시간에 상관없이 NO의 생성을 주목할 만하게 증가시켰다. 그러나 60℃에서 24시간에서 28시간 추출된 산양삼 추출물은 NO의 생성을 유도하지 못하였고, 72시간 추출된 산양삼 추출물은 미약하게 NO의 생성을 증가시켰다. 그리하여 추후 연구는 40℃에서 24시간 추출된 산양삼 추출물을 사용하였다.
p62/SQSTM1 (p62/sequestosome 1)은 자기포식과정에서 중요한 화물 수용체(cargo receptor)로 알려져 있다(Lamark et al., 2009). p62/SQSTM1은 침입한 병원체를 유비퀴틴화된 집합체로 변환하고 이들을 자가포식체에 수용하여 분해하는 역할을 한다(Komatsu and Ichimura, 2010). 게다가 p62/SQSTM1은 침입성 병원체를 대상으로 해서, 이러한 병원체의 자가포식에 있어서 매우 중요한 역할을 한다고 알려져 있다(Zheng et al., 2009). 그리하여 산양삼 추출물이 RAW264.7세포의 자가포식에 미치는 영향을 조사하기 위해, 산양삼 추출물이 처리된 RAW264.7 세포에서 p62/SQSTM1 단백질 발현을 측정했습니다. Fig. 1B와 같이, p62/SQSTM1 단백질 은 산양삼 추출물 처리 3시간째 최고로 증가하였으며, 그 이후 서서히 감소하는 것으로 나타났다. 또한, 산양삼 추출물은 농도 의존적으로 p62/SQSTM1 단백질 발현도 증가시켰다(Fig. 1C). 이러한 결과는 산양삼 추출물이 대식세포의 자가포식 유도에 긍정적인 영향을 미칠 수 있다는 것을 보여준다.
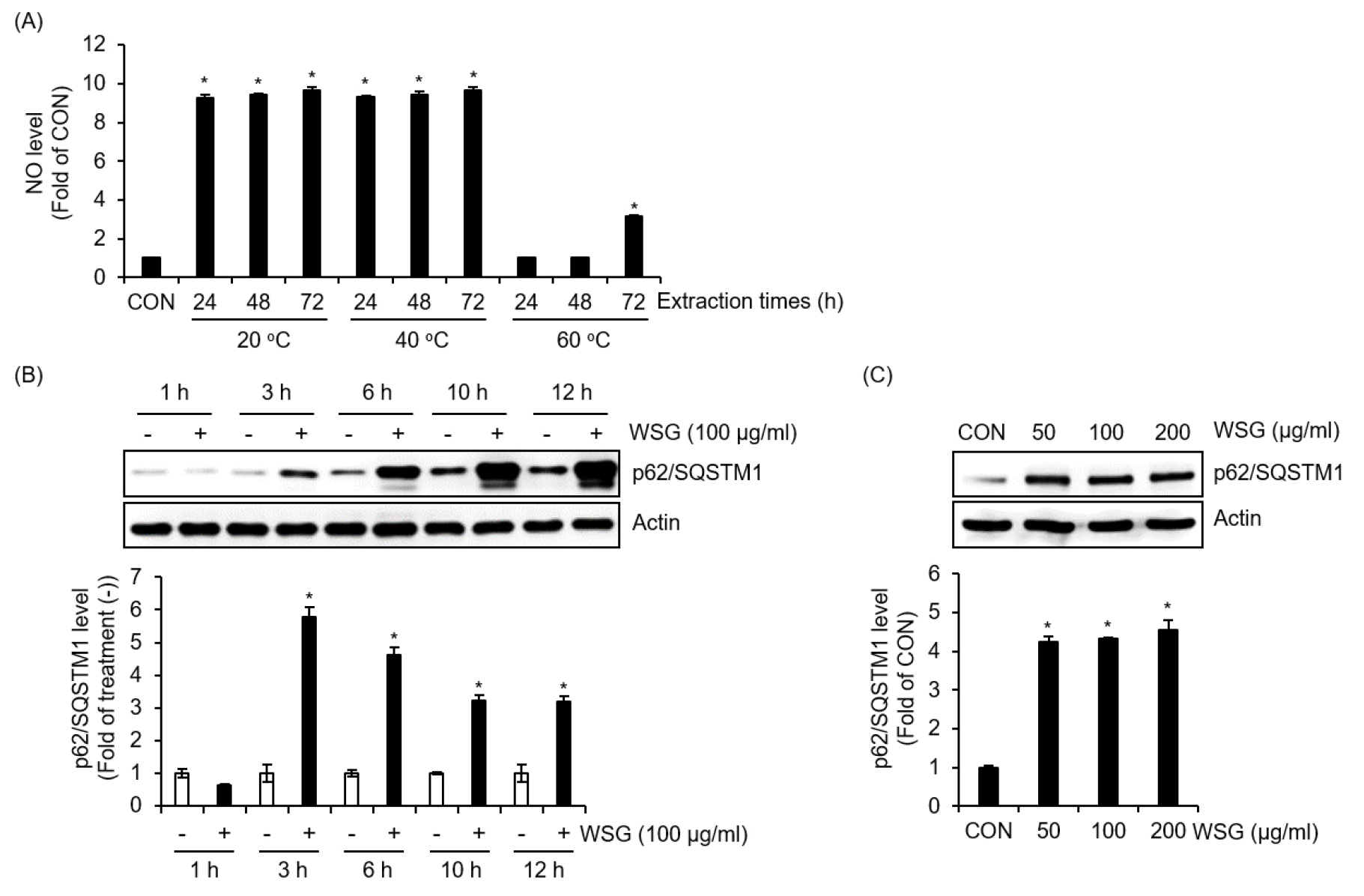
Fig. 1.
The effect of WSG on the expression of p62/SQSTM1 in RAW264.7 cells. (A) WSG (100 ㎍/mL) extracted under different temperature or time conditions were treated in RAW264.7 cells for 24 h. NO levels were determined using the Griess assay. (B) RAW264.7 cells were treated with WSG (100 ㎍/mL) at the indicated times. The level of p62/SQSTM1 was analyzed by Western blot analysis. (C) RAW264.7 cells were treated with WSG at the indicated concentration. The level of p62/SQSTM1 was analyzed by Western blot analysis.
TLR2/4가 산양삼 추출물 매개 p62/SQSTM1 단백질 수준 증가에 미치는 영향
대식세포는 Toll-like receptors (TLRs)를 통해 외부 병원체를 인식하여 체내 면역반응을 시작하는데, 이는 체내 면역방어에 매우 중요한 과정으로 알려져 있다(Chou et al., 2020). 최근 연구에서는 TLRs이 자가포식을 유도함으로써 대식세포의 항원처리 및 항원제시능을 증진시키는 것으로 보고되고 있다(Chou et al., 2020). 따라서 우리는 TLR2 및 TLR4의 산양삼 추출물에 의한 p62/SQSTM1 단백질 증가에 미치는 영향을 분석하였다. 그 결과 산양삼 추출물은 p62/SQSTM1의 단백질 증가를 유도하였다(Fig. 2). 그러나 산양삼 추출물만 처리된 세포와 비교할 때, TLR2 억제제인 C29, 그리고 TLR4 억제제인 TAK-242 존재 하 산양삼 추출물이 처리된 RAW264.7세포에서도 p62/SQSTM1의 증가가 나타났다(Fig. 2). 비록 TLRs에 의존하는 자가포식은 자가포식체를 통해 외부 병원체를 제거하는 것을 촉진시킨다고 보고되었지만(Xu et al., 2007) 본 연구결과를 미루어 볼 때 산양삼 추출물에 의한 p62/SQSTM1의 증가는 TLR2와 TLR4 비 의존적인 것으로 판단된다. 비록 본 연구에서 TLRs 중 TLR2와 TLR4 경로만 확인한 것이 본 연구의 제한점이기 때문에 추후 연구를 통해 산양삼 추출물 매개 p62/SQSTM1 증가와 관련된 다른 TLRs의 구명이 필요할 것으로 판단된다. 실제로 TLR2와 TLR4 외에 TLR3, TLR5, TLR7 또는 TLR9 등이 대식세포의 자가포식 유도에 관련이 있다고 알려져 있다(Delgado and Deretic, 2009).
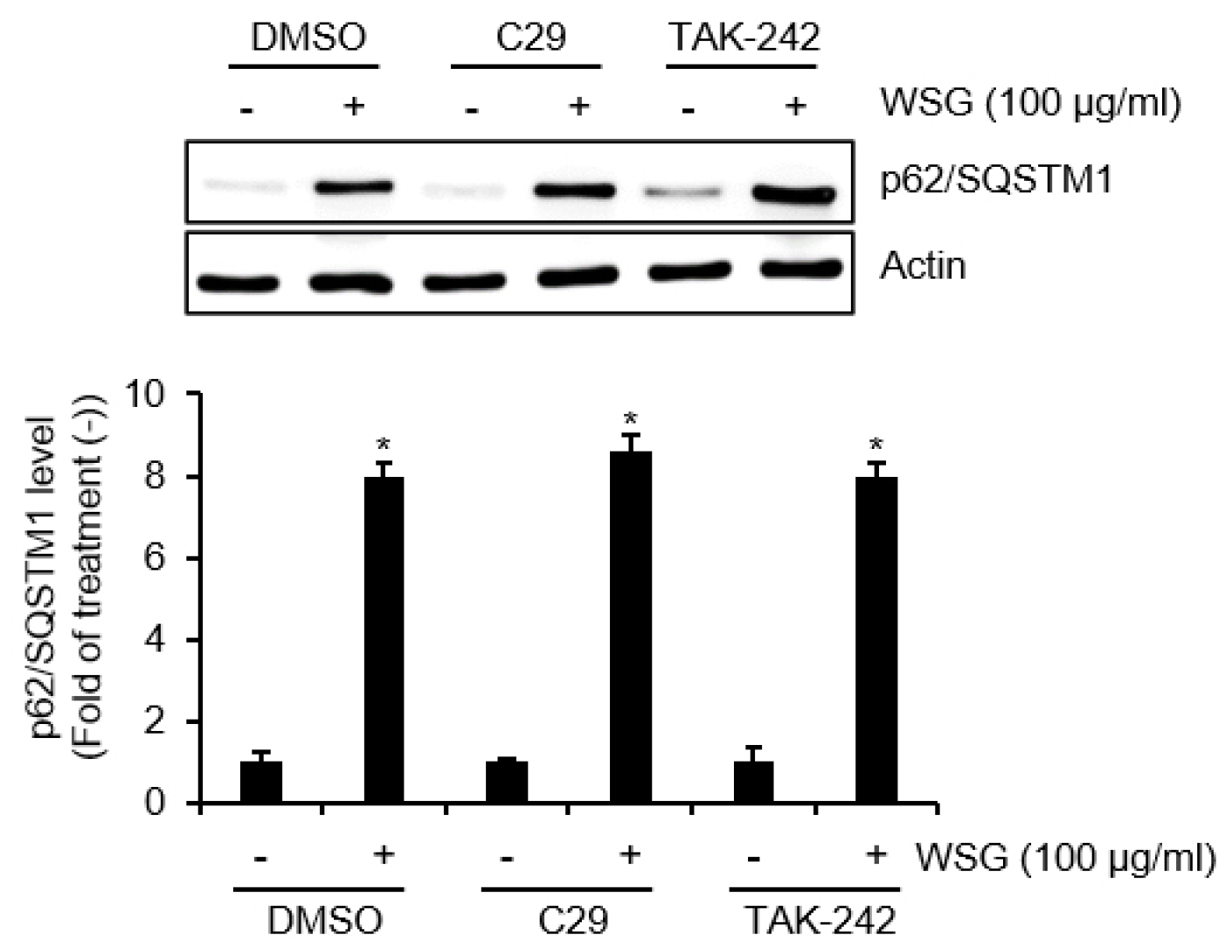
Fig. 2.
The effect of TLR2/4 on the WSG-mediated expression of p62/SQSTM1 in RAW264.7 cells. RAW264.7 cells were treated with WSG (100 ㎍/mL) in the absence or presence of C29 (TLR2 inhibitor, 100 nM) or TAK-242 (TLR4 inhibitor, 10 ㎍/mL) for 3 h. The level of p62/SQSTM1 was analyzed by Western blot analysis.
산양삼 추출물 매개 p62/SQSTM1 단백질 수준 증가와 관련 신호전달 분석
산양삼 추출물에 의한 p62/SQSTM1 단백질 증가와 관련 신호전달을 구명하기 위해 RAW264.7세포에 kinase 억제제를 전처리하고 산양삼 추출물을 처리한 다음 Western blot 분석으로 p62/SQSTM1 단백질의 변화를 확인하였다. 그 결과 MAPK 신호전달 중 PD98059에 의한 ERK1/2 억제, SB203580에 의한 p38 억제 그리고 SP600125에 의한 JNK의 억제는 산양삼 추출물 매개 p62/SQSTM1 단백질의 증가에 아무런 영향이 없는 것으로 나타났다(Fig. 3A). 또한 BAY 11-7082에 의한 NF-κB 신호전달 억제도 산양삼 추출물 매개 p62/SQSTM1 단백질의 증가에 아무런 영향이 없었다(Fig. 3B). 본 결과를 미루어 볼 때, 산양삼 추출물 매개 p62/SQSTM1 단백질의 증가는 MAPK와 NF-κB 신호전달에 비 의존적이라고 생각된다. 그러나 LY294002에 의한 PI3K 신호전달 억제와 Compound C에 의한 AMPK 신호전달 억제는 산양삼 추출물에 의한 p62/SQSTM1의 단백질 증가를 주목할 만하게 감소시켰다(Fig. 3C, 3D). 실제로 PI3K 신호전달은 자가포식에 의한 자가포식체 형성을 통한 병원체들의 리소솜 분해에 필수적이라고 알려져 있다(Iershov et al., 2019). 게다가 AMPK의 활성화도 p62/SQSTM1 단백질 증가를 통한 자가포식 유도에 관련이 있다고 보고되었다(Puissant and Auberger, 2010). 따라서, 본 연구의 결과와 선행보고들을 미루어 볼 때 산양삼 추출물은 PI3K와 AMPK 신호전달 활성화를 통해 p62/SQSTM1 단백질을 증가시켜 자가포식을 유도하는 것으로 사료된다.
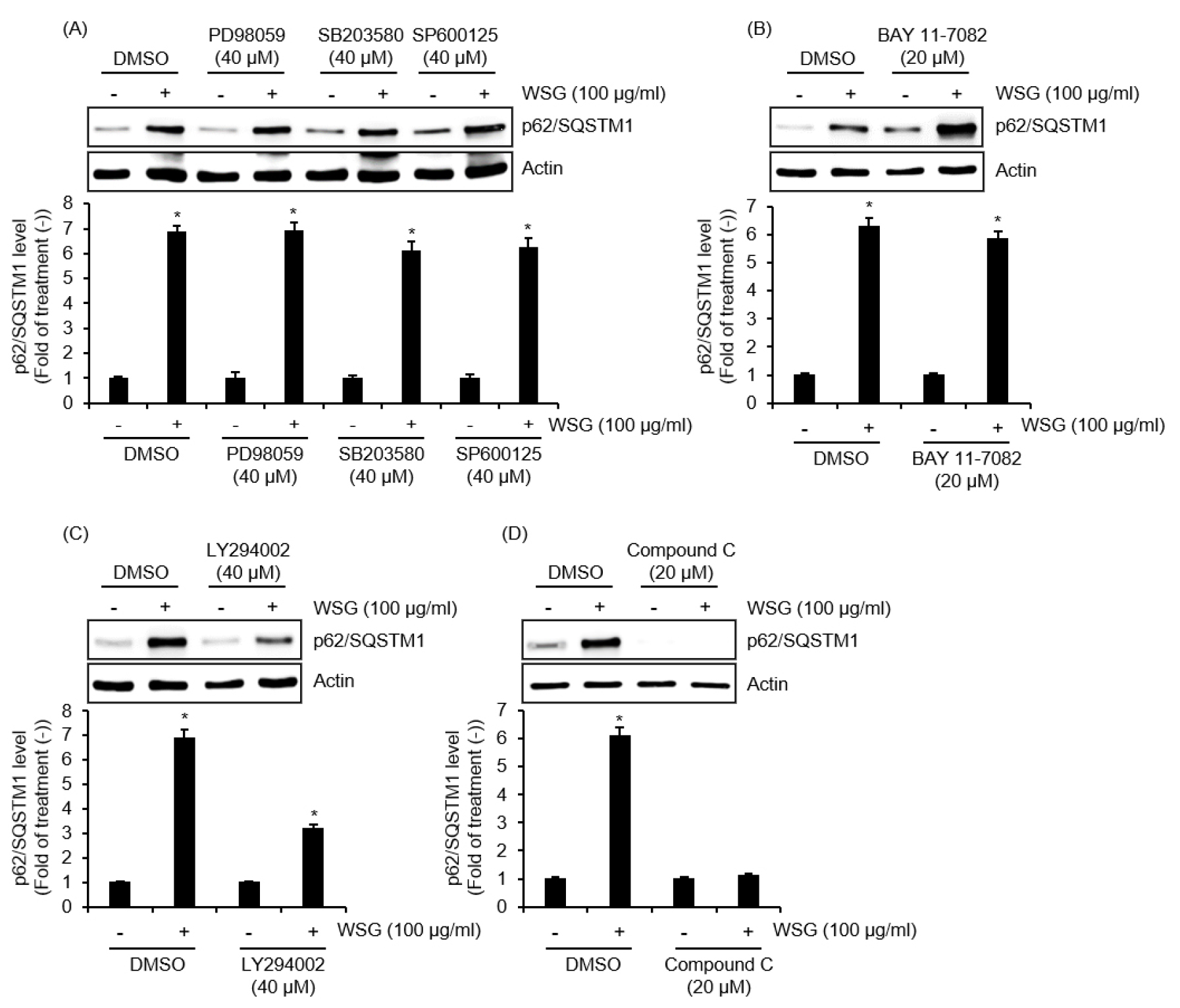
Fig. 3.
The effect of various kinase on the WSG-mediated expression of p62/SQSTM1 in RAW264.7 cells. RAW264.7 cells were pre-treated PD98059 (40 μM), SB203580 (40 μM), SP600125 (40 μM), BAY 11-7082 (20 μM), LY294002 (40 μM) or Compound C (20 μM) for 2 h and then co-treated with WSG (100 ㎍/mL) for 3 h. The level of p62/SQSTM1 was analyzed by Western blot analysis.
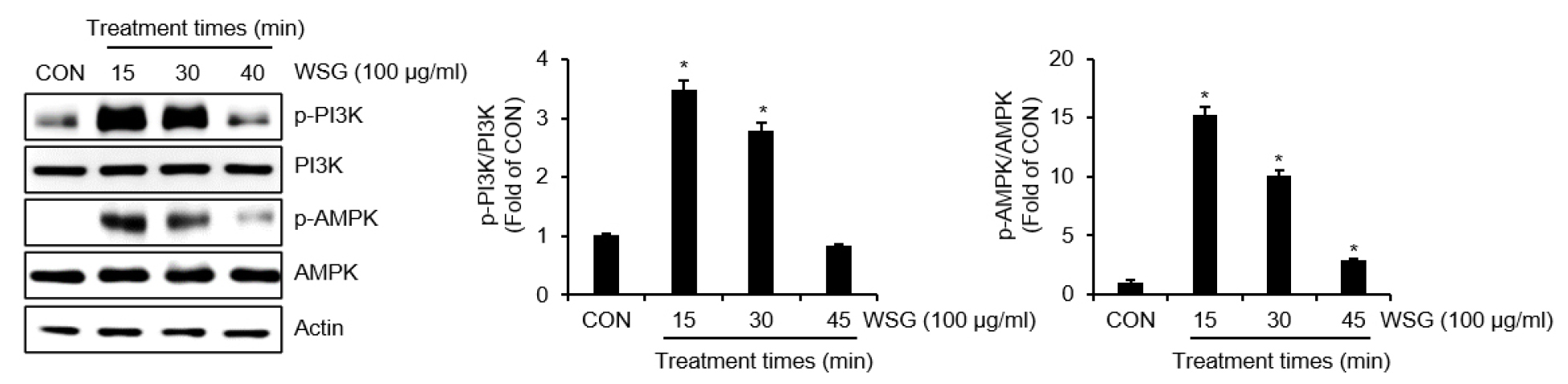
산양삼 추출물의 PI3K와 AMPK 신호전달 활성화에 미치는 영향
산양삼 추출물은 PI3K와 AMPK 신호전달을 의존해서 p62/SQSTM1 단백질을 증가시켰기 때문에, 산양삼 추출물의 PI3K와 AMPK 신호전달 활성화에 대한 영향을 분석하였다. 그 결과 산양삼 추출물은 PI3K와 AMPK 신호전달 활성화 지표인 PI3K와 AMPK를 처리 15분부터 급격하게 인산화시키는 것으로 나타났다(Fig. 4). 본 결과를 미루어 볼 때 산양삼 추출물은 PI3K와 AMPK의 활성화를 유도하는 것으로 판단된다.
산양삼 추출물이 Nrf2 단백질 수준에 미치는 영향
Nrf2는 p62/SQSTM1의 발현을 증가시켜 자가포식 과정에 관여함으로 선천성 면역반응의 활성화에 관여한다고 보고되었다(Fujita et al., 2011a, 2011b; Thimmulappa et al., 2006). 그리하여 산양삼 추출물이 Nrf2의 발현에 미치는 영향을 조사한 결과, 산양삼 추출물이 처리된 RAW264.7 세포에서 Nrf2의 발현이 증가하는 것으로 나타났다(Fig. 5A). 산양삼 추출물에 의한 p62/SQSTM1의 증가가 PI3K와 AMPK 신호전달 활성화에 의존하기 때문에 PI3K와 AMPK 신호전달이 산양삼 추출물 매개 Nrf2의 발현에 미치는 영향을 조사하였다. 그 결과 LY294002에 의한 PI3K와 Compound C에 의한 AMPK 신호전달의 억제는 산양삼 추출물 매개 Nrf2의 발현 증가를 유의적으로 감소시켰다(Fig. 5B). 따라서 본 결과들은 산양삼 추출물은 PI3K와 AMPK의 활성화를 통해 Nrf2의 발현을 증가시키는 것으로 사료된다.
본 연구에서 도출된 결과를 종합해 볼 때 산양삼 추출물은 PI3K와 AMPK을 활성화하여 Nrf2의 발현을 증가시킴으로써 p62/SQSTM1을 증가시키는 것으로 사료된다(Fig. 5C).
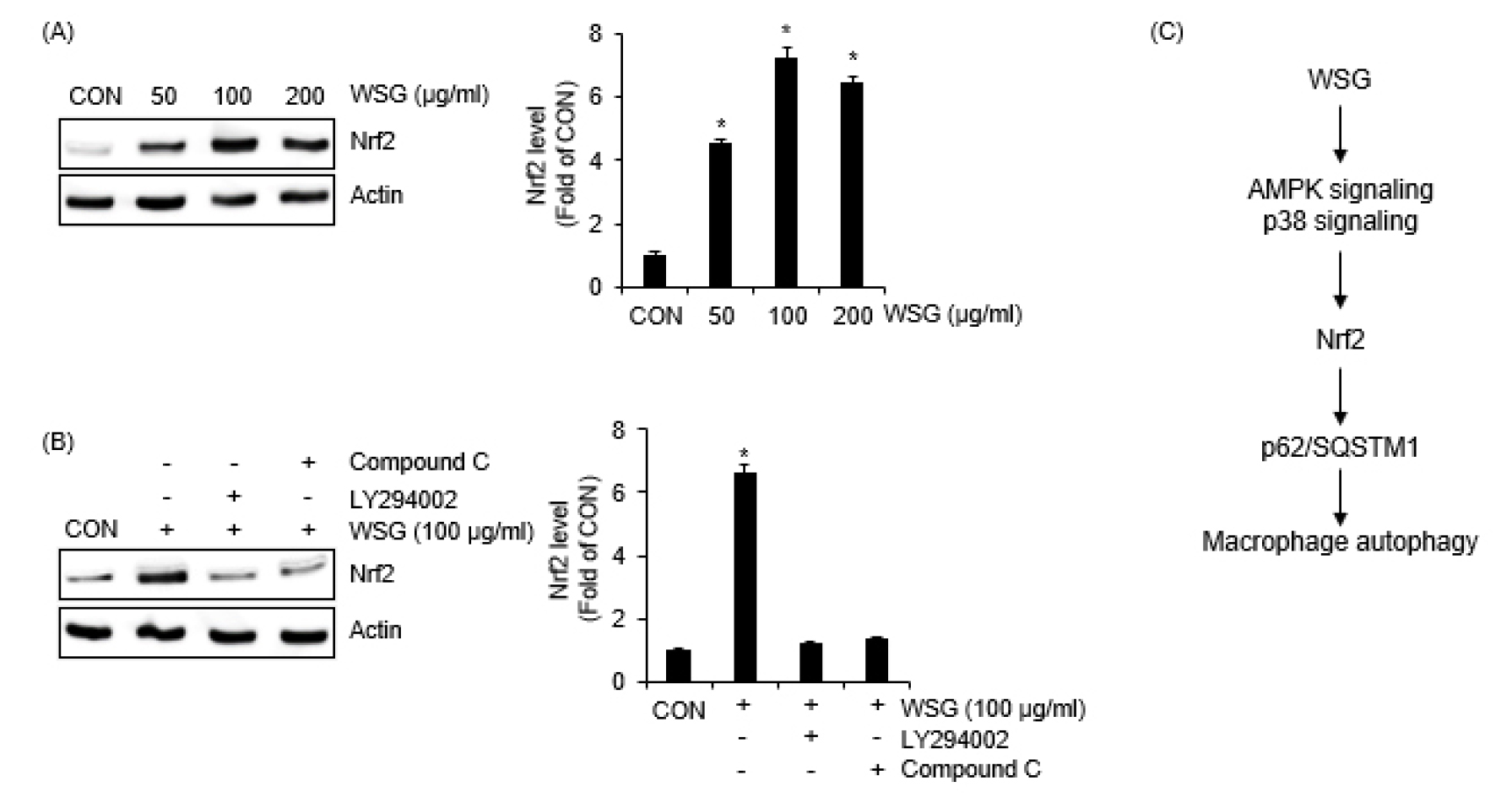
Fig. 5.
The effect of WSG on the expression of Nrf2 in RAW264.7 cells. (A) RAW264.7 cells were treated with WSG (100 ㎍/mL) for 1 h. The level of Nrf2 was analyzed by Western blot analysis. (B) RAW264.7 cells were pre-treated with LY294002 (40 μM) or Compound C (20 μM) and then co-treated with WSG (100 ㎍/mL) for 1 h. The level of Nrf2 was analyzed by Western blot analysis. (C) The potential mechanism for WSG-mediated autophagy in macrophages.
적 요
본 연구에서 우리는 산양삼 추출물이 PI3K와 AMPK을 활성화하여 Nrf2의 발현을 증가시킴으로써 p62/SQSTM1을 증가시킨다는 것을 확인하였고, 이것은 산양삼 추출물이 대식세포의 자가포식을 유도할 수 있다는 것을 나타낸다. 대식세포의 자가포식 유도는 선천성과 적응성 면역 반응 간의 연결을 강화해 백신 보조제 개발에 있어서 중요한 표적으로 사용되기 때문에, 산양삼 추출물은 백신개발에 필수적인 백신보조제로의 활용이 가능할 것으로 생각된다. 그러나 실제로 산양삼 추출물이 백신보조제로의 활용 가능성을 재검증하기 위한 in vivo 연구가 필요하다고 판단된다.