서 언
재료 및 방법
실험 재료 및 시료 제조
재료 및 시약
Chlorogenic acid 분석
항산화 활성 측정
총 폴리페놀 및 총 플라보노이드 함량 측정
세포독성
NO 생성 억제
염증성 사이토카인 분비 억제
항균활성 측정
소화효소 활성 측정
통계처리
결과 및 고찰
Chlorogenic acid 함량
항산화 활성
총 폴리페놀 및 총 플라보노이드 함량
RAW 264.7 세포의 항염 활성
Caco-2 세포의 항염 활성
항균활성
소화효소활성
적 요
서 언
Aralia elata는 두릅나무과(Araliaceae)에 속하는 식물로서 한국, 일본, 중국 북동부, 러시아 등에 자생하고 있으며, 민간에서 약용 또는 식용으로 섭취하고 있다. 두릅나무는 한방에서 신장병, 당뇨병, 간염, 및 위장질환 등의 치료에 사용하고 있다(Cha et al., 2009; Kwon et al., 2018; Qi et al., 2018). 약리성분은 triterpenoid saponin, sitosterol, choline, 3,4-dihydroxybenzoic acid, oleanolic acid, echinocystic acid, palmitic acid, echinocystic acid, linoleic acid, hederagenin, methyl eicosanoate, congmuyanosides A, C, D, 3,4-dihydroxybenzoic acid 등을 함유하고 있다(Ahn et al., 2017; Jin et al., 2017; Kwon et al., 2018). 약리작용은 혈당 조절에 의한 당뇨 개선, 항산화, 항염증, 알코올 흡수저해, 피부 광노화억제, 간세포 보호 등의 효과가 있는 것으로 알려져 있다(Cha et al., 2009; Kwon et al., 2018; Qi et al., 2018). 두릅의 어린순과 잎은 독특한 풍미와 맛을 가지고 있어 봄철에 나물로 식용하고 있다. 두릅의 어린순과 잎에는 ascorbic acid, retinol, β-carotene, chlorogenic acid, 5-O-caffeoylquinic acid, 3,5-di-O-caffeoylquinic acid 등을 함유하고 있다(Ahn et al., 2017; Cha et al., 2009; Kim et al., 2013). Chlorogenic acid는 caffeic acid와 quinic acid가 ester 결합한 hydroxy cinamic acid에 속하는 폴리페놀 화합물로서 커피, 사과, 블루베리, 향신료, 채소류, 와인, 올리브오일, 고구마 등 다양한 식품소재에 함유되어 있다(Chung et al., 2011; Kim, et al., 2018; Lee et al., 2018). Chlorogenic acid는 탄수화물을 분해하는 효소인 α-glucosidase를 억제시켜 탄수화물과 포도당의 흡수를 감소시킴으로써 식후 혈당 강하를 통한 항당뇨 효능과 과산화 지질 생성 억제, 콜레스테롤 생합성 억제, 혈장 및 간의 지방 감소, 항산화, 항암, 세포보호, 혈압강하 등의 효능을 나타낸다(Chung et al., 2011; Lee et al., 2018; Oboh et al., 2015).
최근 감염성 질환이 증가하고 있다. 특히 coronavirus disease 2019 (COVID-19)가 확산됨에 따라 현대인들의 식생활이 무공해 건강식품을 선호하여 신선채소에 대한 관심이 증가하고 있다. 또한 항산화 활성, 면역증진 등의 효능을 갖고, 인체 부작용이 적고 건강증진에 도움이 되는 천연자원식물에 대한 관심이 증가함에 따라 관련 연구가 증가하고 있다(Cha and Kim, 2008; Jun et al., 2014). 학술적으로 천연자원식물에 대한 생리활성이 검증됨에 따라 이들을 재배하는 농가가 증가하였고, 농가의 고소득 작물로 인정받고 있다. 전북 순창지역은 지형적 특성과 기후가 두릅재배에 적합하여 전국 생산량의 약 70%를 차지하고 있으며, 지역 특산물로 각광받고 있다. 본 연구를 통해 순창에서 전북 순창에서 생산되는 두릅의 항산화, 항염, 항균, 소화효소 활성을 검증하였으며, chlorogenic acid 함량을 분석하였기에 보고하고자 한다.
재료 및 방법
실험 재료 및 시료 제조
전북 순창에서 생산된 두릅을 순창군농산물직판장에서 구입하여 빛깔, 모양 등 외부형태를 확인하고 강원대학교 산림환경과학대학 최선은 교수에게 검증받은 후 실험에 사용하였으며, 표본(SCAE-2000)은 (재)순창건강장수연구소에 보관되어 있다. 시료는 수세하여 이물질을 제거하고 10 ㎜ 두께로 자른 후 동결건조기(CLN-50C, Nihon freezer, Tokyo, Japan)를 이용하여 동결 건조시킨 후 분쇄기(HR3752/00, Philips, Amsterdam, Netherlands)로 분쇄하여 1:5 비율로 40% EtOH을 첨가하고 25℃에서 4시간 추출하였다. 추출물은 원심분리기(Super-22K, Hanil Science, Incheon, Korea)를 이용하여 10분간 3,000 × g로 원심분리하고 상등액 내 고형물의 제거를 위해 여과지(Advantec NO. 2, Tokyo, Japan)를 이용하여 감압 여과시켰다. 여과액은 감압농축기(N-1000, Eyela, Tokyo, Japan)를 사용하여 30 brix로 농축시킨 후, 동결건조기를 사용하여 완전히 건조시켜 분말(AEE, 3.16 g, 15.8%)로 제조하여 -20℃에 보관하면서 실험에 사용하였다.
재료 및 시약
2,2-diphenyl-1-picryl hygrazyl (DPPH), 2,2-azino-bis[3-ethylbenzothiazoline-6-sulfonic acid] (ABTS), pyrogallol, gallic acid, ascorbic acid, quercetin, Folin-Ciocalteu's phenol reagent, minimum essential media (MEM), 2’,7’-dichlorofluorescein diacetate (DCFH-DA), potassium persulfate (K2S2O8), 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT), lipopolysaccharide (LPS), amoxicillin, sulfanilamide, 2,2’-azobis(2-amidinopropane) dihydrochloride는 Sigma-Aldrich (St. Louis, MO, USA)사, agar powder는 Daejung (Siheung, Korea)사, brucella broth는 Difco (Detroit, MI, USA)사, Welgene (Seoul, Korea)사, Dulbecco’s modified Eagle’s medium (DMEM)은 Gibco (Grand island, NY, USA)사, penicillin-streptomycin (PS), fetal bovine serum (FBS)는 HyClone (Pittsburgh, PA, USA)사, mouse TNF ELISA kit는 BD Biosciences (San Diego, CA., USA)사 제품을 사용하였다.
Chlorogenic acid 분석
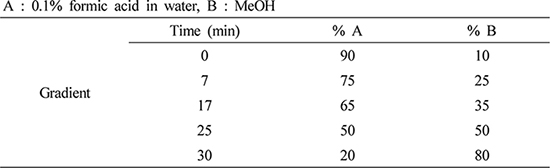
AEE (두릅 40% EtOH 추출물) 1 g에 MeOH (Burdick & Jackson Co., Muskegon, MI, USA) 50 mL를 넣고 30분 초음파 추출 후, 0.45 ㎛ syringe filter (Whatman Co., Buckinghamshire, UK)로 여과하여 분석하였다. Chlorogenic acid (Sigma Chemical Co., USA) 표준용액은 MeOH을 이용하여 1 ㎎/mL로 조제한 후 0.2 ㎛ syringe filter (Whatman Co., Buckinghamshire, UK)로 여과하여 분석하였다(Fig. 1). HPLC 시스템은 Agilent 1200 series (Agilent Technologies, CA, USA) DAD detector는 G1315D 1200 Series (Agilent Technologies, CA, USA), 컬럼은 ZORBAX Eclipse Plus C18 (5 ㎛, 250 × 4.6 ㎜, Agilent Technologies, CA, USA)를 이용하여 25℃에서 분석하였다. 이동상은 0.1% formic acid (A)와 MeOH (B), 유속은 1.0 mL/min, 시료 20 μL를 주입하여 검출파장 254 ㎚에서 분석하였으며, 분석조건은 Table 1과 같다. 모든 용매는 사용 전 탈기 및 여과하여 사용하였다. Chlorogenic acid의 정량곡선은 피크 면적비와 농도 그래프를 작성하여 함량을 분석하였다(Kang et al., 2016; Suh et al., 2014).
Table 1.
Analytical conditions of HPLC
항산화 활성 측정
DPPH 라디칼 소거활성은 시료 40 μL (312.5-10,000 ㎍/mL)와 0.2 mM DPPH 용액 180 μL을 혼합하고 37℃에서 30분간 반응시킨 후 microplate reader (Infinite M200 Pro, Zurich, Switzerland)를 이용하여 흡광도(515 ㎚)를 측정하였다. DPPH 라디칼 소거활성은 아래 식을 이용하여 산출하였고, Microsoft Office Excel 2018 (Microsoft Co., Redmond, WA., USA)를 사용하여 DPPH 라디칼을 50% 소거하는 농도(SC50)를 계산하였다. 대조군으로 L-ascorbic acid를 사용하였다(Wang et al., 2005).
ABTS 라디칼 소거활성을 측정하기 위한 반응용액은 7 mM ABTS 용액에 2.4 mM의 potassium persulfate를 혼합하여 12시간 동안 반응시켜 흡광도가 734 ㎚ 파장에서 1.0이 되도록 조정하였다. 농도별로 제조된 시료 10 μL와 ABTS 반응용액 190 μL을 혼합한 후 상온에서 10분간 반응시켜 microplate reader를 이용하여 734 ㎚에서 흡광도를 측정하였다. ABTS 라디칼 소거활성은 아래 식에 대입하여 산출하였고, Microsoft Office Excel 2018를 사용하여 ABTS 라디칼을 50% 소거하는 농도(SC50)을 계산하였다. 대조군으로 L-ascorbic acid를 사용하였다(Berg et al., 1999).
총 폴리페놀 및 총 플라보노이드 함량 측정
총 폴리페놀 함량은 농도별로 조제한 시료 1 mL에 1 N Folin-Ciocalteu's reagent 용액 0.5 mL와 5% Na2CO3 용액 1 mL를 첨가한 후 1시간 동안 암소에서 반응시킨 후 분광광도계(Agilent 8453, Agilent, CA, USA)를 이용하여 흡광도 725 ㎚에서 분석하였다. 총 폴리페놀 함량은 gallic acid의 표준곡선(25-200 μL/mL, 회귀식 y=0.0055x-0.0318, R2=0.9969)을 이용하여 측정하였으며, 총 폴리페놀 함량을 ㎎ gallic acid equivalent(GAE)/g으로 나타내었다(Singleton and Rossi, 1965). 총 플라보노이드 함량은 농도별로 제조된 시료 0.5 mL에 1 M potassium acetate 용액 0.1 mL, 10% aluminum nitrate 용액 0.1 mL, EtOH 4.3 mL 첨가하여 40분간 실온에서 반응시킨 후 흡광도 415 ㎚에서 분석하였다. 총 플라보노이드 함량은 quercetin의 표준곡선(20-100 μL/mL, 회귀식 y=0.0014x+0.0011, R2=0.9989)을 이용하여 측정하였으며, 총 플라보노이드 함량을 ㎎ quercetin(QE)/g으로 나타내었다(Moreno et al., 2000).
세포독성
대식세포주 RAW 264.7 세포와 결장직장암세포주 Caco-2 세포에 대한 독성을 측정하기 위하여 96 well plate에 RAW 264.7 세포를 1×105 cells/well의 농도로 분주하고 5% CO2 배양기에서 37℃, 24시간 배양하였다. 배양된 세포에 농도별로 조제된 시료를 처리하고 24시간 배양한 후 0.5 ㎎/mL의 MTT 용액으로 4시간 동안 반응시킨 후 상등액을 제거하였다. 생성된 formazan은 DMSO 100 μL를 첨가하여 흡광도 540 ㎚에서 측정하였다(Alley et al., 1988; Boligon et al., 2014). Caco-2 세포를 96 well plate에 2.5×105 cells/well의 농도로 분주하고 5% CO2 배양기에서 37℃, 24시간 배양한 후 상기와 동일한 방법으로 측정하였다(Shon et al., 2010; Walia and Chen, 2020).
NO 생성 억제
대식세포인 RAW 264.7 세포주에 농도별로 조제된 시료를 2시간 동안 전처리하고 NO 생성을 유도하기 위하여 LPS를 1 ㎍/mL 농도로 처리한 후 24시간 동안 37℃, 5% CO2 incubator에서 배양하였다. 이후 배양액에 griess 시약(0.1% N-(1-naphtyl) ethylenediamine : 1% sulfanilamide = 1:1)을 처리하여 반응시킨 후 570 ㎚에서 흡광도를 측정하였다. NO 함량은 sodium nitrate 표준곡선을 활용하여 계산하였으며, NO 생성 억제 활성은 시료를 처리하지 않은 대조군을 기준하여 백분율로 계산하였다(Green et al., 1982). 인간 결장직장암 세포주인 Caco-2 세포주로부터 NO 생성을 측정하기 위하여 Caco-2 세포를 2.5×105 cells/mL의 농도로 분주하여 37℃, 5% CO2 배양기에서 48시간 배양한 후 상기와 동일한 방법으로 측정하였다(Romier-Crouzet et al., 2009).
염증성 사이토카인 분비 억제
상기와 같은 조건에서 24시간 배양된 RAW 264.7 세포에 농도별로 조제한 시료를 2시간 동안 전처리한 후 LPS를 처리하여 24시간 배양한 다음, 배양된 세포의 상층액을 수거하여 실험에 사용하였다. 염증성 사이토카인은 ELISA MAXTM Deluxe Set (BioLegend, San Diego, CA, USA) ELISA kit를 이용하여 TNF -α, IL-1β, IL-6 생성량을 manufacturer’s instruction에 따라 측정하였다(Jo et al., 2019, Rahbari et al., 2021).
항균활성 측정
Salmonella typhimurium, Listeria monocytogenes와 Helicobacter pylori에 대한 AEE의 항균활성은 한천 확산법(agar well diffusion)과 디스크 확산법(paper disc diffusion)으로 clear zone 생성을 측정하였으며, 최소성장억제농도(minimum inhibitory concentration; MIC)와 최소살균농도(minimum bactericidal concentration; MBC)는 broth microdilution method으로 측정하였다. 시료가 농도별로 첨가된 LB broth에 negative control과 균주 처리군을 나누어 Salmonella typhimurium, Listeria monocytogenes 균을 균일하게 접종한 후 24시간, 37℃에서 배양하고 흡광도 600 ㎚에서 흡광도를 측정하여 균주의 생장 변화에 기초하여 MIC를 측정하였다. 시료에 대한 살균작용을 확인하고 항균활성의 역가를 측정하기 위하여 생균수 측정법으로 MBC를 결정하였다. 배양한 균주배양액에 시료를 MIC보다 높은 400 ㎎/mL까지 첨가하고 LB agar 배지에 도포한 후 24시간 배양시킨 후 생균수를 측정하여 사멸된 균수가 99.9%가 넘는 최소농도를 MBC로 결정하였다(Akbar et al., 2019; Jo et al., 2019; Lehrer et al., 1991; Osuagwu et al., 2021). 농도별로 제조된 시료가 첨가된 Brucella broth 배지를 균일하게 분주한 후 H. pylori 균주를 0.5×107 CFU/mL씩 첨가하여 10% CO2 배양기에서 37℃, 24시간 배양하였다. 상기와 같은 방법으로 균주의 생장 변화 및 사멸 정도를 측정하여 MIC와 MBC 농도를 결정하였다(Takarada et al., 2004).
소화효소 활성 측정
α-Amylase의 효소활성은 1.0%(w/v) soluble starch solution (20 mM sodium phosphate buffer에 6.7 mM sodium chloride, pH 6.9) 250 μL와 시료액 500 μL를 혼합하여 30분간 37℃에서 반응시킨 후 96 mM dinitrosalicylic acid (DNS) solution을 0.5 μL을 첨가하고 5분 동안 100℃에서 반응시킨 뒤 4℃에서 3분간 냉각시켰다. 반응 시료는 UV-spectrophotometer (Specord 200 Plus, Analytikjena Co., Konrad, Germany)를 이용하여 흡광도 540 ㎚에서 측정하였다. 표준곡선은 0.2% (w/v) maltose을 이용해 작성하였으며, 효소 활성도 (unit definition)는 상기 반응 조건(37℃, pH 6.9)에서 starch로부터 1분 동안에 생성되는 1.0 ㎍의 maltose 양을 1 unit로 정의하였다(Bernfeld, 1955). Protease 효소활성은 0.65%(w/v) casein buffer (casein 6.5 g/mL, 50 mM potassium phosphate buffer, pH 7.5) 1.25 mL를 시료액 0.5 mL를 추가 혼합하여 10분간 37℃에서 반응시킨 후 110 mM trichloroacetic acid 2.5 mL를 첨가하여 반응을 정지시켰다. 반응 시료는 37℃에서 30분 동안 정치시킨 뒤 잔류하는 침전물을 0.45 ㎛ syringe filter로 여과하였다. 여과액 2 mL에 500 mM sodium carbonate solution 5 mL와 0.5 M Folin & Ciocalteu’s phenol reagent 1 mL을 혼합한 후 30분간 37℃에서 반응시킨 뒤 UV-spectrophotometer를 이용하여 흡광도 660 ㎚에서 측정하였다. 표준곡선은 L-tyrosine을 상기와 동일한 방법으로 분석하여 작성하였으며, 1 unit는 1분 동안 tyrosine 1 ㎍을 유리시키는 양을 환산하여 계산하였다(Kim et al., 2011).
통계처리
모든 실험의 통계처리는 Sigma plot (window version 10.0, USA) program을 이용하여 평균±표준편차를 산출하였으며, 두 군 간의 분석은 Student’s t-test를 실시하였고, 3군 이상의 군간 분석은 one-way ANOVA와 사후 분석으로 Tukey’s multiple comparison test를 실시하였다. p < 0.05를 유의성 있는 것으로 해석하였다.
결과 및 고찰
Chlorogenic acid 함량
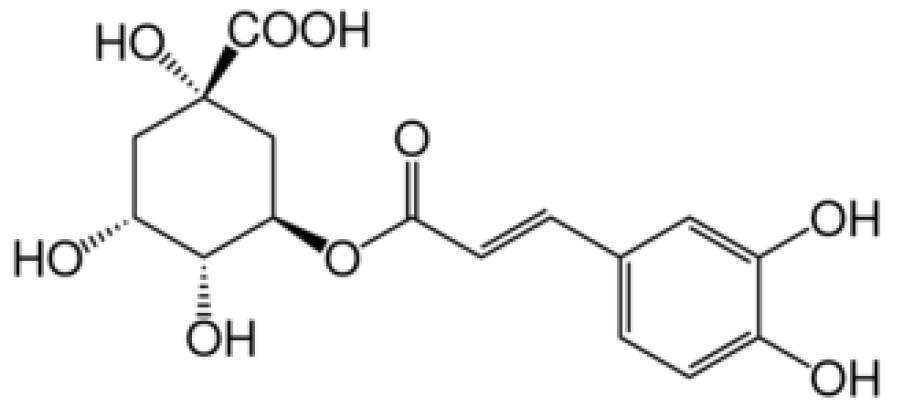
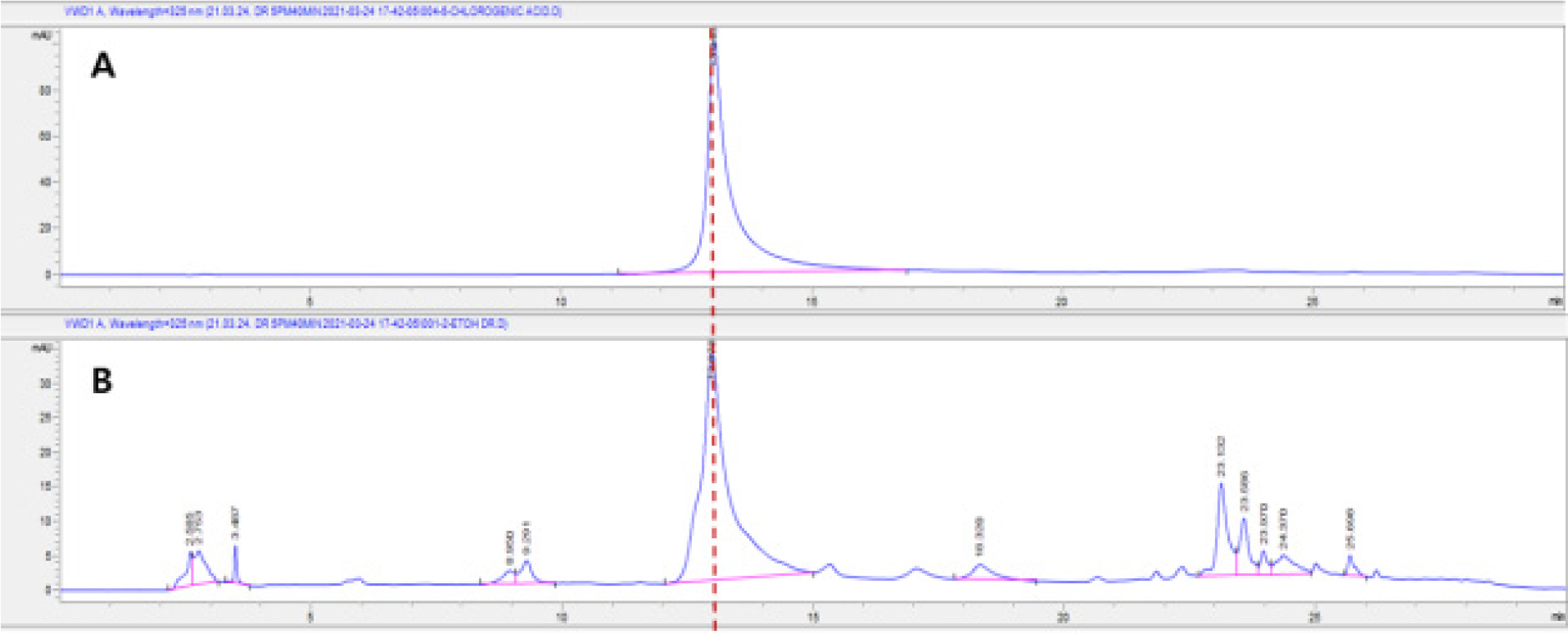
Chlorogenic acid는 과일, 채소, 커피, 올리브오일, 블루베리, 와인, 고구마 등의 식품에 함유되어 있으며, quinic acid와 caffeic acid가 결합된 폴리페놀 화합물로서 항산화, 항당뇨, 항암, 세포보호, 혈압강하, 콜레스테롤 생합성 억제 등의 활성을 가지고 있다(Kwon et al., 2018; Lee et al., 2018; Olthof et al., 2001). AEE에 함유된 chlorogenic acid 함량을 HPLC를 이용하여 Table 1의 조건으로 분석하였다. Chlorogenic acid 표준용액은 HPLC용 MeOH을 이용하여 1 ㎎/mL로 조제하였으며, AEE 1 g을 HPLC용 MeOH 50 mL을 넣고 초음파기를 이용하여 30분간 추출한 후 0.45 ㎛ syringe filter로 여과시켰다. HPLC 분석기기는 Agilent 1200 series, ZORBAX Eclipse Plus C18 (250 × 4.6 ㎜, 5 ㎛), DAD detector 325 ㎚에서 분석하였다. 분석 조건은 유속 1.0 mL/min, 시료 20 μL를 주입하여 column 온도는 25℃, 0.1% formic acid in water/MeOH (A/B, v/v)를 B; 0분: 10%, B; 7분: 25%, B; 17분: 35%, B; 25분: 50%, B; 30분: 80%의 조건으로 분석하였다. Chlorogenic acid 표준용액 검량선의 상관계수(R2)=0.9997 이상의 직선성을 얻었으며, retention time 13.01분대에서 main peak가 관찰되었다. AEE의 HPLC 분석결과 chlorogenic acid 표준용액에서와 같이 13.00분대에 peak가 관찰하였다(Fig. 2). AEE에 함유된 chlorogenic acid 함량을 분석한 결과 7.06±0.01 ㎎/g 함유되어 있었다.
항산화 활성
인체 질병의 약 90%는 활성산소와 관계가 있는 것으로 알려져 있다. 인체 대사과정에서 생성된 활성산소는 산화물과 잘 반응하여 생체조직에서 전자를 얻어 안정한 화학구조를 이루지만 전자를 잃은 생체조직과 세포는 radical로 변화에 인체에 악영향을 일으킨다. 따라서 항산화 활성 물질은 radical의 전자 공여를 낮추는 것이라 할 수 있다. Radical이 체내에서 생성되면 세포내 지방질과 단백질, DNA를 손상시켜 암을 유발시키며, 동맥경화, 뇌졸중, 심근경색증 등의 질병을 일으킨다. 따라서 체내에 생성된 radical의 제거는 인체 질병을 예방하는 것으로 항산화 활성 물질은 radical 전자의 공여를 낮추는 것이라 할 수 있다(Chang et al., 2001; Kim, 2020; Suh et al., 2020). DPPH는 ascorbic acid, butylated hydroxyanisole (BHA), tocopherol 등에 의하여 환원되어 짙은 자색으로 변하는 원리를 이용하여 항산화 활성을 측정한다. ABTS은 청록색의 인위적인 radical로 Potassium persulfate에 의하여 생성되는 ABTS free radical이 항산화 물질에 의하여 제거되어 연녹색으로 탈색되는 원리를 이용하여 측정한다(Cha et al., 2009; Kwon et al., 2018; Lee et al., 2014). AEE의 DPPH 라디칼 소거활성과 ABTS 라디칼 소거활성을 312.5-10,000 ㎍/mL 농도 범위로 측정하였으며, 양성대조군으로 L-ascorbic acid를 사용하였다(Table 2). DPPH 라디칼과 ABTS 라디칼을 50% 소거하는 농도인 SC50은 일반적으로 측정값이 낮을수록 활성이 높은 것을 의미한다. DPPH 라디칼 소거활성(SC50)은 4.79±0.05 ㎎/mL, 양성대조군인 L- ascorbic acid는 0.19±0.00 ㎎/mL, 상대활성(relative activity)은 3.97%로 측정되었다. ABTS 라디칼 소거활성(SC50)은 5.79± 0.05 ㎎/mL, 양성대조군인 L-ascorbic acid는 0.11±0.00 ㎎/mL, relative activity은 1.73%로 측정되었다.
Table 2.
SC50 values of Aralia elata ethanol extract
| Sample | DPPH radical | ABTS radical | |||
| SC50z (㎎/mL) | Relative activity(%)y | SC50z (㎎/mL) | Relative activity(%)y | ||
| AEEx | 4.79±0.05 | 3.97 | 5.79±0.05 | 1.73 | |
| AAw | 0.19±0.00 | 100.00 | 0.11±0.00 | 100.00 | |
총 폴리페놀 및 총 플라보노이드 함량
천연자원에 함유된 페놀성 화합물은 식물의 2차 대사산물로서 phenolic hydroxyl기가 있어 거대분자인 단백질 등과 쉽게 결합한다. 폴리페놀 화합물은 과일과 채소에 함유된 천연 항산화 활성물질로서 다양한 화학구조와 분자량을 가지고 있으며, flavonoid, catechin, tannin류로 구분되며, 콜레스테롤 저하, 항암, 항미생물, 비만억제, 심혈관 질환 예방 및 항산화 작용 등 다양한 항산화 생리활성 기능을 가지고 있다(Cha et al., 2009; Kim et al., 2000). 폴리페놀 화합물은 하이드록실기(-OH) 가지고 있어 여러 화합물과 쉽게 결합한다. 폴린-시오칼토 시약에 의해 환원되어 몰리브데넘 청색으로 발색하는 원리를 이용하여 폴리페놀의 함량을 측정한다(Kwon et al., 2018; Middleton et al., 2000; Park et al., 2021). 플라보노이드는 과일, 채소 등 다양한 식물에 존재하는 물질로서 flavones, flavonones, flavonols, cathechins, anthocyanidins 등으로 항산화, 항암, 항염증, 항노화, 항부종, 관상 동맥 심장 질환 예방 등의 생리활성을 가지고 있다(Hertog et al., 1992; Lee et al., 2014; Qi et al., 2018). AEE에 함유된 총 폴리페놀 함량은 gallic acid, 총 플라보노이드 함량은 quercetin을 기준물질로 설정하여 측정하였다. 총 폴리페놀 함량은 170.0±1.8 ㎎GAE/g, 총 플라보노이드 함량은 105.5±4.1 ㎎QE/g으로 분석되었다(Table 3). Kwon et al. (2018)의 연구에서 두릅 에탄올 추출물을 n-hexane, chloroform, ethyl acetate로 분획한 분획물의 폴리페놀 함량을 측정한 결과 n-hexane층은 13.42±0.52 ㎎ GAE/g, chloroform층은 16.33±1.18 ㎎ GAE/g, ethyl acetate층은 258.92± 0.52 ㎎ GAE/g, 증류수층은 69.58±0.38 ㎎GAE/g으로 분석되었다고 보고되었다. 본 연구에서는 AEE에서 170.0±1.8 ㎎GAE/g으로 폴리페놀 함량이 높게 측정되어 두릅은 항산화 활성이 우수한 것으로 판단된다.
Table 3.
Total polyphenol and flavonoid content of Aralia elata ethanol extract
| Total polyphenol (㎎GAEz/g) | Total flavonoid (㎎QEy/g) |
| 170.0±1.8x | 105.5±4.1x |
RAW 264.7 세포의 항염 활성
RAW 264.7 세포에 대한 AEE에 대한 세포독성을 MTT assay 실험법으로 측정하였다. AEE을 농도별(25-150 ㎍/mL)로 처리한 결과 150 ㎍/mL 농도까지 100% 이상의 세포생존이 측정되어 세포독성이 나타나지 않았다(Table 4). 따라서 독성이 나타나지 않는 100 ㎍/mL 이하의 농도에서 NO 생성 억제를 측정하였다(Table 5). LPS로 염증 유도된 RAW 264.7 세포에 AEE을 25, 50, 75, 100 ㎍/mL 농도로 처리한 후 NO 생성 억제를 측정한 결과 각각 79.3±1.7, 73.9±0.9, 65.5±0.3, 60.0±1.1%로 NO 생성이 농도 의존적으로 억제되었다. Jin et al. (2017)의 선천성 고혈압 흰쥐에서 두릅 에탄올 추출물의 항고혈압 효과 연구에서 두릅나무 에탄올 추출물에 대한 혈장 NO생성량을 측정한 결과 10 ㎎/㎏ 투여군에서 17.51 ± 3.84 μM, 50 ㎎/㎏ 투여군에서 47.69 ± 2.94 μM으로 측정되었다고 보고되었다. 이와 같이 AEE는 NO 생성을 억제하는 것으로 나타남에 따라 순창산 두릅은 다양한 염증인자를 억제하는 것으로 사료된다.
Table 4.
Effect of Aralia elata extract on cell viability of RAW 264.7 cell
| Concentration (㎍/mL) | |||||
| 25 | 50 | 75 | 100 | 125 | 150 |
| 105.3±0.7z | 105.1±1.5z | 101.2±3.5z | 99.5±1.7z | 102.5±0.4z | 101.2±3.7z |
Table 5.
Inhibitory effects of Aralia elata ethanol extract on nitric oxide production in LPS-induced RAW 264.7 cell
| Control |
LPS (1 ㎍/mL) | Concentration (㎍/mL) + LPS (1 ㎍/mL) | |||
| 25 | 50 | 75 | 100 | ||
| 1.9±0.3z | 100.0±0.0z | 79.3±1.7z | 73.9±0.9z | 65.5±0.3z | 60.0±1.1z |
RAW264.7 세포가 활성화되면 cytokine인 TNF-α, IL-6, IL-1β 등을 분비한다. 일반적으로 cytokine은 염증과정과 면역반응 등을 관여하는 세포의 작용을 조절한다. T림프구의 성장과 활성을 조절하는 TNF-α는 암세포를 사멸시킨다. 하지만 과량 분비되면 염증 및 면역반응의 이상을 초래하여 혈관 확장, 혈압강하 등을 일으킨다. 염증과 면역반응, 조혈작용을 조절하는 cytokine인 IL-6은 plasma cell의 분화를 유도하고 면역글로불린을 합성하는 등의 작용을 한다. IL-1β는 T세포를 활성화 시키고, T세포에서 분비되는 cytokine을 활성화시킨다(Cha et al., 2010; Woo et al., 2018; Yu et al., 2012). LPS를 이용하여 RAW 264.7 세포에 염증을 유발시키고, AEE에 대한 TNF-α, IL-1β, IL-6 생성을 측정하였다(Table 6). LPS를 RAW 264.7 세포에 처리함에 따라 TNF-α, IL-1β, IL-6 생성이 증가하였으며, AEE의 처리 농도가 증가함에 따라 TNF-α, IL-1β, IL-6 생성이 농도 의존적으로 억제되었다. AEE 100 ㎍/mL 농도에서 TNF-α 생성은 8.9±0.1 ng/mL로 LPS 처리군 대비 74.7±0.8% 억제되었으며, IL-6 생성은 15.2±0.8 ng/mL로 63.3±0.3%, IL-1β 생성은 30.9±0.9 pg/mL로 40.9±1.1%로 억제되어 순창산 두릅은 염증성 cytokine의 생성을 억제하여 항염증 효과를 나타냄을 확인하였다.
Table 6.
Effect of Aralia elata ethanol extract on the production (%) of TNF-α, IL-6 and IL-1β in RAW 264.7 cells
| Control |
LPS (1 ㎍/mL) | Concentration (㎍/mL) + LPS (1 ㎍/mL) | ||||
| 25 | 50 | 75 | 100 | |||
|
TNF-α (ng/mL) | 2.5±0.0z | 11.9±0.3z | 11.4±0.1z | 10.4±0.3z | 9.3±0.3z | 8.9±0.1z |
|
IL-6 (ng/mL) | 0.4±0.0 | 24.0±0.2 | 18.2±0.1 | 16.8±0.2 | 15.2±0.2 | 15.2±0.8 |
|
IL-1𝛽 (pg/mL) | 24.9±3.5 | 75.5±4.7 | 36.9±2.9 | 36.4±0.7 | 35.5±1.0 | 30.9±0.9 |
Caco-2 세포의 항염 활성
Caco-2 세포에 대한 AEE의 세포독성을 MTT assay 실험법으로 측정하였다. AEE를 50-250 ㎍/mL 농도로 처리한 결과 250 ㎍/mL 농도까지 100% 생존율이 측정되어 처리한 모든 농도에서 세포독성이 나타나지 않았음을 확인하였다(Table 7). 이에 따라 독성이 나타나지 않는 농도를 100 ㎍/mL 이하의 농도로 설정한 후 NO 생성 측정하였다. AEE 25, 50, 75, 100, ㎍/mL의 농도에서 63.9±1.3, 59.7±0.3, 56.4±1.7, 50.7±2.8%로 NO 생성이 농도 의존적으로 억제하였다(Table 8). 이를 통해 AEE가 결장직장 세포 내 염증을 효과적으로 감소시킬 수 있는 것으로 사료된다.
Table 7.
Cell viability on Caco-2 cell culture incubated for 24 h with Aralia elata ethanol extract
| Caco-2 Cell viability (%) | ||||
| Concentration (㎍/mL) | ||||
| 50 | 100 | 150 | 200 | 250 |
| 101.5±1.0z | 103.9±1.3z | 103.9±2.9z | 101.6±1.5z | 102.0±2.4z |
Table 8.
Nitric oxide production activity (%) on LPS-stimulated Caco-2 cell culture incubated for 24 h with Aralia elata ethanol extract
| Control |
LPS (1 ㎍/mL) | Concentration (㎍/mL) + LPS (1 ㎍/mL) | |||
| 25 | 50 | 75 | 100 | ||
| 0.9±0.1z | 100.0±0.0z | 63.9±1.3z | 59.7±0.3w | 56.4±1.7z | 50.7±2.8z |
항균활성
S. typhimurium, L. monocytogenes, H. pylori에 대한 AEE의 항균활성은 agar well diffusion과 paper disc diffusion 분석법으로 측정하였다(Table 9). AEE 3 ㎎/disc 농도에서 S. Typhimurium의 agar well diffusion은 0.64 ㎜, paper disc diffusion에서 0.57 ㎜, L. monocytogenes의 agar well diffusion은 3.99 ㎜, paper disc diffusion에서 2.17 ㎜, H. pylori의 agar well diffusion은 6.10 ㎜, paper disc diffusion은 7.14 ㎜의 clean zone이 나타났다. AEE의 S. typhimurium, L. monocytogenes, H. pylori의 생육을 억제시키는 최소성장억제농도(MIC)와 최소살균농도(MBC)를 측정하였다(Table 9). S. typhimurium와 H. pylori의 MIC는 100 ㎎/mL, MBC는 350 ㎎/mL, L. monocytogenes의 MIC는 75 ㎎/mL, MBC는 275 ㎎/mL로 측정되었다.
Table 9.
Antibacterial activity against S. typhimurium, L. monocytogenes and H. pylori of Aralia elata ethanol extract
| Bacteria | Diffusion Assay | Diameter of clean zone (㎜) | ||
| Concentration (㎎/disc) | ||||
| 1 | 2 | 3 | ||
| S. Typhimurium | Agar well | N.D. | N.D. | 0.64 |
| Paper disc | 0.01z | 0.02z | 0.57z | |
| L. monocytogenes | Agar well | 1.32 | 1.86 | 3.99 |
| Paper disc | N.D. | 2.10 | 2.17 | |
| H. pylori | Agar well | 1.56 | 4.46 | 6.10 |
| Paper disc | 2.49 | 6.67 | 7.14 | |
소화효소활성
α-Amylase는 포도당, 말토오스 등의 α-D-(1,4)-glucan 결합을 가수분해하는 촉매 효소이며, protease는 단백질의 아미노산 peptide 결합을 가수분해 효소로서 단백질의 소화와 분해, 세포의 불필요한 단백질을 제거한다(Kang et al., 2017; Lee et al., 2008; Lee et al., 2015). AEE의 α-amylase 효소 활성은 고농도인 25 ㎎/mL 농도에서 1.46±0.01 unit/mL으로 저농도인 5 ㎎/mL (0.81±0.08 unit/mL) 보다 약 1.8배 높게 측정되었다(Table 10). 식물에 함유된 anthocyanin, proantocyanidins 등의 phenol성 화합물을 다량 함유하고 있는 물질은 α-amylase 활성을 저해한다(Kim et al., 2007). α-Amylase 효소 활성이 높게 측정된 것은 AEE에 함유된 phenol성 화합물에 기인한 것으로 판단된다. Protease 효소활성은 100 ㎎/mL 농도에서 1.24±0.02 unit/mL로 분석되었으며, 저농도인 20 ㎎/mL (0.34±0.01 unit/mL) 보다 약 3.7배 높게 측정되었다(Table 11). AEE의 처리 농도가 증가함에 따라 α-amylase 효소와 protease 효소 활성이 증가하였다.
Table 10.
α-Amylase activity of Aralia elata ethanol extract
| α-Amylase activity (Unit/mL) | ||||
| Concentration (㎎/mL) | ||||
| 5 | 10 | 15 | 20 | 25 |
| 0.81±0.08z | 1.30±0.00z | 1.64±0.05z | 2.11±0.05z | 1.46±0.01z |
적 요
순창군에서 생산된 두릅을 40% EtOH을 이용하여 추출한 후 chlorogenic acid 함량, 항산화, 항균, 항염 및 소화효소 활성을 측정하였다. HPLC를 이용하여 chlorogenic acid 함량을 측정한 결과 7.06±0.01 ㎎/g 함유되어 있었다. DPPH 라디칼 소거활성(SC50)은 4.79±0.05 ㎎/mL, ABTS 라디칼 소거활성(SC50)은 5.79±0.05 ㎎/mL, 총 폴리페놀 함량은 170.0±1.8 ㎎GAE/g, 총 플라보노이드 함량은 105.5±4.1 ㎎QE/g으로 분석되었다. RAW 264.7 세포, Caco-2 세포에서 세포독성이 나타나지 않았으며, 농도 의존적으로 NO 생성이 억제되었다. RAW 264.7 세포에서 염증성 cytokine인 TNF-α 생성은 8.9±0.1 ng/mL, IL-6 생성은 15.2±0.8 ng/mL, IL-1β 생성은 30.9±0.9 pg/ mL으로 억제되었으며, AEE의 처리 농도가 증가함에 따라 TNF-α, IL-1β, IL-6 생성이 농도 의존적으로 억제되었다. S. typhimurium, L. monocytogenes, H. pylori에 대한 항균활성이 우수하게 나타났으며, 두릅을 EtOH 추출물의 처리농도가 증가함에 따라 효소 활성인 α-amylase와 protease 효소활성도 증가하였다. 순창군에서 생산된 두릅은 chlorogenic acid를 다량 함유하고 있으며, 항산화, 항염, 항균, 소화효소 활성이 우수하게 나타나 향후 건강기능성 소재로 개발할 수 있을 것으로 판단된다.