서 언
재료 및 방법
약재
실험재료 및 시약
실험동물
급성췌장염 유발
췌장 중량/체중 비율 측정
조직학적 관찰 및 분석
혈청 소화효소 측정
통계처리
결 과
국내 감초 신품종 물 추출물이 췌장조직에 미치는 효과
국내 감초 신품종 물 추출물의 췌장 중량/체중 비율(P.W./B.W. Ratio) 변화에 미치는 효과
국내 감초 신품종 물 추출물이 혈청 소화효소 (Amylase, Lipase)에 미치는 효과
고 찰
적 요
서 언
감초(甘草)는 콩과에 속하는 다년생 식물로 러시아, 이란, 유럽, 중동, 미국, 중앙아시아 등의 건조한 사막 또는 황토 지역에 주로 분포한다(Abudayyak et al., 2015; Bernacchi et al., 1996). 기침, 발열, 소화불량, 인후통, 기관지염, 천식, 피로 등의 다양한 증상을 완화하는 목적으로 오래전부터 의료용 목적으로 사용되어 왔을 뿐만 아니라 이름에서 알 수 있듯이 단맛이 나기 때문에 음료, 캔디, 과자, 차, 담배 등 다양한 식품에 첨가제로써도 사용되고 있다(Chen et al., 2019; Husain et al., 2021; Isbrucker and Burdock, 2006). 산화적 스트레스, 감염, 암, 천식, 비만, 우울증, 알레르기 반응, 폐경기 증상, 염증, 화상 및 상처 등 다양한 증상에 대해 유효한 약리학적 활성이 밝혀지고 있는 만큼 최근에는 감초의 활용범위가 건강기능식품 및 화장품에까지 이르고 있다(Assar et al., 2021; Asl and Hosseinzadeh, 2008; Gao et al., 2009; Hajirahimkhan et al., 2013; Kwon et al., 2020; Pastorino et al., 2018). 이렇듯 다양한 분야에서 감초의 수요가 증가하고 있으며, 한국에서 연간 사용되는 감초의 양은 약 9,000~10,000 ton에 이르고 있지만 국내 수급률은 약 3~5%에 불과하다. 22가지 감초 품종 중 Glycyrrhizin을 생산한다고 알려져 있으며, 대한민국약전에 등재되어 있는 3가지 품종(G. uralensis Fisch., G. glabra L., 및 G. inflata Batal.)을 국내에서 재배하면 낮은 생산성, 조기 낙엽, 질병 및 도복성 증가뿐만 아니라 지표성분(Glycyrrhizin 및 liquiritigenin) 함량 부족 등의 원인으로 인하여 수요 대부분을 수입에 의존하고 있다. 하지만 수입된 감초도 대한민국약전에서 규정하는 지표성분 기준(Glycyrrhizin의 경우 2.5% 이상, liquiritigenin의 경우 0.7% 이상)을 충족하지 못하는 경우가 많고 수입 시기에 따른 함량의 격차가 크기 때문에 의약품으로써 사용하기 부적합하다는 논쟁이 계속되어왔다. 이에 농촌진흥청 국립원예특작과학원에서 G. uralensis Fisch.와 G. glabra L.를 교잡하여 감초 신품종 Glycyrrhiza korshinskyi Grig.를 만들었으며, 이는 앞서 설명했던 기존의 품종이 가지고 있던 한계점을 모두 개선하여 감초의 국산화를 가능하게 하였다(Lee et al., 2020). 약리활성 측면에서도 면역력 증가, 항알레르기, 항산화, 피부 미백, 항암 및 다양한 염증성 질환(대장염, 관절염)에 대한 유효한 효능이 검증되었으며 일반독성 및 유전독성에 관한 연구도 수행되어 이를 바탕으로 최근 대한민국약전에 감초의 신품종으로 등록되었다(Ali et al., 2021; Kang et al., 2020a, 2020b; Kang et al., 2021a; Kang et al., 2021b; Kim et al., 2021a; Kim et al., 2021c; Song et al., 2021). 이에 국내 감초 신품종에 대해 아직 밝혀져 있지 않은 약리활성을 스크리닝하였고 급성 췌장염에 대한 유효한 효능을 발견하게 되어 본 연구를 수행하였다.
급성 췌장염(Acute Pancreatitis; AP)은 췌장의 내분비 기능과 외분비 기능 중 외분비 기능의 장애로 인하여 췌장 내 소화효소가 비정상적으로 활성화됨으로써 발생하는 급성 염증성 질환이다. 발병률은 10만 명 중 약 30명 정도로 알려져 있으며, 대표적인 발현 증상으로는 오심, 구토, 발열 및 상복부 통증 등이 있다(GBD, 2017; Cirrhosis Collaborators, 2020; Kingsnorth and O'Reilly, 2006). 염증의 발현 정도에 따라 염증반응이 췌장에서만 발생하는 경미한 수준에서부터 패혈증, 쇼크, 간과 폐 기능 실조 등 다발성 장기부전을 동반하는 중증 수준으로까지 발전할 수 있으므로 사망률은 최소 1%부터 최대 30~40%에까지 이를 수 있다(Cavallini et al., 2004; Petrov et al., 2010). 주요 발병 원인으로는 음주와 담석이 전체 병인의 약 60%로 상당 부분을 차지하고 있으며, 그 외 약물 독성, 감염, 고칼슘혈증, 고지혈증, 내시경적 역행성 담췌관조영술(ERCP) 후유증 등이 있다(Kota et al., 2013; Weiss et al., 2019). 질병이 발생하였을 경우 현재 행해지고 있는 처치 방법으로는 진통제 및 항생제 투여, 초기 정맥 내 수액 및 영양공급과 괴사 조직을 제거하는 췌장 절제술 등으로 근본적인 원인을 치료하지 못할뿐더러 효과 또한 미미하고 부작용의 문제도 야기될 수 있는 한계점이 있다(Kimura and Mössner, 1996; Lee, 2015). 이에 부작용이 적으면서 증상을 효과적으로 억제할 수 있는 치료제를 개발하기 위해 현재까지 다양한 연구가 진행되고 있지만 아직 뚜렷한 결과가 없는 실정이다.
따라서 본 연구에서는 국내 감초 신품종인 G. korshinskyi Grig.가 cerulein으로 유도한 생쥐의 급성 췌장염에 대해 유효한 효능을 나타내는지 확인하고자 연구를 수행하였으며, 이에 유의미한 결과를 얻었기에 본 논문을 보고하는 바이다.
재료 및 방법
약재
본 실험에 사용한 감초는 충북 음성군 소재 농촌진흥청 국립원예특작과학원에서 2년간 재배한 국내 감초 신품종(Glycyrrhiza korshinskyi Grig.)을 제공받아 수행하였다. 겨울에 수확하였으며 세척 후에는 55~58℃ 조건의 건조기에서 3일간 건조하였다. 그 후 분쇄기를 이용해 분말화하였으며, 감초 분말 100 g을 3차 증류수 1 L에 넣고 100℃에서 4시간 30분 동안 추출하였다. 추출 후에는 회전증발농축기를 이용해 70℃에서 3시간 동안 감압농축 하였으며 정성여과지로 여과 후 최종 시료로 사용하였다.
실험재료 및 시약
Cerulein은 Bachem AG Laboratories (Bubendorf, Switzerland)에서 구매하였다. Formalin, xylene, hematoxylin, eosin, chloroform은 Sigma (St. Louis, MO, USA)에서 구매하였다. 정성여과지는 Whatman (Maidstone, Kent, UK)에서 구매하였다. 실험에 사용된 모든 시약은 분석용 등급 이상으로 사용하였다.
실험동물
모든 실험은 전북대학교 동물윤리위원회의 허가를 받고 정해놓은 동물 관리 규정에 따라 수행되었다(동물실험 승인번호: JBNU 2021-055). 본 실험에 사용한 C57BL/6 mouse (6주령, 체중 15~20 g, 암컷)는 Samtako Biokorea Co.Ltd (오산, 경기도, 한국)에서 구매하였다. 실험동물은 전북대학교 특성화캠퍼스 동물실험실습관에서 일정한 조건(온도: 25±2℃, 습도: 50~60%, 명암: 12시간 주기)에서 일반 고형사료와 물을 충분히 공급하면서 환경 적응을 위해 일주일 동안 적응시킨 후 실험에 사용하였다.
급성췌장염 유발
생쥐에서 cerulein으로 유도한 급성췌장염 동물모델은 기존 연구논문을 참고하였으며, 간략하게 요약하면 18시간 금식 시킨 생쥐에 cerulein (50 ㎍/㎏)을 1시간 주기로 총 7번 복강 주사하여 급성 췌장염을 유발하였다(Mareninova et al., 2006). 국내 감초 신품종 물 추출물(20 or 50 ㎎/㎏)은 첫 번째 cerulein을 주사하기 1시간 전 경구투여하였고, 대조군은 생리식염수를 경구투여하였다. 마지막으로 cerulein을 주사한 후 5시간 뒤에 마우스를 마취시키고 개복하여 췌장을 적출하였다.
췌장 중량/체중 비율 측정
췌장을 적출한 후 췌장 중량/ 체중(pancreas weight/ body weight) 계산식을 통하여 체중에 대한 췌장의 중량 비율을 측정하였다.
조직학적 관찰 및 분석
4% formalin 용액에 고정시킨 췌장조직을 사용하여 일반적인 조직표본 제작 방법으로 Hematoxylin & Eosin (H&E) 염색을 시행하였다. 카메라 부착 광학현미경(Zeiss Primo Star, Germany)으로 관찰한 후 촬영하였다. 각 실험군 췌장조직에서 부종 및 염증을 0-3 (0은 정상적인 외관에 상응하고 3은 질병의 중증에 상응함)의 등급으로 채점하였다(Yusoff et al., 2015).
혈청 소화효소 측정
마우스를 마취한 후 Syringe를 이용하여 심장에서 혈액을 채취했으며, 혈액은 5,000 rpm, 4℃에서 10분간 원심분리하여 혈청만 분리하였다. 소화효소인 amylase와 lipase의 측정은 LABOSPECT 008AS (SG medical, 서울, 한국)로 하였다.
통계처리
모든 실험 결과는 3회 이상 실시하여 그 평균값을 기초로 Mean±S.E.M.로 나타내었다. 실험 결과에 대한 통계처리는 GraphPad Prism 5 프로그램의 일원 분산분석(one way ANOVA)에 준하였고 Dunnett’s multiple comparison test로 사후 검증을 하였다. P-value가 0.05 미만일 경우 유의한 것으로 판정하였다.
결 과
국내 감초 신품종 물 추출물이 췌장조직에 미치는 효과
급성 췌장염이 유발되면 췌장조직의 부종과 함께 염증성 세포들이 조직 내로 유입된다(Bae et al., 2019). Cerulein을 투여하여 생쥐의 급성 췌장염을 유도함으로써 발생하는 췌장조직의 손상과 염증성 세포의 유입에 대해 국내 감초 신품종 물 추출물의 개선 효과를 확인하기 위해 췌장조직을 이용하여 H&E 염색법을 시행하였다. 분석 결과 정상군에서는 부종과 염증성 세포의 유입이 거의 없는 일반적인 췌장조직의 구조가 관찰되었지만 급성 췌장염 유도군에서는 부종과 함께 염증성 세포의 유입이 증가한 것을 관찰할 수 있었다. 국내 감초 신품종 물 추출물을 투여한 군에서 조직의 부종이 개선되는 듯 보였으나 유의한 수준은 아니었으며 염증성 세포의 유입은 농도 의존적으로 유의하게 억제됨을 관찰할 수 있었다(Fig. 1).
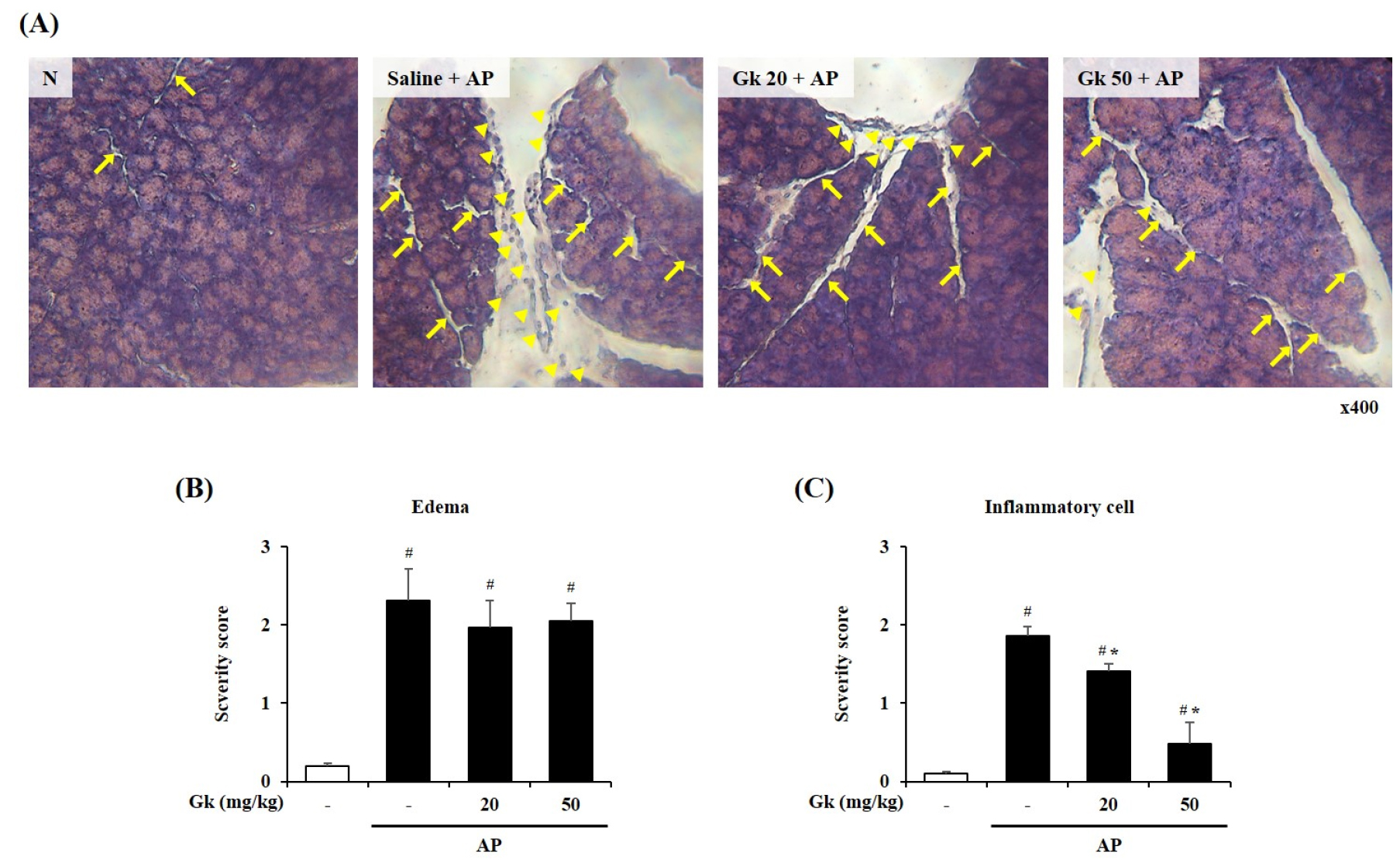
Fig. 1.
Effect of Gk water extract on pancreas histology during cerulein-induced AP. Mice were pre-treated with Gk water extract (20 or 50 ㎎/㎏, P.O.) 1 h before the first cerulein (50 ㎍/㎏, i.p) injection. Mice were injected with cerulein hourly for 7h and sacrificed 5h after the last cerulein injection. (A) 400× magnification of representative hematoxylin & eosin (H&E)-stained sections of the pancreas. Histological scores for (B) edema (arrow on H&E staining) and (C) inflammatory cell (arrowhead on H&E staining). Data show the mean±S.E.M. for 3 mice for each group. Results are representative of three experiments. #P < 0.05 vs saline treatment alone, *P < 0.05 vs cerulein treatment alone.
국내 감초 신품종 물 추출물의 췌장 중량/체중 비율(P.W./B.W. Ratio) 변화에 미치는 효과
급성 췌장염이 발병하게 되면 구토, 탈수 및 영양실조가 발생하여 체중은 감소하는 반면 췌장조직은 부종으로 인해 그 무게가 증가하게 된다(Petrov et al., 2010). 따라서 췌장 중량/체중 비율(P.W./B.W. Ratio)은 급성 췌장염의 중증을 판단할 수 있는 지표 중 하나로 사용된다(Petrov et al., 2010). Cerulein을 투여하여 급성 췌장염을 유도한 군은 정상군에 비해 P.W./B.W. Ratio가 유의하게 증가한 것을 확인할 수 있었다. 하지만 국내 감초 신품종 물 추출물을 투여하더라도 급성 췌장염 유도로 증가하였던 P.W./B.W. Ratio를 개선하지 못함을 확인하였다(Fig. 2). 이러한 결과는 췌장조직의 조직학적 관찰에서 국내 감초 신품종이 조직의 부종을 유의하게 개선하지 못하였던 결과와 일치하는 것을 보여준다(Fig. 1A and B).
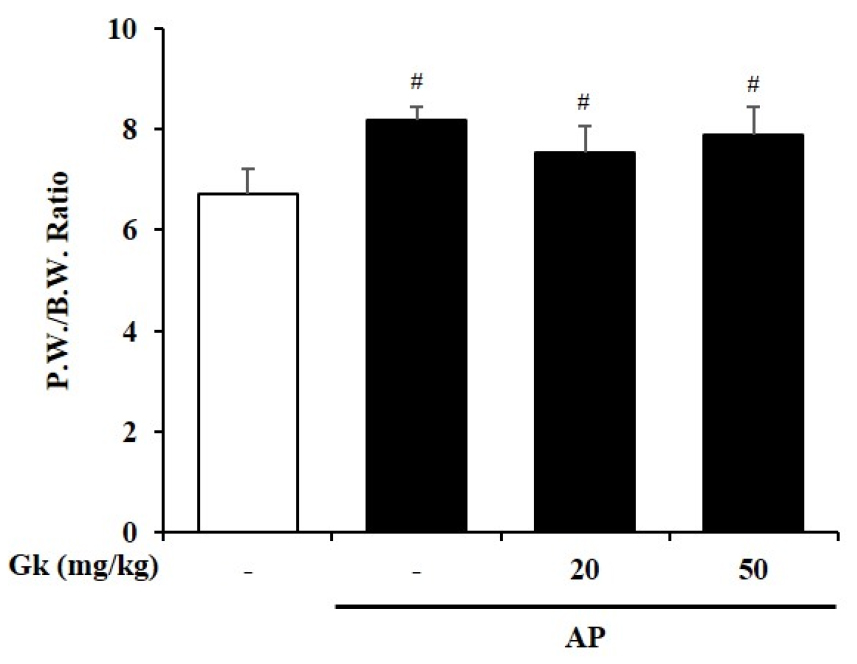
Fig. 2.
Effect of Gk water extract on pancreatic weight/ body weight ratio during cerulein-induced acute pancreatitis (AP). Mice were pre-treated with Gk water extract (20 or 50 ㎎/㎏, P.O.) 1 h before the first cerulein (50 ㎍/㎏, i.p) injection. Mice were injected with cerulein hourly for 7h and sacrificed 5h after the last cerulein injection. Data show the mean±S.E.M. for 3 mice for each group. Results are representative of three experiments. #P < 0.05 vs saline treatment alone, *P < 0.05 vs cerulein treatment alone.
국내 감초 신품종 물 추출물이 혈청 소화효소 (Amylase, Lipase)에 미치는 효과
급성 췌장염이 발병하면 혈중 소화효소(Amylase, Lipase 등)의 수치가 증가하게 되며 이는 실제 임상에서도 급성 췌장염을 진단하는데 일반적으로 사용하는 생화학적 진단지표이다(Weiss et al., 2019). Cerulein을 투여하여 급성 췌장염을 유도한 군은 정상군에 비해 혈청 Amylase와 Lipase의 수치가 모두 증가한 것을 확인할 수 있었다. 국내 감초 신품종 물 추출물을 투여하게 되면 이들 소화효소의 수치가 모두 농도 의존적으로 감소하는 것을 확인할 수 있었으며, 고농도인 50 ㎎/㎏ 투여군에서는 두 가지 소화효소의 수치 모두 유의적으로 감소하는 것을 확인할 수 있었다(Fig. 3).
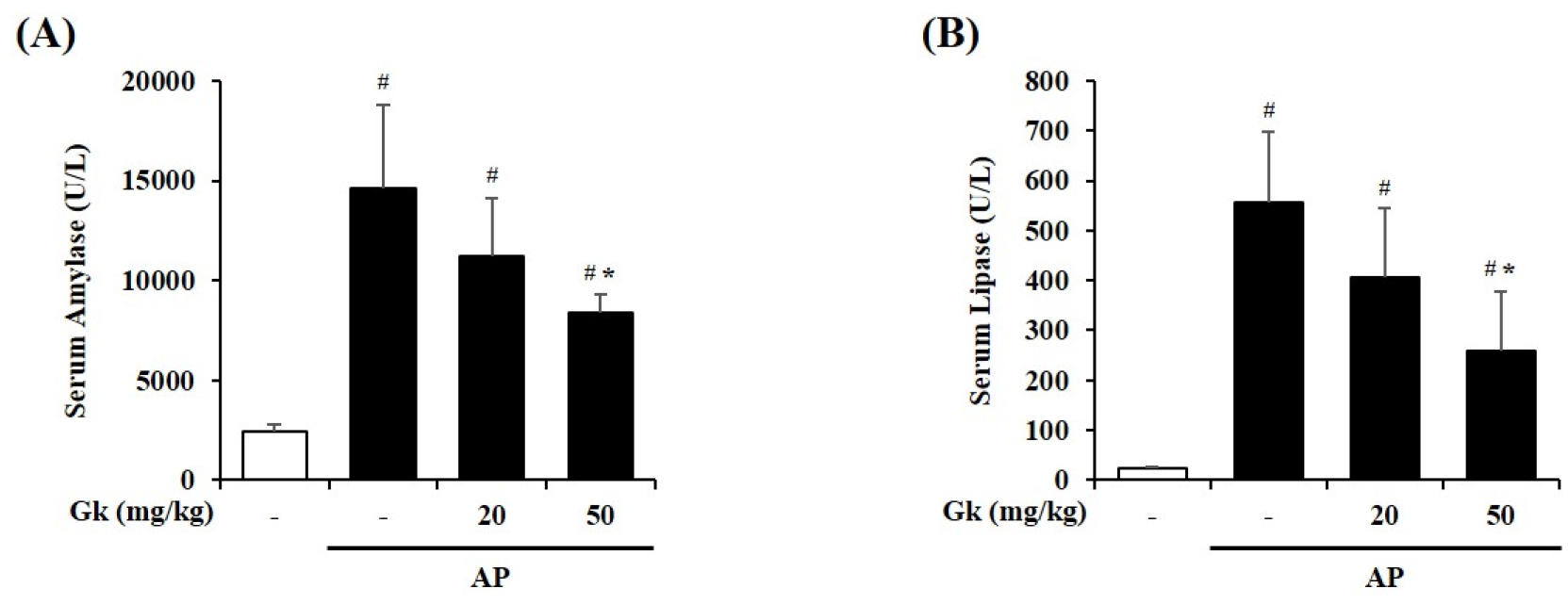
Fig. 3.
Effect of Gk water extract on the production of serum digestive enzymes during cerulein-induced AP. Mice were pre-treated with Gk water extract (20 or 50 ㎎/㎏, P.O.) 1 h before the first cerulein (50 ㎍/㎏, i.p) injection. Mice were injected with cerulein hourly for 7h and sacrificed 5h after the last cerulein injection. Pancreatic digestive enzymes were measured in the serum 5h after the last cerulein injections. Serum (A) amylase and (B) lipase activities. Data show the mean±S.E.M. for 3 mice for each group. Results are representative of three experiments. #P < 0.05 vs saline treatment alone, *P < 0.05 vs cerulein treatment alone.
고 찰
최근 20년간 전 세계적으로 급성 췌장염의 발병률 및 입원율은 꾸준히 증가하는 추세를 보인다. 이러한 원인에는 진단 기술의 향상도 영향을 미치지만 과도한 알코올 섭취, 불규칙하고 건강하지 못한 식습관 및 고령화를 주요 원인으로 보고 있다(Iannuzzi et al., 2022; Li et al., 2021). 급성 췌장염은 염증의 중증도가 증가할수록 사망률이 증가하며, 염증이 반복적으로 발생하면 조직 섬유화라는 불가역적 손상이 특징적으로 나타나는 만성 췌장염으로 발전할 수 있다. 또한 만성 췌장염은 췌장암으로도 질병이 발전될 수 있으므로 급성 췌장염의 신속하고 적절한 치료는 매우 중요하다고 볼 수 있다(Wolfgang et al., 2013). 하지만 현재까지 췌장염 자체를 호전시킬 수 있는 명확한 치료 방법이 없으며, 일반적으로 보존적 치료와 함께 합병증의 증상을 완화하는 처치를 병행하고 있으므로 새로운 치료제의 개발이 절실한 상황이다.
급성 췌장염이 발병하면 다양한 면역 관련 세포들이 췌장 조직내로 유입하게 되는데 대식세포(macrophage), 호중구(neutrophil), 수지상 세포(dendritic cell), 비만세포(mast cell), 자연살해세포(Natural Killer cell: NK cell) 등의 선천 면역 세포뿐만 아니라 T 림프구(T lymphocyte)와 B 림프구(B lymphocyte) 등 후천 면역 세포들 또한 유입하게 된다. 일반적으로 상처 또는 감염된 부위에 몰려드는 면역 세포들은 감염을 제거하거나 조직의 손상을 복구하는 역할을 하지만 특정 원인에 의해 면역 세포가 지나치게 활성화되면 과도한 염증반응이 일어나게 되면서 세포 및 조직의 손상을 초래하게 된다(Kim et al., 2021b; Kim et al., 2023; Peng et al., 2021). 급성 췌장염 발병 시 유입하는 대표적인 면역 세포는 호중구로써 활성산소 및 각종 가수분해 효소를 분비하여 조직손상을 야기하고 국소적 염증반응을 다발성 장기부전으로 발전시키는 데 중요한 역할을 한다(Yang et al., 2015). 따라서 호중구의 유입을 억제하면 급성 췌장염의 염증반응을 억제할 수 있다는 선행연구 결과들을 통해 알 수 있듯이 급성 췌장염 발병 시 증가하는 염증세포의 유입을 억제하는 것은 중요한 요소라고 할 수 있다(Bae et al., 2019; Sandoval et al., 1996). 본 연구에서 cerulein을 투여하여 급성 췌장염을 유도한 군에서는 조직 내 염증성 세포의 유입이 증가한 것을 확인할 수 있었다. 하지만 국내 감초 신품종 물 추출물을 처리한 군에서는 염증 세포의 유입이 유의하게 억제되는 것을 확인할 수 있었으므로(Fig. 1A and C) 이는 국내 감초 신품종이 염증성 세포의 유입을 억제함으로써 염증반응을 조절할 수 있다는 근거가 될 것으로 판단된다.
일반적으로 조직에 염증이 발생하게 되면 면역반응을 활성화하기 위해 해당 부위로 통하는 혈관을 확장해 혈류량을 증가시키게 되며, 이로 인해 세포 외 기질, 혈장 단백질 및 림프액 등의 염증성 액체가 조직 내에 축적되게 됨으로써 조직의 무게가 증가하게 된다(Scallan et al., 2010). 또한 급성 췌장염시 나타나는 구토, 탈수 및 영양실조의 증상은 체중의 감소를 초래한다. 따라서 췌장 중량/체중 비율은 급성 췌장염의 중증을 판단하는 지표 중 하나이다(Petrov et al., 2010). 본 실험에서는 조직학적 관찰 및 췌장 무게와 마우스 체중을 측정함으로써 조직의 부종 정도를 측정하였다. 그 결과 cerulein을 투여하여 급성 췌장염을 유도한 군에서는 조직학적 형태에서 부종을 관찰할 수 있었으며 췌장 무게/체중 무게 비율(P.W./B.W. Ratio)이 증가하였음을 통해 조직내 부종이 발생하였음을 알 수 있었다. 하지만 국내 감초 물 추출물을 투여하더라도 조직의 부종이 개선되지 못하는 것을 확인하였다(Fig. 1B and Fig. 2). 분석 결과 국내 감초 추출물이 급성 췌장염으로 인한 췌장 무게 증가를 유의하게 억제하지 못하였음을 알 수 있었으며, 그중 조직 내 혈류량 또는 염증성 액체 축적 등 어느 단계에서 영향을 미치지 못했는지는 추가적인 연구가 필요하다고 생각된다.
췌장조직의 대부분을 구성하는 선방세포는 Amylase와 Lipase와 같은 소화효소 들을 생성하여 십이지장으로 분비함으로써 소화과정에 관여한다. 하지만 급성 췌장염이 발병하여 소화효소의 기능 및 분비에 문제가 생기게 되면 소화효소 일부가 혈액 내로 유입되게 됨으로써 혈중 소화효소 수치가 증가하게 된다(McNally, 2014; Weiss et al., 2019). 예외적으로 담낭, 간 및 위 손상 등으로 인해 혈중 소화효소 수치가 증가하기도 하므로 췌장염 특이적 진단 방법이 아니라는 한계가 있지만 지금까지 췌장염을 진단하는 데 사용하는 중요 지표 중 하나이다(Lee, 2017). 본 연구에서 cerulein을 투여하여 급성 췌장염을 유도한 군에서는 혈청 Amylase와 Lipase의 수치가 모두 증가한 것을 확인할 수 있었다. 하지만 국내 감초 신품종을 투여함으로써 이들 수치가 모두 감소하는 것을 확인할 수 있었으므로(Fig. 3) 이는 국내 감초 신품종이 급성 췌장염시 발생하는 소화효소의 과분비를 억제함으로써 췌장조직의 손상을 예방한다고 할 수 있는 근거가 될 것으로 판단된다.
현재까지 췌장염에 대한 감초의 생리활성 효능에 대해 밝혀진 논문을 살펴보면 G. glabra L. 70% 에탄올 추출물이 에탄올과 cerulein 병용투여로 유도한 쥐(rat)의 만성 췌장염에서 유효한 효과를 나타낸다고 밝혀져 있으며(Srikantam and Arumugam, 2020) 그 외 감초의 유효성분인 Glycyrrhizin (Glycyrrhizic acid)이 생쥐(mouse) 또는 쥐(rat)의 급성 췌장염에서 유효한 효과를 나타낸다고 밝혀져 있다(Fakhari et al., 2013; Pan, 2014; Xiang et al., 2014; Yildirim et al., 2013). 본 연구는 cerulein 투여로 유도한 생쥐(mouse)의 급성 췌장염에서 감초 물 추출물의 생리활성 효능을 최초로 규명하였다는 데 의의가 있으며 국내 감초 신품종은 기존 감초 품종(G. uralensis Fisch., G. glabra L., 및 G. inflata Batal.)과 대비해 일반독성 및 유전독성 측면에서 더 높은 안전성을 나타낼 가능성이 있다는 선행연구결과(Kim et al., 2021a; Song et al., 2021)를 토대로 추후 급성 췌장염에 대한 생리활성효과를 비교하는 연구를 해 보는 것도 의의가 있을 것으로 생각된다.




