서언
재료 및 방법
재료 및 시약
혈전용해물질의 정제
HPLC와 LC/Q-TOF Mass Spectrometer에 의한 혈전용해물질의 확인
혈전용해활성의 측정
혈전용해물질에 의한 섬유소원의 분해 양상
트롬빈 저해활성 측정
전자공여능 측정
α-glucosidase 저해활성 측정
통계 분석
결과 및 고찰
용매별 분획물의 수득율
혈전용해물질의 정제
HPLC와 LC/MS/MS에 의한 분리한 물질의 확인
혈전용해활성
혈전용해물질에 의한 섬유소원의 분해 양상
트롬빈 저해활성
항산화 효과
α-glucosidase 저해활성
적요
서언
자연에 존재하는 식물, 동물, 미생물, 해양식물과 그들의 대사산물로부터 얻어지는 천연물은 생체에서 다양한 생리활성을 나타내 성인병의 예방과 치료에 이용되고 있다. 특히 약용식물의 2차 대사산물인 flavonoid, terpenoid, steroid, tannin 등의 파이토케미칼(phytochemicals)은 독성이 적고 암, 혈관계질환과 당뇨병의 예방과 치료에 효과를 나타내, 안전성이 확보되면 이용범위가 확대될 것으로 기대된다(Salagami et al., 2007).
한국인의 사망원인 중 암 다음으로 큰 비중을 차지하고 있는 심장 질환은 최근 뇌혈관 질환을 추월하고 암과 함께 빠른 속도로 증가하고 있어 주목 받고 있으며, 심장 질환과 뇌혈관 질환의 주 원인 중 하나로 혈전이 지목되고 있다. 어떤 원인에 의해 혈관이 외상이나 질환에 의하여 손상을 받아 출혈이 생기면 곧 지혈과정이 진행되어 혈소판과 섬유소원이 응집하고 트롬빈이 섬유소원을 섬유소로 만들어 혈소판과 섬유소의 응집체인 혈전이 생성된다. 혈전은 조직의 재생 후 혈장 단백질인 플라스민에 의해 용해되지만, 과응고로 생긴 혈전이 완전히 용해되지 않고 혈관을 따라 흐르며 혈관계질환인 심부전증, 심근경색증, 뇌출혈, 뇌혈전증 등을 유발한다(Daka and Semba, 1995). 혈관계 질환의 치료와 예방을 위해 다양한 제약이 이용되고 있지만 혈전에 대한 선택성이 적어 오랫동안 사용 시 면역 반응과 전신 출혈의 부작용이 나타나 혈전에 대한 선택성이 높고 활성이 큰 새로운 혈전 용해제 개발이 필요하게 되었다.
예로부터 약용으로 사용되는 산수유(Corni fructus)는 층층나무과의 낙엽교목인 산수유나무(Cornus officinalis)의 열매로 온화하며 떫고 신맛이 나며 씨는 독성이 있어 제거한 후 말려서 사용한다. 산수유의 약리효과로는 항암효과(Kim et al., 2004), 항산화 효과(Park et al., 2012), 혈전용해 효과(Oh and Kim, 2006), 항균효과(Lee et al., 2006), 항당뇨 효과(Kim, 2005), 혈액내 cholesterol 감소효과(Joo and Jang, 1989) 등이 보고 되었으며, 성분으로는 gallic acid, malic acid, tartaric acid, ursolic acid와 morroniside, loganin, sweroside와 같은 iridoid 배당체 등이 보고 되었으며(Kim, 1999), 산수유 내 gallic acid와 malic acid의 함량에 대한 결과도 보고되고 있다(Kim et al., 2003).
본 연구는 혈전용해물질을 함유하고 있는 것으로 확인된 산수유를 이용하여 혈전용해제와 기능성 식품을 개발하기 위한 기초 자료를 확보하기 위해 산수유 열수추출물을 유기 용매로 분획화하고, column chromatography를 이용하여 정제 후 HPLC와 LC/MS 분석을 통해 동정한 혈전용해화합물의 혈전용해활성, 트롬빈 저해활성, 항산화활성, 항당뇨 효과를 측정하고, 그 결과를 제시하고자 한다.
재료 및 방법
재료 및 시약
본 실험에 사용한 산수유는 국내산으로 제천약초시장에서(자연인; 경북 영천 생산지) 구입하여 사용하였으며, 생리활성 측정에 사용한 fibrinogen, plasmin, thrombin, 1,1-diphenyl-2-picrylhydrazyl (DPPH), α-glucosidase, p-nitrophenyl-α-D-glucopyranoside, Amberlite IRA-400 chloride form, Sephadex LH-20, malic acid, gallic acid는 Sigma-Aldrich (St. Louis, MO. USA)에서 구입하였고, H-D-phenyl-alanine-L-pipecolyl-L-arginine-paranitroaniline dihydrochloride는 Chromogenix (Orangeburg, NY, USA)에서 구입하였으며, 그 밖의 시약은 모두 일등급 제품을 사용하였다.
혈전용해물질의 정제
산수유 일정량에 20배의 증류수를 가하고 환류 냉각시키면서 3시간 동안 가열 추출 후 aspirator를 이용하여 감압여과(Whatman, No. 1)한 여과액을 물추출물로 사용하였다. 물추출물을 같은 부피의 핵산(hexane), 클로로포름(CHCl3), 에틸아세테이트(ethyl acetate), 부탄올(butanol)로 3번씩 추출 후 각각의 추출물을 농축시키고, 마지막에 남은 물 층을 동결 건조하여 물 분획물을 얻은 후 각 분획물을 100 ㎎/mL의 농도로 준비하여 혈전용해활성을 측정하였다. 혈전용해활성을 나타낸 에틸아세테이트(ethyl acetate) 분획물을, 음이온 교환수지 Amberlite IRA-400 50 g을 넣은 삼각 flask에 넣고 12시간 동안 흔들고 거름 종이로 거른 후 10% methanol로 씻어 불순물을 제거하고, 1N HCl를 넣고 2시간 동안 흔들고 거르기를 반복한 후 HCl 분획을 모아 농축하였다(John et al., 2008). 농축한 활성부분을 모아 Sephadex LH-20 column (2.2 × 40 ㎝)에 H2O를 용매로 용출하고, 활성 부분은 농축하여 다시 Sephadex LH-20 column (2.2 × 40 ㎝)을 이용하여 2차 분획화하였다. 활성 부분을 active charcoal column (1.4 × 3 ㎝)에 흘려 보내고 활성 부분은 동결 건조 후 acetone과 CHCl3로 재결정하고 HPLC와 LC/MS/MS 분석에 사용하였다.
HPLC와 LC/Q-TOF Mass Spectrometer에 의한 혈전용해물질의 확인
준비한 시료(10 ㎎/mL)를 0.2 ㎛ membrane filter로 여과 후 HPLC 시료로 사용하였다. 사용한 HPLC는 Thermo Scientific사의 UltiMate 3000 HPLC였고, column은 AcclaimTM120 (C18, 5 ㎛ 120Å 4.6× 100 ㎜, Thermo Scientific, Waltham, MA, USA)를 사용하였으며 UV 210 ㎚ 파장에서 측정하였다. 0.1% formic acid 수용액을 이동상으로 사용하였으며, 시료 주입량은 10 μL, 유속은 0.8 mL/min로 사용하였다. Malic acid의 동정은 준비한 시료와 산수유에 포함되어 있는 것으로 알려진 5가지 유기산 표준물질(10 ㎎/mL) 용액의 HPLC 결과와 비교하고, 준비한 시료와 표준물질인 malic acid 용액의 LC/MS/MS 분석 결과와 비교하여 동정하였다. LC/MS/MS 분석은 기초과학 지원 연구소의 Agilent사의 LC/Q-TOF Mass Spectrometer로 UHPLC/1290 infinity (Agilent)와 MS Q-TOF/ G6550A (Agilent)로 구성되어 있고, 사용한 HPLC column은 Agilent EclipsePlusC18 RRHD (50 ㎜ × 2.1 ㎜, 1.8 ㎛)였으며, 이동상으로는 0.1% formic acid 수용액을 사용하고, 유속은 0.3 mL/min, 시료 주입량은 3 μL을 사용하였다.
혈전용해활성의 측정
Haverkate and Trass (1974)의 fibrin plate법에 따라 2% gelatin 용액에 녹인 0.5%(w/v) fibrinogen 용액 10 mL와 0.05 M barbital buffer (pH 7.5)에 녹인 thrombin (100 NIH units) 50 μL를 잘 섞고 petri dish에 부어 fibrin 막을 만들었다. 준비한 물 분획물과 유기용매 분획물 20 μL을 fibrin plate 위에 점적하고 36℃에서 18시간 방치한 후 용해면적을 측정하였으며, 대조구로는 플라스민(1.0 plasmin units/mL)을 사용하였다. 분리한 산수유 화합물 용액과 표준 사과산 용액(10 ㎎/mL)의 혈전용해활성 측정은 대조구로 0.5 plasmin units/mL의 플라스민을 사용하였고, 혈전용해활성은 대조구의 용해 면적에 대한 시료의 용해면적의 상대적인 비율로 환산하여 계산하였다.
혈전용해물질에 의한 섬유소원의 분해 양상
산수유로부터 분리한 혈전용해화합물의 섬유소원 분해과정을 확인하기 위해, 분리한 화합물(1 ㎎/mL)과 섬유소원(2 ㎎/mL)를 36℃에서 4시간 반응시킨 후 반응액을 취하여 4.5%의 stacking gel과 7.5% sodium dodecyl sulfate-polyacrylamide gel electrophoresis로 이루어진 SDS-PAGE에서 전기영동을 하여 섬유소원의 분해과정을 분석하였다.
트롬빈 저해활성 측정
트롬빈에 대한 저해활성은 Doljak et al. (2001)의 실험 방법을 이용하였다. 즉, 10 mM HEPES, 150 mM NaCl, 0.1% bovine serum albumin을 포함하는 HBSA 완충용액(pH 7.5) 40 μL에 트롬빈용액(0.5 NIH units/mL) 50 μL를 첨가하고 섞는다. 분리한 화합물(10 ㎎/mL) 10 μL를 첨가하고 실온에서 15분간 incubation 후, H-D-phenylalanine-L-pipecolyl-L-arginine-paranitroaniline dihydrochloride를 이용하여 준비한 기질 용액(0.5 mM) 50 μL을 가하고 5분 동안 incubation시킨 후 405 ㎚에서 흡광도 변화를 측정하였다(UV-1601PC, Shimadzu, Japan). Thrombin 활성 저해율은 다음 식에 의해 산출하였으며, 사용한 흡광도는 대조구의 흡광도를 제외한 수치를 이용하였다.
저해율(%) = [1 - (시료 첨가구의 흡광도)/(시료 무첨가구의 흡광도)]×100
전자공여능 측정
Blois (1958) 및 Kim et al. (1997)의 방법에 따라 분리한 산수유 화합물 적정 희석액 0.4 mL를 시험관에 넣고, 1 × 10–4 M의 1,1-diphenyl-2-picrylhydrazyl (DPPH)-ethanol 용액 5.6 mL을 가하여 6 mL이 되도록 하였다. 이 혼합액을 4분간 반응시키고 다시 여과한 다음, 총 반응시간이 10분이 되면 525 ㎚에서 흡광도를 측정하였다(UV-1201; Shimadzu). 전자공여능은 다음 식에 의해 산출하였다.
전자공여능={1 – (Optical Density (O.D.)시료 / O.D.증류수)} × 100
α-glucosidase 저해활성 측정
α-glucosidase에 대한 저해활성은 Watanabe et al. (1997)의 실험 방법을 이용하였다. 즉, 100 mM phosphate buffer (pH 7.0)로 α-glucosidase (0.7 U, sigma)와 p-nitrophenyl-α-D-glucopyranoside (5 mM)를 용해시켜 각각 효소와 기질 용액을 만든 다음 효소 용액 50 μL, 분리한 산수유 화합물(10 ㎎/mL) 10 μL 및 완충용액 890 μL을 넣고 섞은 다음 5분 동안 실온에서 preincubation하고, 준비한 기질 용액 50 μL을 가하고 다시 5분 동안 incubation시킨 후 405 ㎚에서 흡광도 변화를 측정하였다(UV-1601PC, Shimadzu, Japan). α-glucosidase 활성 저해율은 다음 식에 의해 산출하였으며, 사용한 흡광도는 대조구의 흡광도를 제외한 수치를 이용하였다.
저해율(%) = [1 - (시료 첨가구의 흡광도)/(시료 무첨가구의 흡광도)]×100
통계 분석
3회 반복 실험을 통하여 얻은 결과는 mean ± SD로 나타내었으며, 각 실험군 간의 통계학적 분석은 Student t-test를 실시하여 유의한 결과를 얻었다(p < 0.05).
결과 및 고찰
용매별 분획물의 수득율
산수유 50 g을 열수추출 후 여과한 용액을 동결 건조한 결과 34.69 g의 열수추출물을 얻었다. 이 여과한 용액을 여러 가지 유기용매를 이용하여 추출한 분획물의 수득율을 계산한 결과 핵산 분획물이 0.04%, 클로로포름 분획물 0.26%, 에틸아세테이트 분획물 3.20%, 부탄올 분획물 20.19%, 물 분획물 39.07%로 물 분획물의 수득율이 가장 높았다(Table 1).
Table 1.
The fraction yields of Cornus officinalis S. et Z extractz
| Hexane | Chloroform | Ethyl acetate | Butanol | Water | |
| Yield (%) | 0.04% | 0.26% | 3.20% | 20.19% | 39.07% |
혈전용해물질의 정제
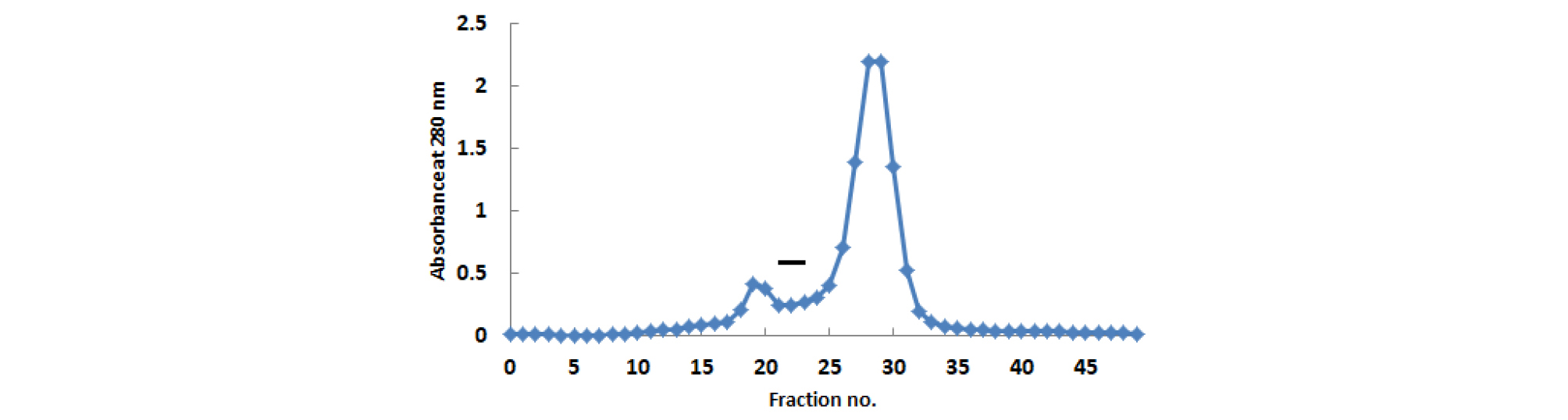
1.29 plasmin units/mL의 혈전용해활성을 나타내는 산수유 열수추출물(Oh and Kim, 2006)을 유기용매로 분획화하여 얻은 분획물의 혈전용해활성을 측정한 결과 물 분획물과 클로로포름 분획물은 활성을 나타내지 않고, 에틸아세테이트 분획물이 1.36 plasmin units/mL의 가장 높은 혈전용해 활성을 나타냈으며 부탄올 분획물은 작은 활성을 나타냈다(Fig. 1). 활성이 높은 에틸아세테이트 분획물을 Amberlite IRA-400과 Sephadex LH-20 관을 이용하여 분리하고(Fig. 2), active charcoal column에 흘려 보내 얻은 활성 부분을 동결 건조하여 acetone과 CHCl3으로 재결정한 후 HPLC분석에 이용했다.
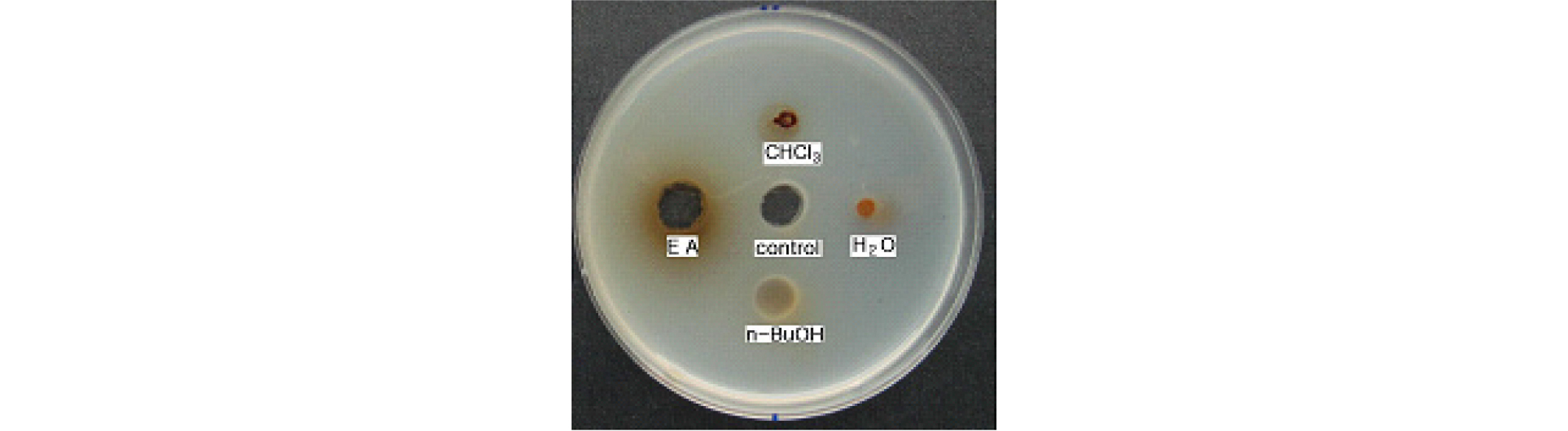
Fig. 1.
Fibrinolytic activity of solvent fractions obtained from hot water extract of Cornus officinalis S. et Z by fibrin plate method. CHCl3: Chloroform fraction; EA: Ethyl acetate fraction; n-BuOH: Butanol fraction; H2O: H2O fraction; Control (Plasmin): 1.0 plasmin unit/mL. The concentration of fraction was 100 ㎎/mL.
HPLC와 LC/MS/MS에 의한 분리한 물질의 확인
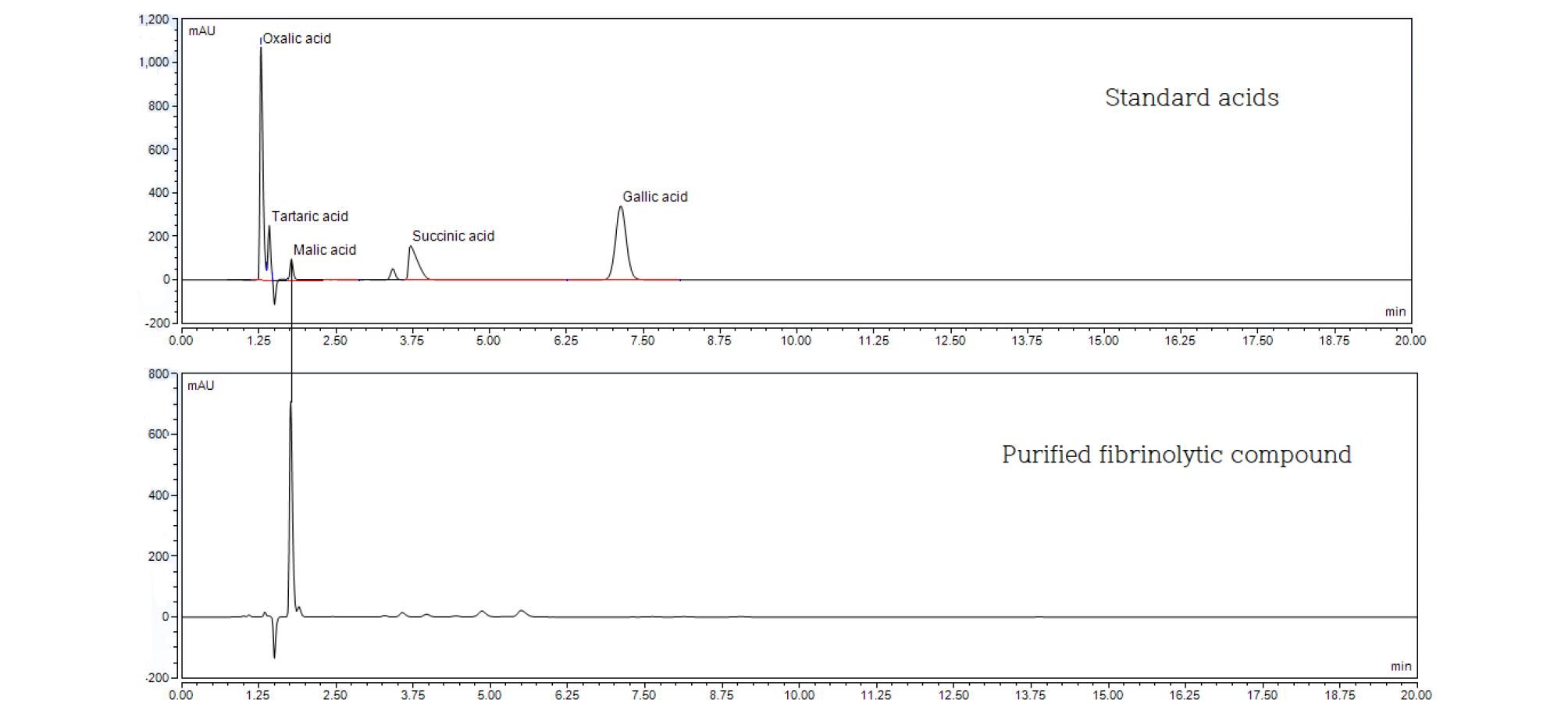
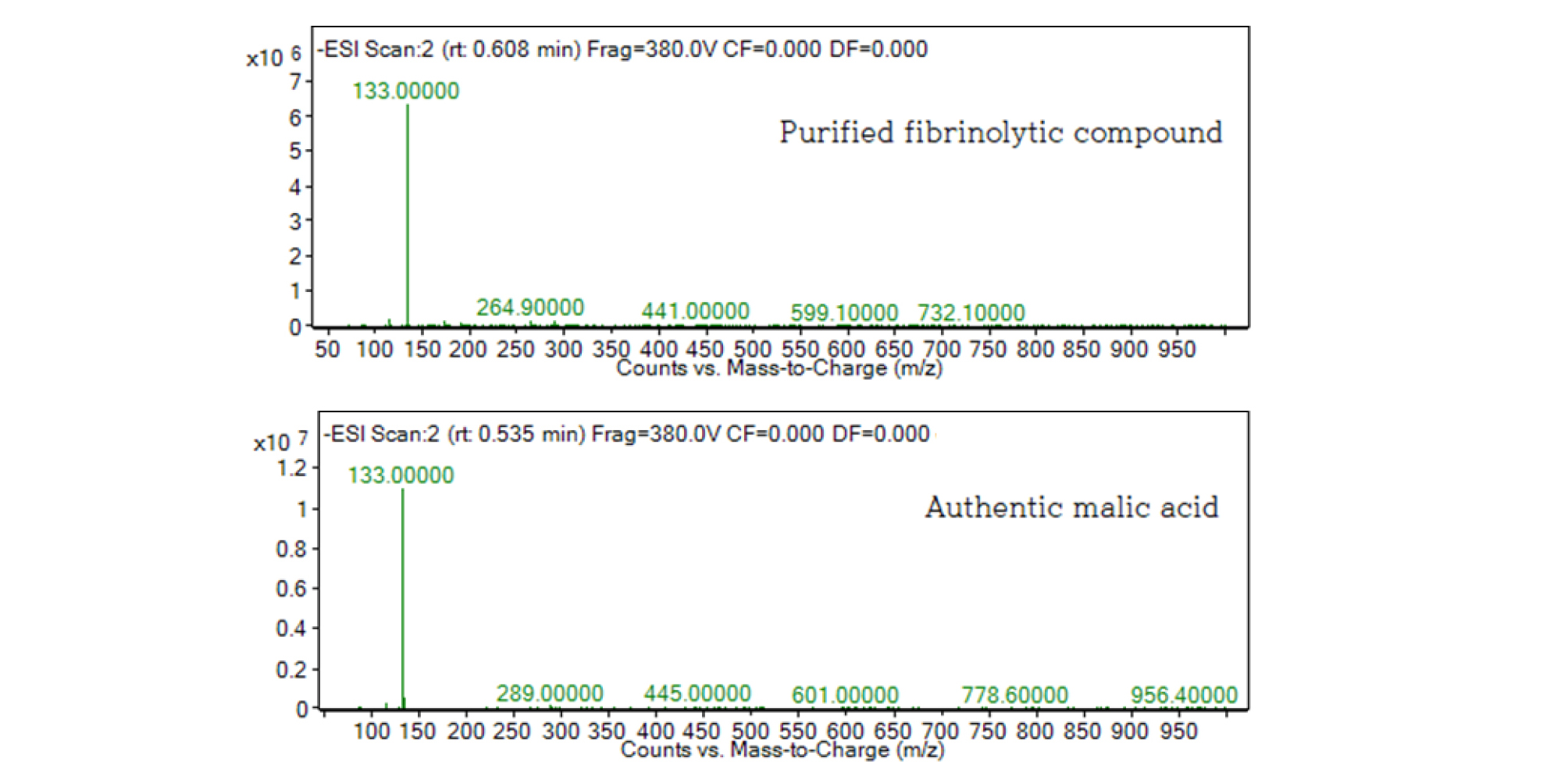
준비한 화합물 용액과 산수유에 포함되어 있는 5가지 유기산 표준물질 용액(10 ㎎/mL)의 HPLC 결과를 비교한 결과 분리한 화합물과 malic acid의 retention time (RT)이 일치하는 것을 확인하고(Fig. 3), 분리한 화합물과 malic acid 용액을 Agilent사의 LC/Q-TOF Mass Spectrometer로 비교 분석한 결과 질량 분석 결과가 일치함을 확인할 수 있었다(Fig. 4). ESI/Ion Trap MS를 Negative와 Positive mode로 분석하여 [M-H]- 값과 [M+Na]+ 값을 확인하였다. Negative mode로 분석할 때 양성자(proton) 하나가 빠진 형태의 molecular ion인 m/z 133에서 강한 peak가 관측되어 분자량 134인 malic acid로 추정되었으며(Fig. 3), Positive mode로 분석할 경우 분자에 Na+ 이온이 붙을 수 있어 분자량이 M+Na+ [M-Na+(23)]의 값인 m/z 157에서 강한 peak가 관측되어 분자량 134인 malic acid로 재 확인할 수 있었다(미발표). Malic acid의 분자량은 정확히 134.20 Da이며, HPLC에서 분리한 최종 화합물은 83.2%의 순도를 나타내었다. 좀 더 확실한 구조 규명을 위해서는 NMR과 IR 등의 실험적인 데이터가 뒷받침되어야 할 것으로 보인다.
혈전용해활성
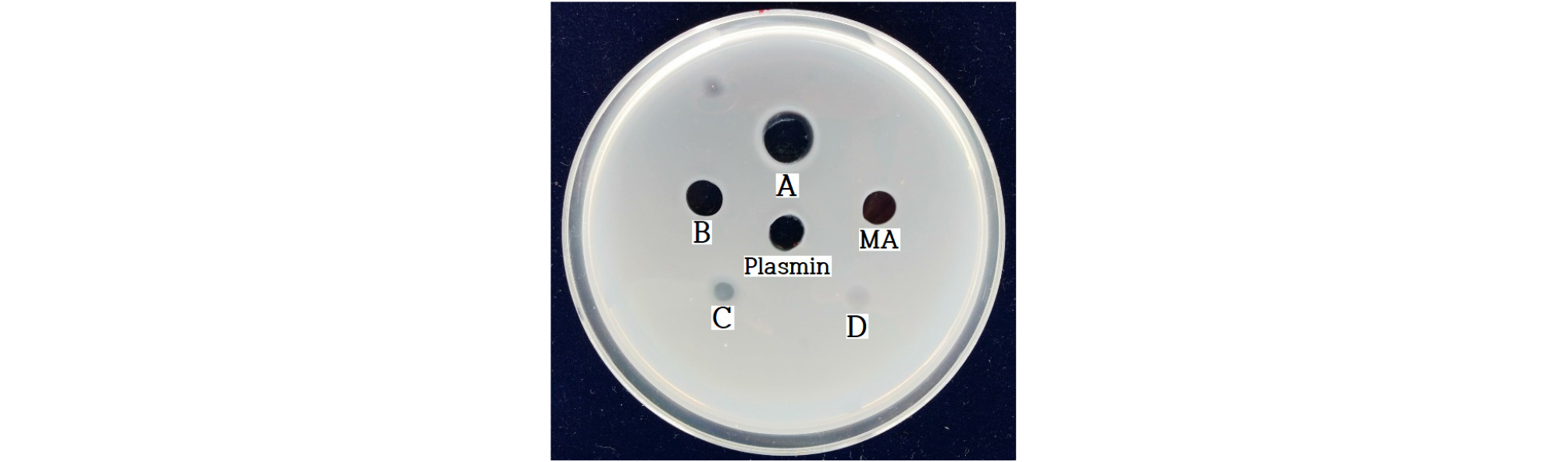
분리한 화합물의 농도에 따른 혈전용해활성을 확인한 결과 20 ㎎/mL의 용액은 1.21 plasmin units/mL의 활성을 나타냈고, 10 ㎎/mL의 용액과 5 ㎎/mL의 용액은 각각 0.69 plasmin units/mL과 0.22 plasmin units/mL의 혈전용해활성을 나타냈으며, 2.5 ㎎/mL의 용액은 작은 활성을 보였고, 10 ㎎/mL의 malic acid 용액은 0.63 plasmin units/mL의 활성을 나타내, 동일한 농도의 분리한 화합물과 malic acid의 혈전용해활성이 비슷한 것으로 확인되었다(Fig. 5). Oh and Kim (2007)에 따르면 한약제 열수추출물의 혈전용해활성을 측정한 결과 소수의 추출물에서만 혈전용해활성을 확인하였다. 사용한 산수유 열수추출물이 1.29 plasmin units/mL의 혈전용해활성을 나타냈는데(미발표 자료), 이는 33 ㎎/mL 농도의 산수유 열수추출물이 0.58 plasmin units/mL의 활성을 나타낸 Oh 등의 실험 결과 보다는 조금 작은 활성이었다(Oh and Kim, 2006; Oh and Min, 2017). 황기 열수추출물(Kim, 2012)과 더덕 열수추출물(Oh and Kim, 2006)은 0.41 plasmin units/mL과 0.78 plasmin units/mL의 활성을 나타냈으며, 빈랑의 ethyl acetate 추출물(Kim and Oh, 2010)과 산사의 butanol 추출물(Oh and Kim, 2008)은 0.84 plasmin units/mL과 1.93 plasmin units/mL의 높은 활성을 나타냈다. 천연물의 활성과 함량은 식물이 자란 환경에 의존하는 것으로 알려져 있으며, 활성 측정 시 재현성이 낮은 문제점도 확인하였다. 새로운 혈전용해물질을 식용 가능한 약용식물, 해양식물, 버섯, 미생물 등에서 찾는 연구가 진행되고 있는데 이는 미량의 효과라도 식자재로 장기간 공급이 가능하여 큰 효과를 기대할 수 있기 때문이다. 열수추출물로부터 얻은 혈전용해물질은 열에 강한 장점이 있어 기존의 열에 약한 효소계열의 혈전용해물질보다 제약과 기능성 식품 개발에 다양하게 이용 가능할 것으로 기대된다.
혈전용해물질에 의한 섬유소원의 분해 양상
섬유소원(fibrinogen)은 분자량 340,000 Da으로 Aα, Bβ, γ의 3개의 chain으로 구성되어 있다. 분리한 화합물(1 ㎎/mL)과 섬유소원(2 ㎎/mL)를 36℃에서 4시간 반응시킨 후 반응액을 SDS-PAGE로 분석한 결과 fibrinogen의 Aα, chain과 Bβ chain은 변화가 없었지만 γ chain이 분해되는 것으로 나타났는데(Fig. 6), 이는 혈전용해제 개발에 장점으로 작용할 수 있을 것이다. 기존에 사용되고 있는 혈전용해제들은 효소들로 활성이 크다. 그러나 식물에서 추출한 혈전용해물질들은 주로 flavonoid나 페놀 유도체 화합물로 효소에 비해 활성이 적어 반응 시 효소 보다 더 많은 양의 시료를 사용해야 했다.
트롬빈 저해활성
비타민 K 의존 인자인 프로트롬빈(prothrombin)으로부터 형성된 트롬빈(thrombin)은 혈액응고과정에 필수효소이다. 트롬빈에 의해 fibrinogen이 fibrin으로 전환되어 혈전이 형성되므로 트롬빈 저해제를 사용하면 혈전형성을 억제 할 수 있어 혈관계 질환의 예방약으로 사용하기 위해 약용식물로부터 트롬빈 저해제 개발 연구가 진행되고 있다(Sohn et al., 2004). Doljak et al. (2001)의 방법에 따라 산수유로부터 분리한 화합물(10 ㎎/mL)의 트롬빈 저해활성을 측정한 결과 14.62%의 트롬빈 저해효과를 나타냈는데(Table 2), 이는 황기와 산사 열수 추출물의 트롬빈 저해활성인 32.33%와 78.73%에 비해 상대적으로 작은 활성이었다(Kim, 2012).
Table 2.
Electron donating, thrombin inhibitory, and α-glucosidase inhibitory activities of the purified fibrinolytic compound from hot water extract of cornus officinalisz
|
Electron donating activities (%) |
Thrombin inhibitory activities (%) |
α-Glucosidase inhibitory activities (%) |
| 6.42 ± 0.26y | 14.62 ± 0.80y | 17.28 ± 0.39y |
항산화 효과
현재 우리가 갖고 있는 질환의 약 90%는 활성 산소와 관련이 있는 것으로 알려져 있다. 활성 산소는 생명체의 대사과정과 면역과정에서 생성되는 전자쌍을 이루지 못한 홀 전자를 가진 불안정한 산소화합물로 반응성이 매우 커 생체조직으로부터 전자를 쉽게 취하고 자신은 안정한 구조를 갖게 되지만, 대신 전자를 잃어버린 조직과 세포의 구성 물질은 라디칼로 변하여 암, 뇌졸증, 심근경색증, 동맥경화증, 당뇨병 등으로 진행할 수 있다. 비타민 E, C와 같은 내인성 항산화제와 더불어 활성 산소를 줄이는 외인성 항산화제를 찾으려는 연구가 천연물에서 이루어지고 있다(So et al., 2019). 분리한 화합물(10 ㎎/mL)로 라디칼형태인 DPPH를 환원시키는 능력을 측정하여 항산화 효과를 조사한 결과 6.42%의 낮은 항산화활성을 나타냈다(Table 2). 그러나 이는 100 ㎎/mL의 농도로 측정한 산사 열수추출물의 항산화활성 78.73%에 비슷하며(Oh and Kim, 2008), 32.33%의 황기 열수추출물보다는 높은 항산화활성으로 예상된다.
α-glucosidase 저해활성
우리나라 인구의 약 10%가 갖고 있는 당뇨병이나 비만 등의 치료를 위해, 탄수화물의 소화를 지연시킴으로써 소장에서 당의 흡수를 억제하여 혈당을 조절하기 위한 혈당강하제의 한 종류인 아카보스계의 약물로 α-glucosidase 저해물질이 사용되고 있다. 그러나 소화불량, 복부팽만, 설사 등의 부작용을 나타내, 치료효과는 크면서 부작용이 작은 새로운 치료제 개발이 필요하다. 산수유로부터 분리한 화합물 시료(10 ㎎/mL)의 α-glucosidase 저해활성을 측정한 결과 17.28%의 낮은 저해활성을 나타냈다(Table 2). 이는 65.30%의 α-glucosidase 저해활성을 나타낸 산사 열수추출물이나 64.91%의 저해활성을 나타낸 황기 열수추출물 보다 작은 저해활성이었다.
적요
산수유 열수추출물의 혈전용해활성을 탐색하고, 유기용매로 분획화한 에틸아세테이트(ethyl acetate) 분획물에서 1.36 plasmin units/mL의 강한 혈전용해활성을 확인하였다. Amberlite IRA-400, Sephadex LH-20 column, active charcoal column과 재결정으로 정제한 혈전용해화합물을 HPLC로 분석 비교한 결과, 표준물질인 malic acid와 같은 retention time (RT)을 나타내고, LC/MS/MS 분석의 Negative mode 측정 시 m/z 133에서 같은 peak를 나타내어 정제한 화합물이 분자량 134 Da인 malic acid 임을 확인하였다. 정제한 화합물은 0.69 plasmin units/mL의 혈전용해활성을 보이고, 14.62%의 트롬빈 저해활성을 나타냈으며, 6.42%의 항산화 효과와 17.28%의 항당뇨 효과를 나타냈다. 분리한 화합물은 섬유소원의 Aα chain, Bβ chain과 반응하지 않았지만 γ chain을 분해하는 것으로 나타났다. 위 연구 결과를 바탕으로 산수유에서 분리한 혈전용해화합물은 혈관계 질환의 치료제 개발과 기능성 식품 개발을 위한 우수한 소재로 이용 가능할 것으로 예상된다.