서 언
재료 및 방법
실험재료 및 시약
추출물 제조
총 폴리페놀 함량 측정
총 플라보노이드 함량 측정
DPPH 라디칼 소거능 측정
ABTS 라디칼 소거능 측정
FRAP 활성 측정
항산화 효소 활성 측정
SOD activity 측정
Catalase activity 측정
APX activity 측정
항노화 활성 측정
Tyrosinase 저해활성 측정
페놀화합물 함량 분석
통계처리
결과 및 고찰
추출용매별 다시마와 쇠미역의 추출 수율
추출용매별 다시마와 쇠미역 추출물의 폴리페놀 및 플라보노이드 함량 분석
추출용매에 따른 다시마와 쇠미역 추출물의 DPPH 라디칼 소거능
추출용매에 따른 다시마와 쇠미역 추출물의 ABTS 라디칼 소거능
추출용매에 따른 다시마와 쇠미역 추출물의 FRAP 활성 측정
추출용매에 따른 다시마와 쇠미역의 항산화효소 활성 분석
추출용매에 따른 다시마와 쇠미역 추출물의 항노화 활성
추출용매별 다시마와 쇠미역 추출물의 tyrosinase 저해 활성
추출용매별 다시마와 쇠미역 추출물의 페놀화합물 함량 분석
다시마와 쇠미역 추출물의 폴리페놀, 플라보노이드 함량과 항산화활성의 상관관계
적 요
서 언
해조류는 해양에 서식하고 육안으로 관찰이 가능한 대형조류(macroalgae)로 이들은 고대부터 한국, 중국, 일본 등 아시아에서 약용, 식용으로 사용되어 왔다(Bangmei and Abbott, 1987). 해조류는 육상식물들과 다른 구성 당 성분을 가지고(Hwang et al., 2011) 낮은 열량을 지니면서 비타민, 미네랄, 식이섬유, 다당류 등의 생리활성물질을 풍부하게 함유한다고 알려져 있다(Ganesan et al., 2019). 현재까지 해조류의 항암(Haijin et al., 2003), 항염(Shin et al., 2006), 항산화(Cornish and Garbary, 2010), 항비만(Ben Abdallah Kolsi et al., 2015) 효과 등의 다양한 활성이 확인되어 아시아 뿐 아니라 세계 곳곳에서 해조류의 섭취량은 점차 증가하고 있다. 이처럼 다양한 활성을 갖는 해조류를 기능성 식품, 의약품, 화장품, 바이오 에너지 등과 같이 산업적으로 이용하기 위해 해조류에 대한 활발한 연구 및 그 수요가 증가되고 있다(Delaney et al., 2016; Tanna and Mishra, 2019).
해조류는 색소의 조성에 따라 홍조류(Rhodophyceae), 녹조류(Chlorophyceae), 갈조류(Phaeophyceae)로 분류되고 전 세계적으로 홍조류 약 6,000 종, 녹조류 약 1,200 종 그리고 갈조류는 약 1,750 종이 밝혀져 있다(Lozano Muñoz and Díaz, 2020). 또한, 해조류는 종류에 따라 색소 조성 뿐 아니라 구성성분 등에서도 차이를 보인다고 알려져 있다(Baweja and Sahoo, 2015). 그 중 갈조류에는 알긴산(alginic acid), 라미나린(laminain), 푸코이단(fucoidan)과 같은 다당류가 풍부하여 홍조류와 녹조류에 비해 높은 항산화능을 나타낸다고 보고되었다(Dang et al., 2018). 현재 식용가능한 해조류 178종 중 갈조류는 다시마, 미역, 쇠미역, 모자반, 톳을 포함한 58종이 있으며(Lozano Muñoz and Díaz, 2020), 특히 다시마(Saccharina japonica)와 쇠미역(Costaria costata)은 국내에서 가장 널리 식용으로 사용되고 있는 다시마목(Laminariales)의 한해성 대형 갈조류로 알려져 있다(Tabakaeva and Tabakaev, 2016).
다시마는 다년생 갈조류로 2018년 전세계 생산량이 11,448,300 톤으로 전세계에서 가장 많이 양식되고 있으며(FAO, 2020), 다양한 분야에서 유용하게 사용되는 해조류 중 하나이다. 우리나라에서는 다시마 조각을 끓는 물에 넣어 육수를 내거나 요구르트(Kim et al., 2008), 된장(Seo et al., 2018), 고추장(Hwang et al., 2019) 등 식품에 다시마를 첨가하여 주로 음식의 풍미를 높이는데 사용되고 있다(Choi et al., 2012). 다시마는 항균활성(Kim et al., 2002), 항염증과 항당뇨 효과(Kang et al., 2018), 다시마에서 추출한 다당류의 항산화 활성 효과(Yao et al., 2017), 항암(Zeng et al., 2017) 효과 등이 있는 것으로 알려져 있다.
쇠미역은 일년생 갈조류로 미역과 달리 포자엽(sporophyll)없이 발달하며 잎에 포자낭을 가지는 특징을 보인다(Park et al., 2011). 이러한 쇠미역은 식감이 독특하여 식용으로 선호도가 높은 것으로 알려져 있어 쌈이나 샐러드 등 주로 직접 식용되고 있다(Na et al., 2016; Kim and Park, 2019). 쇠미역의 생리활성에 관한 연구로는 쇠미역 후코이단의 광노화 억제 효과(Moon et al., 2009), 쇠미역 추출물의 항산화와 항균효과(Kim and Park, 2019) 등이 보고되었다.
해조류는 서식지, 채취시기, 건조방법, 추출조건 등에 따라 유용성분이 변질 및 파괴되고 이에 따라 해조류가 갖는 생리활성이 달라진다고 알려져 있다(Baek et al., 2019; Lee et al., 2020). 이처럼 다시마, 쇠미역을 비롯한 여러 연구들에서 해조류 추출물 제조를 위해 메탄올, 에탄올, 아세톤, 클로로포름 등의 다양한 용매를 사용하였다. 하지만 현재까지 추출용매에 따른 다시마와 쇠미역추출물을 이용한 효능 탐색에 관한 연구는 부족한 실정이며 이를 기능성 식품 또는 식품 첨가물과 같은 제품의 원료로 사용하기 위해서는 식용가능한 용매를 사용할 필요성이 있다(Shin et al., 2013).
따라서 본 연구에서는 완도산 다시마와 쇠미역을 주정, 메탄올, 증류수를 용매로 사용하여 추출을 진행하고 추출조건에 따른 다시마와 쇠미역의 항산화, 항노화 활성을 살펴보고 페놀화합물 함량을 평가하여 안정적인 다시마, 쇠미역의 추출조건을 확립하고 기능성 식품 소재로 활용가능성을 알아보고자 하였다.
재료 및 방법
실험재료 및 시약
본 실험에 사용된 다시마(Saccharina japonica)와 쇠미역(Costaria costata)은 2020년 6월 완도에서 채취하였으며 채취한 시료는 국립 호남권 생물자원관의 이욱재 박사님이 동정하여 사용하였다. 또한 표본을 제작하였으며, 이는 조선대학교 해양생물교육센터 표본실에 보관(MBRC-CU-202006)하였다. 완도산 다시마와 쇠미역 은 증류수로 3회 수세하여 염분을 제거한 후 65℃에서 이틀간 건조하였다. 건조 시킨 다시마와 쇠미역은 식물체 파쇄기(USC, Seoul, Korea)로 파쇄하고 -20℃에 보관하면서 추출물 제조에 사용하였다.
또한, 본 연구에서 폴리페놀 및 플라보노이드 함량, 항산화 및 항노화 활성, 페놀화합물 함량분석에 사용되어진 시약인 Folin-Denis’s Regent, tannic acid, sodium carbonate, aluminum nitrate, potassium acetate, quercetin 등과 페놀 화합물 함량 분석에 사용한 4-hydroxybenzonic acid, naringenin, nicotinic acid, naringin은 순도 95% 이상의 시약을 Sigma Aldrich(St. Louis, MO, USA)로부터 구입하여 실험에 사용하였다.
추출물 제조
다시마와 쇠미역은 95% 주정, 메탄올, 증류수를 이용하여 추출물을 제조하였다. 다시마와 쇠미역 열수추출물은 각 시료에 50배량의 증류수를 가한 후 실온에서 1시간 침지하고 80℃에서 3시간동안 열수추출 하였으며 주정추출물과 메탄올추출물은 다시마와 쇠미역 분말에 10배량의 95% 주정과 메탄올을 가한 후 25℃, 120 rpm으로 24시간 동안 추출하였다. 열수추출물은 Whatman no. 2 여과지를 이용해 여과하여 37℃에서 rotary evaporator로 농축시켰고, 주정과 메탄올추출물은 4℃에서 3,000 rpm으로 20분동안 원심분리하고 38℃에서 농축하고 4℃로 보관하면서 실험에 사용하였다. 다시마와 쇠미역의 추출 수율은 아래와 같은 식으로 계산하였다.
A : 건조 시료의 무게
B : 농축 후 시료의 무게
총 폴리페놀 함량 측정
총 폴리페놀 함량은 Folin and Denis (1912)의 방법을 변형하여 측정하였다. 10 ㎎/mL의 다시마와 쇠미역 주정, 메탄올, 열수 추출물 80 μL에 Folin-Denis’s regent 80 μL를 혼합하여 실온에서 3분간 반응시켰다. 3분 후, 10% sodium carbonate 80 μL를 넣고 실온에서 1시간 반응시키고 760 ㎚에서 흡광도를 측정하였다. 다시마와 쇠미역 추출물의 총 폴리페놀 함량은 tannic acid를 이용해 표준검량곡선을 작성하여 나타내었다.
총 플라보노이드 함량 측정
총 플라보노이드 함량은 Moreno et al. (2000)의 방법을 변형하여 측정하였다. 10 ㎎/mL의 다시마와 쇠미역 주정, 메탄올, 열수 추출물 5 μL에 10% aluminum nitrate 5 μL와 1 M potassium acetate 5 μL, 그리고 95% 메탄올 235 μL을 혼합하여 실온에서 40분간 반응시키고 415 ㎚에서 흡광도를 측정하였다. 총 플라보노이드 함량은 quercetin을 가지고 표준검량곡선을 작성하여 다시마와 쇠미역 추출물의 총 플라보노이드 함량을 나타내었다.
DPPH 라디칼 소거능 측정
DPPH 라디칼 소거능은 Blois (1958)의 방법을 변형하여 1,1-diphenyl-2-picrylhydrazyl (DPPH)에 대한 전자공여 효과로 시료의 환원력을 측정하였다. 150 ㎛ DPPH 용액 0.98 mL에 농도별 다시마와 쇠미역 추출물 0.02 mL를 각각 혼합한 다음 암조건에서 30분간 반응시키고 517 ㎚에서 흡광도를 측정하였다. 양성대조군으로 합성 항산화제인 BHT를 사용하였다. DPPH radical 소거능은 시료 첨가구와 무첨가구의 흡광도 차이를 아래와 같이 계산하여 백분율(%)로 나타내고 50%의 소거능을 갖는 시료 농도인 IC50 (Inhibitory concentration)값을 구하였다.
A : 시료 첨가구의 흡광도
B : 시료 무첨가구의 흡광도
ABTS 라디칼 소거능 측정
추출용매에 따른 다시마와 쇠미역 추출물의 ABTS 라디칼 소거능은 140 mM potassium persulfate을 포함하고 있는 7 mM 2,2'-azino-bis (3-ethylbenzthiazoline-6-sulfonic acid) (ABTS) 용액 250 μL에 에탄올 22 mL을 혼합하여 암소에서 16시간 반응시킨 후 사용하였다(Youn et al., 2019). 농도별 다시마와 쇠미역 추출물 10 μL와 ABTS 용액 200 μL을 혼합하고 실온에서 3분간 반응 후 734 ㎚에서 흡광도를 측정하였고, ascorbic acid를 양성대조군으로 사용하여 마찬가지로 ABTS 라디칼 소거능을 측정하였다. 아래와 같은 식으로 시료의 ABTS 라디칼 소거능을 나타내었고, 50%의 소거능을 갖는 시료 농도인 IC50 (Inhibitory concentration)값을 구하였다.
A : 시료 첨가구의 흡광도
B : 시료 무첨가구의 흡광도
FRAP 활성 측정
추출용매에 따른 다시마와 쇠미역 추출물의 ferric reducing antioxidant power (FRAP) 활성을 측정하기 위하여 Nowak et al. (2021)의 방법을 변형하여 측정하였다. FRAP solution은 300 mM sodium acetate pH 3.6, 20 mM FeCl3, 40 mM HCl을 이용하여 만든 10 mM TPTA를 10 : 1 :1 의 비율로 혼합하여 사용하였다. FRAP solution 150 μL과 농도별 다시마와 쇠미역 시료 10 μL를 혼합하여 37℃ 30분 동안 반응한 후 593 nm에서 흡광도를 측정하였고, 양성대조군으로 ascorbic acid를 사용하였다. 그 후 아래와 같은 식으로 시료의 FRAP 활성을 계산하고 50%의 소거능을 갖는 시료 농도인 IC50 (Inhibitory concentration)값을 구하였다.
A : 시료 첨가구의 흡광도
B : 시료 무첨가구의 흡광도
항산화 효소 활성 측정
추출용매에 따른 다시마와 쇠미역 추출물에 50 mM Potassium phosphate, pH 7.0, 1% Triton X-100, 1% PVP-40 용액을 1 : 4의 비율로 혼합하고 4℃에서 20분간 반응시킨 후 12,000 rpm에서 15분 동안 원심분리한 다음 상층액을 분리하였다. 그 후 BSA protein assay kit (Thermo Fisher Scientific, Waltham, MA, USA)를 사용하여 정량 후 항산화효소 활성 분석에 사용하였다.
SOD activity 측정
SOD activity는 Beauchamp and Fridovich (1971)의 방법을 응용해 Xanthine과 Xanthine oxidase 반응으로 생성된 superoxide anion를 이용해 Nitroblue tetrazolium (NBT)의 환원 정도를 측정하였다. 50 mM potassium phosphate pH7.0, 3 mM EDTA, 3 mM Xanthine, 0.75 mM NBT 용액 0.2 mL에 각각 다시마와 쇠미역 추출물 20 μL를 혼합하고 25℃에서 10분간 반응하였다. 그 다음 0.3 unit/mL Xanthine oxidase를 첨가한 후 560 ㎚에서 흡광도를 측정하였다. SOD 효소 활성은 다음 계산식에 의해 환산하였다.
A : 시료 첨가구의 흡광도
B : 시료 무첨가구의 흡광도
Catalase activity 측정
Catalase activity는 Aebi (1984)의 방법에 따라 기질인 Hydrogen peroxide (H2O2)의 감소량을 측정하였다. 50 mM potassium phosphate pH 7.0, 10 mM H2O2 용액 0.2 mL에 다시마와 쇠미역 추출물 20 μL를 각각 혼합하고 2분동안 30초마다 240 nm에서 흡광도를 측정하였다. 여기서, 43.6은 240 ㎚에서 H2O2의 extinction coefficient이고, 다음과 같이 계산하였다.
A : 시료 첨가구의 흡광도
B : 시료 무첨가구의 흡광도
APX activity 측정
Ascorbate peroxidase는 catalase와 더불어 Hydrogen peroxide (H2O2)를 제거하는 중요한 효소로 알려져 있다. APX activity는 Nakano and Asada (1981)의 방법을 응용하여 ascorbate를 산화 시켜 H2O2의 감소량을 측정하였다. 50 mM potassium phosphate pH 7.0, 0.5 mM ascorbate, 0.1 mM EDTA, 0.1 mM H2O2 용액 0.2 mL에 다시마와 쇠미역 추출물 20 μL를 혼합한 다음 37℃에서 5분간 반응시켰다. 이후 290 ㎚에서 혼합액의 흡광도를 측정하였다. 여기서, 2.8은 290 ㎚에서 ascorbate의 extinction coefficient이고, 다음과 같이 계산하였다.
A : 시료 첨가구의 흡광도
B : 시료 무첨가구의 흡광도
항노화 활성 측정
Collagenase 저해 활성
1 ㎎/mL의 다시마와 쇠미역 추출물 시료 50 μL에 0.1 M Tris-HCl pH 7.5, 4 mM CaCl2 12.5 μL와 0.5 ㎎/mL의 collagenase 75 μL를 혼합 후 37℃에서 20분 동안 반응 후 6% citric acid 0.25 mL을 넣어 반응을 정지시킨다. 마지막으로 ethyl acetate 750 μL를 첨가한 후 96 well plate에 상층액을 0.2 mL씩 분주하여 320 ㎚에서 흡광도를 측정하고, 다음과 같은 식으로 collagenase 저해 활성을 계산하였다(Jeong and Park, 2018; Kim and Lee, 2020).
A : 시료 첨가구의 흡광도
AB : 시료 첨가구에 효소 무첨가구의 흡광도
C : 대조구의 흡광도
CB : 대조구에 효소 무첨가구의 흡광도
Elastase 저해 활성
1 ㎎/mL의 다시마와 쇠미역 추출물 시료 50 μL에 50 mM Tris-HCl, pH 8.6으로 녹인 0.5 ㎎/mL의 N-succinyl-(Ala)3-p-nitroanilide 50 μL를 혼합하여 37℃에서 5분간 반응 시킨 후 410 nm에서 흡광도를 측정하고, 그 위에 50 mM Tris-HCl, pH 8.6를 이용하여 만든 0.2 unit/mL porcine pancreas elastase 50 μL를 넣고 37℃에서 5분간 반응 시킨 후 410 ㎚에서 흡광도를 측정하였다. 다음과 같은 식으로 elastase 저해 활성을 계산하였다(Cannell et al., 1988).
A : 대조군과 효소첨가구의 흡광도
B : 시료와 효소 첨가구의 흡광도
C : 시료 첨가 후 효소 무첨가구의 흡광도
Tyrosinase 저해활성 측정
Tyrosinase 저해활성은 Yagi et al. (1987)의 방법을 변형하여 측정하였다. 1 ㎎/mL의 다시마와 쇠미역 추출물 시료 20 μL에 0.1 M potassium phosphate buffer, pH 6.8로 녹인 1.5 mM의 3,4-dihydroxy-L-phenyl-alanine (L-DOPA) 70 μL와 0.1 M potassium phosphate buffer, pH 6.8, 60 μL를 혼합하여 37℃에서 5분간 반응 시킨 후 500 U/mL의 mushroom tyrosinase 50 μL를 첨가하여 37℃에서 5분간 반응시킨 다음 490 ㎚에서 흡광도를 측정하여 다음과 같은 식으로 tyrosinase 저해활성을 계산하였다(Kim et al., 2022; Kim and Lee, 2020).
A : 대조군과 효소첨가구의 흡광도
B : 시료와 효소 첨가구의 흡광도
C : 시료 첨가 후 효소 무첨가구의 흡광도
페놀화합물 함량 분석
추출용매에 따른 다시마와 쇠미역 추출물의 페놀화합물 정량분석하기 위해 LC-MS/MS 질량분석기(AB SCIEX 4000 Q-Trap, Shimadzu LC 20A System)를 이용하였다. 분석 용매인 acetonitrile과 methanol은 모두 HPCL용을 사용하였고, 20 ㎎의 다시마와 쇠미역 시료를 각 추출용매 1 mL에 녹인 후 상층을 증류수로 40배 희석하여 10 μL를 Gemini C18 컬럼(3 ㎛, 110A 50 ㎜ × 2.0 ㎜)에 주입하여 분석 후 환산하였다. 각 시료는 LC-MS/MS 질량분석기를 이용하여 3회 반복하여 분석하였다.
통계처리
모든 실험은 3회 이상 반복 실험하여 평균과 오차 값을 나타냈고, 통계처리는 IBM SPSS Statistics (SPSS Inc, Chicago, USA, version 25) 을 이용하여 분석하였다. 각 실험의 유의성 분석은 ANOVA 검정을 시행하였으며, p < 0.05 수준에서 Duncan’s multiple test로 검정하였다. 다시마와 쇠미역 추출물의 총 폴리페놀, 플라보노이드 함량과 항산화 능력에 대한 상관관계를 Pearson’s correlation analysis (SPSS Inc, Chicago, USA, version 25)를 통해 분석하였다(p < 0.05, p < 0.01).
결과 및 고찰
추출용매별 다시마와 쇠미역의 추출 수율
본 실험에서 다시마와 쇠미역 시료는 95% 주정, 95% 메탄올, 증류수를 가지고 추출을 진행하였다. 추출용매별 다시마 추출물은 0.6~13.6%의 수율을 보였으며, 그 중 다시마 열수추출물에서 13.6%로 가장 높은 수율이 나타났다(Table 1). 추출용매별 쇠미역의 추출 수율은 0.6~13.6%으로 열수, 메탄올, 주정 추출물 순으로 높은 수율을 보였다. 다시마와 쇠미역 추출물은 모두 열수추출물에서 각각 9.4, 13.6%으로 다른 추출용매에 비해 가장 높은 수율이 측정되었다.
Table 1.
The extraction yields of extracts from Saccharina japonica and Costaria costata
| Solvent | Yield (%) | |
| SJz | CCy | |
| Prethanol | 3.2±0.2b | 0.6±0.1b |
| Methanol | 1.2±0.2c | 2.5±0.2b |
| Water | 9.4±0.8a | 13.6±1.9a |
추출용매별 다시마와 쇠미역 추출물의 폴리페놀 및 플라보노이드 함량 분석
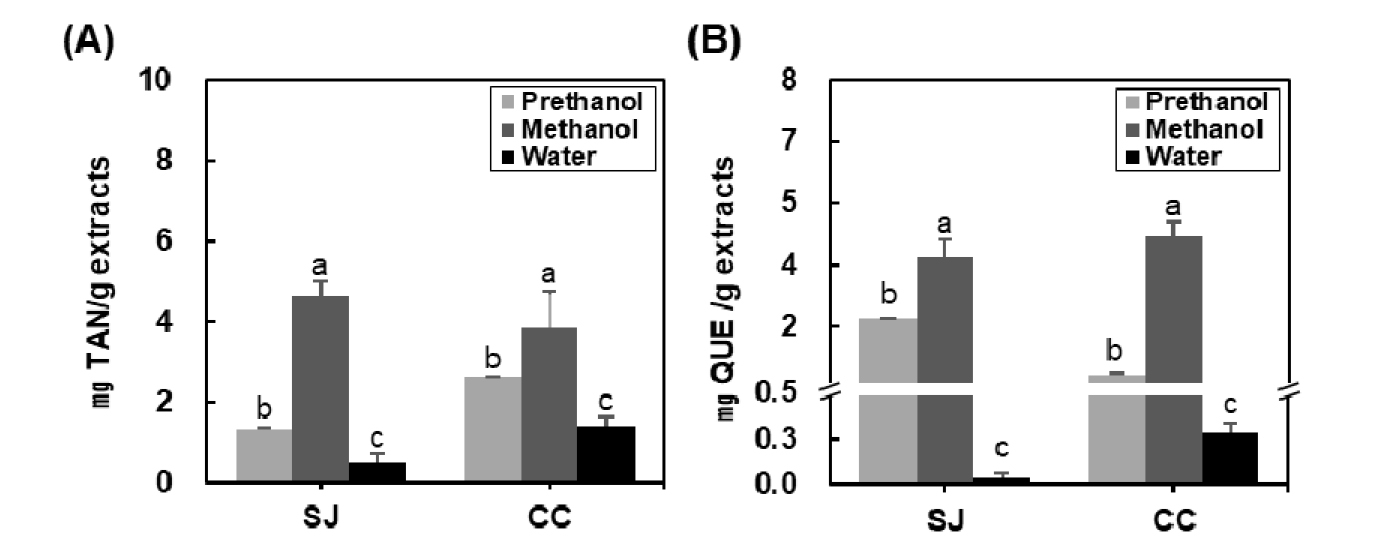
다시마와 쇠미역 주정, 메탄올, 열수추출물의 폴리페놀 함량과 플라보노이드 함량을 분석하였고, 그 결과는 Fig. 1에 나타내었다. 추출용매별 다시마의 폴리페놀 함량은 0.52~4.63 ㎎ TAN/g으로 나타났고, 그 중 다시마 메탄올 추출물이 4.63 ㎎ TAN/g으로 열수, 주정 추출물에 비해 가장 높은 폴리페놀 함량을 보였다(Fig. 1A). 추출용매별 쇠미역의 폴리페놀 함량은(1.38~3.84 ㎎ TAN/g) 메탄올 추출물에서 가장 높게 나타났으며, 이는 쇠미역 열수추출물에 비해 2.8배 높은 함량을 보였다. 다시마와 쇠미역 추출물은 모두 메탄올 > 주정 > 열수 추출물 순으로 높은 폴리페놀 함량이 측정되었고, 쇠미역의 주정과 열수추출물은 다시마 주정과 열수 추출물보다 각각 2.0, 2.7배 높은 폴리페놀 함량 수준을 보였다.
다시마 추출물의 플라보노이드 함량은 각각 0.04~3.69 ㎎ QUE/g으로 확인되었으며 메탄올 > 주정 > 열수 추출물 순으로 높은 함량이 나타났다. 쇠미역 추출물은 0.28~4.19 ㎎ QUE/g의 플라보노이드 함량이 측정되었으며, 그 중 쇠미역 메탄올 추출물이 4.19 ㎎ QUE/g로 가장 높은 플라보노이드 함량을 나타냈다. 다시마와 쇠미역 모두 주정, 열수 추출물에 비해 메탄올 추출물의 플라보노이드 함량이 유의적으로 높았으며, 쇠미역 메탄올과 열수추출물이 다시마 추출물에 높은 플라보노이드 함량을 보였다.
Aminina et al. (2020a)은 개다시마(Saccharina sculpera)와 쇠미역(Costaria costata) 증류, 에탄올 추출물의 폴리페놀 함량을 분석한 결과 개다시마와 쇠미역은 에탄올 추출물보다 증류수추출물에서 각각 1.6, 4.9배 높은 폴리페놀 함량을 나타내 증류수를 이용하였을 때 효과적으로 폴리페놀을 추출할 수 있으며, 같은 다시마 목에 속하더라도 종에 따라 다른 폴리페놀 함량을 보인다고 보고하였다.
폴리페놀 화합물은 한 개 이상의 방향족고리 구조를 가지고 있는 천연 항산화제로 페놀산, 플라보노이드, 스틸벤(stilbenes), 리그난(lignan) 등으로 나눌 수 있다(Machu et al., 2015). 해조류의 폴리페놀 화합물은 세포벽의 필수 구성요소로 알려져 있으며, 폴리페놀 화합물의 구성과 구조는 해조류 종에 따라 다르고(Aminina et al., 2020a), 주로 해조류의 폴리페놀 화합물은 아세톤, 메탄올, 에탄올 등 극성 용매와 증류수를 통해 분리된다고 알려져 있다(Liu et al., 2017).
본 실험에서 추출용매에 따른 다시마와 쇠미역의 폴리페놀, 플라보노이드 함량을 비교분석한 결과 폴리페놀 함량은 다시마 메탄올추출물, 플라보노이드 함량은 쇠미역 메탄올추출물에서 다른 추출물에 비해 높은 함량을 보였으며, 추출용매에 따른 다시마와 쇠미역의 폴리페놀과 플라보노이드 함량은 추출용매와 해조류 종류에 따라 다르게 나타나는 것으로 판단된다.
추출용매에 따른 다시마와 쇠미역 추출물의 DPPH 라디칼 소거능
주정, 메탄올, 열수 추출을 통한 다시마와 쇠미역의 DPPH 라디칼 소거능을 측정한 결과 추출용매에 따른 다시마의 DPPH 라디칼 소거능은 IC50 = 43.5~127.5 ㎍/μL으로 나타났다(Table 2). 다시마 메탄올추출물의 DPPH 라디칼 소거능은 IC50 = 43.5 ㎍/μL으로 다시마 주정과 열수 추출물에 비해 각각 2, 3배 높은 DPPH 라디칼 소거능이 관찰되었다. 쇠미역 추출물의 경우 주정추출물이 IC50 = 42.5 ㎍/μL의 DPPH 라디칼 소거능을 보였으며 쇠미역 메탄올 추출물에서도 IC50 = 45.9 ㎍/μL으로 주정추출물과 비슷한 DPPH 활성을 나타냈다. 또한 추출용매에 따른 다시마와 쇠미역 추출물의 DPPH 라디칼 소거능은 모두 열수 추출물에서 가장 낮은 활성을 보였으며, 다시마 보다 쇠미역에서 높은 DPPH 라디칼 소거능을 나타냈다. 이러한 결과는 Kim et al. (2013)의 다시마, 미역, 톳, 김, 꼬시래기, 파래 6종의 식용해조류의 DPPH 라디칼 소거활성을 측정한 연구에서 6종 모두 에탄올 추출물이 증류수추출물보다 더 높은 활성을 보였다고 보고한 결과와 일치하였다. 본 실험에서 다시마와 쇠미역 열수추출물은 가장 낮은 DPPH 라디칼 소거능을 보인 결과는 Aminina et al. (2020b)의 보고와 같이 열수 추출 과정동안 다시마와 쇠미역에 포함된 물질들의 항산화 활성이 파괴 또는 감소되어 주정과 메탄올 추출물에 비해 낮은 DPPH 라디칼 소거능이 나타난 것으로 판단된다.
추출용매에 따른 다시마와 쇠미역 추출물의 ABTS 라디칼 소거능
다시마와 쇠미역의 주정, 메탄올, 열수추출물의 ABTS 라디칼 소거능을 측정하여 IC50 값을 계산한 결과 추출용매에 따른 다시마 추출물의 ABTS 활성은 IC50 = 15.4~26.2 ㎍/μL 범위의 ABTS 활성이 측정되었다. 다시마 추출물 중 가장 높은 ABTS 활성을 보인 다시마 주정추출물은 다시마 열수추출물에 비해 1.7배 높은 활성이 나타났다(Table 2). 쇠미역 추출물은 IC50 = 10.3~18.2 ㎍/μL의 범위의 ABTS 활성이 나타났으며 쇠미역 주정추출물은 가장 낮은 ABTS활성을 보인 쇠미역 열수추출물보다 1.8배 높은 ABTS활성이 확인되었다. 다시마와 쇠미역 추출물의 ABTS 활성은 주정 > 메탄올 > 열수 추출물 순으로 높은 활성을 보였으며, 모든 추출용매에서 쇠미역 추출물의 ABTS 활성이 다시마보다 높은 것으로 관찰되었다. 이러한 결과는 Aminina et al. (2020)의 다시마과와 쇠미역과에 속하는 해조류 추출물들의 ABTS 활성을 분석한 연구에서 증류수와 에탄올 추출물에서 다시마과 해조류들보다 쇠미역과 해조류들이 효과적인 ABTS 활성을 보였던 결과와 유사한 경향을 보여주었다. 또한 Kim et al.(2021)의 쇠미역의 열수와 주정 추출물의 ABTS 활성을 측정한 연구에서 쇠미역 주정추출물이 열수 추출물보다 약 3.3배 높은 ABTS 활성을 보였으며, 이는 추출물의 총 폴리페놀 함량이 높을수록 전자공여능이 높게 나타났다고 보고하였다. 이와 유사하게 본 실험의 추출용매에 따른 다시마와 쇠미역 추출물의 ABTS 라디칼 소거능에서 쇠미역 주정추출물이 IC50 = 10.3 ㎍/μL으로 다른 추출물에 비해 가장 높은 소거능이 측정되었으며, 폴리페놀 함량이 높을 경우 더 우수한 ABTS 라디칼 소거능이 나타난 것을 확인하였다.
Table 2.
The DPPH, ABTS and FRAP IC50 values of various solvent extracts from Saccharina japonica and Costaria costata
| Solvent | DPPH (IC50=㎍/μL) | ABTS (IC50=㎍/μL) | FRAP (IC50=㎍/μL) | |||
| SJz | CCy | SJ | CC | SJ | CC | |
| Prethanol | 83.7±2.0b | 42.5±5.9a | 15.4±5.3a | 10.3±0.4 | 18.5±0.1a | 16.0±1.4b |
| Methanol | 43.5±2.0a | 45.9±4.0a | 17.9±2.3a | 13.9±2.5 | 18.8±1.2a | 13.7±0.6a |
| Water | 127.5±22.8c | 107.6±8.7b | 26.2±3.4b | 18.2±6.1 | 27.3±0.4b | 17.8±0.2c |
| Ascorbic acid | 0.4±0.0 | 0.5±0.0 | 0.2±0.0 | |||
추출용매에 따른 다시마와 쇠미역 추출물의 FRAP 활성 측정
주정, 메탄올, 열수 추출을 통한 다시마와 쇠미역의 FRAP 활성 측정 결과는 Table 2에 나타내었다. 다시마 추출물의 FRAP 활성의 IC50 값은 18.5~27.3 ㎍/μL으로 측정되었다. 다시마 주정과 메탄올추출물의 FRAP 활성의 IC50 값은 각각 18.5, 18.8 ㎍/μL으로 유사한 활성을 보였고, 다시마 열수추출물에서 27.3 ㎍/μL으로 나타나 다시마 주정과 메탄올 추출물 보다 낮은 FRAP 활성을 나타냈다. 쇠미역 추출물의 FRAP 활성은 IC50 = 13.7~17.8 ㎍/μL 으로 측정되었다. 쇠미역 메탄올추출물에서 IC50 값이 13.7 ㎍/μL으로 가장 높은 FRAP활성을 보였으며 그 다음으로 주정(IC50 = 16.0 ㎍/μL), 열수 추출물(IC50 = 17.8 ㎍/μL) 순으로 관찰되었다. 추출용매에 따른 다시마와 쇠미역 추출물의 FRAP 활성은 ABTS 활성과 유사하게 모든 추출용매에서 쇠미역 추출물이 다시마 추출물보다 높은 활성을 보였으며, 특히 쇠미역 메탄올 추출물이 가장 우수한 FRAP 활성을 나타냈다. Farvin and Jacobsen (2013)의 연구에 의하면 홍조류 Polysiphonia fucoides은 열수추출물보다 에탄올 추출물에서 3배 높은 FRAP 활성을 나타냈으며, 이는 열수추출물에 비해 에탄올 추출물에서 높은 총 페놀 함량이 FRAP활성에 기여한 것으로 보고하였다. 본 실험에서도 쇠미역 메탄올 추출물의 높은 폴리페놀 및 플라보노이드 함량이 쇠미역 메탄올 추출물의 FRAP 활성에 영향을 미쳤을 것으로 판단된다.
추출용매에 따른 다시마와 쇠미역의 항산화효소 활성 분석
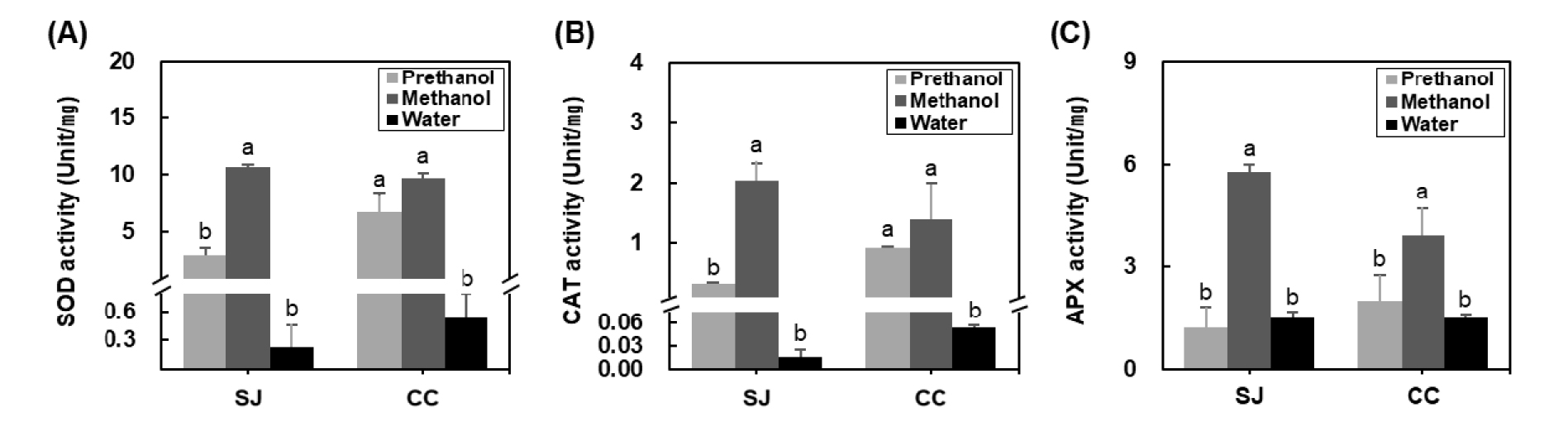
식물과 해조류의 광합성, 광산화 과정의 부산물로 활성산소가 생성되며 과잉 생성된 활성산소는 세포 내 DNA, 단백질, 지질 등을 손상시켜 식물과 해조류의 성장을 방해한다고 알려져 있다(Aguilera et al., 2002). 대표적인 활성산소로는 Superoxide (O2・-), hydroxyl radical (・OH), hydrogen peroxide (H2O2) 등이 있으며, 식물과 해조류는 이러한 활성산소를 제거하기 위한 메커니즘을 가지고 있고, 그 중 SOD (Superoxide dismutase), CAT (Catalase), APX (Ascorbate peroxidase)는 해조류 내에 생성된 활성산소를 억제하는 항산화 효소로 알려져 있다(Bischof and Rautenberger, 2012).
본 실험에서 추출용매에 따른 다시마와 쇠미역 추출물의 SOD, CAT, APX 활성을 측정하였고, 그 결과는 Fig. 2에 나타내었다. 추출용매별 다시마 추출물은 0.23~10.64 unit/㎎의 SOD 활성을 보였으며, 그 중 다시마 메탄올 추출물의 SOD활성이 10.64 unit/㎎으로 가장 높은 활성이 측정되었다(Fig. 2A). 다시마 열수추출물이 주정과 메탄올추출물에 비해 낮은 SOD 활성이 나타났다. 추출용매별 쇠미역 추출물은 0.53~9.66 unit/㎎의 SOD 활성을 보였으며, 다시마 추출물과 유사하게 메탄올 > 주정 > 열수 추출물 순으로 높은 SOD활성이 관찰되었다. 다시마와 쇠미역 메탄올 추출물의 SOD 활성은 각각 10.64, 9.66 unit/㎎으로 유사한 정도의 활성을 보였으며, 주정추출물의 경우 쇠미역 주정추출물이 6.63 unit/㎎의 SOD 활성을 측정되었고 이는 다시마 주정추출물에(2.88 unit/㎎) 비해 2.3배 높은 SOD 활성을 나타냈다. 다시마와 쇠미역 열수추출물에서는 각각 0.23, 0.53 unit/㎎을 보여 다른 추출물에 비해 가장 낮은 SOD활성이 확인되었다.
다음으로 추출용매별 다시마 추출물은 0.01~2.03 unit/㎎의 CAT 활성을 보였다(Fig. 2B). 다시마 메탄올 추출물은 2.03 unit/㎎으로 다시마 주정과 열수 추출물에 비해 유의적으로 높은 CAT활성을 나타냈다. 쇠미역 추출물의 CAT활성은 0.05~1.38 unit/㎎으로 측정되었고, 쇠미역 메탄올 추출물에서 가장 높은 CAT활성을 보였다. 다시마와 쇠미역 메탄올 추출물의 CAT 활성은 각각 2.03, 1.38 unit/㎎으로 주정과 열수 추출물에 비해 유의적으로 높은 활성을 보였으며, 이는 다시마 쇠미역 추출물의 SOD 활성과 유사한 결과를 나타냈다. 주정 추출물의 CAT 활성에서는 쇠미역이 다시마보다 2.7배 높은 활성을 나타냈으며, 다시마와 쇠미역 열수추출물은 주정과 메탄올추출물에 비해 현저히 낮은 CAT활성이 확인되었다.
마지막으로 다시마와 쇠미역 추출물의 APX 활성의 경우, 다시마 추출물에서는 1.22~5.76 unit/㎎의 APX 활성을 보였고 주정 < 열수 < 메탄올 추출물 순으로 나타났으며, 쇠미역 추출물에서는 1.51~3.91 unit/㎎으로 열수 < 주정 < 메탄올 추출물 순으로 APX 활성이 측정되었다. 다시마와 쇠미역 모두 메탄올 추출물에서 각각 5.76, 3.91 unit/㎎으로 가장 높은 APX 활성이 나타났고, 주정 추출물에서는 쇠미역이 다시마에 비해 1.6배 높은 APX활성이 관찰되었다. 열수추출물에서는 다시마와 쇠미역 사이의 APX 활성에 큰 차이가 나타나지 않았으며, 다른 추출물들에 비해 가장 낮은 APX 활성 값을 보였다.
본 실험에서 추출용매에 따른 다시마와 쇠미역 추출물의 SOD, CAT, APX 활성을 측정한 결과 다시마와 쇠미역 모두 주정과 열수추출물에 비해 메탄올 추출물에서 유의적으로 높은 항산화 효소활성을 보였으며, 특히 다시마 메탄올 추출물에서 쇠미역 추출물에 비해 우수한 항산화효소 활성을 가진 것으로 판단된다.
추출용매에 따른 다시마와 쇠미역 추출물의 항노화 활성
Collagen, elastin 단백질은 피부 진피층에 존재하며 세포 접착 및 지지, 피부의 탄력, 견고성 등의 기능을 한다. 세포 외 기질단백질로 알려진 collagenase, elastases의 과도한 활성에 의해 collagen과 elastin 단백질이 분해되면 피부의 주름 생성과 피부가 탄력을 잃어 피부 처짐이 발생하게 되므로 피부 노화를 늦추기 위해서는 collagenase와 elastase의 활성을 저해 시키는 것이 중요하다(Castejón et al., 2021). 따라서 추출용매에 따른 다시마와 쇠미역의 항노화 활성을 알아보기 위해 collagenase와 elastase 저해 활성을 측정하였고 그 결과는 Table 3에 나타내었다.
Table 3.
Collagenase, elastase and tyrosinase inhibition activities of extracts from Saccharina japonica and Costaria costata
| Solvent | Collagenase inhibition activity (%) | Elastase inhibition activity (%) | Tyrosinase inhibition activity (%) | |||
| SJz | CCy | SJ | CC | SJ | CC | |
| Prethanol | 65.0±2.2 | 17.6±1.0 | 19.0±0.2a | ND | 13.7±3.4c | 9.2±0.4c |
| Methanol | 19.6±0.2 | 88.3±0.2 | 12.1±0.5b | 12.6±1.1 | 41.8±2.3z | 30.3±0.5a |
| Water | NDx | ND | 10.3±0.2c | 7.4±0.2 | 28.7±9.2b | 22.4±0.2b |
다시마 추출물의 collagenase 저해 활성의 경우, 주정추출물이 65.0%으로 메탄올추출물에 비해 3.3배 높은 저해능을 보였고 열수추출물에서는 collagenase 저해활성이 나타나지 않았다. 쇠미역 추출물에서는 쇠미역 메탄올추출물이 88.3%의 collagenase 저해활성이 나타나 쇠미역 주정추출물에 비해 5배 높은 저해 활성을 보였다. 다시마와 쇠미역 추출물의 collagenase 저해활성을 비교하였을 때 주정추출물에서는 다시마, 메탄올추출물에서 쇠미역이 각각 높은 collagenase 저해활성이 나타났다. 또한 다시마 주정추출물과 쇠미역 메탄올추출물은 양성대조군으로 사용한 항산화제인 quercetin 보다 높은 우수한 collagenase 저해활성을 갖는 것을 확인하였다. 같은 시료 내에서도 추출용매에 따라 서로 다른 collagenase 저해 활성을 확인 할 수 있었으며, 이와 유사하게 Pak et al. (2016)이 잔가시 모자반 95% 에탄올과 열수 추출물의 collagenase 저해활성을 측정한 결과, 1 ㎎/mL 농도에서 각각 83.27, 28.71%의 collagenase 저해 활성이 보고되었다.
다음으로 추출용매에 따른 다시마와 쇠미역 추출물의 elastase 저해 활성을 측정한 결과 다시마는 주정추출물에서 19.0%로 가장 높은 elastase 저해활성이 측정되었고 다음으로 메탄올, 열수 추출물 순으로 높은 저해활성을 보였다. 쇠미역의 경우 주정추출물의 elastase 저해 활성이 12.6%으로 가장 높은 저해능을 보였다. 주정추출물에서는 다시마가 19.0%의 elastase 저해활성이 측정되었고, 메탄올 추출물에서 다시마와 쇠미역이 각각 12.1, 12.6%의 저해능을 보였으며, 다시마와 쇠미역 간의 elastase 저해 활성 차이는 관찰되지 않았다. 열수추출물에서는 다시마는 10.3%로 측정되었고, 이는 쇠미역 열수추출물에 비해 1.4배 높은 elastase 저해활성을 가지는 것을 확인하였다. Castejón et al. (2021)의 녹조류 Ulva lactuca, 갈조류 Alaria esculenta, 홍조류 Palmaria palmata 추출물의 elastase 저해활성을 비교 한 연구에서 갈조류인 A. esculenta의 추출물에서 가장 높은 elastase 저해활성이 측정되었으며, 이는 A. esculenta 추출물의 높은 폴리페놀과 플라보노이드 함량과 관련됨을 보고하였다. 이와 다르게 본 실험에서 추출용매에 따른 다시마와 쇠미역의 elastase 저해활성 측정 결과는 폴리페놀과 플라보노이드 함량과 연관성은 없는 것으로 판단된다.
본 실험에서 추출용매에 따른 다시마와 쇠미역 추출물의 collagenase와 elastase 저해활성을 평가한 결과 주정과 메탄올 추출물이 열수추출물보다 비교적 높은 collagenase와 elastase 저해활성이 확인되었다. 또한, collagenase 저해활성은 쇠미역 메탄올 추출물, elastase 저해활성은 다시마 주정추출물에서 다른 추출물들에 비해 우수한 collagenase와 elastase 저해 활성이 관찰되어 피부 탄력과 주름 개선 가능성이 높을 것으로 판단된다.
추출용매별 다시마와 쇠미역 추출물의 tyrosinase 저해 활성
멜라닌(melanin)은 동물, 식물, 해조류 뿐만 아니라 다양한 생물에 광범위하게 존재하는 색소 중 하나이며 자외선으로부터 피부를 보호하는 역할을 한다. 멜라닌은 멜라닌 세포(melanocyte)에서 아미노산인 L-tyrosine이 tyrosinase의 활성에 의해 다양한 산화반응을 거쳐 멜라닌이 생성되고 이렇게 합성된 멜라닌 색소의 종류와 양에 따라 피부색, 머리색 등이 결정된다. 자외선, 활성산소에 의한 스트레스, 염증반응 등으로 피부에 과도한 멜라닌 생성 및 축적은 피부에 기미 및 색소침착을 일으킨다고 알려져 있다(Kim and Uyama, 2005; Lee et al., 2021).
추출용매에 따른 다시마와 쇠미역 추출물의 tyrosinase 저해활성을 측정한 결과 다시마 추출물에서는 13.7~41.8%의 저해활성이 나타났으며, 그 중 다시마 메탄올 추출물이 41.8%으로 가장 높은 tyrosinase 저해활성이 측정되었다. 쇠미역 추출물은 9.2~30.3%의 tyrosinase 저해활성이 나타났고, 쇠미역 메탄올 추출물에서(30.3%) 가장 높은 저해활성을 보였으며, 주정 추출물에서 9.2%로 가장 낮은 저해활성을 보였다. 다시마와 쇠미역 추출물 모두 메탄올 > 열수 > 주정 순으로 높은 저해활성이 확인되었다. 주정추출물에서는 다시마의 tyrosinase 저해활성이 13.7%로 쇠미역에 비해 1.5배 높은 저해활성을 보였고, 메탄올 추출물의 tyrosinase 저해활성은 다시마가 41.8%, 쇠미역이 30.3%으로 나타났다. 마지막으로 열수추출물에서 다시마와 쇠미역은 각각 28.7, 22.4%의 tyrosinase 저해활성이 측정되어 모든 추출용매에서 다시마가 쇠미역보다 비교적 높은 tyrosinase 저해활성이 관찰되었다. 본 실험에서 추출용매에 따른 다시마와 쇠미역 추출물의 tyrosinase 저해활성을 평가한 결과, 메탄올 추출물이 다른 추출용매에 비해 높은 tyrosinase 저해활성을 보였으며, 그 중 다시마 메탄올 추출물이 41.8%으로 가장 우수한 tyrosinase 저해활성을 나타냈다. 이와 같은 결과는 Naidoo et al. (2016)이 항산화 물질이 자유라디칼에 의한 피부 손상을 감소시키고 melanin 생성과정에서 환원제의 역할을 함으로서 melanin 생성을 억제할 수 있다고 보고한 바와 같이 다른 추출물에 비해 높은 폴리페놀 함량과 항산화 효소활성이 나타난 다시마 메탄올 추출물에서 가장 우수한 tyrosinase 저해활성을 나타낸 것으로 판단된다.
추출용매별 다시마와 쇠미역 추출물의 페놀화합물 함량 분석
페놀화합물은 중요한 천연 항산화물질 중 하나로 알려져 있으며 한 개 이상의 방향족 고리에 –OH기를 포함하는 구조를 가진다(Machu et al., 2015). 해조류의 페놀화합물은 페놀산(phenolic acid)부터 복잡한 구조의 플로로탄닌(phlorotannin) 까지 다양하며 항산화, 항암 효과 등 여러 생리활성들이 보고되었다(Mekinić et al., 2019). 본 실험에서 다시마와 쇠미역 추출물의 페놀화합물 분석에 사용한 4-hydroxybenzoic acid는 갈조류에서 주로 검출되는 페놀화합물 중 하나로(Dinh et al., 2018) 물에 쉽게 용해되며 저혈당 활성(Al-Hazzani and Alshatwi, 2011), 항균활성(Rushdi et al., 2022) 등을 가지고 있다. Naringin과 naringin의 aglycone 형태인 naringenin은 주로 감귤류에 다량으로 존재하는 플라보노이드 중 하나로 알려져 있고, 참그물바탕말과 같은 갈조류에서도 존재하며(Ibraheem et al., 2017), 이들은 항산화(Andrade and Burgess, 2007), 항염활성(Ribeiro et al., 2008) 등의 효능이 밝혀져 있다. 마지막으로 Nicotinic acid는 수용성 비타민으로 비타민 B3를 구성하고 있고 갈조류 중 주로 미역과 다시마 속의 종에 다량 함유하고 있다고 알려져 있으며(Kumari et al., 2022), 설사병, 피부 상처 및 색소침착 개선(Gehring, 2004), 혈액 순환 개선(Guo et al., 2013)에 도움을 준다고 보고되고 있다.
본 연구에서는 추출용매에 따른 다시마와 쇠미역 추출물의 페놀화합물 함량 변화를 알아보기 위해 각 추출물에 포함된 4-hydroxybenzoic acid, naringenin, nicotinic acid, naringin 4가지 페놀화합물의 함량을 측정하였다(Table 4). 다시마 추출물의 4-hydroxybenzoic acid 함량은 메탄올추출물에서 8.25 ㎍/g으로 열수추출물에 비해 4배 높은 4-hydroxybenzoic acid 함량이 측정되었다. 쇠미역 추출물의 4-hydroxybenzoic acid 함량은 2.82~5.04 ㎍/g으로 측정되었으며, 추출용매에 따라 주정 > 열수 > 메탄올 순으로 관찰되었다. 본 실험결과와 다르게 Dinh et al. (2018)의 연구에서 완도산 다시마의 4-hydroxybenzoic acid 함량을 조사한 결과 증류수추출물(0.15 ㎎/g) 외 에탄올, 아세톤 추출물에서는 4-hydroxybenzoic acid가 검출되지 않았으며, 이는 해조류 추출물의 추출조건에 따라 추출되는 페놀 화합물 양이 달라질 수 있음을 의미한다.
Table 4.
The compound contents analysis of extracts from Saccharina japonica and Costaria costata
| Solvent | 4-hydroxybenzoic acid contents (㎍/g) | Naringenin contents (㎍/g) | |||
| SJz | CCy | SJ | CC | ||
| Prethanol | NDx | 5.04±0.08a | 0.44±0.06 | 0.58±0.04 | |
| Methanol | 8.25±0.03 | 2.82±0.05c | ND | ND | |
| Water | 2.1±0.06 | 4.62±0.10b | ND | ND | |
| Solvent | Nicotinic acid contents (㎍/g) | Naringin contents (㎍/g) | |||
| SJ | CC | SJ | CC | ||
| Prethanol | 0.88±0.11 | ND | 661.66±13.93 | 369.4±5.05 | |
| Methanol | ND | 6.87±0.14 | ND | ND | |
| Water | 2.55±0.27 | 18.06±0.29 | ND | ND | |
다시마와 쇠미역 추출물의 naringenin, naringin 함량은 모두 주정추출물에서만 확인되었으며, naringenin 함량은 쇠미역(0.58 ㎍/g) > 다시마(0.44 ㎍/g) 주정 추출물순으로 나타났다. Naringin함량은 다시마 주정추출물의 함량이 661.66 ㎍/g으로 측정되었고, 다시마 주정 추출물은 쇠미역 주정 추출물에 비해 약 1.8배 높은 naringin 함량 보였다. Fatma et al. (2015)의 연구에 따르면 갈조류인 Taonia atomaria와 Padina pavonica 열수추출물의 naringin함량은 측정되지 않았고 녹조류 Ulva lactuca 열수추출물에서만 0.011 ㎎/g의 naringin 함량이 보고되었으며, 이와 같이 해조류의 종류와 추출용매에 따라 naringin의 함량에 차이가 나타나는 것으로 판단된다.
마지막으로 다시마와 쇠미역 추출물의 nicotinic acid 함량을 비교해본 결과 다시마는 열수추출물에서 2.55 ㎍/g의 nicotinic acid 함량이 측정되었고, 이는 다시마 주정추출물에 비해 2.9배 높은 함량을 보였다. 쇠미역은 열수 추출물에서 가장 높은 nicotinic acid 함량을(18.06 ㎍/g) 보였고, 쇠미역 메탄올추출물에서 6.87 ㎍/g로 가장 낮은 nicotinic acid 함량이 나타났다. 다시마와 쇠미역 추출물 모두 열수추출물에서 가장 높은 nicotinic acid 함량이 측정되었고 다시마보다 쇠미역 추출물에서 높은 nicotinic acid 함량이 확인되었다. Ryzhik et al. (2021)의 홍조류 Palmaria palmatа의 nicotinic acid 함량을 조사한 결과 일년동안 15~35 ㎍/g 범위의 nicotinic acid 함량이 측정되었고 그 중 6월에 가장 높은 함량을 나타내었다. 또한, 다른 해안에서 채취한 P. palmatа의 nicotinic acid 함량은 2~19 ㎍/g으로 보고되었다. Kolb et al. (2004)은 일본산 다시마와 미역의 nicotinic acid 함량을 각각 15.8, 25.6 ㎍/g으로 보고하여 본 실험 결과와 차이를 보였으며, 이러한 비타민 함량 차이는 해조류 채취시기, 서식지, 해조류의 특성에 의해 발생하는 것으로 판단된다.
해조류의 페놀화합물의 함량은 종(species), 해조류의 크기, 위치, 염도, 영양도, 자외선 노출 등 다양한 요인에 의해 영향을 받는다고(Mekinić et al., 2019) 알려져 있다. 이와 같이 본 실험에서 완도산 다시마와 쇠미역은 추출방법, 스트레스 정도, 크기, 연령 등의 여러 요인이 다르기 때문에 추출용매와 종에 따라 페놀화합물 함량이 차이가 나타난 것으로 판단된다.
다시마와 쇠미역 추출물의 폴리페놀, 플라보노이드 함량과 항산화활성의 상관관계
다시마와 쇠미역 추출물의 총 폴리페놀과 플라보노이드 함량이 이들의 항산화 효과에 기여하는지 알아보기 위해 총 폴리페놀, 플라보노이드 함량과 항산화 활성(DPPH 라디칼 소거능, ABTS 라디칼 소거능 FRAP 활성에 대한 상관관계를 분석하였으며 그 결과를 Table 5에 나타내었다. 다시마의 폴리페놀 함량은 DPPH 라디칼 소거능과 높은 음의 상관관계를(r = -0.873, p < 0.01)를 보였으며, 특히 다시마의 플라보노이드 함량은 DPPH 및 ABTS 라디칼 소거능, FRAP 활성의 IC50 값과 높은 음의 상관관계가(r = -0.946, -0.675, -0.887) 나타났다. 다음으로 쇠미역의 경우, 다시마와 유사하게 쇠미역의 총 폴리페놀 함량은 플라보노이드 함량과 높은 양의 상관관계가(r = 0.819, p < 0.01) 확인되었으며, 또한 쇠미역의 총 폴리페놀 함량과 DPPH 라디칼 소거능, FRAP활성의 IC50값과 높은 음의 상관관계(r = -0.755, -0.816)가 측정되었다.
Aminina et al. (2020b)은 13종의 해조류 에탄올, 증류수추출물의 총 폴리페놀 함량과 DPPH 라디칼 소거능 사이에 높은 양의 상관관계가(r = 0.8683, 0.9305) 나타나 총 폴리페놀 함량이 증가할수록 DPPH 라디칼 소거활성이 증가한다고 보고하였다. 이와 유사하게 본 실험 결과, 다시마와 쇠미역 총 폴리페놀 또는 플라보노이드 함량이 증가할수록 DPPH, ABTS 라디칼 소거능과 FRAP 활성이 증가함을 보였으며, 이는 다시마와 쇠미역에 포함된 다양한 폴리페놀과 플라보노이드 물질이 다시마와 쇠미역의 항산화활성에 관여하는 것으로 판단된다.
Table 5.
Pearson's correlation coefficient (r) between total polyphenol, flavonoid content and antioxidant activities according to various solvent extracts from Saccharina japonica and Costaria costata
적 요
본 연구에서는 추출용매에 완도산 다시마와 쇠미역의 항산화, 항노화 활성을 살펴보고 페놀화합물 함량을 비교 분석하였다. 먼저 다시마와 쇠미역 추출물의 폴리페놀, 플라보노이드 함량은 각각 다시마 메탄올추출물(4.64 ㎎ TAN/g), 쇠미역 메탄올추출물(4.19 ㎎ QUE/g)이 다른 추출물에 비해 높은 함량을 보였다. 또한 다시마와 쇠미역의 DPPH 라디칼 소거능은 모두 열수 추출물에서 가장 낮은 활성을 보였으며 쇠미역 주정추출물에서 높은 DPPH 라디칼 소거능(IC50 = 42.5 ㎍/μL)을 나타냈다. ABTS 라디칼 소거능과 FRAP 활성 측정 결과 다시마와 쇠미역 모두 열수보다 주정과 메탄올 추출물에서 높은 활성을 보였으며, 특히 쇠미역이 다시마보다 높은 ABTS 라디칼 소거능과 FRAP 활성을 나타냈다. 또한 다시마와 쇠미역 추출물의 SOD, CAT, APX 활성은 열수, 주정 추출물보다 메탄올 추출물에서, 그리고 쇠미역보다 다시마에서 높은 SOD, CAT, APX 활성이 확인되어 다시마 메탄올 추출물에서 뛰어난 항산화 효소 활성을 보였다. 그 다음으로 Collagenase, elastase 저해 활성은 쇠미역 메탄올 추출물과 다시마 주정추출물에서 각각 88.3, 19.0%의 우수한 collagenase 및 elastase 저해활성을 보였다. 미백 효과를 평가하기 위해 tyrosinase 저해 활성을 측정한 결과에서는 다시마와 쇠미역 모두 메탄올 추출물에서 각각 41.8, 30.3%로 나타나 다른 추출용매에 비해 높은 tyrosinase 저해활성이 측정되었으며, 주로 쇠미역보다 다시마에서 우수한 tyrosinase저해활성이 관찰되었다. 마지막으로 추출용매에 따른 다시마와 쇠미역 추출물의 페놀화합물 함량(4-hydroxybenzoic acid, naringenin, naringin, nicotinic acid) 분석 결과 4-hydroxybenzoic acid 함량은 다시마 메탄올 추출물(8.25 ㎍/g), naringenin과 naringin 함량은 각각 쇠미역 주정추출물(0.58 ㎍/g), 다시마 주정추출물(661.66 ㎍/g), 마지막으로 nicotinic acid 함량은 쇠미역 주정 추출물에서 18.06 ㎍/g으로 가장 높은 함량이 측정되었다. 본 실험 결과 다시마와 쇠미역은 메탄올과 주정 추출물에서 열수추출물에 비해 높은 폴리페놀 함량, 항산화 및 항노화 활성과 naringenin, naringin, nicotinic acid 함량이 나타났으며, 다시마와 쇠미역에 포함된 다양한 폴리페놀과 플라보노이드 물질이 다시마와 쇠미역의 항산화활성에 관여한 것으로 확인되어 다시마와 쇠미역 주정 및 메탄올 추출물의 추출조건을 확립할 수 있었고, 이를 이용한 건강 기능성 식품 소재로 활용과 화장품 소재 개발에 대한 가능성이 증가 될 수 있을 것으로 판단된다.