서 론
재료 및 방법
재료 및 추출물 제조
프로바이오틱스 배양
프로바이오틱스 생균수 측정
세포배양
세포독성 측정
NO 생성량 측정
Prostaglandin E2 (PGE2) 생성량 측정
생리활성 물질(루틴, 퀘세틴 및 콜린) 분석
통계처리
결과 및 고찰
메밀 첨가 배양액의 산도, OD 및 생균수 평가
메밀 첨가 배양액의 NO 생성 및 PEG2 억제 효과
메밀 종실과 새싹의 생리활성 물질 함량
적 요
서 론
인간의 장내 미생물은 건강과 질병에 중요한 역할을 수행하고 있으므로, 건강한 미생물 균총을 유지하는 것이 중요하다(Dupont and Dupont, 2011). 이러한 미생물의 역할은 음식물의 소화를 돕고, 유해균이 증식하는 것을 막아 장 건강을 유지할 뿐만 아니라 체내 대사, 영양, 에너지 이용, 면역과 염증성 장 질환 보호 등과 연관되어 있다(Heselmans et al., 2005). 장내 미생물 중 Bifidobacterium이나 Lactobacillus와 같은 프로바이오틱스들은 유제품의 제조에 널리 이용되고 있다. 이들 미생물은 장내 유해 미생물의 흡착, 증식, 침투, 독소 생산 등을 막아주는 것으로 알려져 있으며, 장내 pH를 낮추거나 또는 박테리오신을 생산하여 유해균의 증식을 억제한다(Fooks and Gibson, 2002). 그러나 발효 유제품 등의 형태로 섭취되는 프로바이오틱스들은 위장관을 통과하면서 대부분 사멸되고, 20~40% 정도만이 살아 남아 대장에까지 이르게 된다(Bae, 2012).
이러한 단점을 보완하기 위해 여러 가지 식물성 소재의 프리바이오틱스가 함유된 유산균을 활용한 신바이오틱스(synbiotics)를 개발하려는 연구가 활발히 진행되고 있다(Chow, 2002; Karimi and Peria, 2008). 이는 프리바이오틱스가 장내 균총을 개선하여 인체 건강을 증진시키는 효과가 있기 때문으로 주요 물질로는 라피노오스(raffinose)와 스타키오스(stachyose) 등의 대두 올리고당과 fructooligosaccharides로 알려진 야콘 올리고당이 있다(Chang and Kim, 2010; Chow, 2002; Kim et al., 2020; Oh and In, 2008; Sung et al., 2014). 대두 올리고당은 소화성 올리고당으로 소장 등에서 흡수가 이루어지나 프락 토올리고당은 난소화성 올리고당으로 소장에서 소화, 흡수가 되지 않아 대장까지 도달한다(Kim et al., 2013). 이러한 올리고당은 모두 장내 환경을 개선시키는 효능을 가지고 있으나, 난소화성 올리고당이 당분 흡수율이 더 낮아 장내 환경 개선에 더 적합하다(Lee et al., 2003).
메밀은 일반메밀(common buckwheat)과 쓴메밀(tartary buckwheat)이 주로 재배되고 있으며, 식용 및 약용 소재로 사용되고 있다(Kim et al., 2022a). 메밀의 약리효능으로는 항균 및 항궤양 효과(Hwang et al., 2006), 항산화 및 항염증 효과(Kim et al., 2019), 혈관질환 개선효과(Marshall et al., 1982) 등이 보고된 바 있다. 이는 메밀의 루틴(rutin), 퀘세틴(quercetin), 콜린(choline) 등의 생리활성 물질 때문이다(Kim and Kim, 2018). 메밀의 대표적인 기능성 물질인 루틴은 플라보노이드 성분의 하나로, 미국 건강보조식품 목록에 포함되어 있으며(Gullón et al., 2017; Kim et al., 2022b), 항염, 항산화, 항암, 항바이러스 및 간 보호 효과 등 광범위한 생리활성 기능이 확인되어 일반의약품 영양보조제로 많이 사용되고 있다(Ganeshpurkar and Saluja, 2017). 콜린은 세포막에서 인지질의 합성, 메틸 대사, 콜린성 신경전달 등에 작용하는 중요한 성분으로 1998년 미국식품영양위원회 의학연구소로부터 필수 영양소로 지정되었다(USDA, 2018; Zeisel and Blusztajn, 1994). 특히, 일반메밀은 발아 시 루틴 함량이 종실에 비해서 35-65배까지 증가하며(Jeon et al., 2015), 메밀싹을 요구르트 제조에 첨가 시 유산균 수가 많아진다(Kang and Kim, 2009). 이처럼 메밀 새싹추출물은 인체에 유익한 기능성이 확인된 루틴과 콜린 성분을 함유하고 있어 프로바이오틱스를 비롯한 다양한 기능성 제품개발에 활용될 가능성이 높다.
하지만 장 건강과 관련된 프리바이오틱스로서 메밀을 활용한 생리활성 연구는 상대적으로 미비한 실정이다. 따라서 본 연구에서는 10종의 프로바이오틱스에 메밀 새싹 추출물을 첨가하여 배양하는 방법으로 메밀 새싹의 유산균에 대한 영향과 염증 세포인 Lipopolysaccharide (LPS) 세포의 억제효과를 확인함으로써 잠재적인 프리바이오틱스 효과를 구명하고자 하였다. 또한, 일반메밀과 쓴메밀의 새싹 추출물 2종을 대상으로 유익균을 선택적으로 증식시키는 활성을 비교하여 프리바이오틱스로서의 효과적인 소재를 선발함과 동시에 장 건강에 도움이 되는 천연소재의 개발을 통해 건강기능식품으로의 산업적인 적용 가능성 여부에 대한 과학적 기초자료를 얻고자 하였다.
재료 및 방법
재료 및 추출물 제조
본 실험에는 농촌진흥청에서 육성한 일반메밀(Fagopyrum esculentum Moench)인 ‘양절메밀(Yangjul-memil)’과 쓴메밀(Fagopyrum tataricum Gaertner)인 ‘황금미소(Hwangguem-miso)’ 2품종을 강원도 평창군 대관령면(북위 37.40°, 동경 128.45°, 750 m)에 위치한 국립식량과학원 고령지농업연구소 시험포장에서 재배하여 수확한 종실을 사용하였다.
메밀 새싹을 암실 조건 및 20±2℃에서 7일 동안 재배하였으며, 동결건조한 분말을 추출에 사용하였다. 새싹 50 g을 동결건조한 분말에 80% 에탄올 5 L를 첨가하여 50℃에서 8시간 동안 총 3회 추출(50 g/15 L)하였다. 메밀 새싹 추출에는 환류 냉각장치를 이용하였고, 추출물은 No. 2 여과지(Whatman Inc., Kent, UK)로 여과하였다. 최종 추출물은 진공농축 후 동결건조한 다음 -20℃에서 보관하면서 프리바이오틱스 및 항염증 실험에 사용하였다(Fig. 1).
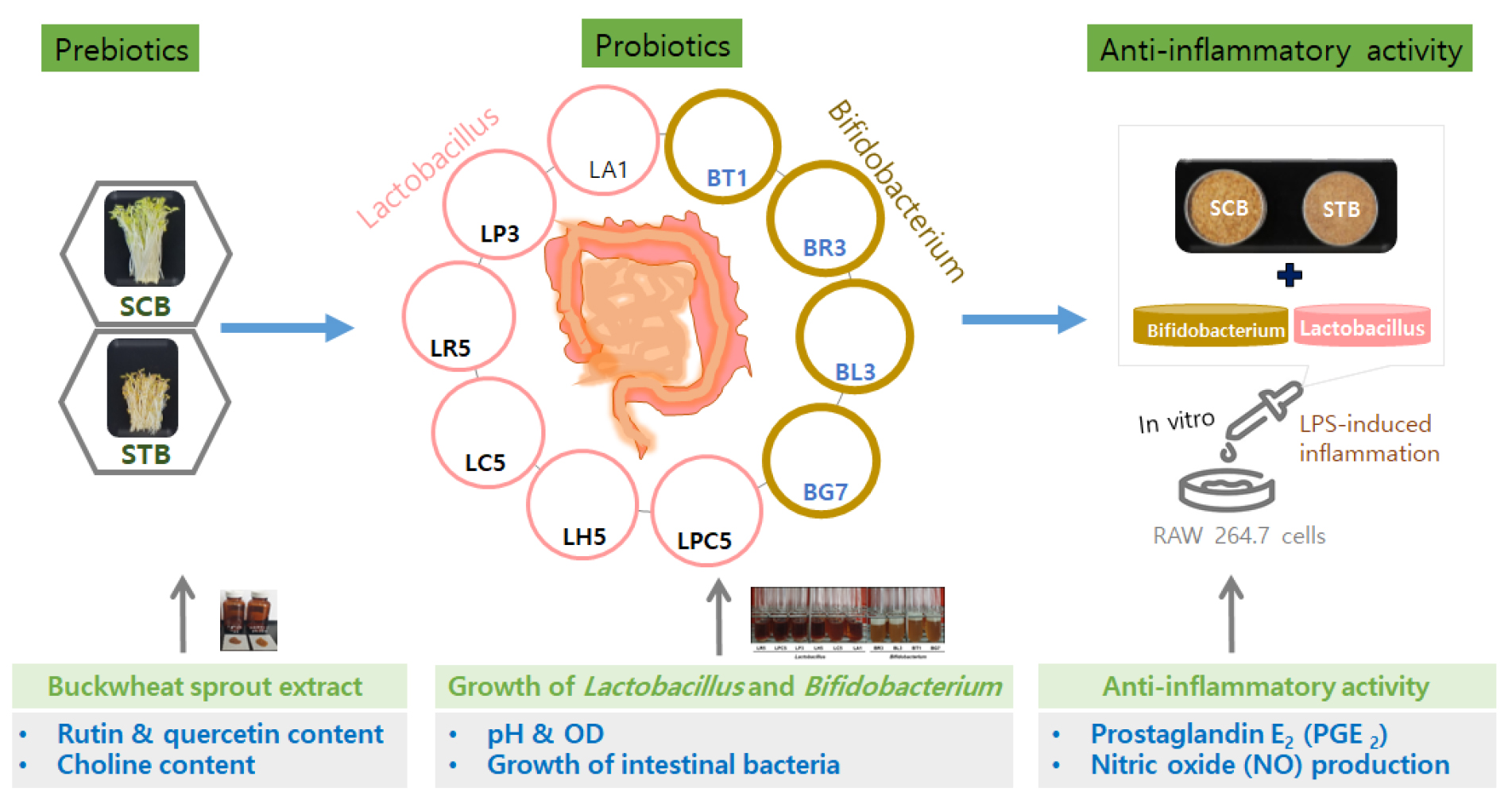
Fig. 1.
Scheme for probiotic with buckwheat sprout on intestinal bacteria and their anti-inflammatory effects. Raw 264.7 cells were divided into 3 groups: CON, SCB and STB. CON, control medium without glucose group; SCB, Medium with sprout of common buckwheat (Fagopyrum esculentum Moench) with alcohol extract group; STB, Medium with sprout of tartary buckwheat (Fagopyrum tataricum Gaertn.) with alcohol extract group.
프로바이오틱스 배양
프로바이오틱스 배양에는 ㈜ 쎌바이오텍이 한국인의 분변 및 발효 식품으로부터 분리하여 한국생명공학연구원 생물자원센터(KCTC, Jeongeup, Korea)에 등록한 10종의 균주를 사용하였다(Table 1). Bifidobacterium 속인 Bifidobacterium longum ssp. infantis BT1 (KCTC No. 11859BP), B. longum BG7 (KCTC No. 12200BP), B. animal subsp. lactis BL3 (KCTC No. 11904BP) 및 B. breve BR3 (KCTC No. 12201BP) 등 4종은 Glucose Blood Liver (BL) 배지(KisanBio, Seoul, Korea)에서 37℃조건으로 48시간 동안 혐기 배양하였고, Lactobacillus 속인 Lactobacillus acidophilus LA1 (KCTC No. 11906BP), Lacticaseibacillus casei LC5 (KCTC No. 12398BP), Lactobacillus helveticus LH5 (KCTC No. 12670BP), Lactiplantibacillus plantarum LP3 (KCTC No. 10782BP), Lacticaseibacillus paracasei LPC5 (KCTC No. 12451BP) 및 Lacticaseibacillus rhamnosus LR5 (KCTC No. 12202BP) 등 6종은 De Man, Rogosa and Sharpe (MRS) 배지(BD Difco, Detroit, MI, USA)에서 37℃조건으로 24시간 동안 배양하였다(Table 2). 메밀 새싹추출물을 제외한 각종 영양 성분은 균주에만 접종하였으며, glucose가 없는 배양액은 비교 기준이 되는 대조군 처리로 하고 메밀 배지는 glucose를 넣지 않은 MRS 배지와 BL 배지(KisanBio, Korea)에 각각 일반메밀 새싹추출물(일반메밀군) 또는 쓴메밀 새싹추출물(쓴메밀군)을 3 g/L가 되도록 첨가하여 제조하였다. 각각의 배지에 프로바이오틱스의 배양액을 접종하여 37℃에서 48시간 배양하였다.
Table 1.
Probiotics species used in this study and their origin
| Abbreviation | Probiotics species | KCTC No.z | Origin |
|
BT1 BG7 BL3 BR3 LA1 LC5 LH5 LP3 LPC5 LR5 | Bifidobacterium longum ssp. infantis BT1 Bifidobacterium longum BG7 Bifidobacterium animal subsp. lactis BL3 Bifidobacterium breve BR3 Lactobacillus acidophilus LA1 Lacticaseibacillus casei LC5 Lactobacillus helveticus LH5 Lactiplantibacillus plantarum LP3 Lacticaseibacillus paracasei LPC5 Lacticaseibacillus rhamnosus LR5 |
11859BP 12200BP 11904BP 12201BP 11906BP 12398BP 12670BP 10782BP 12451BP 12202BP |
Korean infant feces Korean infant feces Korean infant feces Korean infant feces Korean infant feces Korean infant feces Korean infant feces Korean fermented vegetable product, kimchi Korean fermented food, Jeotgal Korean infant feces |
Table 2.
The composition of different MRS and BL medium for the probiotics cultivation
| Components | Experiment treatmentz | Control | ||||
| SCB | STB | CON | ||||
| MRS | BL | MRS | BL | MRS | BL | |
|
Sample Beef extract Liver extract Proteose peptone Yeast extract Dipotassium Phosphate Monopotassium Phosphate Soluble starch Tryptone Soy Peptone Glucose Sodium Chloride Sodium Acetate L-cysteine HCl H2O Ferrous Sulfate Tween 80 Ammonium citrate Magnesium Sulfate Manganese Sulfate D.W. |
3.0 g 10.0 g - 10.0 g 5.0 g 2.0 g - - - - - - 5.0 g - - 1.0 g 2.0 g 1.0 g 0.1 g 1,000 mL |
3.0 g 3.0 g 5.0 g 10.0 g 5.0 g 1.0 g 1.0 g 0.5 g 5.0 g 3.0 g - 0.01 g - 0.5 g 0.01 g 1.0 g - 0.2 g 0.0067 g 1,000 mL |
3.0 g 10.0 g - 10.0 g 5.0 g 2.0 g - - - - - - 5.0 g - - 1.0 g 2.0 g 1.0 g 0.1 g 1,000 mL |
3.0 g 3.0 g 5.0 g 10.0 g 5.0 g 1.0 g 1.0 g 0.5 g 5.0 g 3.0 g - 0.01 g - 0.5 g 0.01 g 1.0 g - 0.2 g 0.0067 g 1,000 mL |
- 10.0 g - 10.0 g 5.0 g 2.0 g - - - - - - 5.0 g - - 1.0 g 2.0 g 1.0 g 0.1 g 1,000 mL |
- 3.0 g 5.0 g 10.0 g 5.0 g 1.0 g 1.0 g 0.5 g 5.0 g 3.0 g - 0.01 g - 0.5 g 0.01 g 1.0 g - 0.2 g 0.0067 g 1,000 mL |
zRaw 264.7 cells were divided into 3 groups: CON, SCB and STB. CON, Control medium without buckwheat group; SCB, Medium with sprout of common buckwheat (Fagopyrum esculentum Moench) with alcohol extract group; STB, Medium with sprout of tartary buckwheat (Fagopyrum tataricum Gaertn.) with alcohol extract group.
프로바이오틱스 생균수 측정
일반메밀의 새싹 또는 쓴메밀의 새싹 추출물이 첨가된 BL 배지에 10종의 프로바이오틱스 균주를 2%씩 접종하여 37℃에서 48시간 동안 혐기배양 하였으며, 총 4회(0, 6, 24, 48시간)에 걸쳐 산도(pH), OD (optical density, 600 ㎚), 콜로니 형성 단위(colony forming unit)를 측정하여 생균수를 조사하였다.
세포배양
Raw 264.7 세포주는 한국세포주은행(KCLB, Seoul, Korea)에서 분양 받았으며, 배양용기에 Dulbecco’s modified Eagle’s minimum essential medium (DMEM, Life Technologies Inc., Brand Island, NY, USA), 10% fetal bovine serum (FBS, HycloneTM, GE healthcare life sciences, Chicago, IL, USA), 100 U/mL 페니실린(penicillin, HycloneTM, GE healthcare life sciences) 및 100 μg/mL 스트렙토마이신(streptomycine, HycloneTM, GE healthcare life sciences)을 첨가하고, RPMI 1640 배지에서 배양하였다. 세포 배양은 온도 37℃, CO2 5% 조건에서 수행하였다.
세포독성 측정
시료의 세포독성을 Cell counting Kit-8 (CCK-8, DOJINDO Laboratories)을 이용하여 측정하였다. 세포를 96 well plate에 5 × 104 cell/mL로 분주하여 24시간 배양하고 CCK-8을 첨가하여 37℃, CO2 5%에서 2시간 반응시킨 후 microplate reader를 이용하여 450 ㎚에서 흡광도를 측정하였다.
NO 생성량 측정
NO 생성량은 NO Plus Detection Kit (Nitric Oxide iNtRON Biotechnology, Seongnam, Gyeonggi, Korea)로 추출하여 상등액 100 μL에 50 μL의 N1 버퍼를 첨가하여 10분간 상온에서 반응시키고 N2 버퍼를 50 μL 추가하여 10분간 반응시킨 후 microplate reader를 이용하여 540 ㎚에서 측정하였다.
Prostaglandin E2 (PGE2) 생성량 측정
Lipopolysaccharide (LPS) 자극에 의하여 Raw 264.7 세포로부터 생성되는 PGE2 분비량을 측정하기 위해 세포를 96 well plate에 1×104 cells/mL로 분주한 후, 24시간 뒤 시료를 ELISA에 농도별로 처리하였다. 1시간 후 LPS를 1 μg/mL로 처리하고 24시간 동안 배양한 후 PGE2 parameter assay kit (R&D systems)를 사용하여 450 ㎚에서 PGE2 분비량을 측정하였다.
생리활성 물질(루틴, 퀘세틴 및 콜린) 분석
생리활성 물질의 분석을 위해 메밀 종실과 새싹 시료를 -70℃의 초저온냉동고(deep freezer, Ilsin BioBase Co. Ltd., Yangju, Korea)에 24시간 보관한 후 동결건조기(freeze dryer, Iksan BioBase Co., Ltd., Dongducheon, Korea)에서 96시간 건조시켰다. 시료의 루틴과 퀘세틴 분석은 Kim et al. (2017)의 방법에 따라 UV 검출기가 장착된 UPLC (Ultra Performance Liquid Chromatograph, Acquity UPLC I-Class, Waters Corporation, Milford, MA, USA) 기기에 분석 칼럼(Acquity UPLC CSH C18, 2.1 x 100 mm, 1.7 μm particle size, Waters Corporation, Milford, MA, USA)을 장착하여 온도 30℃, 시료 주입량 1 μL조건에서 수행하였다. 이동 용매는1% formic acid가 함유된 증류수와0.1% formic acid가 함유된 acetonitrile의 조성비를 7% (0~2 min), 7~17% (2~11 min), 17~25% (11~13 min), 25% (13~19 min), 25~7% (19~21 min), 7% (21~23 min)로 하였으며, 이동상의 유속은 0.25 mL/min, UV 검출 장치의 파장(detection wavelength)은 259 ㎚로 하여 분석하였다. 검출된 생리활성 물질의 정량분석을 위해 루틴(rutin, Extrasynthese, Genay, France) 표준물질을 50, 100, 200, 500 μg/mL의 농도별 면적에 대해 검량곡선을 작성하여 검량선 대비 농도를 산출하였다.
메밀의 콜린 함량은 Phillips (2012) 및 Bruce et al. (2010)의 방법에 따라 MS/MS (Triple quad 4500, AB SCIEX, Framingham, MA, USA)를 장착한 LC (Liquid Chromatograph, 1260 Infinity II LC, Agilent, Santa Clara, CA, USA) 기기에 분석 칼럼(InfinityLab poroshell 120 hilic column, 2.1×150 ㎜, 2.7 micron, Agilent, Santa Clara, CA, USA)을 장착하여30℃ 온도로 설정하여 분석하였다. 장내 이동 용매는0.2% formic acid가 함유된 10 mM ammonium formate와100% acetonitrile의 조성비를 10~90% (0~8 min), 90~10% (8.1~13 min) 농도로 하여 이동상의 유속을 0.4 mL/min로 하여 분석하였다. 표준물질로 순도 99%의 콜린 클로라이드(choline chloride, Sigma-Aldrich Co. St. Louis, MO, USA)와 콜린 클로라이드-D9 (choline chloride trimethyl-D9, Sigma-Aldrich Co. St. Louis, MO, USA)을 사용하여 검량선을 작성한 다음 콜린 함량을 산출하였다.
통계처리
실험 데이터는 SAS software (version 9.4, SAS Institute Inc., Cary, NC, USA)를 이용하여 분산분석(one way analysis of variance)으로 통계처리하였으며, 다중범위 검정법(Duncan’s multiple range test)으로 유의성을 검증하였다.
결과 및 고찰
메밀 첨가 배양액의 산도, OD 및 생균수 평가
메밀 새싹 추출물을 10종의 프로바이오틱스와 함께 각각 배양하고 시간 경과(0, 6, 24, 48 시간)에 따른 pH, OD 및 생균수 변화를 측정하는 방법으로 메밀 새싹 추출물의 프리바이오틱스 효능을 평가하였다(Fig. 2, 3, 4).
메밀 새싹 추출물을 비피더스 4종(BT1, BG7, BL3, BR3)에 첨가하여 배양한 실험군의 pH 값이 대조군보다 낮았으나 락토바실러스 6종(LA1, LC5, LH5, LP3, LPC5, LR5) 실험군은 대조군과 비슷한 수치를 보였다(Fig. 2). 전반적으로 배양시간이 경과함에 따라 실험군의 pH값이 낮아지는 경향을 보였다.
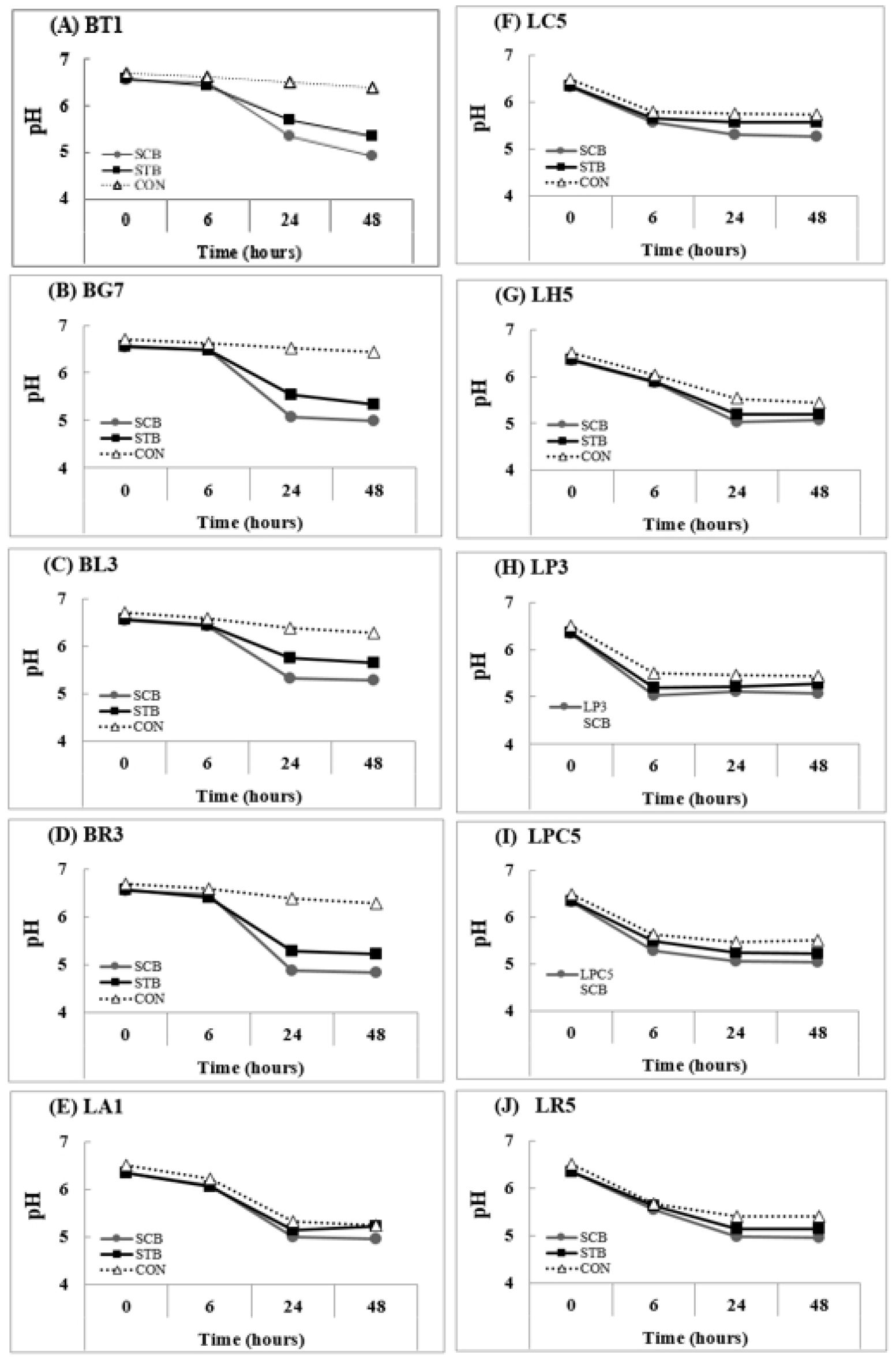
Fig. 2.
pH change of 10 probiotics without/with buckwheat sprout extract by incubation time. SCB, Sprout extract of common buckwheat; STB, Sprout extract of tartary buckwheat; CON, Control without glucose medium. (A), Bifidobacterium longum ssp. infantis BT1; (B), Bifidobacterium longum BG7; (C), Bifidobacterium animal subsp. lactis BL3; (D), Bifidobacterium breve BR3; (E), Lactobacillus acidophilus LA1; (F), Lacticaseibacillus casei LC5; (G), Lactobacillus helveticus LH5; (H), Lactiplantibacillus plantarum LP3; (I), Lacticaseibacillus paracasei LPC5; (J), Lacticaseibacillus rhamnosus LR5.
메밀 새싹 추출물을 비피더스에 첨가해 배양한 실험군의 OD값이 락토바실러스 보다 높았다(Fig. 3). 전반적으로 배양시간이 경과함에 따라 실험군의 OD 값이 높아지는 경향이었다. 특히, 일반메밀 새싹 추출물을 첨가한 BT1, BG7 및 BR3실험군에서 OD 값이 높았으며, 이 중 BG7에서 가장 높았다.

Fig. 3.
OD change of 10 probiotics without/with buckwheat sprout extract by incubation time. SCB, Sprout extract of common buckwheat; STB, Sprout extract of tartary buckwheat; CON, Control without glucose medium. (A), Bifidobacterium longum ssp. infantis BT1; (B), Bifidobacterium longum BG7; (C), Bifidobacterium animal subsp. lactis BL3; (D), Bifidobacterium breve BR3; (E), Lactobacillus acidophilus LA1; (F), Lacticaseibacillus casei LC5; (G), Lactobacillus helveticus LH5; (H), Lactiplantibacillus plantarum LP3; (I), Lacticaseibacillus paracasei LPC5; (J), Lacticaseibacillus rhamnosus LR5.
메밀 새싹 추출물을 10종의 프로바이오틱스에 첨가하여 각각 배양하였을 때, 비피더스균의 생균수는 배양 24시간 이후부터 증가하여 48시간에 확연히 증가하였으나 락토바실러스균의 경우 거의 변화가 없다가 48시간 이후 약간 증가하였다(Fig. 4).메밀 새싹 추출물을 비피더스균에 첨가하여 배양한 경우 생균수 증식에 우수한 효능을 보였는데, 특히 BR3와 BL3는 짧은 시간 내 급속히 증식하였다. 좀 더 살펴보면 대조군의 생균수는 5.30×108 CFU/mL로 증식 효과가 크지 않았지만 쓴메밀 새싹 추출물을 BT1에 첨가하여 배양한 실험군의 생균수는 8.61×108 CFU/mL로 높아 증식 효과가 가장 우수하였다.
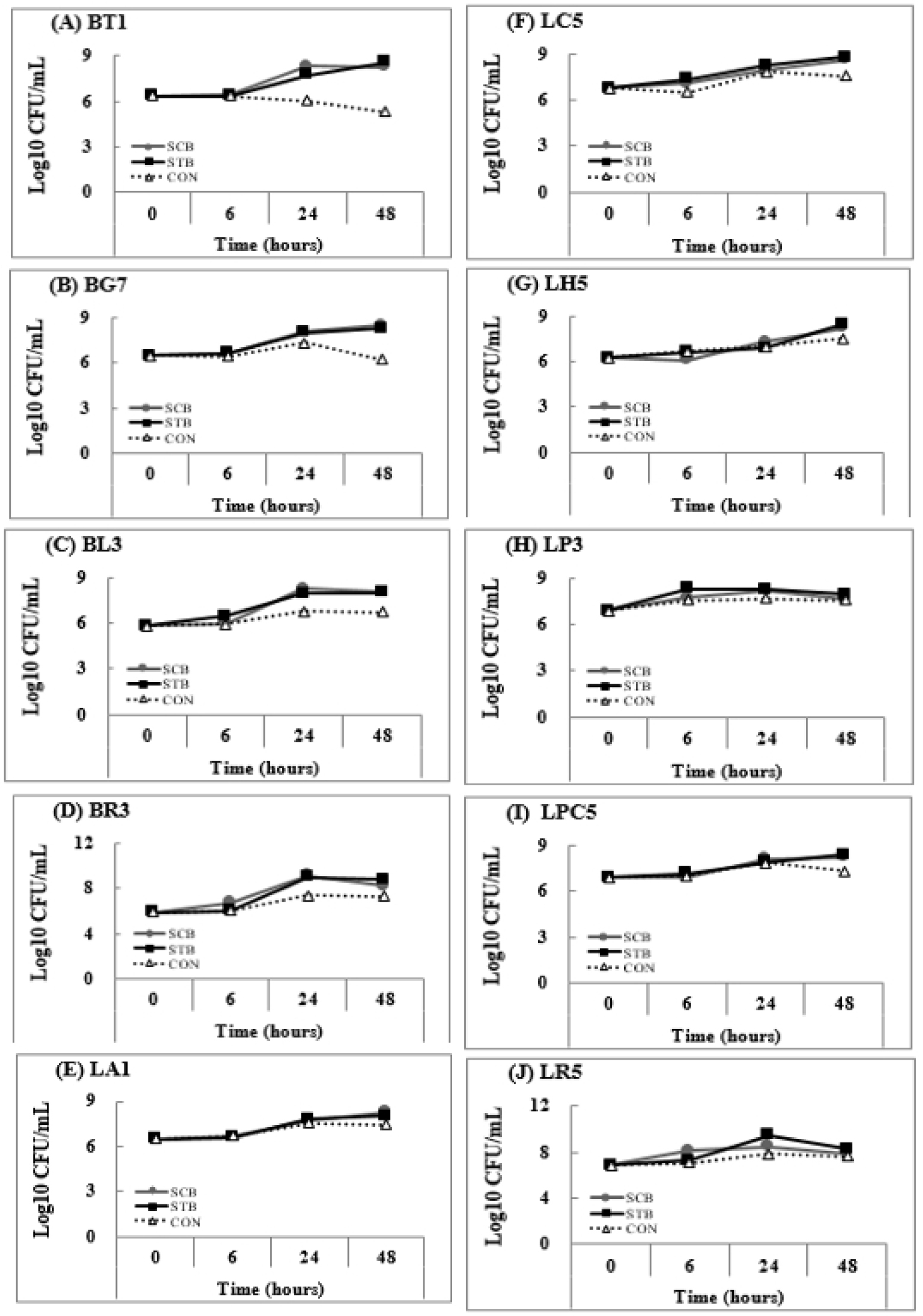
Fig. 4.
Change of viable cell count of 10 probiotics without/with buckwheat sprout extract by incubation time. SCB, Sprout extract of common buckwheat; STB, Sprout extract of tartary buckwheat; CON, Control without glucose medium. (A), Bifidobacterium longum ssp. infantis BT1; (B), Bifidobacterium longum BG7; (C), Bifidobacterium animal subsp. lactis BL3; (D), Bifidobacterium breve BR3; (E), Lactobacillus acidophilus LA1; (F), Lacticaseibacillus casei LC5; (G), Lactobacillus helveticus LH5; (H), Lactiplantibacillus plantarum LP3; (I), Lacticaseibacillus paracasei LPC5; (J), Lacticaseibacillus rhamnosus LR5.
Niu et al. (2020)은 생리활성 성분이 유산균 증식에 도움을 줄 수 있다고 하였다. 또한, Nuryana et al. (2019)은 유산균이 주요 발효 산물로 젖산, 아세트산, 구연산 등과 같은 유기산을 생성하여 장내 환경을 산성화시킴으로써 장내 건강이 유지된다고 하였다. 본 연구에서도, 메밀 새싹 추출물을 비피더스 배양액에 첨가하였을 때 대조군보다 pH 값이 낮아지고 OD 값은 높아지며, 생균수는 증가하여 유산균의 생육 및 유기산 생성에 긍정적 영향을 주는 것으로 판단된다. 이는 장내 건강을 유지하는데 쓴메밀 추출물이 프리바이오틱스 소재로서 산업화 가능성이 있을 것으로 판단된다.
메밀 첨가 배양액의 NO 생성 및 PEG2 억제 효과
LPS 자극을 통한 대식세포 활성은 다양한 염증 매개 물질을 유도하여 염증반응 실험에 주로 사용되고 있다(Yun et al., 2008). 본 연구에서도 메밀 새싹 추출물의 항염증 효과를 알아보기 위해 대식세포를 내독소 작용물질인 LPS로 자극하여 생성되는 Nitric oxide (NO)와 Prostaglandin E2 (PGE2)에 대한 억제 효과를 비교하였다. 먼저 메밀 새싹 추출물을 비피더스와 락토바실러스에 배양하여 Raw 264.7 cell에서 세포독성을 평가하였다. 배양액 중 일반배지와 LR5, BG7 배양액 일부를 대표 시료(pH보정, pH미보정)로 사용하여 0~100% v/v 농도로 세포독성을 확인한 결과, pH 보정 여부와 관계없이 5% v/v 농도 처리에서 90% 이상의 세포생존율을 보였다. 이후 모든 배양액을 5% v/v 농도로 Raw 264.7 cell에 처리하여 세포생존율을 확인하였을 때 모두 90% 이상의 세포 생존율을 보여 세포독성은 없는 것으로 확인되었다. 이러한 결과를 바탕으로 항염증 실험인 NO와 PGE2 평가는 5% v/v 농도로 처리하여 수행하였다(data not shown).
사전 실험으로 메밀 새싹 추출물을 비피더스균(BL3)과 락토바실러스균(LPC5)에 배양하여 NO와 PGE2의 저해 효과를 평가하였다(Fig. 5). 메밀 새싹 추출물이 첨가된 BL3와 LPC5 균주를 6, 24, 48시간 동안 배양 시간에 따라 비교한 결과, 균주의 배양액은 24시간 후NO 생성량이 양성 대조군(LPS)보다 감소하여 함염증 효과가 확인되었다. 이러한 결과를 바탕으로 프로바이오틱스 10종에 대한 NO생성량과 PGE2 억제효과는 배양 24시간 후에 측정한 결과를 기준으로 분석하였다.

Fig. 5.
Nitric oxide production in the culture broth of Bifidobacterium animal subsp. lactis BL3 (A) and Lacticaseibacillus paracasei LPC5 (B) probiotics with buckwheat sprout extract by Raw 264.7 cells at 6, 24 and 48 hours. DMEM media was used for negative control (NC). LPS (100 ng/mL) was used for positive control (LPS). Data shown represent the mean ± SD based on three independent experiments. ***Represents a statistically significant difference of p < 0.001 compared with the negative control (NC).
선행 실험에서 결과를 바탕으로, 메밀 새싹 추출물을 10종의 프로바이오틱스에 첨가하여 24시간 배양한 후 Raw 264.7 세포내에서의 NO 생성량을 조사하였다(Fig. 6). LPS를 처리한 Raw 264.7 cell에서 유발된 NO 생성량에 대한 메밀 새싹 추출물의 처리 효과를 살펴보면 정상군은 8.8 μM인 반면 LPS로 산화적 스트레스를 유발시킨 대조군은 37.2 μM로 NO가 증가하였고, 일반메밀군과 쓴메밀군에서 NO 생성이 각각 29.5∼33.2와 31.7∼32.8 mM로 모든 군에서 유의적으로 감소시켰다. 이로 보아 메밀 새싹 추출물 및 활성물질인 루틴이 NO 소거에 우수한 효과를 나타내어 산화적 스트레스 개선효과가 있음을 확인할 수 있었다. 특히, 비피더스균 중 BT1에서 NO 생성량이 각각 29.5 mM로 가장 낮았으며, 락토바실러스균 중에서는 LPC5가 30.6 mM로 낮아 항염증 효과가 우수하였다.
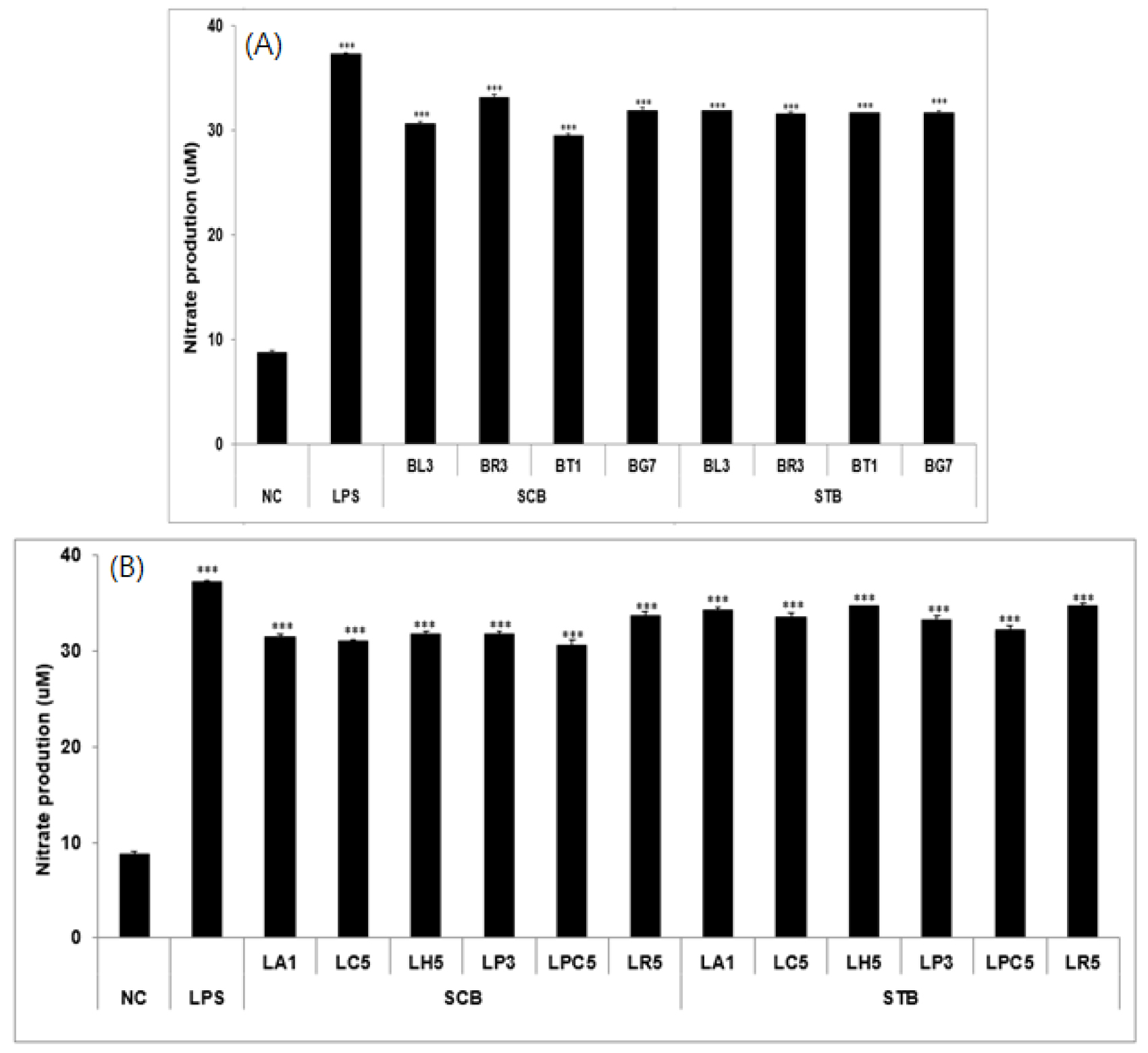
Fig. 6.
Nitric oxide production in the culture broth of four Bifidobacterium (A) and six Lactobacillus (B) probiotics with buckwheat sprout extract by Raw 264.7 cells at 24 hours. DMEM media was used for negative control (NC). LPS (100 ng/mL) was used for positive control (LPS). Data shown represent the mean ± SD based on three independent experiments. ***Represents a statistically significant difference of p < 0.001 compared with the negative control (NC). BT1, Bifidobacterium longum ssp. infantis; BG7, Bifidobacterium longum; BL3, Bifidobacterium animal subsp. lactis; BR3, Bifidobacterium breve; LA1, Lactobacillus acidophilus; LC5, Lacticaseibacillus casei; LH5, Lactobacillus helveticus; LP3, Lactiplantibacillus plantarum; LPC5, Lacticaseibacillus paracasei; LR5, Lacticaseibacillus rhamnosus.
메밀 새싹 추출물을 비피더스와 락토바실러스에 첨가하여 배양한 실험군의 PGE2 생성 억제 효과를 분석한 결과는 Fig. 7에 나타냈다. 음성대조군의 PGE2 농도는 422 pg으로 측정되었으나 LPS를 1.0 mg/mL 농도로 처리한 양성대조군의 PGE2 농도는 4,076 pg으로 크게 증가하였다. 그러나 일반메밀과 쓴메밀의 새싹 추출물을 3.0 ㎎/mL으로 처리한 실험군의 PGE2 농도는 각각 3,904∼4,025와 3,920∼4,013 pg/mL 범위로 억제되어 유의한 차이를 나타내었다. 특히, 쓴메밀 새싹 추출물을 BT1 균주에 첨가하여 배양하였을 때 PGE2 농도가 3,920 pg/mL로 저해 효과가 가장 좋았으며, 일반메밀 새싹 추출물은 LH5와 LA1 균주에 첨가하여 배양하였을 때 PGE2 농도가 각각 3,904및 3,905 pg/mL 로 가장 낮았다.
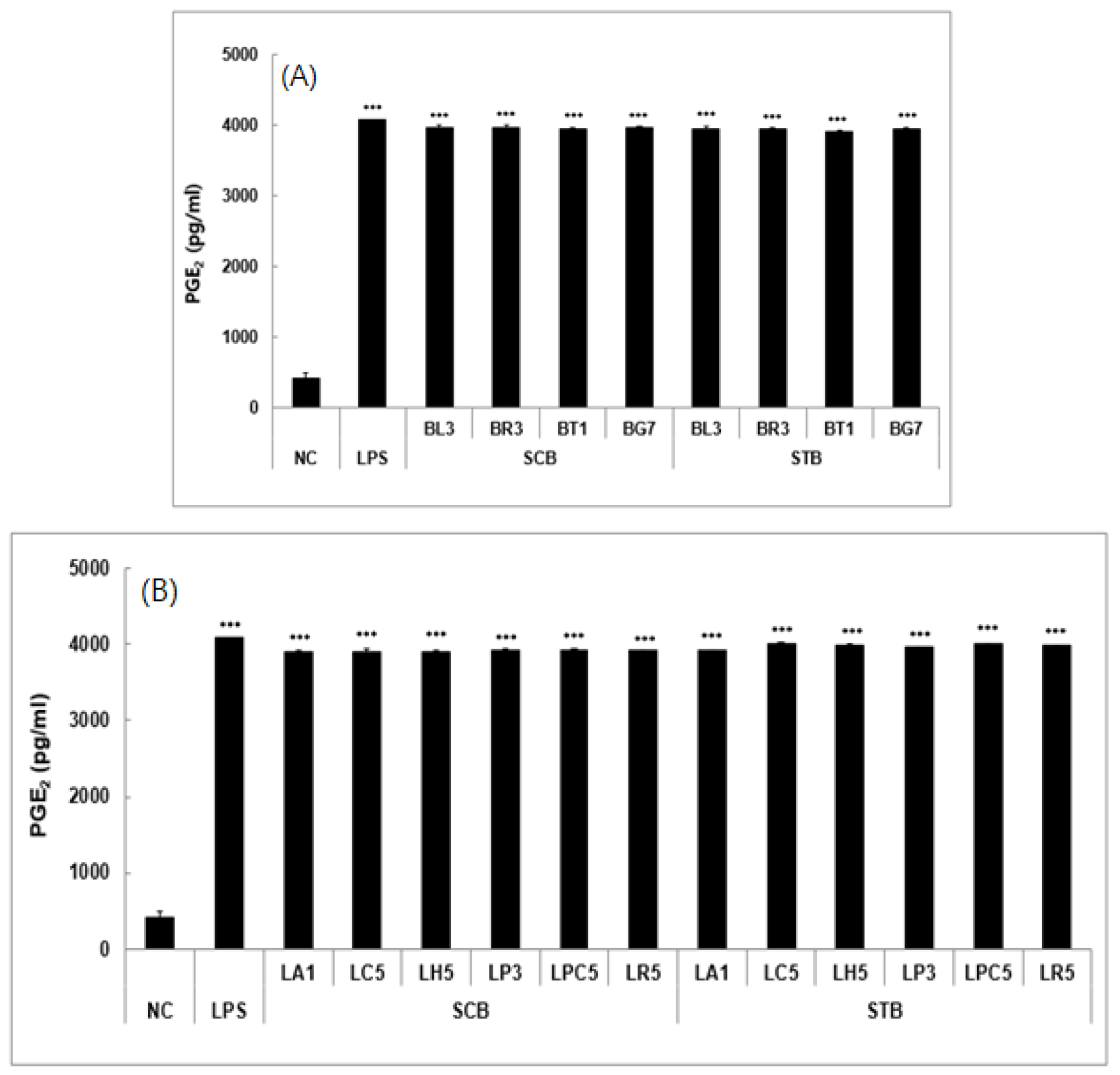
Fig. 7.
PGE2 production in the culture broth of four Bifidobacterium (A) and six Lactobacillus (B) probiotics with buckwheat sprout extract by Raw 264.7 cells at 24 hours. DMEM media was used for negative control (NC). LPS (100 ng/mL) was used for positive control (LPS). Data shown represent the mean ±SD based on three independent experiments. ***Represents a statistically significant difference of p < 0.001 compared with the negative control (NC). BT1, Bifidobacterium longum ssp. infantis; BG7, Bifidobacterium longum; BL3, Bifidobacterium animal subsp. lactis; BR3, Bifidobacterium breve; LA1, Lactobacillus acidophilus; LC5, Lacticaseibacillus casei; LH5, Lactobacillus helveticus; LP3, Lactiplantibacillus plantarum; LPC5, Lacticaseibacillus paracasei; LR5, Lacticaseibacillus rhamnosus.
이전 연구 결과를 보면 메밀 종실 추출물이 NO 생성에 관여하는 iNOS 단백질의 발현 저해(Kim et al., 2019) 및 볶음메밀 추출물이 NO 생성 억제(Kwon et al., 2023)에 관한 선행 연구결과와 맥락을 같이 한다. 특히 루틴은 IL-6의 분비를 억제하고 핵에서 NO에 의해 유도되는 염증 반응 중 첫 번째 과정인 염증유전자 NF-κB의 down-regulation에 기여하여 염증성 단백질인 COX-2와 iNOS의 down-regulation까지 영향을 미치고 이로 인한 항염증 효과를 나타내는 것을 알 수 있었다(Choi, 2013).
메밀 종실을 이용한 기존 연구에서도 메밀에는 생리활성 물질인 루틴이 다량 함유되어 대식 세포에서 LPS로 유도된 염증성 사이토카인(IL-1β, IL-6, TNF-α)의 mRNA 발현을 억제하고, PGE2로 유도되는 세포 손상도 억제한다고 하였다(Kim et al., 2019). 이러한 연구결과는 본 실험에서 NO와 PGE2의 유의적인 감소를 확인한 결과와 일치하는 것으로 메밀 새싹 추출물도 염증을 완화시킬 수 있는 활성성분으로서 잠재적 가능성이 있음을 보여주고 있다.
메밀 종실과 새싹의 생리활성 물질 함량
메밀 종실과 새싹의 생리활성 물질인 루틴, 퀘세틴 및 콜린 함량을 분석한 결과는 다음과 같다(Table 3). 쓴메밀 새싹의 루틴 함량은 4,758 ㎎/100 g으로 종실 함량보다 3배 이상 많았다. 일반메밀 새싹의 루틴 함량은1,483 ㎎/100 g으로 종실의 루틴 함량보다 50배 높았으며, 쓴메밀 종실의 루틴 함량과 비슷하였다. 쓴메밀 새싹의 퀘세틴 함량은 39.9 ㎎/100 g으로 일반메밀 새싹보다 2.9배 높았으나 콜린 함량에서는 일반메밀 새싹(11.8 ㎎/100 g)이 쓴메밀 새싹보다 1.3배 높았다.
Table 3.
Rutin, quercetin and choline contents in fresh seed and vinegar extract from common buckwheat and tartary buckwheat
| Materialz |
Rutin (㎎/100g) |
Quercetin (㎎/100g) |
Choline (㎎/100g) |
|
FCB FTB SCB STB |
29±1.0y*** 1,579±2.2 1,483±1.3 4,758±5.4 |
12±0.3*** 18±0.6 14±0.4 40±0.7 |
4±0.0*** 3±0.0 12±0.1 9±0.1 |
메밀은 루틴, 퀘세틴, 유기산 및 다당류 등으로 구성되어 있다. 루틴은 염증성 질환 개선, 항균 활성 및 항당뇨 효과 등 다양한 생리활성 기능이 있는 것으로 보고되었다(Kim et al., 2022b). 또한, 루틴은 산화적 스트레스 개선을 통한 신경세포 보호효과를 나타내고 인지능력 향상 효과가 있으며, 염증에 관련된 NF-κB, COX-2와 iNOS의 mRNA 발현을 조절하는 것으로 보고된 바 있다(Choi, 2013). 또한, 퀘세틴은 대표적인 항산화 물질로서의 역할을 수행함으로써 산화 스트레스를 막는 것으로 알려져 있다(Kim and Kim, 2018).
메밀에 들어 있는 콜린은 간 기능 개선, 두뇌 발달, 신경 기능 및 건강한 신진대사 유지, 해독효과가 알려져 있으며, 피로를 방지하는데 유용할 수 있다(Wang et al., 2020; Zeisel and Blusztajn, 1994). 따라서, 메밀 새싹 추출물의 비피더스균(BT1와 BG7) 생육에 도움을 주는 프리바이오틱스 효과와 NO 생성량 억제 등의 항염증 효과는 루틴 등 여러가지 생리활성 물질에서 기인한 것으로 판단된다.
이상의 결과를 종합하면 메밀 새싹 추출물이 특정 배양액에서 염증 관련 지표인 NO 생성 및 PGE2 생성량 억제에 효과가 있음을 나타내는 것으로 메밀이 장내 유익균 증식과 염증 조절에 긍정적인 영향을 줄 수 있을 것으로 판단된다.
적 요
본 연구에서는 메밀 새싹 추출물의 비피더스균과 락토바실러스균 증식에 미치는 영향, 항염증 효과 및 관련 생리활성 물질의 분석을 통해 프리바이오틱스 소재로서의 활용 가능성을 평가하였다. 메밀 새싹 추출물을 10종의 프로바이오틱스에 첨가하여 각각 배양하였을 때, 대조군보다 pH 값이 낮아지고, 생균수는 증가하였다. 쓴메밀 새싹 추출물을 Bifidobacterium longum ssp. infantis BT1에 첨가하여 배양한 실험군의 생균수는 8.61×108 CFU/mL로 증식 효과가 가장 뛰어났다. 메밀 새싹 추출물을 10종의 프로바이오틱스에 첨가한 다음 LPS로 유도하였을 때, 세포독성에 대한 보호 효과와 NO, PGE2 발현에서도 유의적인 억제 효과를 보여 우수하였다. 특히, 비피더스균 중 BT1에서 NO 생성량이 29.5 mM로 가장 낮았으며, 락토바실러스균 중에서는 Lacticaseibacillus paracasei LPC5에서 30.6 mM로 NO 생성량이 매우 낮아 항염증 효과가 있었다. 이상의 결과는 루틴, 퀘세틴 및 콜린 등 다양한 생리활성 물질을 가진 메밀 새싹 추출물이 특정 배양액에서 염증 관련 지표인 NO 생성 및 PGE2 생성량 억제에 효과가 있음을 나타내는 것으로 메밀이 장내 유익균 증식과 염증 조절에 긍정적인 영향을 줄 수 있을 것으로 판단된다.




