서 언
재료 및 방법
실험재료
추출물 제조
세포 배양
Oil red O staining
SDS-PAGE and Western blot analysis
통계분석
결과 및 고찰
솔잎 추출물이 3T3-L1 세포의 지질 형성 억제
솔잎 추출물이 3T3-L1 세포의 지질 형성 관련 단백질 억제
솔잎 추출물(PDL)은 초기 및 후기 지방생성 억제
적 요
서 언
지방조직은 전신 에너지 항상성을 유지하는 데 필수적이며 중성지방을 저장하고 있는 지방세포로 구성되어 있지만, 에너지 섭취와 방출의 불균형에 의해 지방조직 내 지방이 과도하게 축적될 경우 비만을 유발하게 된다(Chang et al., 2017). 비만은 관절질환, 당뇨, 고혈압 등 각종 성인병을 유발하는 위험인자로 잘 알려져 있으며(Park and Kim, 2006; Yu et al., 2021), 비만이 있는 환자들은 비만이 없는 환자들보다 당뇨병 합병증을 가질 가능성이 더 높다(Yu et al., 2021). 현재 다양한 비만치료제들이 시판되고 있으나 이러한 약물들은 여러 부작용을 동반하고 있어 천연물로부터 비만에 효과적인 기능성 소재들을 찾아내는 연구들이 활발하게 진행되고 있다(Ji et al., 2012). 소나무는 전국 산지에 자생하는 소나무과(Pinaceae)에 속하는 상록 교목으로 예로부터 잎, 솔방울, 꽃가루, 송진, 껍질 등 모든 부위가 구황식물로 사용되었다. 이 중 솔잎은 방부, 살균 및 향기를 돋우는 효과로 잘 알려져 있지만(Lee and Oh, 2008), 이외에 동맥경화증, 고혈압, 당뇨병, 신경통과 같은 노인성 및 성인병과 같은 질환의 예방과 치료 목적으로 다양한 형태의 제재로 활용되고 있다(Choi, 2009). 솔잎 추출물의 성분 중 폴리페놀계 항산화제는 당뇨병 및 지방간 질환과 같은 질병에 효과적인 것으로 알려져 있다. 솔잎의 다른 성분인 테르페노이드는 혈중 콜레스테롤과 포도당 수치를 하향 조절한다(Kim et al., 2021). 이러한 기존 연구를 미루어 볼 때, 솔잎은 항비만 효능이 있을 것으로 사료 되어 지방전구세포를 이용하여 솔잎의 항비만 활성을 검증하였다.
재료 및 방법
실험재료
마우스 지방전구세포인 3T3-L1 세포의 배양을 위한 배지 DMEM/F-12는 Lonza (Morristown, NJ, USA)에서 구매하였다. Dexamethasone, 3-Isobutyl-1-methylxanthine (IBMX), Insulin, Oil Red O staining solution은 Sigma-Aldrich (St. Louis, MO, USA)에서 구입하였다. 그리고 Western blot 분석을 위한 antibody인 anti-CEBPα (#2295), anti-PPARγ (#2435), 그리고 anti-perilipin-1 (#9349), β-actin (#5125) 그리고 anti-rabbit IgG, HRP-linked antibody (#7074)들은 Cell Signaling Technology (Danvers, MA, USA)에서 구입하였다.
추출물 제조
본 연구의 시료인 소나무잎(Pinus densiflora leaf)은 농업회사법인 PINOGEN (Andong, Korea)에서 제공 받았다. 문경시 회룡길의 적송 15년생 내외의 소나무 가지에서 솔잎만을 분리한 후 열풍건조 하여 분쇄한 솔잎 40 g을 2 L의 증류수에 넣고 100℃에서 5시간 동안 약탕기(DW-890, Daewoongbio, Korea)로 추출하였다. 추출 후 ADVANTEC filter paper (185 ㎜)로 2회 여과한 후 동결건조하여 보관하였고, 50 ㎎/mL로 녹여 실험에 사용하였다. 동결건조 된 솔잎 추출물(PDL)은 –80℃의 냉동고에 보관하면서 연구를 위한 시료로 사용되었다.
세포 배양
본 연구에서 사용된 마우스 지방전구세포인 3T3-L1 세포는 American Type Culture Collection (Manassas, VA, USA)에서 구입하였다. 3T3-L1 세포는 10% bovine calf serum, 100 U/mL penicillin, 100 ㎍/mL streptomycin이 포함된 DMEM/F-12 배지로 CO2 incubator (37℃, 5% CO2)에서 배양되었다. 3T3-L1 세포의 분화 및 지질축적 유도를 위해, 3T3-L1 세포가 well에 가득 차고 2일 후(D0), 3T3-L1 세포를 DMI 배지 (10% FBS, 1 μM Dexamethasone, 0.5 mM 3-isobutyl-1-Methylxanthine, 10 ㎍/mL Insulin)에 48시간 동안 배양하였다. 48시간 후(D2)에는 3T3-L1세포를 10% FBS와 10 ㎍/mL insulin을 포함하는 DMEM/F-12 배지에 48시간 동안 배양하였다. 그 후, D4와 D6에는 10% FBS가 포함된 DMEM/F-12 배지로 배양하였다.
Oil red O staining
솔잎 추출물이 3T3-L1 세포에서 지질 형성에 미치는 영향을 육안으로 확인하기 위해 Oil Red O staining을 수행하였다. 시료를 처리한 3T3-L1 세포를 D8에 회수하여 1XPhosphate-Buffered Saline (PBS)로 2회 세척 한 후, 실온에서 1시간 동안 10% formalin으로 고정시켰다. 고정된 3T3-L1 세포를 증류수로 2회 세척 한 후, 60% isopropanol을 처리하여 5분 동안 방치하였다. 5분 후, 3T3-L1 세포를 완전히 건조 시키고 실온에서 20분 동안 Oil Red O 용액(60% isopropanol과 40% 증류수)으로 염색하였다. 증류수로 5회 세척 한 후, 염색된 3T3-L1 세포의 지질 방울을 광학현미경(Olympus, Tokyo, Japan)으로 관찰, 촬영하였다. 촬영 후, 100% isopropanol에 녹여 UV/Visible spectrophotometer (Xma-3000PC, Human Corporation Co., Seoul, Korea)를 이용하여 500 ㎚에서 흡광도를 측정하였다.
SDS-PAGE and Western blot analysis
3T3-L1 세포를 6-well plate에 well 당 4X105 cells로 배양하였다. 3T3-L1 세포가 well에 100%가 되고 2일 후, PDL과 DMI가 포함된 배지로 3T3-L1 세포를 48시간 동안 배양하였다. 48시간 후, PDL과 insulin (10 ㎍/mL)이 포함된 배지로 3T3-L1세포를 48시간 배양하였다. 그 후 2일마다 PDL이 포함된 배지로 교체하면서 3T3-L1세포를 배양하였다. 8일째 세포로부터 단백질을 추출하기 위해, 시료를 처리한 세포를 4℃의 1X phosphate-buffered saline (PBS)로 2회 세척하였다. 그 후 protease inhibitor cocktail (Sigma-Aldrich Co.)과 phosphatase inhibitor cocktail (Sigma-Aldrich Co.)이 포함된 radioimmunoprecipitation buffer (Boston Bio Products, Ashland, MA, USA)를 4℃에서 30분간 방치하여 단백질을 추출하였다. 추출된 단백질은 Bicinchoninic acid protein assay (Pierce Biotechnology Inc., Waltham, MA, USA)로 정량분석을 진행 후, 동일한 양의 단백질을 10% SDS-acrylamide gel로 전기영동하고 PVDF membrane (Bio-Rad, Hercules, CA, USA)에 이동시켰다. 이동시킨 membrane을 5% non-fat dry milk로 상온에서 1시간 동안 blocking 한 후, 1차 항체를 5% non-fat dry milk에 용해 시켜 4℃에서 16시간 동안 반응시킨다. 반응시킨 membrane을 0.05% tween-20 이 포함된 tris-buffered saline (TBS-T)로 5분간 3회 세척 한 후 2차 항체는 5% non-fat dry milk에 용해 시켜 membrane에 상온에서 1시간 동안 방치하였고, TBS-T로 10분간 3회 세척 후 ECL western blotting substrate (Amersham Biosciences Co., Little Chalfont, England)를 이용하여 단백질을 확인하였다.
통계분석
모든 결과는 3회 반복 측정한 후 평균 ± 표준편차로 표기하였고, 처리한 유의성은 Student’s t-test로 검증하여 p-value 값이 0.05 미만일 때 통계적으로 유의하다고 판정하였다(Microsoft Excel 2010, Microsoft, Redmond, WA, USA).
결과 및 고찰
솔잎 추출물이 3T3-L1 세포의 지질 형성 억제
솔잎 추출물(PDL)이 3T3-L1 세포의 지질 형성을 억제하는 효과가 있는지 확인하기 위해 지방분화를 유도하고자 DMI/insulin을 처리한 3T3-L1 세포에 PDL을 농도별로 처리하였다. 처리 후 Oil red O staining을 통해 지질 형성 정도를 확인한 결과, PDL은 농도의존적으로 DMI/insulin에 의해 유도되는 과도한 지질 형성을 억제하는 것으로 나타났다(Fig. 1). PDL의 지질 형성 억제가 세포독성에 의한 것인지 확인하기 위해 PDL의 3T3-L1세포에 대한 세포독성을 평가한 결과, 세포독성은 없는 것으로 나타났다(Data not shown). 본 결과를 미루어 볼 때, PDL은 항비만 활성이 있는 것으로 판단된다.
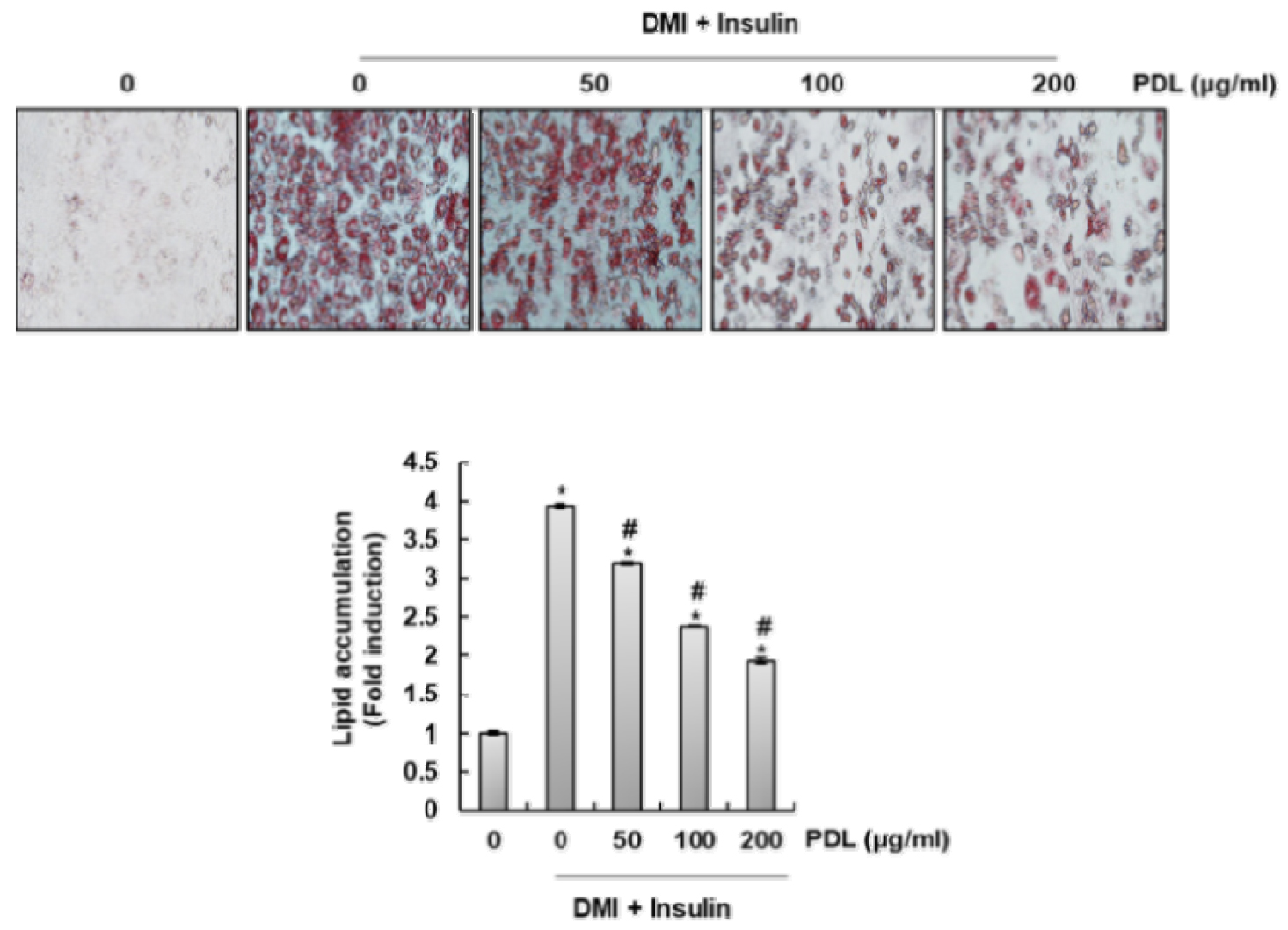
Fig. 1.
Inhibitory effect of PDL against DMI/insulin-mediated excessive lipid accumulation in 3T3-L1 cells. Differentiation of confluent 3T3-L1 mouse preadipocytes was initiated with MDI (0.5 mM 3-isobytyl-1-methylxanthine, 1 μM dexamethasone, and 10 ㎍/mL insulin) and maintained DMEM/F12-10% FBS medium (maintenance differentiation medium) in the absence or presence of PDL for 8 days. For Oil red O staining, Cells were fixed and stained with Oil Red O to visualize lipid accumulatons by light microscopy. Magnification, ×200. *P < 0.05 compared to the cells without the treatment. #P < 0.05 compared to the cells treated with DMI/insulin.
솔잎 추출물이 3T3-L1 세포의 지질 형성 관련 단백질 억제
지방세포 유전자의 프로모터에 결합하는 전사인자로 알려진 CEBPα (CCAAT/enhancer binding protein-alpha)의 과발현은 지방세포에서 지질 형성을 유도할 수 있다고 보고되고 있으며(Tontonoz et al., 1994) 지방세포 말단 분화 유도에 중요한 역할을 한다(Brun et al., 1996). PPARγ (peroxisome proliferator-activated receptor-gamma)는 지방세포 분화 과정의 중추 조정자로서 세포 주기의 출구를 유도하고 지방세포 특이적 유전자의 발현을 촉발하여 세포로의 에너지 전달을 증가시키며 주로 지방생성의 말단 분화에 필요하다(Fajas et al., 1998). Perilipin-1은 지질대사를 조절하는 역할을 수행하며, 지질저장에 주요한 역할을 한다(Kim et al., 2014). 따라서, PPARγ, CEBPα 그리고 perilipin-1의 발현억제는 지방세포 내 지질 형성을 억제하는 주요한 타겟으로 여겨지고 있다. 그리하여, 솔잎 추출물(PDL)의 지방세포 내 지질 형성 억제 활성이 PPARγ, CEBPα 그리고 perilipin-1의 발현억제와 관련이 있는지 확인하기 위해 Western blot을 통해 확인하였다. 그 결과, 솔잎 추출물은 DMI/insulin에 의한 PPARγ, CEBPα 그리고 perilipin-1의 과대발현을 억제하였다(Fig. 2). 본 결과를 미루어 볼 때, 솔잎추출물은 PPARγ, CEBPα 그리고 perilipin-1의 발현억제를 통해 지질 형성을 완화하는 것으로 판단된다.
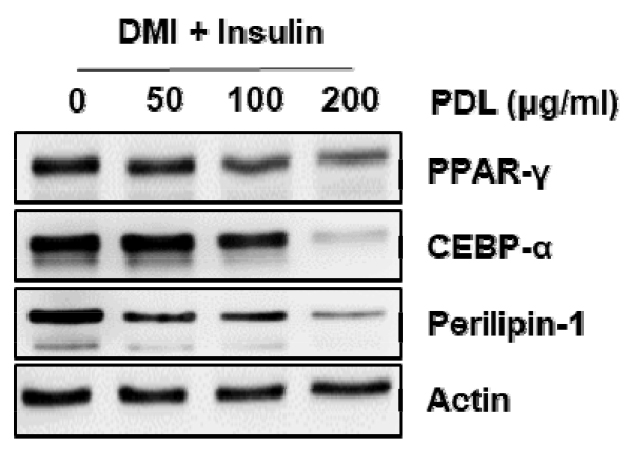
Fig. 2.
The Effect of PDL on the the protein expression such as PPARγ, CEBPα and perilipin-1 associated with adipocyte adipogenesis in 3T3-L1 cells. Cells were lysed and cellular proteins were separated by SDS-polyacrylamide gels and transferred onto nitrocellulose membranes. The membranes were probed with the indicated antibodies. Proteins were visualized using an ECL detection system. Actin was used as an internal control.
솔잎 추출물(PDL)은 초기 및 후기 지방생성 억제
지방이 축적되면서 지방전구세포가 성숙한 지방세포로 분화되는 과정인 지방형성은 비만의 발달과 밀접한 관련이 있다(Ando et al., 2019). 지방 생성 과정은 0일부터 2일까지의 초기 단계와 3일부터 8일까지의 후기 단계로 구분되는 것으로 알려져 있다(Geum et al., 2021). 3T3-L1 세포의 지방 형성 초기 및 후기 단계에 대한 PDL의 영향을 평가하기 위해, 3T3-L1 세포에 PDL을 처리한 후 Oil Red O 염색에 의한 지질 축적과 Western blot 분석에 의한 단백질 발현을 시간에 따라 조사하였다. Fig. 3에서 볼 수 있듯이 D0 (초기 단계)에서의 PDL 처리는 3T3-L1 세포에서 지질축적을 완전히 감소시켰다. 또한 D2, D4, D6 (후기)에 PDL을 처리한 3T3-L1 세포에서 지질축적이 현저히 감소하였다. 또한 PDL은 3T3-L1 세포에서 지방 생성의 초기 및 후기 단계에서 CEBPα, PPARγ 및 Perilipin-1과 같은 단백질 발현을 억제하였다(Fig. 3B). 이러한 결과를 고려할 때 PDL은 지방형성의 초기 단계뿐만 아니라 후기 단계까지 억제하는 것으로 생각된다.
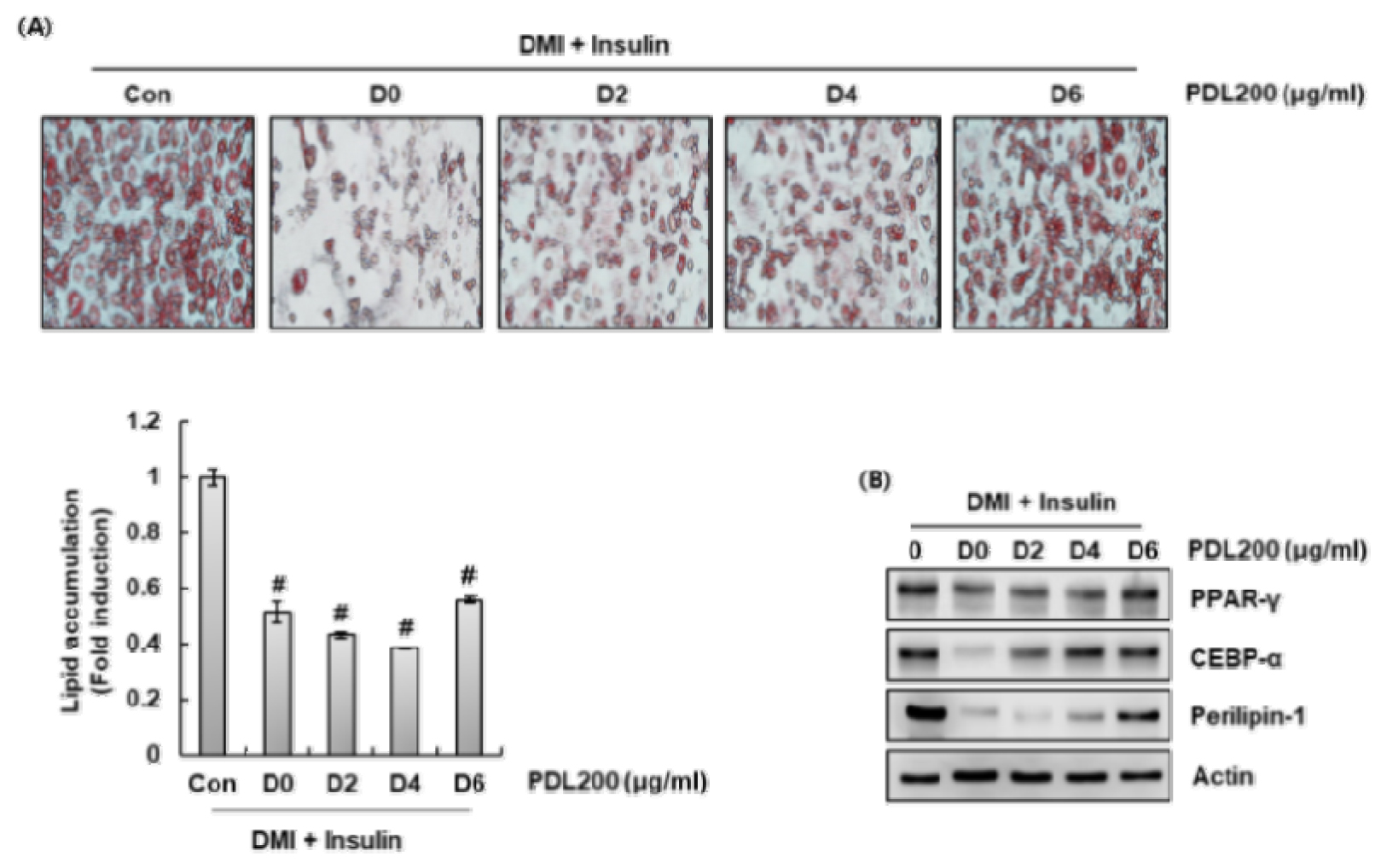
Fig. 3.
Effect of PDL on the early and late adipogenesis in 3T3-L1 cells. The treated cells were recovered on D8. (A) Lipid accumulation was determined by measuring Oil Red O staining. (B) The protein levels were determined by Western blot analysis. #P < 0.05 compared to the cells treated with DMI/insulin. Actin was used as internal control for Western blot.
적 요
본 연구에서는 솔잎 추출물(PDL)의 항비만활성을 검증하기 위해, PDL이 3T3-L1에서 DMI/insulin에 의해 유도되는 과도한 지질 형성을 억제하는지 평가하였다. 본 결과를 미루어 볼 때, PDL은 지방세포의 adipogenesis과 관련된 PPARγ, CEBPα 그리고 perilipin-1의 발현을 억제하여 과도한 지질형성을 억제하는 것으로 판단되며, PDL은 향후 비만 예방 및 치료를 위한 잠재적 소재로 활용이 가능할 것으로 판단된다. 그러나 본 연구는 PDL이 항비만 활성이 있는지 검증한 초기 단계 연구로 추가적인 기전연구와 동물기반 전임상 항비만활성 검증이 필요하다.




