서 언
보통밀(Triticum aestivum L., 2n = 6x = 42, AABBDD)은 A, B, 그리고 D 게놈(genome)을 가지고 있는 6배체(hexaploid)식물이다. 밀 염색체는 게놈과 그룹에 따라 상호관계를 가지고 있으며, 상호관계에 따라 상동(homologous), 동조(homoeologous) 및 비상동(non-homologous) 염색체로 구분되며, 이러한 상호관계를 구분하는 유전자는 Ph1 (pairing homoeologous 1)으로 상동염색체에서만 염색체 접합(chromosome association)이 일어난다(Chen et al., 1994; Martinez-Perez et al., 2001; Riley and Chapman, 1958).
밀의 생식세포분열 동안에 일어나는 염색체 접합은 염색체가 결합하는 접합기(zygotene)와 태사기(pachytene)동안 합사기 복합체(synaptonemal complex)가 형성되고 재조합 결절(recombination nodules)이 완료되면서 교차점(chiasma)이 일어나며, 염색체 교차에 의한 교차점의 빈도에 따라 생식세포 분열 제1감수분열 중기(metaphase I)에 원(ring), 팬(pan) 및 막대(rod) 모양의 이가염색체(bivalent chromosome)의 형태를 보인다(Jordan, 2006). 이러한 현상은 상동염색체에서만 일어나며, 동조 및 비상동 염색체사이에서는 일어나지 않아 Ph1 유전자에 의한 종내(intraspecies) 밀의 유전적 다양성 확장에 있어서 제한적인 요소로 작용한다. 종내뿐만 아니라 종간 교잡(interspecies cross)을 통한 유전적 다양성 확장을 위하여 Ph1 유전자의 억제에 대한 연구들이 지속적으로 수행되고 있다(Dvorak et al., 2006; Rey et al., 2017; Roberts et al., 1999).
Ph1 유전자를 억제하기 위하여 Ph1 억제자(suppressor)인 PhI(inhibitor of Ph)와 Ph1b 유전자의 돌연변이인 ph1b 외에도 생물학적 방법인 호밀 B 염색체를 이용하는 연구가 수행되었다(Alvarez et al., 1991; Kousaka and Endo 2012; Li et al., 2011; Rey et al., 2015). B 염색체는 일반적인 염색체 형태를 가진 정상적인 염색체인 A 염색체(A chromosome)보다 크기가 작아 형태적으로 비정상적인 염색체로 기존의 염색체 수와는 관련이 없는 여분의 염색체(supernumerary chromosome)로 다양한 생물종에 분포하고 있다(Camacho et al., 2000; Jones, 1995; Kousaka and Endo, 2012; Taylor and Evans, 1976). 작물분야에 있어서 호밀 B 염색체는 보통밀의 유전적 배경(genetic background)에서 동조 관계(homoeologous relationship)에 있는 밀 염색체와 외래 염색체 (alien chromosome)간에 결합을 초래하기 때문에 Ph1 유전자를 이용하여 동조 결합(homoeologous pairing)에 대한 연구들이 수행되어 왔다(Cunado et al., 1986; Estepa et al., 1993; Kousaka and Endo, 2012; Remerro and Lacadena, 1980).
이 연구에서는 genomic in situ hybridization (GISH)을 통하여 제1생식세포분열(the first meiosis) 동안에 동조 관계(homoeologous relationship)에 있는 두 종류의 Leymus 염색체가 밀의 유전적 배경에서 호밀 B 염색체 유무에 따라 염색체 접합 및 괴리(disjunction)의 염색체 이동을 관찰함으로써 호밀 B 염색체가 생식세포분열 동안 염색체 접합에 미치는 영향을 확인하고자 한다.
재료 및 방법
식물재료
밀의 유전적 배경(AABBDD)에서 염색체 접합에 대하여 호밀 B 염색체의 영향을 확인하기 위하여 공통 게놈을 공유하는 야생 호밀 속인 Leymus mollis (L.m)와 L. racemosus (L.r)에서 동조관계(homoeologous relationship)에 있는 각각 1개의 염색체가 첨가된 밀 첨가계통(AABBDD + L.m + L.r)을 육성하여 사용하였다(Cho et al., 2011; Kishii et al., 2003). 호밀 B 염색체가 추가적으로 첨가된 밀 첨가계통을 육성하기 위하여 2개의 호밀 B 염색체(rye B chromosome, B)와 이질염색질(heterochromatic region)이 결여된 2개의 호밀 B 염색체(small rye B chromosome, sB)를 가지고 있는 보통밀인 Chinese Spring (Triticum aestivum L.)을 밀 첨가계통과 교배하여 밀의 유전적 배경에 1개의 L. mollis 염색체와 호밀 B 염색체를 가지고 있는 첨가계통 (AABBDD + L.m + 2B + 2sB) 또는 밀의 유전적 배경에 1개의 L. racemosus 염색체와 호밀 B 염색체를 가지고 있는 첨가계통(AABBDD + L.r + 2B + 2sB)을 육성하였다. 육성된 각 계통들은 다시 L. mollis 또는 L. racemosus 이가염색체 첨가 밀 계통(AABBDD + 2L.m or AABBDD + 2L.r)과 교배하였다(Edet et al., 2018; Kishii et al., 2004). 최종적으로 밀의 유전적 배경에 호밀과 Leymus 염색체 첨가계통(AABBDD + L.m + L.r +B or AABBDD + L.m + L.r +sB)을 육성하여 연구에 이용하였다.
감수분열 염색체 이동 관찰
밀의 유전적 배경에서 호밀 B 염색체가 동조 관계(homoeologous relationship)에 있는 Leymus 염색체의 생식세포 분열에 미치는 영향을 관찰하기 위하여 식물재료의 이삭으로부터 약(anther)을 고정액(3 ethanol : 1 acetic acid, v/v)에 처리하여 상온에서 5일 동안 생식세포 염색체를 고정시켰다. 염색체의 생식세포적 염색체 이동을 확인하기 위하여 고정된 화분 모세포(pollen mother cells)를 관찰하였다. 생식세포 분열은 위상차 현미경(phase-contrast microscope, BX-53, Olympus, Japan)을 사용하여 관찰하였으며, 관찰한 슬라이드는 GISH를 수행하기 위하여 -80℃에 사용전까지 보관하였다.
GISH를 수행하여 호밀 B 및 Leymus 염색체를 구분하였으며, 이 염색체들은 형광인 fluorescein-12-dUTP (Roche, Switzerland)과 tetramethyl-rhodamione-5-dUTL (Roche, Switzerland)을 이용하여 염색하였다. 탐침자(probe)는 L. mollis와 L. racemosus의 DNA를 고온과 고압으로 절단하여 500 bp 정도의 단편을 이용하여 무작위 시발체 표시(random-primer labeling) 방법으로 제작하였다(Mukai, 1996). 형광 탐침자의 활성을 위해 변성시약인 0.2M NaOH 수용액에 5분간 침지하여 염색체를 변성(denaturation)한 후, 차가운 에탄올에 5분간 탈수화(dehydration)하여 실온(25℃)에서 건조시켰다. 형광 탐침자 50-500 ng이 포함된 혼성화액 10 µL를 건조된 슬라이드 위에 분주하고 덮개유리를 덮고 37℃에서 24시간 동안 반응시켰다. 혼성화 후, 덮개유리를 조심스럽게 제거하고 2x SSC (saline sodium citrate)와 Triton x-100가 첨가된 2x SSC에 5분간 순차적으로 혼성화 된 슬라이드를 세척하였다. 세척된 슬라이드를 건조하여 10-15 µL의 DAPI (Vectashield mounting medium with DAPI)를 처리하고 형광현미경(Bx53F2, Olympus, Japan with color camera, eXcope X7M, China)을 이용하여 염색체 이동을 관찰하였다.
통계분석
호밀 B 염색체의 유무에 따라 Leymus 염색체 사이의 염색체 조합 비율의 차이를 검정하여 호밀 B 염색체가 염색체 조합에 미치는 영향을 확인하였다. 생식분열하는 100개의 세포를 3반복 관찰하여 일가염색체의 random과 symmetrical positioning 및 이가염색체의 비율을 산출하였다. 산출된 비율은 t-검정을 통하여 비율의 차이에 대한 유의성을 검정하였다.
결과 및 고찰
밀 첨가계통에서 밀의 유전적 배경은 동조 관계(homoeologous relationship)에 있는 두 Leymus 염색체의 상동성(homology)을 엄격히 인식한다(Cho et al., 2011). 그로 인하여 생식세포분열에서 두 Leymus 염색체 사이의 결합(chromosome association)에 제약을 받아 Leymus 이가염색체(bivalent chromosome)의 비율(약 1.9%)이 매우 낮은 비율을 나타낸 반면, 호밀 B 염색체를 가지고 있는 밀 첨가계통은 Leymus 이가염색체의 비율(약 10.3%)이 호밀 B 염색체의 첨가에 따라 상대적으로 Leymus 이가염색체의 비율이 높아졌다(Table 1). 이와 유사하게 일반 호밀 B 염색체보다 이질염색질 부분이 결실된 크기가 작은 호밀 B 염색체 역시 호밀 B 염색체가 첨가되지 않은 밀 첨가계통보다 Leymus 이가염색체의 비율이 높아졌다(7.0 ± 0.7%). 두 호밀 B 염색체에 따라서도 Leymus 이가염색체의 비율에 차이를 보였다(P < 0.05).
Table 1.
Frequency (% ± SD) of chromosome association between two Leymus chromosomes in wheat genetic background with rye B or small B chromosomes lines during the first metaphase
|
Chromosome composition (No. chromosomes)z | Univalent | Bivalenty | ||
| Random positioning | Symmetrical positioning | Total | ||
| DMA (44) | 47.2 ± 1.7 | 52.8 ± 1.7 | 98.1 ± 0.5 | 1.9 ± 0.5 |
| DMA + rye B (45) | 46.1 ± 2.8 | 53.9 ± 2.8 | 89.4 ± 0.2 | 10.3 ± 0.2*** |
| DMA + rye sB (45) | 44.8 ± 5.7 | 55.2 ± 5.7 | 93.0 ± 0.7 | 7.0 ± 0.7** |
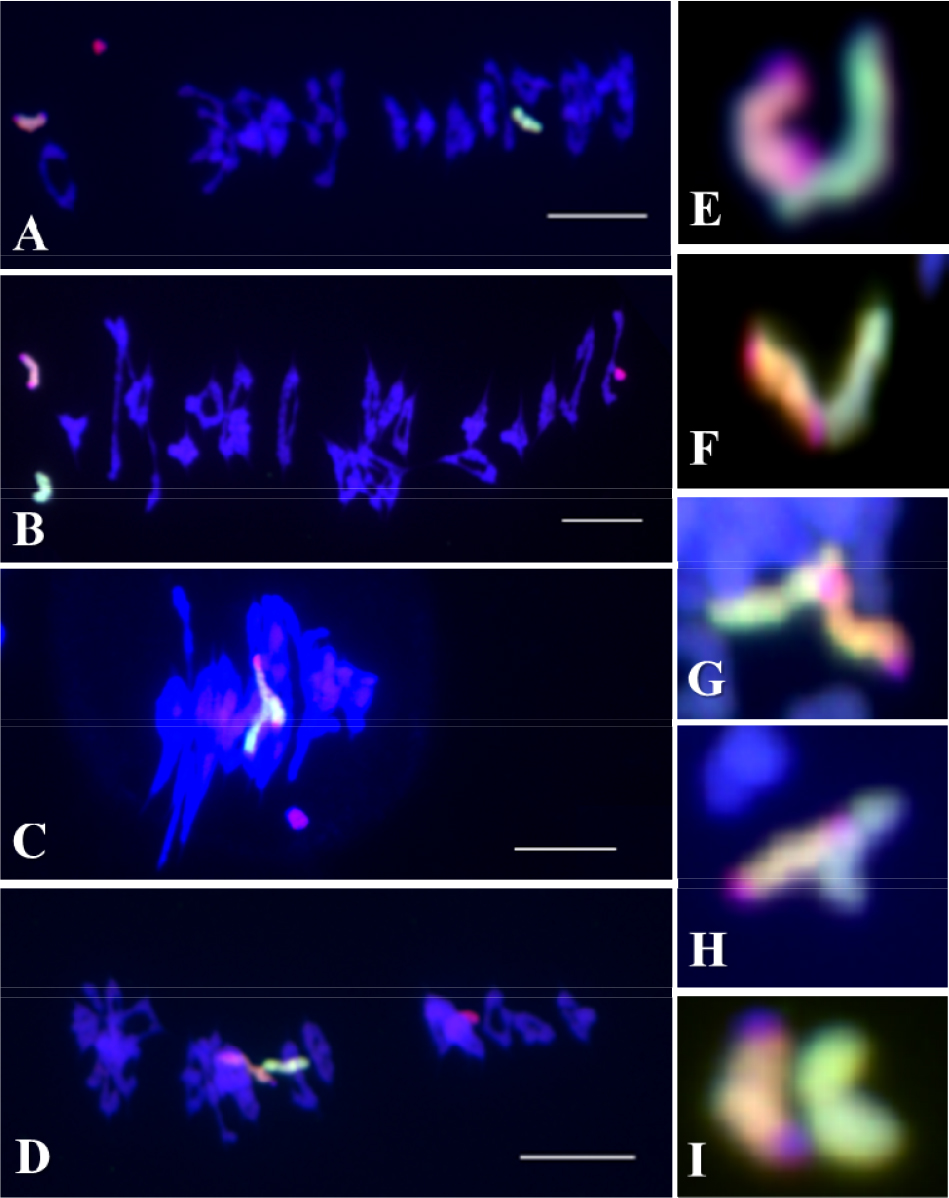
밀 첨가계통의 두 Leymus 염색체는 밀의 유전적 배경에서 두 가지 배열형태를 보인다(Cho et al., 2011). 두 배열형태를 적도판(equational plate)을 기준으로 두 염색체의 위치에 따라 적도판 상에 위치할 경우는 두 염색체 사이의 염색체 결합과의 관계가 없는 random positioning과 적도판을 중심으로 위와 아래로 위치할 경우는 염색체 결합과는 관계가 있으나 결합이 완벽하지 않아 쉽게 분리된 symmetrical positioning으로 구분하였다(Cho et al., 2011). 결합이 완벽하지 않은 symmetrical positioning의 경우에는 두 Leymus 염색체가 염색체 결합은 이루어지나 염색체가 결합된 부분의 제한과 그로인한 형태적 불안정으로 쉽게 염색체 결합이 풀려 적도판을 기준으로 두 Leymus 염색체가 위와 아래로 위치한다고 예측되었다(Cho et al., 2011). 즉, 염색체 결합의 정도가 방추미세관(microtubles)이 당기는 힘보다 약하기 때문일 것이다. 이러한 두 Leymus 염색체 사이의 관계에 있어 호밀 B 염색체의 존재유무에 따라 염색체 결합에 미치는 영향을 확인하였다. 호밀 B 염색체가 첨가된 밀 첨가계통에서 보통의 밀 첨가계통에서는 나타나지 않았던 Leymus 이가염색체가 확인되었다(Fig. 1C). 이 Leymus 이가염색체는 보통밀의 이가염색체와 같은 형태를 가지고 있으며, 교차점(chiasmata)과 같은 교차부분이 확인되었다. 하지만 이 연구에서는 보통밀의 생식세포분열에서 보여지는 재조합 결절(recombination nodules)에 의한 교차점인지 아니면 염색체 절단(chromosome breakage)에 의한 결합인지 확인하지는 못하였다.
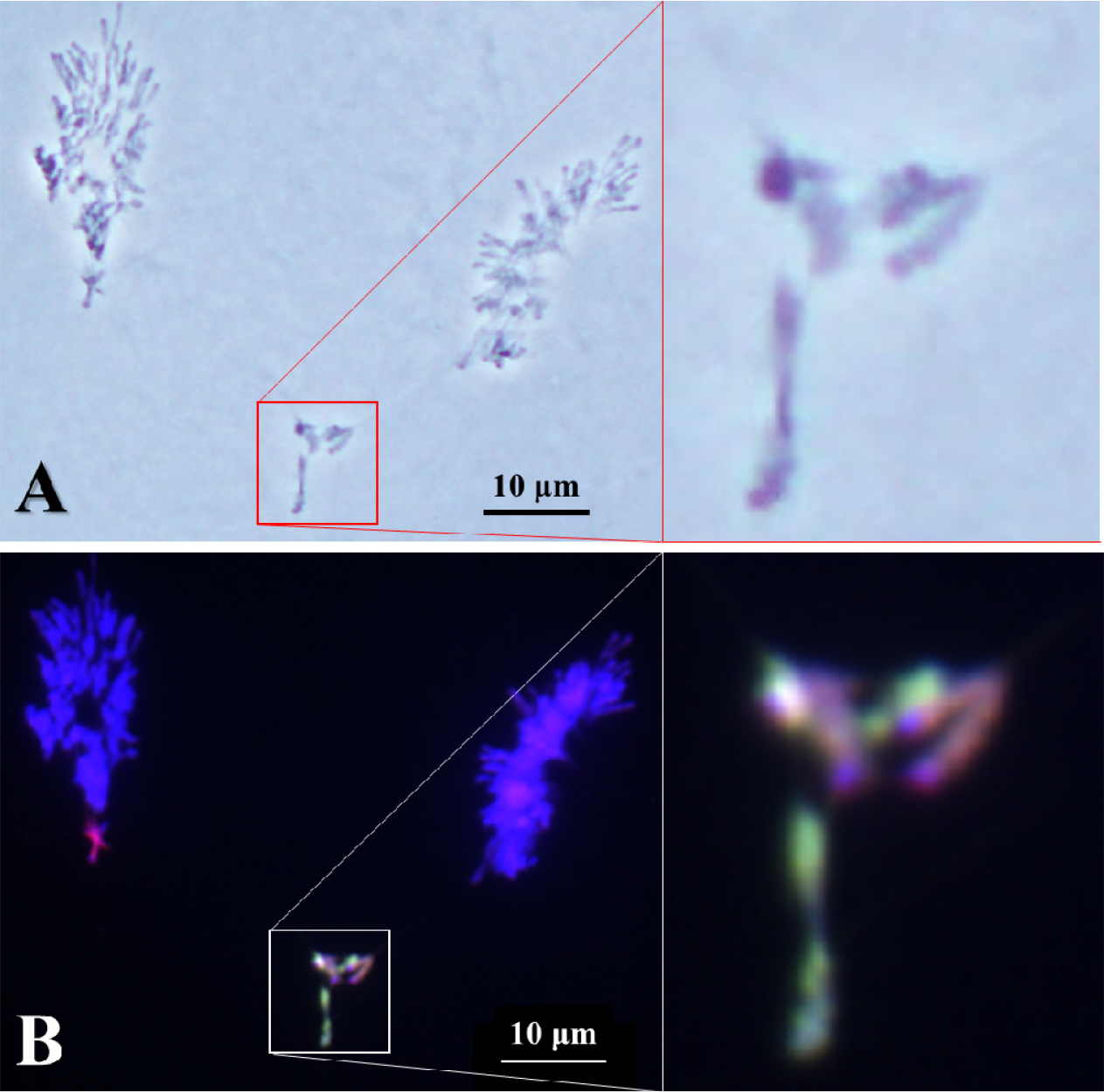
일반적으로 제1감수분열(reductional division)에서 방추미세관에 의해 괴리(disjunction)가 일어난 염색체는 각 극으로 이동하게 된다(Cai and Xu, 2007). 하지만 염색체 조합이 이루어지지 않은 일가염색체는 지체염색체(lagging chromosome)로 존재하고 이가염색체의 상동염색체의 분리가 아닌 자매염색분체의 분리가 일어나는 것을 확인하였으며 이 지체염색체들은 대부분이 보통밀의 염색체가 아닌 Leymus mollis, L. racemosus와 호밀 B 염색체로 확인되었다(Fig. 2). 또 다른 지체염색체의 관찰에서 우리는 이 지체염색체 역시 Leymus 일가염색체일 것으로 예상하였다(Fig. 3A). GISH 후, 이 지체염색체는 Leymus 이가염색체로 확인되었다(Fig. 3B). 이 지체염색체는 방추미세관에 의하여 분리가 일어날 때까지 두 Leymus 염색체가 결합된 것을 확인하였다. 염색체가 분리되는 과정에서 결합이 풀리지 않은 것은 방추미세관의 당기는 힘보다 강하다는 것을 설명할 수 있다. 하지만, 이러한 경우가 매우 드물게 관찰되어 정확한 결론을 낼 수는 없지만 방추미세관에 의해 분리가 되어 보통밀의 염색체와 같이 이동하지 않고 지체염색체가 되었다는 것은 두 Leymus 염색체의 결합이 재조합 결절에 의한 교차점이 아니라 염색체 절단에 의한 결합인 것으로 설명할 수 있다.
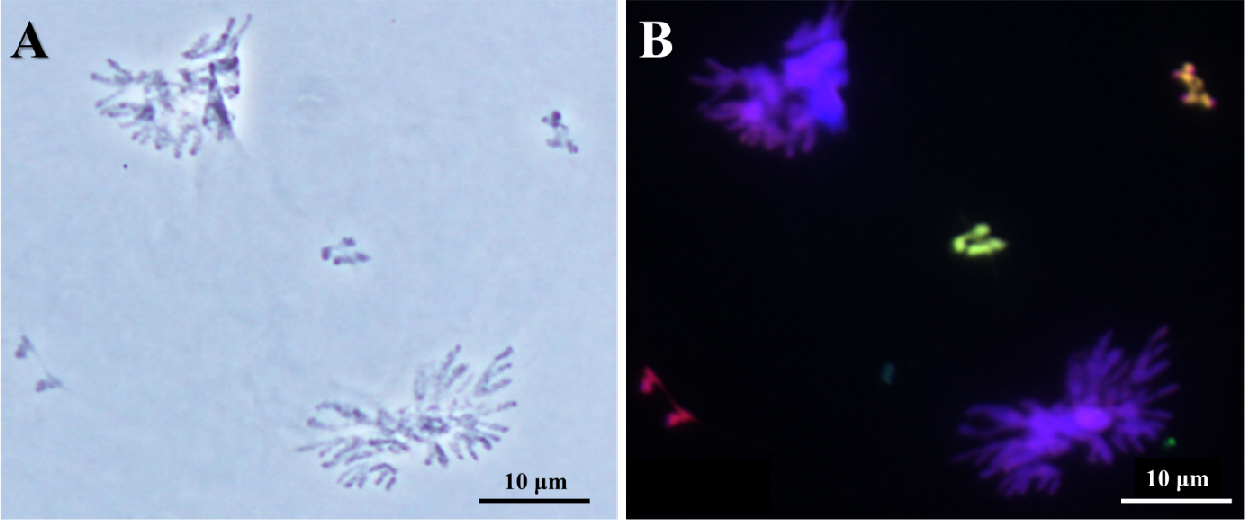
Fig. 2.
Chromosome disjunction of two Leymus chromosomes and rye B chromosome of wheat addition line during the first anaphase. Genomic in situ hybridization reveals L. mollis chromosome in greenish signal, L. racemosus chromosome in yellowish signal, and rye B chromosome in reddish signal. Scale bar, 10 ㎛.
기존의 호밀 B염색체는 보통밀의 정상적인 염색체인 A염색체와 염색체결합을 하지 않는다(Jones and Rees, 1967). 그러나 이 연구에서 호밀 B염색체는 두 Leymus 염색체와 결합이 이루어지는 것을 확인하였다(Fig. 4). 이러한 현상은 보통밀의 Ph 유전자에 의하여 서로 상동성에 의한 완벽한 통제가 이루어지고 있으나 동조 관계에 놓은 두 Leymus 염색체는 각각의 상동염색체가 존재하지 않고 또한 호밀 B 염색체의 Ph 유전자의 억제에 의하여 호밀 B 염색체와 각 Leymus 염색체 사이의 접합이 일어난 것으로 설명할 수 있다. 또한, 매우 제한적인 빈도로 발생하지만 이러한 이가 염색체는 제1감수분열에서 호밀 B염색체와 Leymus 염색체 사이의 결합하는 힘은 방추미세관이 당기는 힘보다 강하여 지체염색체로 발생하는 것을 확인하였다.
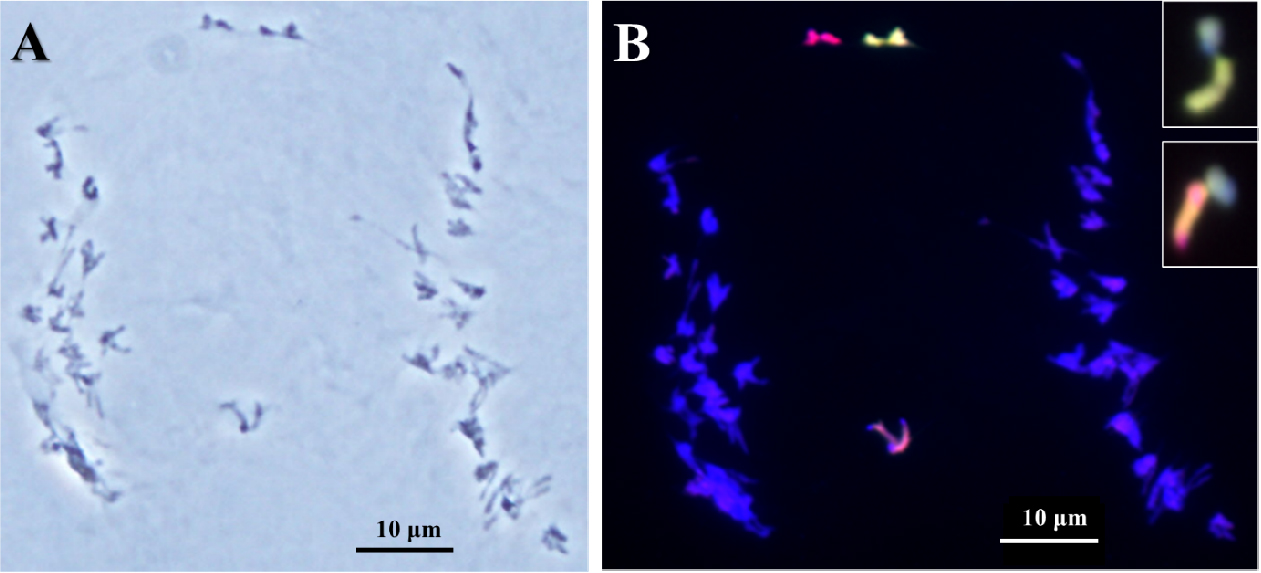
Fig. 4.
Lagging bivalent between Leymus mollis chromosome and rye B chromosome and univalent of L. racemosus under chromosomal disjunction chromosome in the first anaphase of wheat addition line. Genomic in situ hybridization reveals L. mollis chromosome in greenish signal, L. racemosus chromosome in reddish signal, and rye B chromosome in deep red signal or cyan signal in white boxes. Scale bar, 10 ㎛.
호밀 B 염색체의 Ph 유전자 억제에 의한 염색체 이동의 이상은 호밀 B 염색체와 Leymus 염색체 사이뿐만 아니라 보통밀과 Leymus 염색체 사이에서도 일어나는 것을 확인하였다(Fig. 5). 이러한 염색체 이동의 빈도도 매우 제한적이지만 L. mollis와 보통밀의 염색체가 서로 연결되어 있는 것이 확인되었다. 또한, 이 세포에서는 대부분의 염색체가 서로의 상동성을 인지하지 못하고 서로 연결되어 각각의 염색체를 구분하기가 매우 어려웠으며, GISH에 의하여 Leymus와 밀 B 염색체가 구별되면서 Leymus와 보통밀의 염색체 사이의 결합이 일어나는 것을 확인하였다. 하지만 제1생식세포 이른 초기분열기에 일어난 이 염색체 이동은 다른 분열기에 특징적인 연결된 염색체 이동으로 관찰되지 않았다.

Fig. 5.
Indiscriminate chromosomal association between wheat and Leymus mollis chromosomes of wheat addition line during diakinesis by acetocarmine(A) and genomic in situ hybridization (B). Genomic in situ hybridization reveals L. mollis chromosome in greenish signal, L. racemosus chromosome in reddish signal, and rye B chromosome in cyan signal. Scale bar, 10 ㎛.
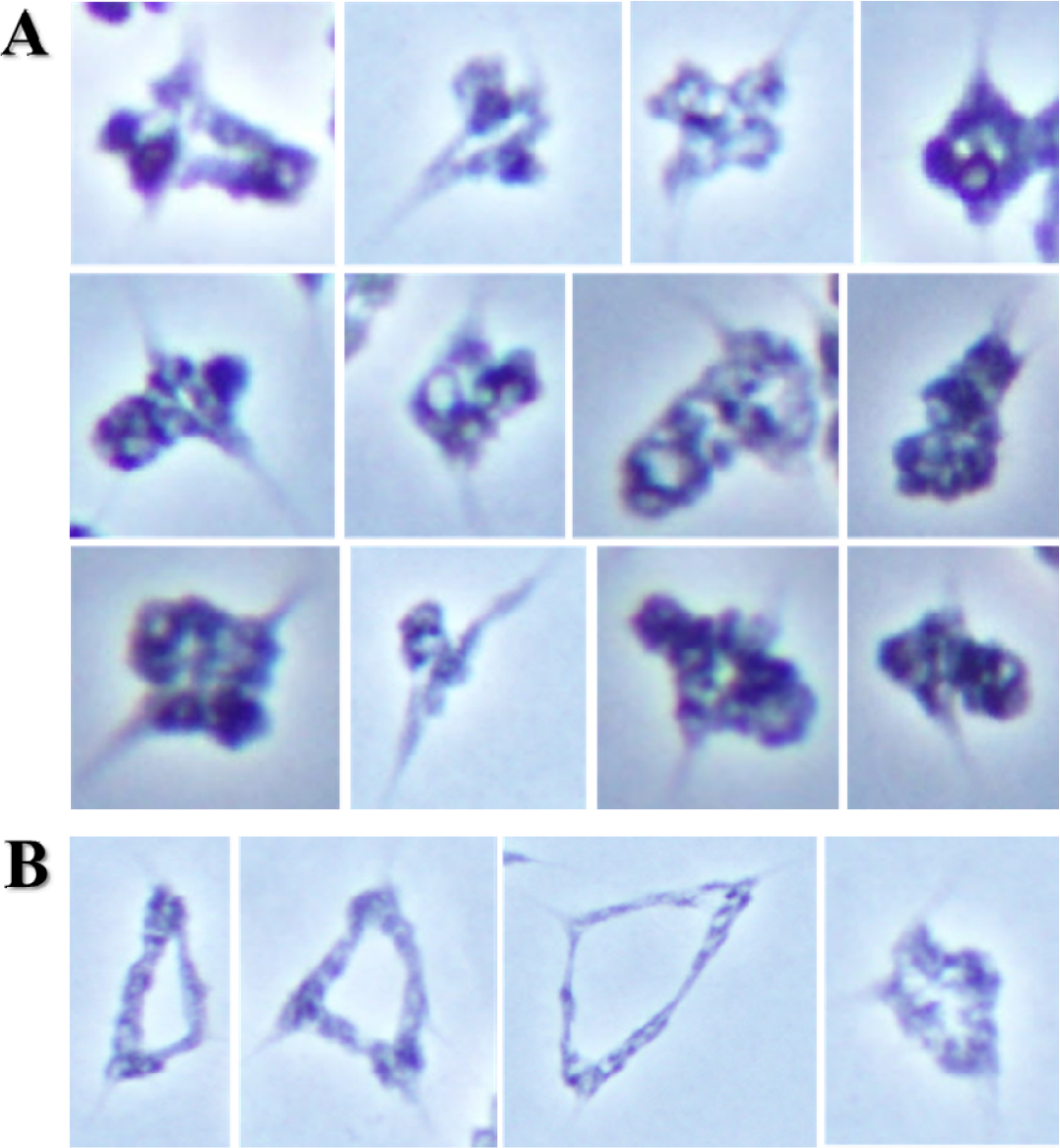
호밀 B 염색체가 보통밀에 영향을 주는 것은 Leymus 염색체와의 결합뿐만 아니라 보통밀 염색체 사이에서 확인되었다. 일반적으로 보통밀 이가염색체는 원(ring), 팬(pan) 및 막대(rod) 모양의 형태를 이루고 있지만, 호밀 B 염색체의 영향에 의하여 초과 교차점(hyper-crossover)을 보인 보통밀 이가염색체는 뭉쳐 보이거나 긴 막대 모양을 보였다(Fig. 6 and Fig. 7A). 이 외에도 삼각형 모양의 삼가염색체(trivalent chromosome)가 드물게 확인되었다(Fig. 7B). 이러한 염색체 결합은 모든 보통밀 이가염색체에서 확인된 것은 아니다. 초과 교차점(hyper- crossover)을 가진 보통밀 이가염색체의 발생빈도는 상대적으로 Leymus 염색체간, Leymus 염색체와 호밀 B 염색체, 및 Leymus와 보통밀 염색체 사이의 이가염색체보다 높은 비율로 관찰되었다(Fig. 7A). 보통밀에서 관찰된 초과 교차점과 같은 염색체 결합은 기존에 확인되었던 Leymus 염색체간, Leymus 염색체와 호밀 B 염색체 및 Leymus와 보통밀 염색체 사이의 결합과는 차이가 있었다. Leymus 염색체간, Leymus와 호밀 B 염색체 및 Leymus와 보통밀 염색체 사이의 결합은 그 결합력이 방추미세관이 당기는 힘보다 강하여 지체염색체가 유발되는 것으로 추측하였지만, 호밀 B 염색체에 의한 보통밀 사이에서 일어난 초과 염색체 결합에 따른 보통밀 지체염색체는 제1생식세포 후기분열(anaphase)에서는 관찰되지 않았다. 이러한 결과로 보아, 보통밀 염색체 사이에서 일어난 결합은 방추미세관이 당기는 힘보다 작으며, Leymus 염색체간, Leymus와 호밀 B 염색체, 및 Leymus와 보통밀 염색체 사이의 결합과는 차이가 있는 결합의 종류로 추측할 수 있다. 하지만 식물재료의 특성상 여러 번의 교배와 선발을 통하여 동일한 계통을 육성할 수 있으며 세대진전을 할 경우 일가 염색체의 불규칙적인 생식세포분열로 동일한 유전적 조성을 가진 세대를 얻기가 어려운 문제로 인하여 추가적으로 초과 교차점을 항원항체 반응으로 확인할 수는 없었다.

Fig. 6.
Wheat bivalent chromosome with hyper-chiasmata in the first anaphase of wheat addition line during the first metaphase, and Genomic in situ hybridization reveals Leymus mollis chromosome in greenish signal, L. racemosus chromosome in reddish signal, and rye B chromosome in cyan signal in white boxes.
식물육종프로그램에 있어 신품종 개발은 인공교배 및 기존 식물체의 염색체 배수성 등을 이용하는 육종방법으로 작물의 질적 및 양적 향상을 추구하였다(Jo et al., 2018; Ma et al., 2018; Oh et al., 2015). 이 연구에서 확인된 호밀 B 염색체의 영향이 염색체 결합에 의한 교차점을 상동염색체 사이 또는 동조 및 비상동 염색체 사이에서 일어나게 할 수 있다면 종간 교배장벽뿐만 아니라 종내 유전적 한계를 극복을 통하여 작물의 특성 향상에 도움을 줄 수 있을 것으로 생각한다.
적 요
이 연구에서는 밀 첨가 계통의 생식세포분열시, 호밀 B 염색체가 염색체 접합에 미치는 영향을 관찰하였다. 밀 첨가 계통은 동조관계에 있는 Leymus mollis와 L. racemosus 염색체를 각각 하나씩 가지고 있다. 밀의 유전적 배경에서 두 Leymus 염색체의 이동은 genomic in situ hybridization에 의하여 확인되었다. 호밀 B 염색체를 가지고 있지 않은 밀 첨가 계통의 생식세포 제1중기 분열기에 두 Leymus 염색체의 대부분은 일가염색체를 보였다(98.1 ± 0.5%). 반면에 호밀 B 염색체를 가지고 있는 밀 첨가 계통에서 Leymus 이가염색체의 빈도(10.3 ± 0.2%)는 호밀 B 염색체를 가지고 있지 않은 밀 첨가 계통의 Leymus 이가염색체의 빈도(1.9 ± 0.5%)보다 높았다. 호밀 B 염색체를 가지고 있지 않은 밀 첨가 계통에서는 비정상적인 구조를 가지고 있는 이가염색체가 관찰되었다. 반면, 비록 매우 낮은 빈도이지만 호밀 B 염색체를 가지고 있는 밀 첨가 계통에서는 정상적인 형태를 보이는 이가염색체가 확인되었다. 호밀 B 염색체의 영향은 또한 보통밀과 L. racemosus 염색체 사이의 이가염색체의 형성을 유도하였으며, 보통밀과 L. mollis 염색체 사이의 삼가염색체의 형성도 유도하였다. 뿐만 아니라 보통밀 염색체 사이에서 초과 교차가 일어나는 것을 확인하였으며, 이러한 현상으로 원, 막대, 그리고 후라이팬 모양의 일반적인 이가염색체의 형태가 아닌 막대모양이나 응축된 형태의 보통밀 이가염색체가 확인되었다.