서 언
콩(Glycine max (L.) Merr.)은 전세계적으로 재배되고 있는 고단백 유지 작물로 최근에는 지구 온난화를 비롯한 환경 및 식량 문제 등으로 식물성 대체육이 각광을 받으면서 식물성 단백질의 주요 공급원으로 주목 받고 있다(Huang et al., 2019). 콩은 단백질과 같은 1차대사산물 외에 항산화, 항암, 면역력 강화 등의 생리활성을 가진 2차대사산물을 다양하게 함유하고 있다(Coward et al., 1993). 콩에 함유된 이차대사산물에는 이소플라본, 소야사포닌, 콜린, 레시틴 등이 있다(Hwang et al., 2019; Messina et al., 1994). 녹황색 채소나 과일에 많이 함유되어 있는 카로티노이드는 대표적인 식물의 이차대사산물로 알려져 있다(Monma et al., 1994). 카로티노이드에 속하는 루테인은 눈건강 및 안구질환 예방에 탁월한 효과를 가진 것으로 알려져 있으며, 베타카로틴은 항암 및 면역 시스템 강화, 심혈관 질환의 예방에 관여하는 것으로 알려져 있는데, 콩에서도 다양한 품종 및 생육 단계에 따른 카로티노이드 함량 분석 연구가 보고되었다(Gebregziabher et al., 2022). 콩에 함유된 대표적인 이차대사산물로 알려진 이소플라본은 식물성 에스트로겐으로 불리며, 피부건강, 골다공증 예방 및 항산화, 항암 등의 다양한 효능을 가지고 있는 것(Sohn et al., 2021)으로 알려져 있으며, 콩에서 이소플라본 생합성 기작에 관여하는 유전자가 다수의 연구결과로 확인된 바 있다(Matsuda et al., 2020). 식물에 포함된 사포닌은 약 500여종이 알려져 있는데 인삼에 포함된 진세노사이드(ginsenoside), 엘루테로사이드(eleutheroside)등 30여종이 중추신경계, 면역계에 약리적 작용을 하는 반면에, 두과에 광범위하게 분포되어 있는 triterpenoid계 사포닌인 소야사포닌은 항암, 항산화 및 면역력 강화 등의 생리적 활성을 가진 이차대사산물로 알려져 있다(Sundaramoorthy et al., 2019). 이러한 이차대사산물의 함량은 식물의 유전적 요인, 환경적 요인 등에 영향을 받는 것(Gutierrez-Gonzalez et al., 2009; Hoeck et al., 2000)으로 알려져 있어서, 콩의 농업적 가치를 향상시키고 새로운 기능성 콩 품종을 개발하기 위해서는 다양한 유전자원에서 이차대사산물의 함량을 분석하고, 환경 변이에 따른 함량 변화를 이해할 필요가 있을 것이다. 본 연구에서는 유전체 재분석이 완료된 콩 핵심집단에 속하는 23개 자원들과 미국 품종 2종을 대상으로 카로티노이드, 이소플라본, 소야사포닌 함량을 분석함으로써 고기능성 콩 자원을 선발하고, 다양한 이차대사산물의 생합성에 관여하는 메커니즘 규명의 자료로 활용할 예정이다.
재료 및 방법
실험 재료
본 연구를 위해 사용된 재료는 콩 핵심집단(Jeong et al., 2019)에 속하는 23 자원들과 LG팜한농이 보유한 미국 품종 Jack, Maverick을 제공받아 총 25개 자원의 완숙 종자를 대상으로 다양한 이차대사물질 함량 분석을 수행하였다. 실험에 사용한 25개 자원은 동일한 온실 조건에서 파종하여 Hoseo, Savoy를 제외한 모든 자원은 3개체를 선발하여 수확한 완숙 종자를 사용하였다.
카로티노이드 분석
콩 종자내 카로티노이드 성분 분석을 위해 25개 자원으로부터 수확한 완숙종자를 동결건조 후 분쇄하였고, 시료 당 100 ㎎씩 screw tap tube에 넣은 후 0.5 mM BHT (Butylated hydroxytoluene)를 함유하는 ethanol 1 mL를 넣어 혼합하였다. 혼합액에 acetone 3 mL, 15 mL petrol eter 3 mL을 넣어 혼합하고, 20% NaCl 8 mL을 넣고 혼합한 후 3000 rpm, 10분간 원심분리하여 회수한 상층액을 여과한 후 분석을 수행하였다. 카로티노이드 함량은 역상컬럼(Kinetex 2.6 ㎛, C18 100A, 100Ⅹ4.60 ㎜; Phenomenex)을 장착한 액체크로마토그래피를 사용하여 분석을 실시하였다. 이동상 A는 75% methanol, 이동상 B는 100% ethyl acetate를 사용하였다. 표준물질은 ß-carotene, lutein (Sigma)을 사용하여 표준검량곡선을 작성하여 총 카로티노이드 함량을 측정하였다.
소야사포닌 및 이소플라본 분석
콩 종자내 소야사포닌 및 이소플라본 성분 분석을 위해 25개 자원의 완숙종자를 동결건조 후 분쇄하였고, 시료 당 1g을 분석에 사용하였다. 소야사포닌 및 이소플라본 함량 분석은 Lee et al. (2020)의 방법을 사용하여 액체크로마토그래피(UHPLC, Dionex Ultimate 3000)를 사용하여 분석되었다. 소야사포닌을 위한 표준 물질로는 soyasaponin Aa, Ab, Ac, Ba, Bb, Bc, Bc'를 사용하였고, 이소플라본을 위한 표준 물질은 aglycones, ß-glycosides, acetyl-glycosides와 malonyl-glycosides를 사용하여 표준검량곡선을 작성하여 총 소야사포닌 및 이소플라본 함량을 산출하였다(Lee et al., 2020).
결과 및 고찰
카로티노이드
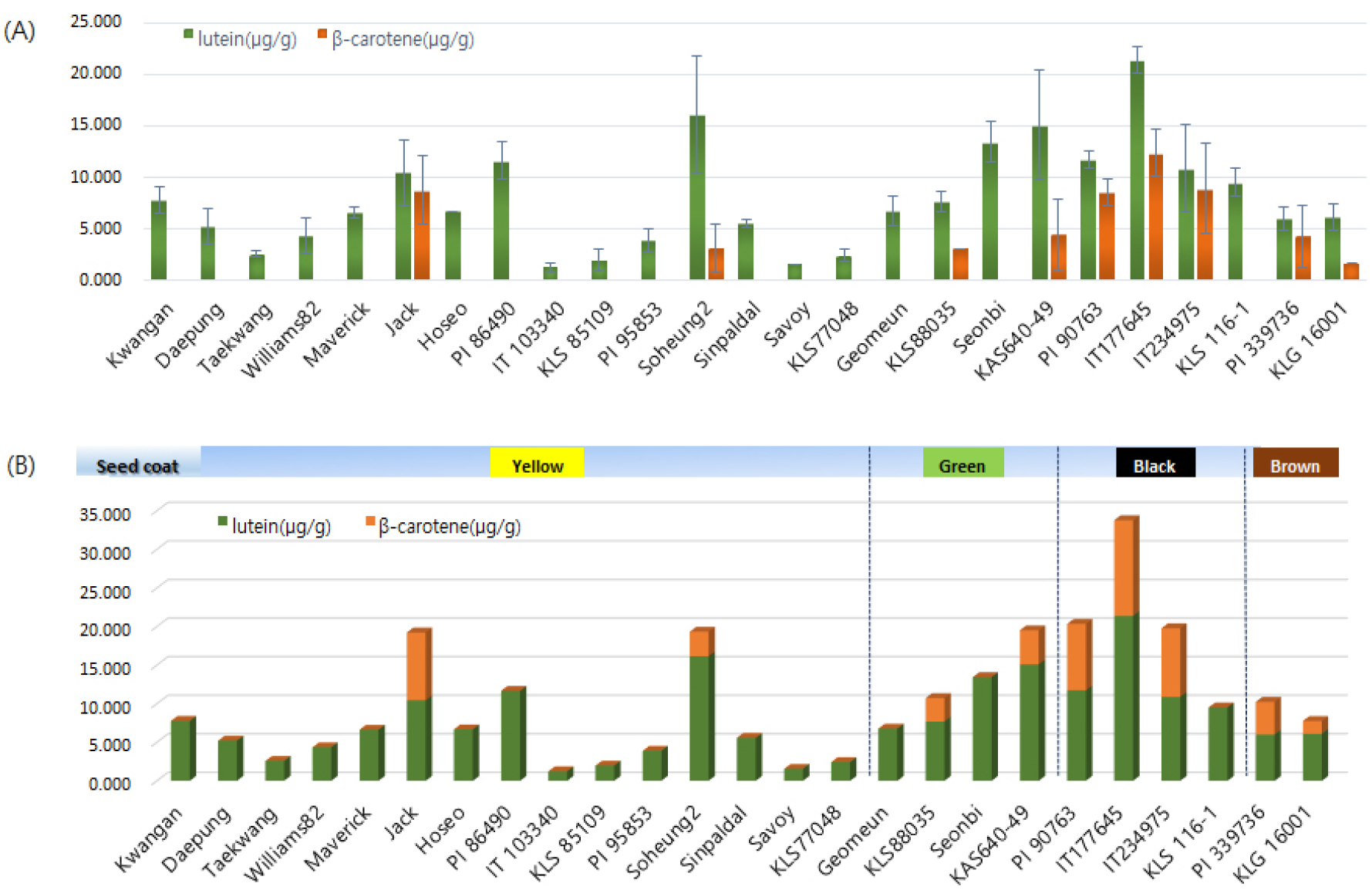
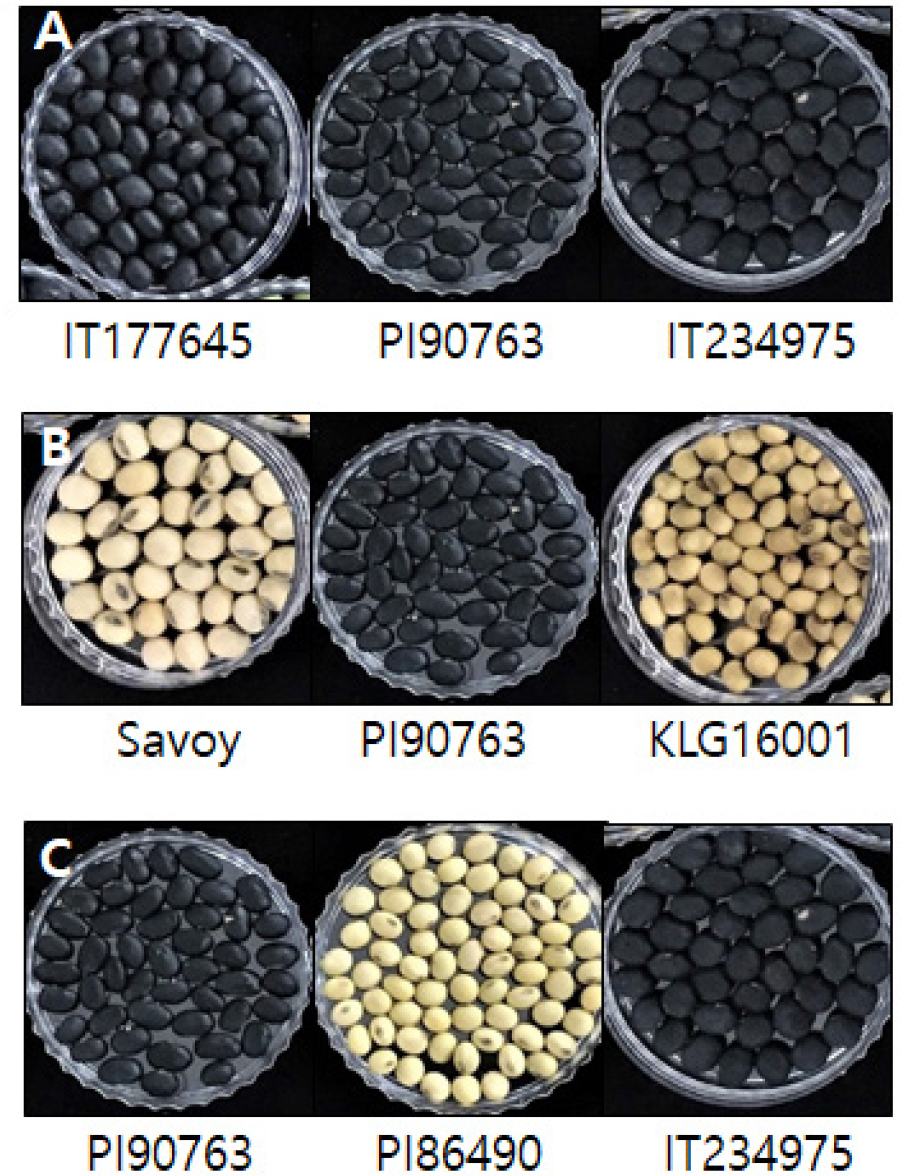
콩 25개 자원들을 대상으로 카로티노이드 함량을 분석한 결과는 Fig. 1(A)과 같다. 모든 자원들에서 루테인 함량이 베타카로틴의 함량보다 높게 관찰되었다. 루테인은 IT177645에서 21.38 ㎍/g로 가장 높은 함량을 보였고, IT103340에서 1.23 ㎍/g으로 가장 낮은 함량을 보였다. 베타카로틴은 9개 자원들에서 검출되었는데 1.66~12.40 ㎍/g의 범위로 분포하였으며, 이들 자원을 제외한 16개 자원들에서는 베타카로틴의 함량을 확인할 수 없었다. 본 실험에서 측정한 루테인과 베타카로틴의 함량을 합산한 총 카로티노이드 함량을 종피색에 따라 분석한 결과, IT177645에서 33.78 ㎍/g로 가장 높은 함량을 보였고, IT103340에서 1.23 ㎍/g 으로 가장 낮은 함량을 보였다(Fig. 1B). 또한 25개 자원들의 종피색에 따른 총 카로티노이드 함량을 분석한 결과, 검은 종피색을 가진 4개 자원들 중에 KLS116-1을 제외한 PI90763, IT77645 그리고 IT234975에서 가장 높은 총 카로티노이드 함량을 확인할 수 있었다. 콩에서 카로티노이드 함량은 유전형, 종자의 성숙도, 그리고 종피색에 영향을 받는 것으로 알려져 있다(Gebregziabher et al., 2022, Monma et al., 1994). 카로티노이드 함량은 품종에 따라 큰 차이를 보이며, chlorophyll 함량과 높은 상관관계를 가지고 있다. 이로 인해 검은콩이 가장 높은 카로티노이드 함량을 보이며, 노란콩이 낮은 함량을 보였으며, 미성숙 종자가 완숙종자 보다 높은 카로티노이드 함량을 보이는 것으로 보고되었다. 본 실험의 결과에서도 25개 자원들의 유전형에 따른 카로티노이드 함량의 다양성을 확인할 수 있었고, IT177645, PI90763, IT234975와 같이 검은 종피색을 가진 자원들에서 높은 카로티노이드 함량이 관찰되었다.
이소플라본
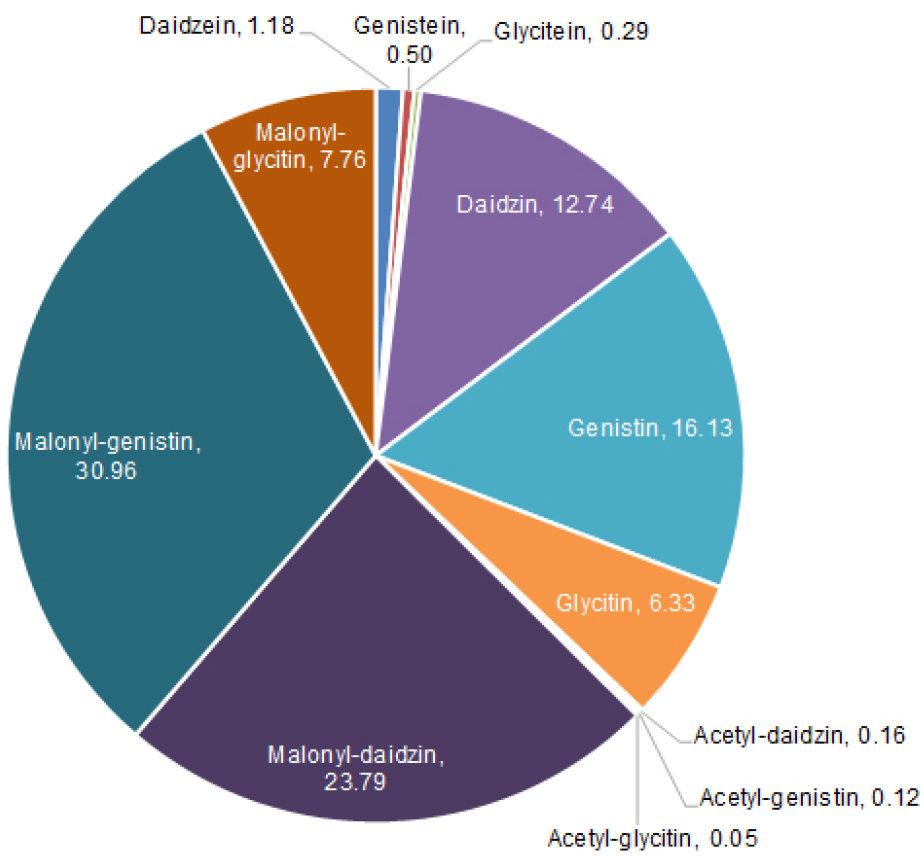
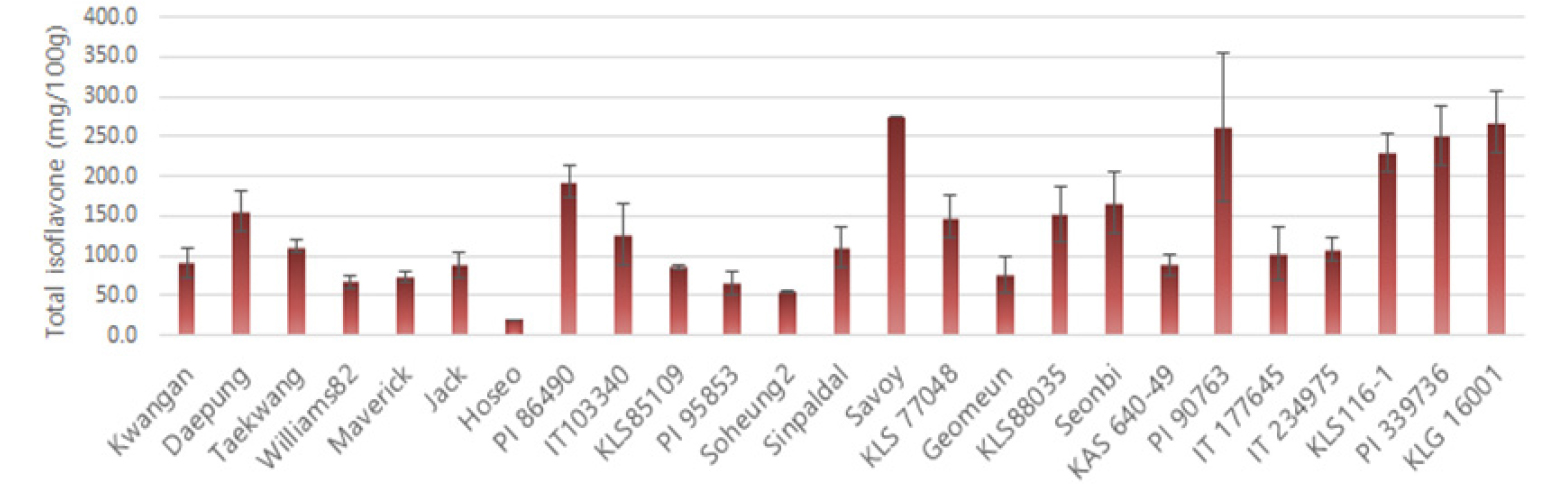
25개 콩 자원들의 완숙 종자내 이소플라본 성분을 분석한 결과, 총 12종의 이소플라본 유도체가 검출되었다(Table 1, Fig. 2). 25개 자원들에서 검출된 12종의 이소플라본 함량의 비율을 분석한 결과, malonyl-genistin이 총 이소플라본 함량의 약 30.96%의 가장 높은 비율을 보였고, 10.17~89.72 ㎎/100g의 분포를 확인할 수 있었다. 콩에서 이소플라본 유도체는 화학적 구조에 따라 당이 결합되지 않은 비배당체(aglycone)와 포도당과 결합된 형태의 배당체(glycoside)(Kudou et al., 1991)로 존재하는데, 본 실험에서 확인된 12종의 이소플라본 중 비배당체에 해당하는 daidzein (1.18%), genistein (0.5%), 그리고 glycitein (0.29%)는 미량으로 확인되었고, 배당체인 malonyl-glucoside형태가 약 62.51%를 차지하였다. 비배당체 형태의 이소플라본은 배당체에 비해 뛰어난 생리활성 작용을 가지는 것으로 보고(Yang et al., 2013)되고 있는데, 본 실험에서 비배당체의 총 함량은 KLG16001에서 약 10.3 ㎎/100g으로 가장 높은 함량을 보였다. 5개 자원들(savoy, PI90763, KLS116-1, PI339736, 그리고 KLG16001)에서 230 ㎎/100g 이상의 고함량 이소플라본 함량이 확인되었고, savoy에서는 276.35 ㎎/100g의 가장 높은 이소플라본 함량을 확인할 수 있었다(Fig. 3). 25개 자원들의 총 이소플라본 함량을 분석한 결과, 자원에 따라 이소플라본의 함량이 다양하게 관찰되어 선행 연구 결과들(Lee et al., 2013; Choi et al., 2020)에서 언급된 바와 같이 이소플라본 함량이 유전적 요인에 기인한다는 것을 확인할 수 있었다.
Table 1.
Analysis of isoflavones content (㎎/100 g) in 25 cultivars of soybean
| Cultivar | Daidzein | Genistein | Glycitein | Daidzin | Genistin | Glycitin |
Acetyl- daidzin |
Acetyl- genistin |
Acetyl- glycitin |
Malonyl- daidzin |
Malonyl- genistin |
Malonyl- glycitin |
| Kwangan |
1± 0.07Z |
0.13± 0.03 |
0.13± 0.01 |
10.85± 1.73 |
10.52± 2.42 |
5.36± 0.69 |
0.15± 0.03 |
0.09± 0.02 |
0.05± 0.01 |
26.14± 5.3 |
29.91± 6.87 |
7.29± 1.21 |
| Daepung |
1.06± 0.23 |
0.3± 0.1 |
0.56± 0.32 |
15.46± 2.9 |
23.97± 5.84 |
12.07± 1.83 |
0.16± 0.04 |
0.16± 0.04 |
0.1± 0.01 |
30.26± 6.46 |
55.97± 12.5 |
16.15± 2.19 |
| Taegwang |
1.66± 0.18 |
0.61± 0.05 |
0.37± 0.01 |
14.32± 1.27 |
16.4± 1.94 |
6.81± 0.49 |
0.19± 0.03 |
0.14± 0.03 |
0.06± 0 |
26.32± 2.73 |
36.99± 2.99 |
8.33± 0.99 |
| Williams82 |
0.85± 0.07 |
0.15± 0.01 |
0.17± 0.03 |
6.69± 1.12 |
9.85± 1.3 |
6.17± 0.74 |
0.05± 0.01 |
0.06± 0.01 |
0.04± 0.01 |
11.36± 2.81 |
24.39± 3.45 |
7.48± 0.82 |
| Maverick |
0.89± 0.08 |
0.24± 0.11 |
0.29± 0.07 |
7.36± 0.69 |
9.92± 1.95 |
8.56± 1.62 |
0.07± 0.01 |
0.07± 0.01 |
0.07± 0.01 |
12.38± 2.68 |
22.11± 3.1 |
11.34± 2.89 |
| Jack |
1.09± 0.2 |
0.48± 0.2 |
0.57± 0.22 |
6.74± 1.51 |
15.16± 3.2 |
8.88± 1.37 |
0.08± 0.01 |
0.14± 0.02 |
0.1± 0.01 |
10.71± 2.79 |
32.21± 5.56 |
12.46± 1.59 |
| Hoseo | 0.710 | 0.040 | 0.040 | 3.350 | 2.310 | 1.260 | 0.030 | 0.020 | 0.010 | 5.320 | 5.550 | 1.640 |
| PI 86490 |
0.8± 0.01 |
0.11± 0.01 |
0.11± 0 |
22.51± 2.62 |
22.09± 3.24 |
13.23± 1.41 |
0.19± 0.03 |
0.11± 0.01 |
0.07± 0.01 |
56.45± 6 |
57.26± 6.17 |
20.58± 1.74 |
| IT103340 |
2.23± 0.58 |
0.93± 0.37 |
0.34± 0.02 |
18.88± 5.79 |
19.99± 7.31 |
6.22± 0.53 |
0.26± 0.1 |
0.16± 0.06 |
0.05± 0.01 |
33.76± 10.83 |
37.72± 12.58 |
7.8± 0.82 |
| KLS85109 |
3.37± 0.19 |
1.64± 0.16 |
0.63± 0.1 |
14.12± 0.52 |
13.74± 0.59 |
4.94± 0.39 |
0.21± 0 |
0.12± 0 |
0.06± 0.01 |
20.42± 1.03 |
21.8± 1.27 |
5.32± 0.47 |
| PI 95853 |
0.69± 0.01 |
0.11± 0.02 |
0.06± 0.01 |
8.11± 0.99 |
11.75± 3.29 |
3.27± 1.03 |
0.07± 0.01 |
0.07± 0.02 |
0.02± 0.01 |
13.34± 2.15 |
24.17± 6.64 |
3.54± 1.04 |
| Soheung2 |
0.74± 0.02 |
0.04± 0 |
0.07± 0.01 |
9.86± 0.21 |
4.5± 0.17 |
4.98± 0.06 |
0.08± 0.01 |
0.03± 0 |
0.02± 0 |
18.61± 1.22 |
10.17± 0.64 |
6.35± 0.18 |
| Sinpaldal |
0.77± 0.11 |
0.16± 0.08 |
0.24± 0.18 |
11.86± 2.76 |
20.44± 5.96 |
9.93± 1.2 |
0.11± 0.03 |
0.13± 0.03 |
0.07± 0.01 |
19.32± 4.88 |
37.16± 8.86 |
11.04± 1.67 |
| Savoy | 2.220 | 1.180 | 0.530 | 39.770 | 60.960 | 10.340 | 0.540 | 0.500 | 0.090 | 60.020 | 89.720 | 10.490 |
| KLS 77048 |
2.37± 0.66 |
1.08± 0.39 |
0.43± 0.15 |
21.9± 3.51 |
28.22± 4.44 |
7.88± 0.56 |
0.34± 0.02 |
0.23± 0.01 |
0.09± 0.02 |
34.47± 9.36 |
43.86± 11.08 |
8.64± 0.28 |
| Geomenu |
0.89± 0.05 |
0.12± 0.04 |
0.07± 0 |
11.45± 2.8 |
8.82± 3.4 |
3.64± 0.9 |
0.1± 0.02 |
0.05± 0.01 |
0.02± 0 |
24.57± 7.44 |
22.25± 8.72 |
4.27± 1.15 |
| KLS88035 |
0.81± 0.07 |
0.12± 0.03 |
0.03± 0.01 |
19.06± 5.13 |
23.44± 4.9 |
2.56± 1.08 |
0.15± 0.04 |
0.1± 0.01 |
0.01± 0.01 |
45.67± 13.49 |
56.8± 10.3 |
3.78± 1.66 |
| Seonbi |
1.05± 0.09 |
0.16± 0.03 |
0± 0 |
25.66± 4.4 |
25.46± 7.77 |
0.05± 0 |
0.21± 0.04 |
0.11± 0.03 |
0± 0 |
57.87± 10.27 |
56.57± 15.71 |
0.01± 0 |
| KAS 640-49 |
1.03± 0.11 |
0.47± 0.15 |
0.48± 0.04 |
8.29± 0.58 |
15.32± 4.83 |
12.73± 1.07 |
0.11± 0.02 |
0.14± 0.04 |
0.15± 0.03 |
11.11± 1.16 |
24.04± 7.47 |
15.06± 1.55 |
| PI 90763 |
2.16± 0.74 |
0.59± 0.29 |
0.73± 0.41 |
31.92± 12.46 |
33.92± 11.68 |
19.22± 3.9 |
0.45± 0.13 |
0.25± 0.05 |
0.16± 0.02 |
75.75± 35.63 |
68.69± 22.45 |
28.21± 6.87 |
| IT 177645 |
0.74± 0.03 |
0.11± 0.05 |
0.08± 0.02 |
10.74± 2.1 |
16.82± 7.08 |
6.66± 1.68 |
0.08± 0.02 |
0.07± 0.03 |
0.03± 0.01 |
21.37± 5.38 |
36.62± 15.22 |
9.27± 2.84 |
| IT 234975 |
1.57± 0.47 |
0.44± 0.18 |
0.59± 0.26 |
16.26± 0.99 |
15.91± 4.26 |
11.77± 1.08 |
0.19± 0.03 |
0.14± 0.04 |
0.09± 0.01 |
24.19± 1.35 |
26.08± 6.47 |
12.01± 0.67 |
| KLS116-1 |
2.88± 0.72 |
0.72± 0.2 |
1.03± 0.43 |
33.77± 3.38 |
36± 4.59 |
19.37± 0.58 |
0.44± 0.04 |
0.28± 0.03 |
0.14± 0.02 |
57.32± 7.58 |
57.96± 8.84 |
20.69± 0.45 |
| PI339736 |
3.47± 1.33 |
2.88± 1.83 |
0.75± 0.32 |
30.34± 5.02 |
47.33± 10.07 |
9.84± 1.16 |
0.5± 0.12 |
0.48± 0.12 |
0.09± 0.02 |
56.52± 7.76 |
87.55± 11.05 |
11.56± 0.99 |
| KLG 16001 |
4.84± 0.95 |
3.97± 1.25 |
1.51± 0.31 |
31.85± 5.12 |
53.07± 11.52 |
18.4± 1.25 |
0.56± 0.08 |
0.55± 0.12 |
0.2± 0.02 |
52.2± 6.34 |
82.53± 13.6 |
19.26± 1.4 |
소야사포닌
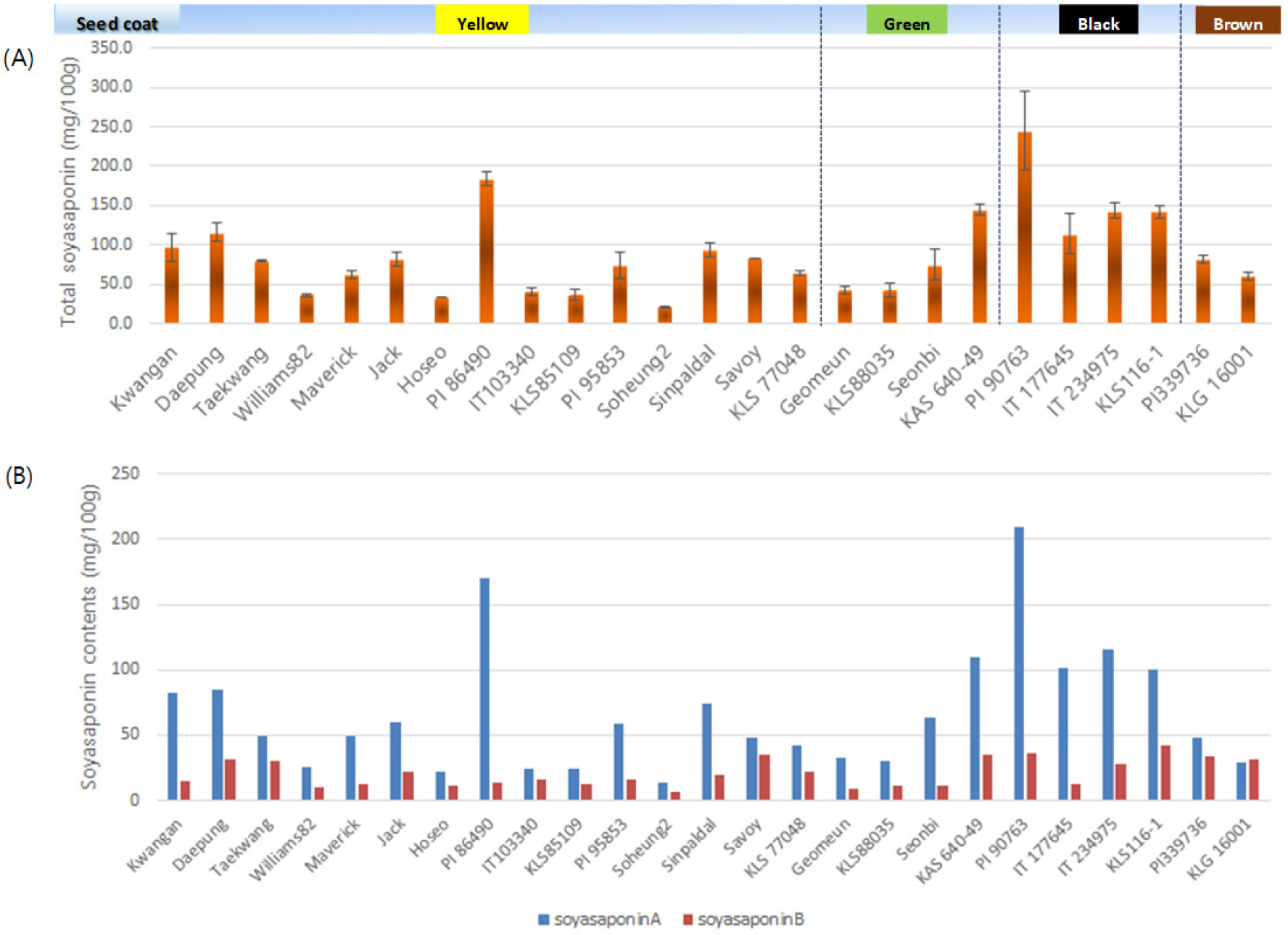
콩 25 자원을 대상으로 소야사포닌 5종에 대한 함량을 분석하였다(Table 2). Soyasaponin Aa와 Ab 함량을 분석한 결과, soyasaponin Aa가 검출된 자원에서는 soyasaponin Ab의 매우 낮은 함량이 관찰되거나 미검출된 반면에, soyasaponin Ab가 검출된 자원에서는 soyasaponin Aa가 검출되지 않았다. Soyasaponin Aa와 Ab는 모두 간기능 강화에 효과적인 group A saponins에 속하며 soyasaponin Aa는 2,3,4-tri-O-acetyl-b-D xylopyranosyl (1→3)-a-L-arabinopyranosyl sugar chain을 가지고 있고, soyasaponin Ab는 2,3,4,6-tetra-O-acetyl-b-D glucopyranosyl (1→3)-a-L-arabinopyranosyl sugar chain을 가지고 있으며 Aa와 Ab 모두 콩의 떪은맛을 유도하는 것으로 알려져 있다(Kuzuhara et al., 2000; Tsukamoto et al., 1993). 또한 soyasaponin group B의 수산기 그룹과 결합한 DDMP saponins는 항암, 항산화 및 당뇨병에 효과적인 작용을 하는 것으로 알려져 있다(Yano et al., 2018). PI90763은 약 209.06 ㎎/100 g의 가장 높은 soyasaponin Aa 함량을 보였고, Daepung은 약 84.39 ㎎/100 g으로 가장 높은 soyasaponin Ab의 함량을 보였다. Group B saponins에 속하는 soyasaponin Ba는 PI90763에서 약 3.49 ㎎/100 g로 가장 높은 함량을 보였고, soyasaponin Bb는 KLS116-1이 약 36,08 ㎎/100g, soyasaponin Bb'는 PI339736에서 약 2.9 ㎎/100g으로 가장 높은 함량을 보였다. 콩 자원별 총 소야사포닌 함량을 분석한 결과는 Fig. 4과 같다. 총 소야사포닌 함량은 PI90763에서 가장 높은 약 246 ㎎/100g의 함량이 확인되었고, Hoseo에서는 가장 낮은 33.12 ㎎/100g의 함량을 보였다(Fig. 4(A)). 또한, soyasaponin group A와 group B의 함량을 분석한 결과, KLG16001을 제외한 모든 자원에서 group A의 함량이 group B의 함량보다 높게 나타났으며(Fig. 4(B)), 이와 동일한 연구 결과는 선행된 연구에서도 보고되었다(Lee et al., 2020). Soyasaponin group A는 PI90763과 PI86490에서 가장 높게 검출되었고, group B의 경우는 KLS116-1과 PI90763에서 가장 높은 함량이 확인되었다. 종피색에 따른 소야사포닌 함량은 Fig. 4(A)와 같이 검은색 종피를 가진 자원들에서 대체적으로 높은 총 소야사포닌 함량이 관찰된 반면에, Kang et al. (2010)의 연구결과에서는 노란콩이 검은콩과 갈색콩에 비해 높은 총소야사포닌 함량을 보였다. 소야사포닌 함량과 종피색의 상관관계를 명확하게 규명하기 위해서는 동일한 재배환경에서 수확한 다양한 종피색을 가진 광범위한 자원들의 소야사포닌 함량 분석이 필요할 것이다.
Table 2.
Analysis of soyasaponins content (㎎/100 g) in 25 cultivars of soybean
| Cultivar | Soyasaponin Aa | Soyasaponin Ab | Soyasaponin Ba | Soyasaponin Bb | Soyasaponin Bb` |
| Kwangan | 0±0z | 82.28±15.7 | 1.31±0.1 | 13.14±2.0 | 0.46±0.1 |
| Daepung | 0±0 | 84.39±7.27 | 2.44±0.22 | 27.66±5.29 | 1.58±0.38 |
| Taegwang | 49.7±1.61 | 0.04±0 | 1.41±0.01 | 27.1±2.36 | 1.47±0.17 |
| Williams82 | 0±0 | 25.77±2.06 | 0.91±0.02 | 9.11±0.6 | 0.45±0.02 |
| Maverick | 0±0 | 49.33±3.06 | 1.17±0.17 | 11.14±2.04 | 0.48±0.12 |
| Jack | 0±0 | 60.38±8.95 | 2.0±0.12 | 19.12±1.22 | 1.12±0.05 |
| Hoseo | 0.00 | 21.61 | 2.44 | 7.87 | 1.19 |
| PI 86490 | 169.89±6.81 | 0.24±0.03 | 1.64±0.2 | 11.29±1.35 | 1.32±0.05 |
| IT103340 | 0±0 | 24.53±4.08 | 1.16±0.05 | 14.26±0.77 | 0.88±0.16 |
| KLS85109 | 0±0 | 24.9±5.44 | 1.26±0.17 | 10.21±1.29 | 0.84±0.18 |
| PI 95853 | 0±0 | 58.34±13.84 | 1.02±0.12 | 14.63±2.4 | 0.86±0.2 |
| Soheung2 | 0±0 | 13.83±0.43 | 0.66±0.06 | 5.66±1.17 | 0.38±0.07 |
| Sinpaldal | 0±0 | 74.73±4.53 | 2.19±0.41 | 16.56±3.74 | 0.87±0.27 |
| Savoy | 0.00 | 48.41 | 1.79 | 30.91 | 2.60 |
| KLS 77048 | 42.75±5.89 | 0.037±0.01 | 1.45±0.17 | 18.62±2.09 | 1.57±0.04 |
| Geomenu | 0±0 | 33.04±3.55 | 0.76±0 | 8.63±0.99 | 0.22±0.03 |
| KLS88035 | 30.74±7.91 | 0±0 | 0.49±0.08 | 10.15±0.67 | 0.56±0.12 |
| Seonbi | 63.30±18.03 | 0.04±0.02 | 0.71±0.07 | 10.33±1.92 | 0.65±0.16 |
| KAS 640-49 | 109.14±4.99 | 0.13±0.01 | 3.16±0.13 | 29.99±2.66 | 1.85±0.12 |
| PI 90763 | 209.06±54.15 | 0.38±0.14 | 3.49±1.16 | 31.01±9.12 | 2.04±0.71 |
| IT 177645 | 101.42±23.59 | 0.1±0.05 | 1.06±0.1 | 10.8±1.37 | 0.54±0.15 |
| IT 234975 | 0.01±0.01 | 115.57±10.72 | 1.95±0.27 | 24.37±6.12 | 1.52±0.37 |
| KLS116-1 | 100.08±1.8 | 0.12±0.06 | 4.38±1.11 | 36.08±7.95 | 2.06±0.52 |
| PI339736 | 0±0 | 48.55±6.48 | 2.76±0.2 | 27.95±1.39 | 2.9±0.32 |
| KLG 16001 | 0±0 | 29.16±0.56 | 1.56±0.2 | 27.86±3.9 | 1.72±0.35 |
콩 25개 자원들의 이차대사산물 함량
콩 25 자원들에 대한 다양한 이차대사산물의 함량을 분석하여 자원을 선발한 결과는 Fig. 4와 같다. 총 카로티노이드 함량을 분석한 결과, Fig. 5(A)와 같이 IT177645, PI90763, 그리고 IT234975에서 가장 높은 함량을 보였고, 총 이소플라본 함량(Fig. 5(B))은 Savoy, PI90763, KLG16001에서 높게 확인되었다. 또한 총 소야사포닌 함량은 PI90763, PI86490, 그리고 IT234975에서 가장 높은 함량을 보였다(Fig. 5(C)). 총 카로티노이드 고함량 자원들은 모두 검은색 종피를 가지고 있으며, PI90763은 3종의 모든 이차대사산물을 고함량으로 보유한 자원으로 확인되었다. 콩의 종피색과 이차대사산물의 상관관계는 다양한 연구에서 보고된 바 있다(Choi et al., 2020; Kang et al., 2010; Monma et al., 1994). 본 실험의 결과, 검은 종피색을 가진 자원들에서 이차대사산물들의 높은 함량을 확인할 수 있었다. 콩은 전통적인 단백질 공급원으로 다양한 생리활성을 가진 이차대사산물의 함량이 풍부한 작물로 널리 알려져 있다(Lee et al., 2013). 본 연구에서는 콩 25개 자원들의 이차대사산물 함량을 분석하여 고함량 자원을 선발하였으며, 향후 이들 자원의 농업 형질을 분석하여 고기능성 품종 개발을 위해 육종에 활용할 예정이다. 이를 통해 콩의 새로운 고부가가치 자원 발굴 및 산업적 활용도 제고에 기여할 것이다. 또한, 콩의 이차대사산물 생합성에 관여하는 메커니즘 규명을 위한 기초 정보 및 재료를 제공할 수 있을 것으로 사료된다.
적 요
콩(Glycine max (L.) Merr.)은 전세계적으로 널리 재배되고 있는 고단백 유지 작물로서 다양한 생리활성을 가지는 이차대사산물을 함유하고 있다. 본 연구에서는 콩 25개 자원들을 대상으로 카로티노이드, 이소플라본, 그리고 소야사포닌 함량을 분석하였다. 총 카로티노이드 함량을 분석한 결과, 1.23~33.78 ㎍/g의 분포를 보였고, IT177645, PI90763, 그리고 IT234975과 같은 검은 종피색을 가진 자원들에서 가장 높은 카로티노이드 함량이 관찰되었다. 이소플라본 함량은 Savoy, PI90763, KLG16001에서 높게 확인되었고, 소야사포닌은 PI90763, PI86490, 그리고 IT234975에서 가장 높은 함량을 보였다. PI90763은 카로티노이드, 이소플라본, 그리고 소야사포닌 3종 모두를 고농도로 함유한 자원으로 확인되었다. 본 실험의 결과, 다양한 이차대사산물의 고함량 자원들은 고기능성 품종 개발을 위한 육종 소재 및 이차대사산물의 생합성 관련 연구를 위한 기초자료로써 활용이 가능할 것이다.