서 언
재료 및 방법
세잎쥐손이풀 추출물 제조
세포배양 및 분화유도
MTT assay
Lipid accumulation 측정
Triglyceride contents
Western blot
통계처리
결과 및 고찰
MTT assay
Lipid accumulation 측정
세포내 triglyceride contents
Western blot을 이용한 단백질 발현
적 요
서 언
비만은 과다하게 섭취되는 에너지와 소비되지 못하는 에너지 사이의 불균형으로 인한 잉여 에너지가 체지방조직에 과다하게 축적되는 상태를 의미한다(Kang et al., 2019; Lee et al., 2014). 비만으로 인해 당뇨병, 지방간, 심혈관질환, 근골격계 질환 및 우울증 등의 질환 발생을 증가시켜 삶의 질 저하, 사회성 저하, 실업 등의 다양한 사회적 문제를 야기한다(Blüher, 2019; Choi et al., 2020; Yu et al., 2022).
급속한 경제성장으로 인한 생활패턴 변화와 흡연, 음주, 에너지 과잉섭취에 의해 비만 환자가 증가하였으며, 특히 코로나19 이후 실외 활동이 줄고 실내에서의 활동이 늘어나면서 비만 환자가 늘어나고 있다. 2022년 질병관리청에서 발표한 국민건강영양조사 기반의 성인 비만 심층보고서에 따르면 국내 19세 이상 성인의 비만 유병율은 2008년 31.1%에서 2021년 기준 37.1%로 증가하였으며, 특히 남성은 2008년 35.9%에서 2021년 44.8%로 비만 유병률의 증가가 확인되어 비만의 예방 및 치료의 중요성이 강조되고 있다.
비만의 예방 및 치료를 위하여 식이조절, 운동, 생활 습관 개선 및 약물 등이 있으나 장기간의 치료 및 지속적인 관리가 필요한 실정이다. 비만치료제의 경우 구토, 설사, 소화기장애와 같은 부작용이 보고되면서 안전성이 확보된 비만 치료제의 필요성이 대두되고 있다(Kim and Kim, 2018). 천연물은 약물과 비교해 부작용이 없으며 폴리페놀 등과 같은 다양한 성분을 함유하고 있어 다중 효능을 나타내는 경우가 많아 현재 천연물에 대한 연구가 활발히 진행되고 있다(Kim and Kim, 2018). 식품의약품안전처에 등재된 기능성 원료 중 체지방감소 소재로는 보이차추출물, 시서스추출물, 와사비잎추출물, 가르시니아캄보지아 껍질 추출물 등 2023년 현재 39종이 등재되어 있으며, 소비자의 needs와 소비 트렌드에 부합하여 체지방감소 개별인정형 건강기능식품은 꾸준히 개발이 이어지고 있다.
세잎쥐손이풀(Geranium wilfordii Maxim.)은 쥐손이풀과로 다년생 초본으로 일본, 중국, 한국에 주로 분포하며 주로 산비탈, 초지, 길가에서 서식한다(Feng et al., 2022). 세잎쥐손이풀에는 corilagin, geraniin, gallic acid, ellagic acid 및 myricetrin 등을 함유하고 있음이 보고되었다(Liu et al., 2020; Liu et al., 2011). 세잎쥐손이풀의 corilagin은 항산화제, 항고혈압제 및 항감염제를 포함하여 광범위한 생리 활성이 있음이 보고되어 있으며, geraniin도 높은 항산화 활성을 가지고 있음이 보고되어 있다(Liu et al., 2020; Liu et al., 2011). 세잎쥐손이풀은 항산화, 항고혈당, 항염증 및 항종양활성과 같은 다양한 생리활성이 보고되고 있지만 항비만 효과에 대한 연구는 전무한 상황이다(He et al., 2022). 본 연구에서는 세잎쥐손이풀 추출물이 지방세포내 lipid accumulation 및 triglyceride 함량에 미치는 영향과 adipogenesis를 조절하는 peroxisome proliferator-activated receptor-gamma (PPAR γ), CCAAT/enhancer binding protein-α (C/EBPα), lipogenesis를 조절하는 fatty acid synthetase (FAS), stearoyl CoA desaturase-1 (SCD-1) 및 체내 항상성을 조절하는 AMP-activated protein kinase (AMPK) 단백질 발현에 미치는 영향을 확인하였으며, 세잎쥐손이풀의 체지방 감소 건강기능식품 소재 가능성을 확인하고자 하였다.
재료 및 방법
세잎쥐손이풀 추출물 제조
실험에 사용된 세잎쥐손이풀은 대한민국 경상북도 영천시에서 채취하였으며, 용매에 따라 성분 및 효능에 차이가 있어(Jin et al., 2012; Lee et al., 2019) 물 추출(NG-GT-T1L), 10% 에탄올 추출(NG-GT-T2L), 30% 에탄올 추출(NG-GT-T3L), 50% 에탄올 추출(NG-GT-T4L), 70% 에탄올 추출(NG-GT-T5L) 조건으로 추출하였다. 세잎쥐손이풀 추출은 무게 대비 10배의 추출용매를 넣고 60℃에서 6시간 동안 shaking incubator를 이용하여 추출하였다. 6시간 추출 후 3,000×g에서 20분간 원심분리하고 상층액을 whatman filter paper (Whatman International, Maidstone, UK)로 여과한 후, 감압농축기(Eyela SB-1000, Tokyo, Japan)로 농축하여 동결건조기(FD 8508, Ilshin, Korea)로 건조하여 실험 시료로 사용하였다.
세포배양 및 분화유도
3T3-L1 preadipocyte는 American Type Culture Collection (ATCC, Manassas, USA)로부터 구입하였다. 3T3-L1은 10% bovine calf serum (Welgene, Daegu, Korea)과 1% penicillin-streptomycin (Welgene, Daegu, Korea)이 첨가된 dulbecco’s modified eagle’s medium (DMEM, Welgene, Daegu, Korea) 배지를 사용하여 37℃, 5% CO2 조건에서 배양하였다.
3T3-L1 지방전구세포를 지방세포로 분화시키기 위해 6 well plate에 5×105 cell/well의 세포를 분주 후 세포가 완전히 밀집되게 배양하였으며, 2일을 더 배양한 후 분화유도 시약을 처리하였다. 분화유도 시약은 0.5 mM 3-isobutyl-1-methylxanthine (IBMX), 0.5 μM dexamethasone, 10 ㎍/mL insulin을 포함하는 MDI solution과 10% FBS가 포함된 DMEM 배지에서 2일 동안 배양하여 분화를 개시한 다음 10 ㎍/mL insulin 및 10% FBS가 포함된 DMEM 배지로 교환하여 2일 동안 분화시켰다. 이후로는 10% FBS만을 포함된 DMEM 배지에서 4일 동안 배양하여 세포 내 지방축적에 의해 지방구(lipid droplet)를 형성하는 지방세포로 분화를 완료하였다.
MTT assay
세잎쥐손이풀 추출물이 3T3-L1 지방세포에서 독성이 나타나는지 확인하고자 MTT assay로 측정하였다. 세포를 96 well plate에 1×105 cells/mL로 100 μL씩 분주하고 24시간 배양한 뒤 serum이 첨가되지 않은 배지에 세잎쥐손이풀 추출물을 농도별로 희석하여 세포에 처리하였다. 24시간 후 세잎쥐손이풀을 포함한 배양배지를 제거하고, MTT (0.5 ㎎/mL)를 배양한 배지에 녹여 100 μL씩 각각 분주한 뒤 37℃에서 4시간 동안 배양 후 배양배지를 제거하였다. 각 well에 형성된 formazan에 DMSO 100 μL 용해하고 30분 후 UV/vis spectrophotometer (Opiwen 2120UV plus, Mecasys Co. Ltd., Korea)를 사용하여 570 ㎚에서 흡광도를 측정하였고, 대조군의 흡광도 값을 기준으로 세포독성을 확인하였다.
Lipid accumulation 측정
세잎쥐손이풀 추출물의 처리에 따른 3T3-L1 지방세포 분화 및 그 과정에 있어 지방축적에 대한 영향을 확인하기 위하여 oil red O stain의 방법을 이용해 분석하였다. 3T3-L1 세포 분화유도시 MDI solution 및 배지 교환시마다 실험 소재를 동시에 처리해 분화유도가 완료되는 시점까지 배양하였다. 분화유도 완료 후 세포를 PBS로 2회 세척하고, 10% formalin을 처리하여 4℃ 냉장에서 1시간 동안 고정시킨 뒤 증류수로 세척하고, 60% isopropanol solution을 처리해 지방세포를 염색하였다. 염색이 완료된 세포는 PBS로 세척하고, 100% isopropanol을 이용해 oil red O를 용출한 뒤 520 ㎚에서 흡광도를 측정하여 대조군과 lipid accumulation을 비교하여 확인하였다.
Triglyceride contents
Triglyceride contents 측정을 위해 EZ-Triglyceride Quantification Assay Kit를 사용하여 분석하였다. 3T3-L1 세포 분화유도시 MDI solution 및 배지 교환시마다 세잎쥐손이풀을 농도별로 동시에 처리해 분화유도 완료시까지 배양하였다. 분화유도가 완료된 세포는 PBS로 2회 세척하고, NP40을 이용해 균질한 뒤 100℃에서 가열해 세포내에 존재하는 triglyceride을 용해한 후 13,000 rpm에서 2분간 원심분리하여 불용성 물질을 제거하였다. Lysate 및 standard는 96 well plate에 50 μL와 lipase 2 μL를 넣어주고, 실온에서 20분간 반응시킨 뒤 triglyceride assay buffer 46 μL, triglyceride enzyme mix 2 μL, triglyceride probe 2 μL를 각각 넣어준 뒤 실온에서 30분간 반응시킨 뒤 570 ㎚에서 흡광도를 측정해 대조군과 비교해 triglyceride 함량을 확인하였다.
Western blot
분화가 완료된 3T3-L1 지방세포에 세잎쥐손이풀을 30㎍/mL, 60㎍/mL, 90㎍/mL 농도로 처리하고 24시간 배양하였다. 배양이 완료된 세포는 cell scraper로 긁어 모으고, 5,000 rpm에서 10분간 원심분리하고 RIPA buffer를 이용해 lysis하였다. Lysis된 세포는 bradford 방법으로 정량한 동일양의 단백질을 sodium dodecyl sulfate (SDS)와 β-mercapto-ethanol를 포함한 sample buffer에 3:1로 혼합한 후 100℃ 에서 10분간 가열하였다. 단백질 샘플은 SDS-PAGE로 전기영동한 후 polyvinylidene fluoride membrane (0.45㎛, PVDF transfer membrane, Thermo, Rockford, IL, USA)으로 transfer하였다. Membrane은 0.1% tween 20과 5% skim milk를 함유한 tris-buffered saline (TBS)에 2시간 동안 blocking하였다. 그 후 PPARγ (1:1000), C/EBPα (1:1000), FAS (1:1000), SCD-1 (1:1000), AMPK (1:1000), β-actin (1:2000) (Cell signaling technology, danvers, MA, USA), 1차 antibody가 첨가된 buffer에서 overnight 반응하고 TBS-T (TBS containing 0.1% tween 20)로 5분씩 3회 세척하였다. 그런 다음 horseradish peroxidase-conjugated secondary antibody (1:1000) (Santa Cruz Biotechnology, Santa Cruz, CA, USA)가 첨가된 buffer에서 1시간 동안 반응한 후 enhanced chemiluminescence method를 이용하여 x-ray 필름에 감광시켰다. Detection된 밴드의 강도는 image J (National institutes of health, Bethesda, MD, USA) 소프트웨어를 이용하여 분석하였다.
통계처리
통계처리는 SAS (statistical analysis system) program을 사용하여 각각의 시료에 대한 평균±표준편차로 나타내었으며, 각 군의 평균치의 통계적 유의성을 p<0.05 수준에서 ANOVA test 및 Duncan’s multiple range test로 사후분석 후 유의성을 검정하였다.
결과 및 고찰
MTT assay
세잎쥐손이풀 추출물이 3T3-L1 preadipocyte에 미치는 독성을 확인하기 위해 온도와 추출용매를 달리한 추출물 5종을 농도별로 3T3-L1 세포에 처리하고, 24시간 후 MTT assay를 통해 확인한 결과는 Fig. 1과 같다. 세잎쥐손이풀 추출물을 3T3-L1 preadipocyte에 100, 250, 500, 1000 ㎍/mL 농도로 24시간 배양하였을 때 NG-GT-T1L, NG-GT-T2L, NG-GT-T3L, NG-GT-T4L, NG-GT-T5L 모두 500 ㎍/mL로 처리하였을 때 80% 이하의 세포생존률을 나타내어 preadipocyte에 독성을 나타내는 것이 확인되었다.
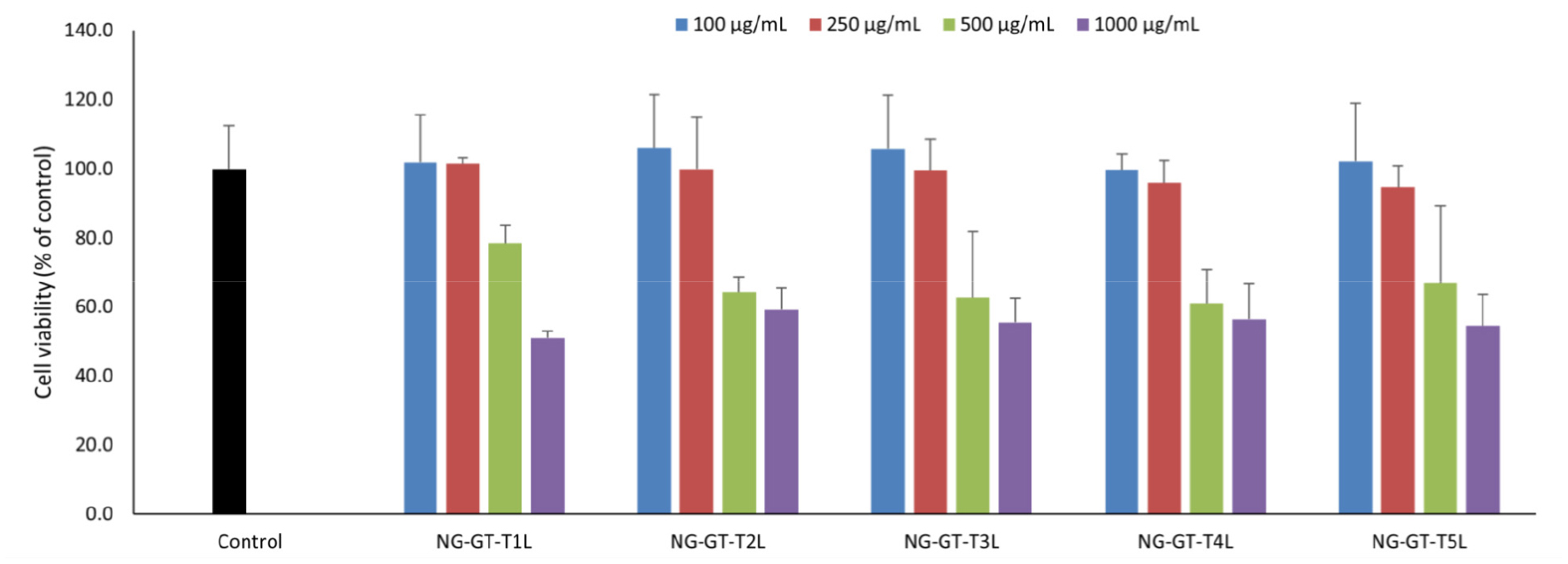
Fig. 1.
Concentration-dependent effects of Geranium wilfordii Maxim. extract on 3T3-L1 cell viability. Cell viability was analyzed using MTT assay. Values expressed are mean±SD of triplicate measurements. Values with different superscripts in column are significantly different (P<0.05) by Duncan’s multiple range test.
Lipid accumulation 측정
3T3-L1 지방전구세포(preadipocytes)는 증식 및 분화를 통해 지방세포(adipocytes)가 되는 세포주로 adipogenesis 및 lipogenesis에 대한 유전자 발현 연구가 가능하다(Lee and Lee, 2016). 세잎쥐손이풀 추출물이 지방축적에 미치는 영향을 확인하기 위해 3T3-L1 지방전구세포를 지방세포로 분화유도하고, 분화유도하는 과정에 세잎쥐손이풀을 농도별로 처리하였다. 분화가 완료된 3T3-L1 전구세포의 lipid droplet 형성에 관한 영향을 확인한 결과는 Fig. 2와 같다.
실험결과 추출 조건별로 세포내 lipid accumulation 억제 효능을 확인하였으며, 추출물 중 NG-GT-T3L에서 가장 높은 세포내 lipid accumulation 억제 효능을 보이는 것으로 확인하였다. NG-GT-T3L의 효능 검증을 위해 세포내 triglyceride, western blot 실험으로 세잎쥐손이풀 NG-GT-T3L 추출물의 항비만 효능을 검증하였다.
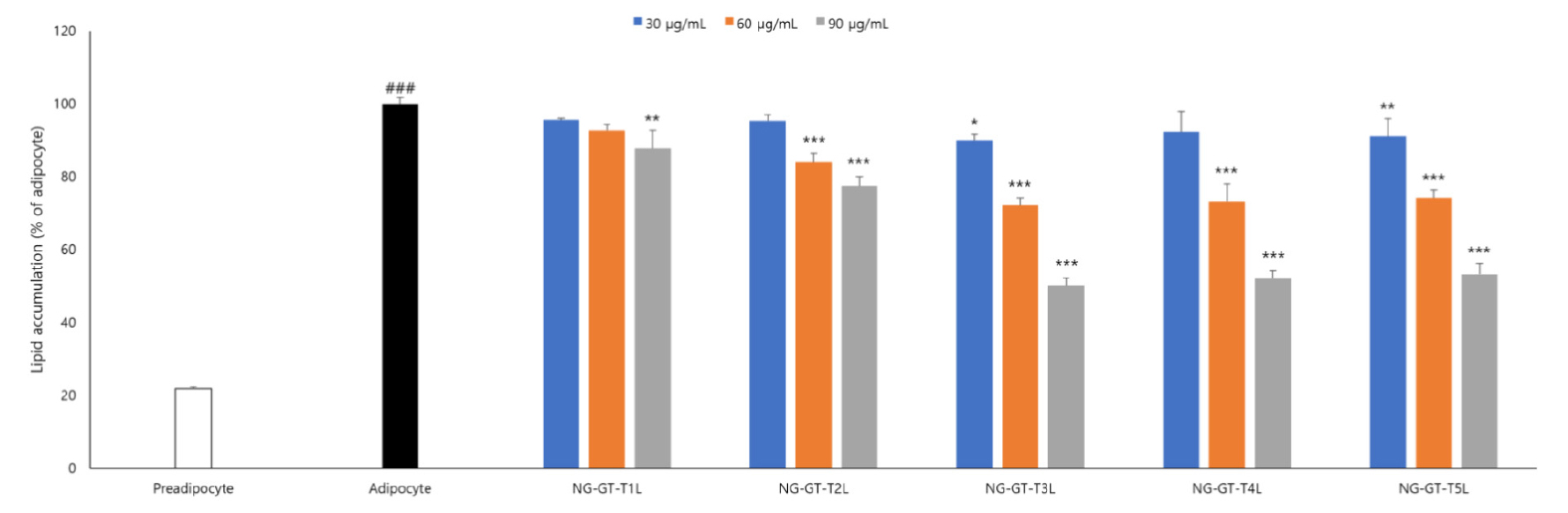
Fig. 2.
Geranium wilfordii Maxim. extract treatment inhibits lipid accumulation in 3T3-L1 adipocytes. Values expressed are mean±SD of triplicate measurements. Values with different superscripts in column are significantly different (P<0.05) by Duncan's multiple range test. ###p <0.001, when compared to the preadipocyte. *p <0.05, **p <0.01 and ***p <0.001, when compared to the adipocyte.
세포내 triglyceride contents
Triglyceride는 글리세롤과 지방산으로 구성되며 체내에 중요한 에너지원이지만 과도하게 생성될 경우 비만 및 고지혈증의 원인이 된다(Lee et al., 2020).
세잎쥐손이풀 추출물이 지방세포 분화유도과정의 triglyceride 축적에 미치는 영향을 확인하기 위해 3T3-L1 지방전구세포를 지방세포로 분화유도하고, 분화유도하는 과정에 세잎쥐손이풀을 농도별로 처리하였으며, 분화가 완료된 세포내 triglyceride contents를 측정한 결과는 Fig. 3과 같다.
실험결과 세잎쥐손이풀 추출 조건별로 세포내 triglyceride 축적 억제 효능이 있음을 확인하였으며, 그 중 NG-GT-T3L에서 가장 높은 세포내 triglyceride 축적 억제 효능을 보이는 것으로 확인하여 세잎쥐손이풀 NG-GT-T3L 추출물의 항비만 효능을 검증하였다.
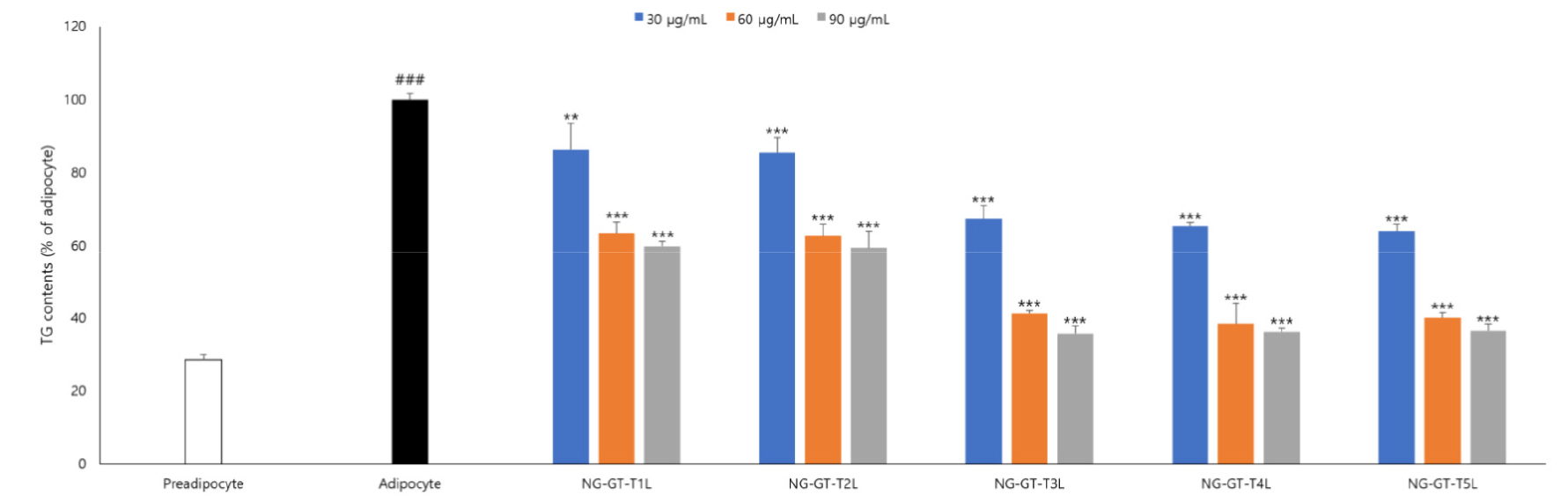
Fig. 3.
Geranium wilfordii Maxim. extract treatment inhibits cellular triglyceride contents in 3T3-L1 adipocytes. Values expressed are mean±SD of triplicate measurements. Values with different superscripts in column are significantly different (P<0.05) by Duncan's multiple range test. ###p <0.001, when compared to the preadipocyte. **p <0.01 and ***p <0.001, when compared to the adipocyte.
Western blot을 이용한 단백질 발현
세잎쥐손이풀 추출물의 lipid accumulation 및 triglyceride 축적억제 실험결과 NG-GT-T3L 추출물이 가장 높은 효능을 나타냈으며, 3T3-L1 지방세포에서 NG-GT-T3L 추출물의 지방세포 분화유도 및 지방 합성 대사에 미치는 영향을 확인하기 위해 adipogenesis를 조절하는 PPARγ, C/EBPα와 lipogenesis를 조절하는 FAS, SCD-1 및 AMPK 단백질 발현에 미치는 영향을 확인한 결과는 Fig. 4와 같다.
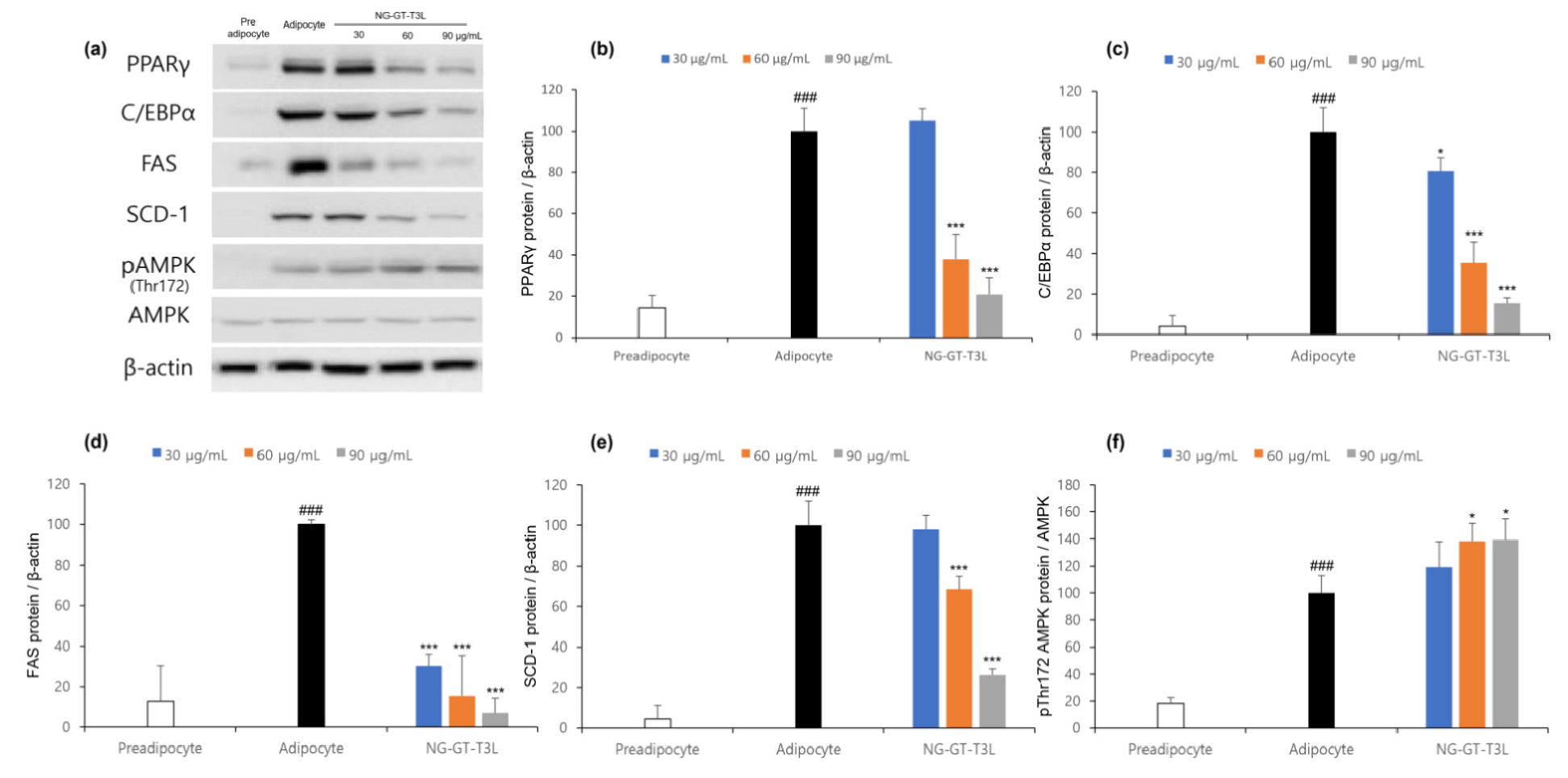
Fig. 4.
Effect of Geranium wilfordii Maxim. extract on lipolysis-related protein expression. (a) western blot band, (b) PPARγ, (c) C/EBPα, (d) FAS, (e) SCD1, (f) pThr172 AMPK/AMPK analyzed by Image J. Values expressed are mean±SD of triplicate measurements. Values with different superscripts in column are significantly different (P<0.05) by Duncan's multiple range test. ###p <0.001, when compared to the preadipocyte. *p <0.05 and ***p <0.001, when compared to the adipocyte.
지방전구세포의 adipogenesis와 관련 주요한 인자 중 PPARγ는 지방세포 유전자 발현 및 분화 조절에 중심적인 역할을 하는 핵 호르몬 수용체이며, 분화 초기 C/EBPβ 및 C/EBPδ의 증가에 따라 PPARγ의 발현이 활성화된다. PPARγ의 과발현은 과도한 지방형성을 초래하게 되며 PPARγ 조절을 통해 대사성 관련 질병의 치료나 예방을 탐구하는 연구가 진행되고 있다(Rosen et al., 1999). 그리고 C/EBPα는 지방전구세포를 성숙한 지방세포로 분화시키는데 관여하며 주로 간, 장 조직 또는 지방에서 발현되는 지방세포의 특이적 인자로 다면발현성의 전사 활성인자로 알려져 있다(Zuo et al., 2006). NG-GT-T3L 처리를 통해 세포내 adipogenesis 조절 인자인 PPARγ와 C/EBPα 단백질 발현을 억제시킴으로 지방세포 생성 억제 및 축적을 감소시킬 수 있을 것으로 판단된다.
Lipogenesis는 다양한 인자들에 의해 조절된다. FAS는 간, 지방조직, 근육 등에서 지방산 및 글리세롤을 합성하여 중성지방을 생성한다(Ranganathan et al., 2006; Wang et al., 2004). SCD-1은 palmitate (C16:0)와 stearate (C18:0)를 단일 불포화 유도체인 pamitoleate (C16:1)와 oleate (C18:1)로 변환하는 효소이며, 생체 내에서 불포화지방산 합성 속도조절에 관여하는 효소이다(Martín-Núñez et al., 2013; Rizki et al., 2006). NG-GT-T3L 처리를 통해 세포내 lipogenesis 조절 인자인 FAS와 SCD-1 단백질 발현을 억제시킴으로 유리지방산 합성을 억제시켜 세포내 중성지방 전환 및 축적을 감소시킬 수 있을 것으로 판단된다.
AMPK는 세포 내의 에너지 항상성 유지에 센서 역할을 하는 효소로 당과 지방의 대사에 있어 중요한 역할을 하는 것으로 보고되었다(Kim et al., 2016). AMPK는 acetyl-CoA carboxylase (ACC)를 인산화함으로써 지방산 합성을 억제하고 전사 인자 sterol-regulatory element binding protein 1c (SREBP1c)의 작용 감소를 통해 FAS, SCD-1 및 ACC를 포함한 지방 생성 유전자의 발현을 억제하여 항비만 효과를 나타낸다(Han et al., 2019; Kim et al., 2011). NG-GT-T3L 처리를 통해 세포내 AMPK 인산화를 증가시킴으로 지방산 합성 억제, 지방생성 억제 등의 조절이 가능할 것으로 판단된다.
본 연구는 추출용매에 따른 세잎쥐손이풀 추출물의 lipid accumulation, triglyceride contents를 통한 지질형성에 미치는 효능과 adipogenesis 및 lipogenesis 단백질 발현에 미치는 영향을 확인하여 세잎쥐손이풀 추출물이 세포내 중성지방을 조절하는 소재임을 확인 할 수 있었다. 본 연구와 유사한 체지방감소에 도움을 주는 건강기능식품원료인 시서스 추출물은 adipogenesis 관련 유전자인 PPARγ, C/EBPα, aP2, LPL과 lipogenesis 관련 유전자인 FAS, ACC, SCD-1를 조절하여 지방산 및 triglyceride의 합성을 감소시켜 항비만 효과가 있음이 보고되어있다(Lee et al., 2018). 따라서 세잎쥐손이풀 추출물의 실험결과에서 지질조절효능이 확인되어 향후 in vivo 및 임상시험을 수행함으로써 세잎쥐손이풀 추출물이 체지방감소에 도움을 주는 건강기능식품 소재로서의 개발이 가능할 것으로 사료된다.
적 요
본 연구는 추출용매에 따른 세잎쥐손이풀 추출물의 중성지방 조절에 대한 논문으로 3T3-L1 지방전구세포를 이용해 지방세포로 분화유도한 뒤 lipid accumulation, triglyceride contents, PPARγ, C/EBPα, FAS, SCD-1 및 AMPK 단백질 발현을 확인하였다. 실험결과 다섯가지 조건의 세잎쥐손이풀 추출물 중 NG-GT-T3L lipid accumulation과 triglyceride contents의 가장 높은 억제 효능을 확인하였다. NG-GT-T3L 추출물의 세포내 지방 축적 억제는 지방세포 내 adipogenesis와 lipogenesis를 조절하는 효소 조절을 통해 나타난 결과로 판단된다. 따라서 세잎쥐손이풀 추출물은 PPARγ, C/EBPα, FAS, SCD-1를 억제시키고, AMPK를 증가시켜 세포내 중성지방을 조절함으로서 체지방 감소 후보 소재로의 사용이 가능할 것으로 사료된다.




