서 언
재료 및 방법
꽃잎 배양
캘러스 배양
Real-time reverse transcription quantitative polymerase chain reaction (RT-qPCR) 분석
결과 및 고찰
적 요
서 언
장미는 국내 절화류 판매액의 29.6%, 재배면적의 19.5%를 차지하는 비중 있는 절화로서 뿐만 아니라 정원용이나 분화용으로도 사용되는 주요 화훼 작목이다(MAFRA, 2021). 그러나, 다른 화훼 작목과 마찬가지로 2005년 이후 생산량이 감소하고 있어 소비자 기호에 적합한 국내 신품종 육성 및 영역 확장을 통한 산업 확대 필요성이 대두되고 있다.
식물에서 체세포 배발생과정을 통한 재분화 기술은 주로 대량증식(Kim et al., 2008)이나 형질전환체 개발(Lee et al., 2020; 2022)에 활용되고 있다. 장미, 호접란 등 다양한 화훼 작목의 잎, 뿌리 등의 절편체로부터 체세포 배발생 유도에 관하여 보고된 바 있다(Chen et al., 2019). 또한 체세포 유래의 배 또는 캘러스 추출물은 피부에 부작용이 적고 항산화 및 피부장벽 효과가 확인되었을 뿐 아니라 안정적으로 원료 공급이 가능하다는 장점 등이 있어 화장품 분야에서 주목받고 있다(Eibl et al., 2018). 더욱이 향기 꽃잎 유래의 캘러스나 체세포배 발생 캘러스는 화장품 소재로서 공급 수요가 증대하고 있는 바 장미의 적용 가능성에 대한 검토가 필요한 실정이다. 특히 장미는 옛부터 향장품 소재로 이용되고 있으므로 장미의 꽃잎에서 체세포배발생 캘러스나 캘러스 유도 또는 캘러스 추출물의 기능성 성분 증가 등의 연구가 필요할 것이다. Darwish and Ahmed (2020)는 중요한 장미 에센셜 오일 생산 원료로 주로 이용되는 Rosa damascena 꽃잎 유래 캘러스로 부터 phenolic 화합물 생산시 glycine 등 6종의 abiotic and biotic elicitors 등과 jasmine oil 첨가가 대조구 대비 37.2~153.3% 증가하였다고 보고하였다. 그러나, 장미에서 체세포 유래의 배발생 캘러스 유도 여부는 품종에 따라 다른 것으로 알려져 있다(Marchant et al., 1996), 본 연구팀에서는 장미 기내뿌리로부터 체세포배 발생 캘러스 유도 기술을 확립하였으며(Lee et al., 2011), 내건성 및 내충성 형질전환체 개발을 위한 재료로서 활용한 바 있다(Lee et al., 2020; 2022). 그러나, 현재까지 장미 꽃잎으로부터 체세포배 발생 캘러스 유도 연구 보고는 없다.
국립원예특작과학원에서는 1992년에 본격적으로 장미 품종육성 연구가 시작된 이후 2021년까지 약 100여 품종을 개발하였고, 이중 ‘Mihyang’ 등 13품종은 향기가 강한 품종이다(KSVS, 2022). 따라서, 본 연구에서는 국내 육성 장미 품종 꽃잎으로부터 형질전환 재료 및 화장품 산업 소재로 활용 가능한 체세포배발생 캘러스 유도 기술을 확립하고자 하였다.
재료 및 방법
꽃잎 배양
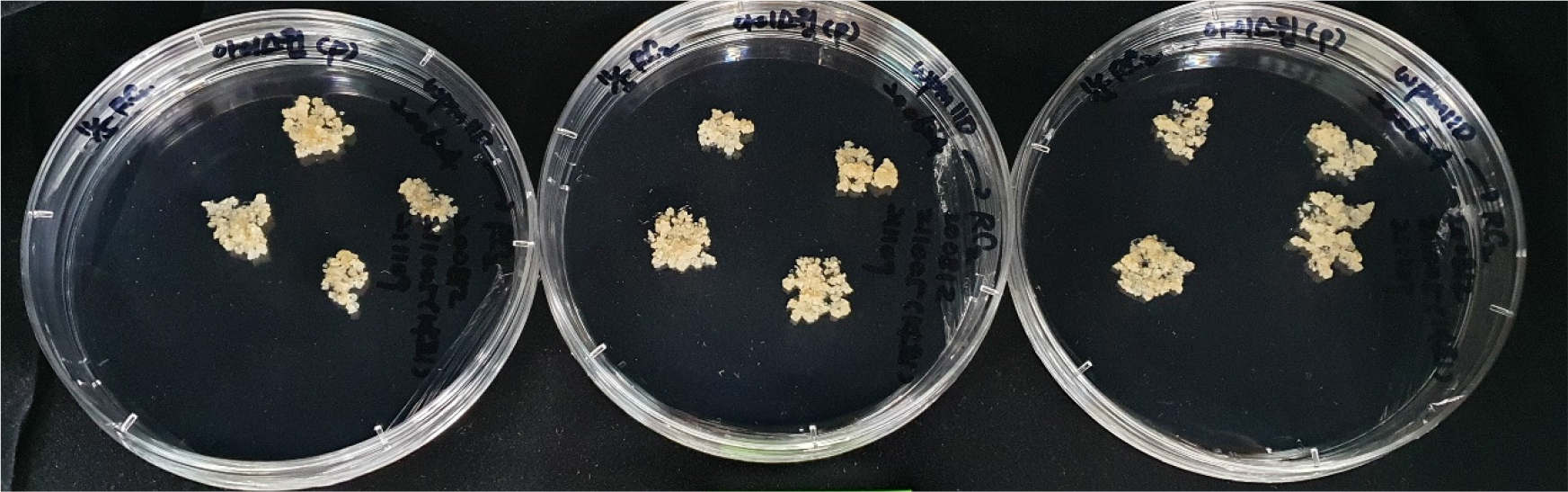
국립원예특작과학원 유리온실에서 만개한 국내 육성 장미 3품종(‘Orange Eye’, ‘Ice Wing’, ‘Pink Beauty’) 꽃잎을 흐르는 물에 세척후 1% NaOCl 용액에 10분간 소독 후 Murashige & Skoog (MS) (Murashige and Skoog, 1962), Schenk & Hildebrandt (SH) (Schenk and Hildebrandt, 1972), 그리고 woody plant medium (WPM) 기본배지에 11 ㎎/L 2, 4-dichlorophenoxyacetic acid (2,4-D), 3% sucrose, 2.4 g/L phytagel 등을 첨가한 고체배지로 채운 petri-dish (100 ㎜ × 20 ㎜)에 약 0.5~1 ㎝ 크기의 꽃잎 절편체 10개를 온도 25℃±1℃에서 암배양을 3반복으로 실시하였다(Fig. 1).
캘러스 배양
장미 ‘Pink Beauty’ 등 꽃잎 절단면에 형성된 캘러스만을 SH 기본배지 또는 SH기본배지에 3 ㎎/L 2,4-D, 3% sucrose, 300 ㎎/L L-proline, 2.4 g/L phytagel 등을 첨가한 고체배지(Lee et al., 2011)로 옮겨 25℃±1℃에서 암배양하였고, 4~6 주 간격으로 동일배지로 계대배양하였다.
Real-time reverse transcription quantitative polymerase chain reaction (RT-qPCR) 분석
Zakizadeh et al. (2010)은 분화용 미니 장미 품종 ‘Linda’ 잎 유래 캘러스로부터 유도된 체세포배 발생 캘러스에서 분리한 somatic embryogenesis receptor-like kinase (SERK) 유전자 2종[RhSERK3 (GenBank Accession No. EF631969)와 RhSERK4 (GenBank Accession No. EF631970)]이 체세포배 발생의 마커로서 사용가능함을 보고한 바 있다. 본 연구에서 유도된 장미 ‘Ice Wing’ 꽃잎 유래의 체세포배 발생 캘러스가 일반 캘러스와 RhSERK3와 RhSERK4 유전자의 발현 차이가 있는지 조사하였다. 장미 ‘Ice Wing’ 꽃잎 유래의 체세포배 발생 캘러스와 일반 캘러스 각각 0.1 g으로부터 RNeasy Plant Mini Kit (Qiagen, Hilden, Germany)를 이용하여 total RNA를 추출하였고, Nano Vue (GE healthcare, Chicago, USA)으로 정량했다. Genomic DNA (gDNA)의 제거와 cDNA의 합성에는 RT reagent Kit with gDNA Eraser (Takara, Kusatsu, Japan)를 사용하였다. cDNA 합성은 total RNA (1 ㎍) 5 μL, 5× gDNA Eraser buffer 2 μL, gDNA Eraser 1 μL, RNase free dH2O 2 μL를 혼합 후 42℃에서 2분간 반응시켰다. 그 다음 5× Prime Script buffer 2 4 μL, RT primer Mix 1 μL, RT Enzyme MixⅠ 1 μL, RNase free dH2O 4 μL를 첨가하여 37℃에서 15분, 85℃에서 5초 반응하여 cDNA를 합성 후 50 배로 희석하여 사용했다. Bio-Rad CFX96 (Bio-Rad, USA)를 이용하여 RT-qPCR (SYBR Premix Ex Taq II(Takara, Kusatsu, Japan) 반응을 3 step으로 수행하였으며, 메뉴얼의 지시에 따라 95℃에서 30초 동안 initial denaturation하고, 95℃에서 5초, 58℃에서 30초로 45 반복하여 PCR 후 65℃에서 95℃까지 5℃씩 상승시켜 melt curve 분석을 수행했다. 상대 정량 값은 ΔΔCt법으로 계산했으며, housekeeping 유전자는 ACTIN (GenBankAccession No. AB239794.1)을 사용했다. 3반복의 상대 정량 값으로 평균과 표준오차를 계산하였고, 유전자별 사용된 primer 서열은 Table 1과 같다.
Table 1.
Sequences of primers used for real-time quantitative polymerase chain reaction (RT-qPCR) analysis in this study
결과 및 고찰
국내 육성 장미 품종 꽃잎으로부터 체세포배발생 캘러스를 유도하고자 화색이 다른 ‘Ice Wing’ 등 장미 3품종 꽃잎 절편체를 기본배지를 달리한 3종류 배지에 암배양하고, 47일 후 캘러스 형성 정도를 조사한 결과, 3품종 모두 3종류 배지에서 절편체의 절단부위에 캘러스가 형성되었다. 특히 꽃색이 흰색인 ‘Ice Wing’ 품종의 꽃잎을 11 ㎎/L 2,4-D가 첨가된 SH기본배지에 배양하였을 경우 절편체의 90% 이상에서 캘러스가 형성되어 가장 높은 캘러스 형성률을 나타내었다(Fig. 2). 또한, 유도된 캘러스의 색은 꽃색이나 배지에 따른 차이는 없었고, 아이보리나 브라운 또는 회색 계열이었다(Fig. 2). Datta et al. (2002)은 장미 7품종의 꽃잎을 α-naphthalieneacetic acid (NAA) 와 6- benzylaminopurine (BAP)와 2,4-D농도를 0.2~2 ㎎/L 혼용하여 첨가한 MS 또는 SH배지에 배양하였을 때 캘러스 형성율은 SH배지보다 MS배지가 보다 효과적이라고 하여 본 연구결과와 상이하였다. 또한 MS배지에서 형성된 캘러스는 단단하고 암녹색이었고, SH배지에서 형성된 캘러스는 부드러운 연두색이었다고 하였다.
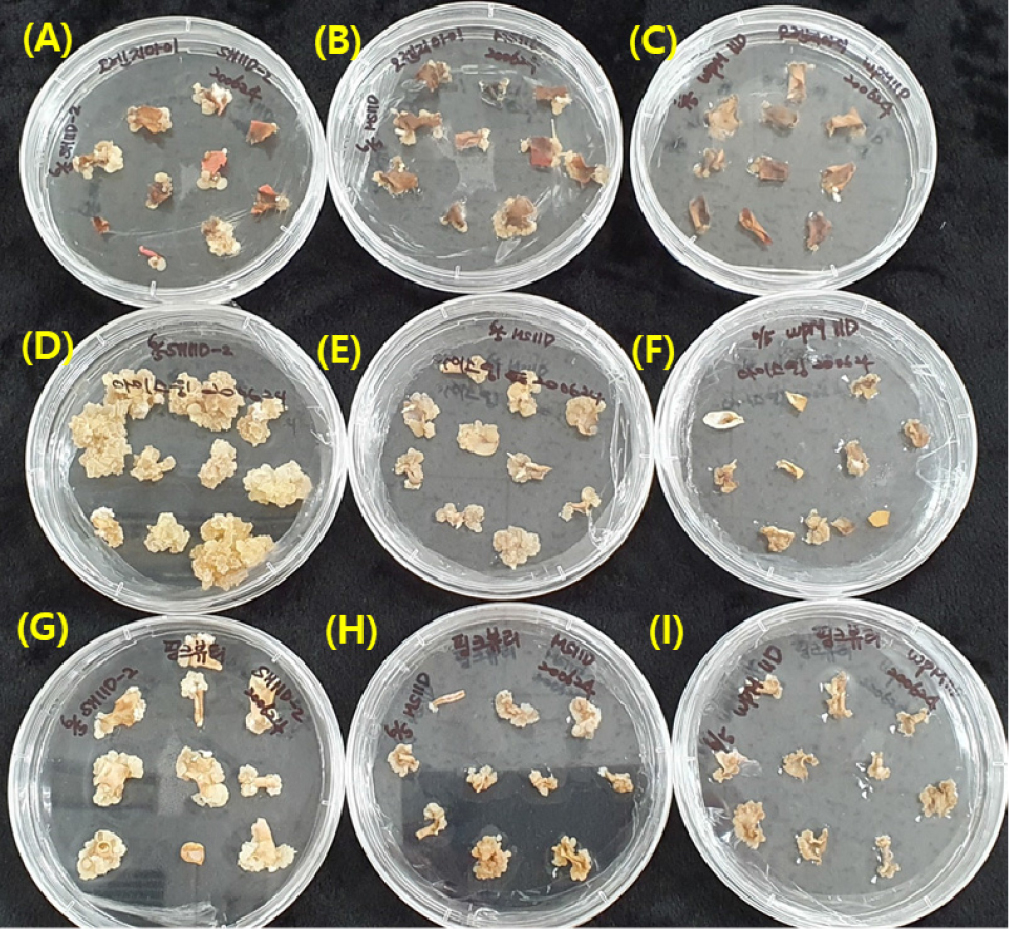
Fig. 2.
The induction of callus derived from petals of Rosa hybrida ‘Orange Eye’ (A, B, and C), ‘Ice Wing’ (D, E, and F), and ‘Pink Beauty’ (G, H, and I) cultured on the SH (A, D, and G), MS (B, E, and H) and WPM (C, F, and I) medium supplemented with 11 ㎎/L 2,4-D and 3% sucrose and solidified with 2.4 g/L phytagel in the dark at 25°C ± 1°C for 47 days.
장미 ‘Ice Wing’ 등 3품종의 꽃잎 유래 캘러스를 체세포배발생 캘러스 유도용 배지에 옮겨(Fig. 3) 배양 1개월 후 현미경으로 관찰한 결과, WPM 기본배지에 배양한 ‘Ice Wing’ 꽃잎 유래의 캘러스로부터만 체세포배가 발생하였다(Fig. 4A). 이후 4주 간격으로 동일한 조성의 배지로 2회 계대배양한 결과, 체세포배가 대량 발생되는 것을 확인하였다(Fig. 4B). 지금까지 장미 꽃잎 유래 체세포배 발생 캘러스 유도에 성공하였다는 연구 보고는 거의 없다. Murali et al. (1996)은 장미 22품종 중 단지 1품종 꽃잎 유래 캘러스에서만 안정적인 배발생캘러스를 유도하였다고 보고한 바 있다. 장미의 경우 이와 같이 몇몇 특정 품종에서만 체세포배 발생 캘러스 유도가 가능함으로써 품종간 유전적 차이가 매우 크다는 것을 의미하는 것으로 이를 극복하기 위한 다양한 연구가 필요하다고 판단된다.
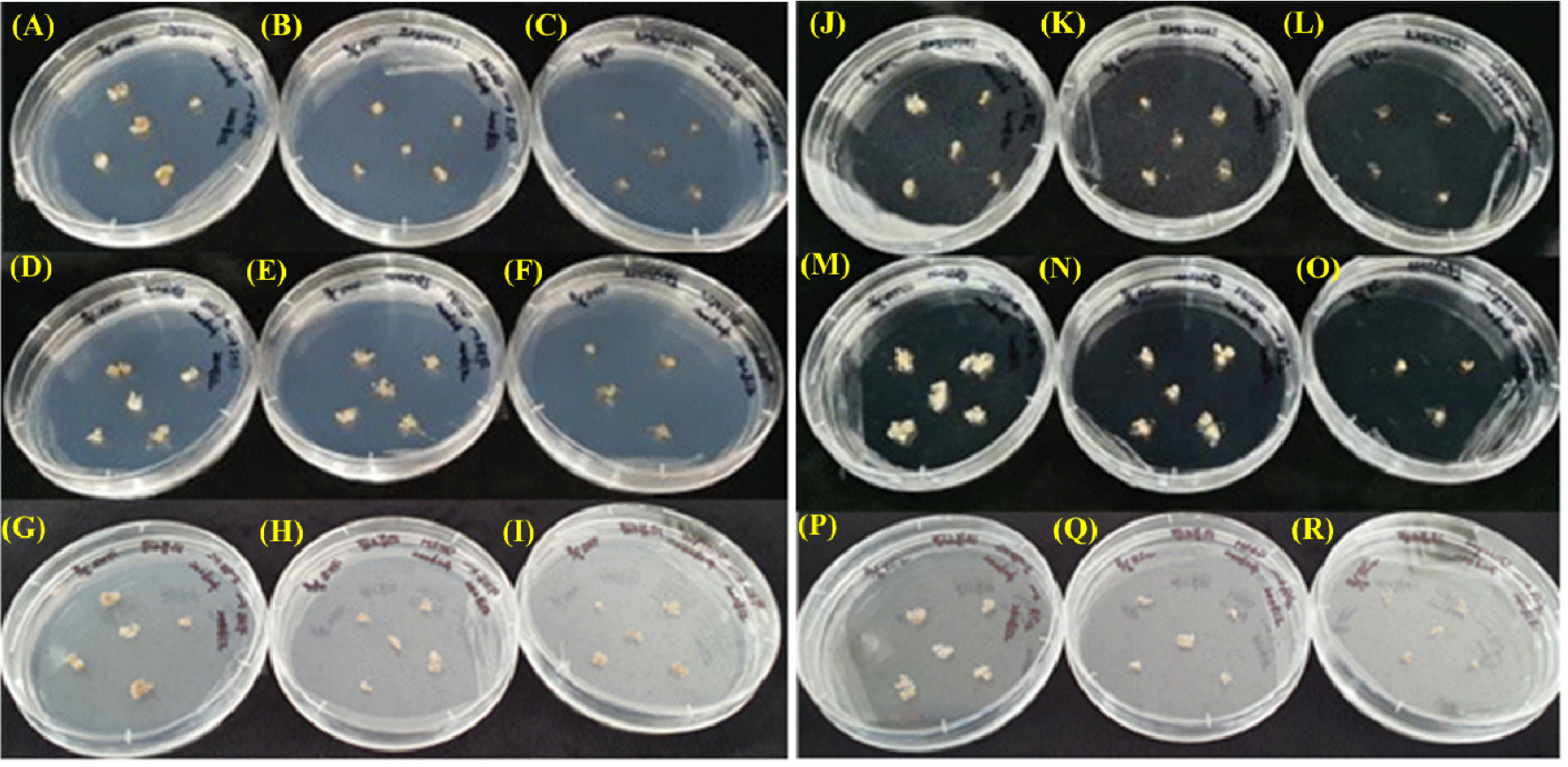
Fig. 3.
Calluses were separated from petals of Rosa hybrida ‘Orange Eye’ (A, B, C, J, K, and L), ‘Ice Wing’ (D, E, F, M, N, and O), and ‘Pink beauty’ (G, H, I, P, Q, and R), and then they transferred to SH basal medium supplemented without (A to I) or with (J to R) 3 ㎎/L 2,4-D, 300 ㎎/L, and L-proline.

Fig. 4.
The generation of somatic embryos derived from Rosa hybrida ‘Ice Wing’ petal-derived callus induced on WPM medium as basal medium and then cultured on the SH medium 3 ㎎/L 2,4-D, 3% sucrose, 300 ㎎/L L-proline, 2.4 g/L phytagel in the dark at 25°C ± 1°C for 5 weeks (A) and their proliferation observed under a microscope (B).
식물 종류에 따라 체세포배발생 빈도가 낮을 뿐 아니라 품종에 따라 차이가 있기 때문에 somatic embryogenesis receptor kinase (SERK) 유전자가 세포에서 체세포배 발생을 인지하는 표지로서 사용되고 있다. Zakizadeh et al. (2010)은 분화용 미니 장미 품종 ‘Linda’ 잎 유래 캘러스로부터 유도된 체세포배 발생 캘러스로부터 SERK partial 유전자 RhSERK1에서 RhSERK4까지 4종을 동정하였다고 보고하였다. 그들은 일반 캘러스에 비해 체세포배발생 캘러스에서 RhSERK3와 RhSERK4 유전자의 발현이 5배 높았다고 하였으나 본 연구에서는 계대배양을 통해 증식 중(Fig. 5)인 ‘Ice Wing’ 꽃잎 유래 체세포배 발생 캘러스와 꽃잎 유래 캘러스로부터 각각 RNA를 추출한 후 실시간 RT-qPCR 분석을 통해 RhSERK3와 RhSERK4 유전자의 발현량을 비교 분석한 결과, RhSERK3 유전자의 발현량은 일반 캘러스에 비해 체세포배 발생 캘러스에서 10배 정도 높았고, 일반 캘러스에서는 거의 발현되지 않은 RhSERK4 유전자의 발현 또한 체세포배 발생 캘러스에서는 700배 이상 높았다(Fig. 6). 본 연구에서 RhSERK4 유전자의 발현량이 높았던 것은 Zakizadeh et al. (2010)이 체세포배의 경우 RhSERK4 유전자의 발현량이 일반 캘러스의 8배라고 보고한 것과 같이 정확히 얼마나 섞여 있는지는 알 수 없지만 증식 과정의 체세포배 발생 캘러스에는 체세포배가 다수 포함되어 있기 때문일 것으로 추정된다.
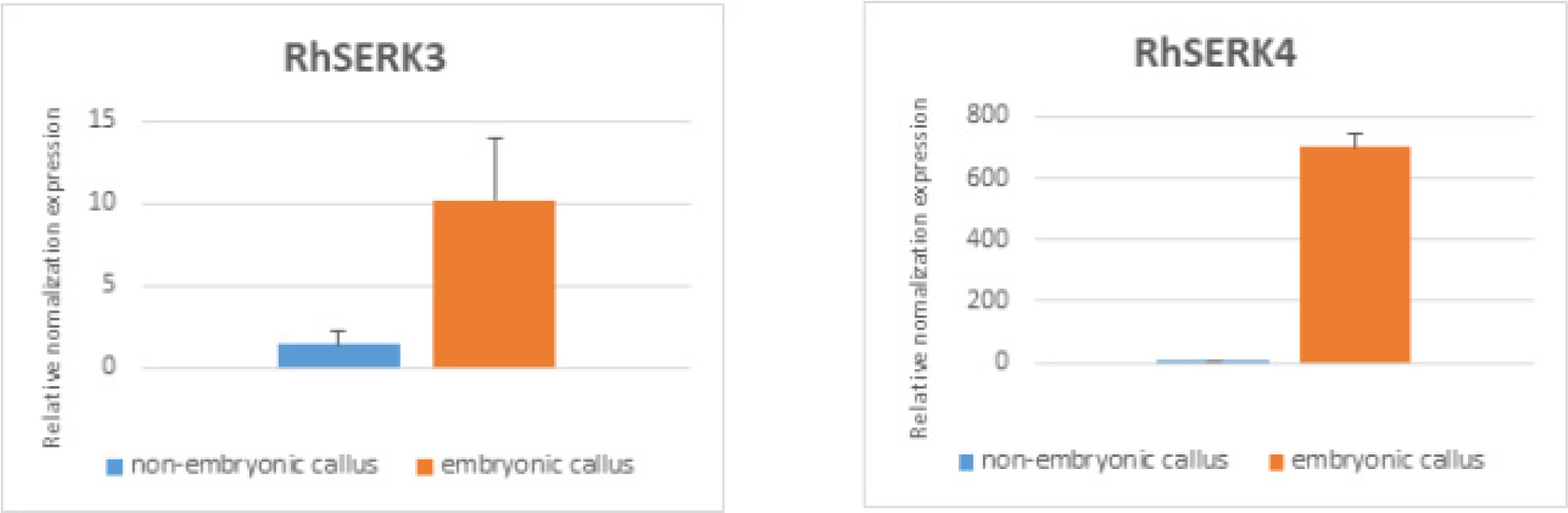
Fig. 6.
The comparison of RhSERK3 and RhSERK4 expression between petal-derived somatic embryogenic callus and petal-derived non-embryogenic callus in Rosa hybrida ‘Ice Wing’ by real-time reverse transcription quantitative polymerase chain reaction (RT-qPCR) analysis. Error bars are standard deviation.
2011년부터 2020년까지 국내 화장품 산업은 연평균 성장률 10.08%로 지속적으로 성장하고 있는 반면 2020년 대비 2021년 화장품 원료 수입액도 1.4배 증가하였다(KPTA, 2022; MFDS, 2022). 이는 화장품 시장이 성장할수록 화장품 원료 수입액이 동시에 증가하는 무역수지불균형의 구조적인 문제점을 안고 있는 바 국내 화장품 산업의 경쟁력 강화를 위해서 장미나 장미 유래 세포 추출액을 화장품에 사용되는 원료의 국산화가 필요한 시점이다. Heo et al. (2021)은 국립원예특작과학원에서 육성된 장미 ‘Sweet Yellow’ 품종 기내 뿌리 유래의 체세포배발생 캘러스 추출물의 항산화 및 피부장벽 효능 평가를 실시한 결과 항노화 소재로서 활용성을 확인하였다고 보고한 바 있다. 또한, Tito et al. (2019)은 피부세포 재생 활성 화합물이 풍부하게 포함되어 있다고 알려진 체세포배가 다량 섞여 있는 Lotus japonicas 세포 배양액 유래의 peptides와 sugar 성분이 인간의 세포재생 및 노화 방지 주요 기능 유전자 growth differentiation factor 11 (GDF11)의 발현을 회복시키는데 효과가 있음을 확인하였다고 보고한 바 있다.
국립원예특작과학원에서 2000년에 육성한 장미 품종 ‘미향’을 시작으로 2021년까지 국내 육성 장미 145품종이 개발된 바 있다(KSVS, 2022). 본 연구를 통해 확립된 장미 꽃잎 체세포배 발생 캘러스 유도 기술은 국내 육성 향기 장미 품종의 고부가성 재료로의 활용성이 높은 소재 획득 기술로 활용될 수 있을 것이다. 또한, 본 연구에서 유도된 국내 육성 장미 ‘Ice Wing’ 꽃잎 유래 체세포배 발생 캘러스는 화장품 산업 소재 및 고부가 장미 품종 육성을 위한 형질전환 연구에 기초자료로 활용이 가능할 것이다.
적 요
화색이 다른 장미 3품종(‘Ice Wing’, ‘Orange Eye’, ‘Pink beauty’) 꽃잎 절편체를 3종류(MS, SH, WPM)의 기본배지에 2, 4-D 11 ㎎/L를 첨가한 배지에 47일간 암배양하고 절편체로부터 캘러스 형성율을 조사한 결과, 모든 품종에서 꽃잎 절편체로부터 캘러스 형성이 관찰되었다. 또한 화색이 흰색인 ‘Ice Wing’ 품종의 꽃잎을 기본 배지를 SH배지에 치상하였을 때 절편체의 약 90% 이상에서 캘러스가 형성되어 가장 높은 캘러스 형성율을 나타내었다. 유도된 캘러스의 색은 꽃색이나 배지에 따른 차이는 없었고, 아이보리나 브라운 또는 회색 계열이었다. 체세포 배발생은 WPM 기본배지에서 획득된 ‘Ice Wing’ 꽃잎 유래 캘러스만을 분리하여3 ㎎/L 2,4-D와 300 ㎎/L L-proline을 첨가한 SH배지에 암배양 1개월 후 관찰되었다. 이후 4주 간격으로 동일한 조성의 배지로 2회 교체한 결과 체세포배가 대량 발생되는 것을 확인하였다. RT-qPCR분석에 의해 ‘Ice Wing’ 꽃잎 유래의 캘러스와 증식중인 체세포배 발생 캘러스간 캘러스로부터 체세포배 발생을 인지하는 표지로서 사용되고 있는 somatic embryogenesis receptor kinase (SERK) 유전자의 발현량을 비교한 결과, RhSERK3 유전자의 발현량은 일반 캘러스에 비해 체세포배 발생 캘러스에서 10배 높았고, 일반 캘러스에서는 거의 발현되지 않은 RhSERK4 유전자의 발현은 체세포배 발생 캘러스에서는 700배 높았다.