서 언
재료 및 방법
시약 및 항체
시료추출
세포배양
3T3-L1 세포의 분화
Oil-Red O 염색
Small interference RNA (siRNA)의 형질도입
SDS-PAGE 및 Western blot analysis
통계분석
결 과
추출조건에 따른 SRPL의 지질축적 억제 활성 비교
AE20-SRPL의 농도 및 분화단계별 지질방울 축적 억제활성
AE20-SRPL이 3T3-L1세포에서 adipogenesis 유도 관련 인자들의 발현에 미치는 영향
AE20-SRPL이 3T3-L1세포의 β-catenin 단백질 발현에 미치는 영향
고 찰
적 요
서 언
에너지 섭취와 소비의 불균형은 지방 조직에서 비만을 유발하며(Galgani and Ravussin, 2008; Yu et al., 2002), 이는 고혈압, 제2형 당뇨병, 이상지질혈증, 동맥경화증과 같은 다양한 대사 질환의 주요 원인으로 작용한다고 알려져 있다(Jahangir et al., 2014). 이러한 비만 관련 질환들은 전 세계적으로 심각한 공중보건 문제로 대두되고 있으며, 그 악영향은 지속적으로 증가하고 있다(Seo et al., 2018). 비만은 단순히 건강상의 문제에 그치지 않고, 개인의 삶의 여러 측면에 걸쳐 깊은 영향을 미치는 다면적인 문제로 인식되어 왔다(Oh et al., 2009). 신체적 질환 외에도, 비만은 사회적 관계와 경제적 안정성에 부정적인 영향을 미쳐 고용 기회의 감소, 차별 경험, 의료비 증가 등의 문제를 초래할 수 있다고 보고되고 있다(Oh et al., 2009). 또한, 자존감 저하, 우울증, 불안과 같은 심리적 어려움을 유발하거나 악화시켜 개인의 전반적인 삶의 질을 크게 저하시킬 수 있다(Oh et al., 2009). 이처럼 비만이 미치는 광범위하고 다차원적인 영향을 고려할 때, 비만은 공중보건 분야에서 중요한 논의 주제로 부상하고 있다(Oh et al., 2009). 천연물을 활용한 비만 해결 전략은 최근 몇 년 동안 지속적으로 주목받고 있다(Karri et al., 2019). 천연물은 합성 약물에 비해 부작용 위험이 낮고, 안전한 장기 사용이 가능하다는 점에서 매우 매력적인 대안으로 평가되고 있다(Karri et al., 2019). 이에 따라, 자연 유래 물질 기반의 항비만제는 비만 관리에서 새로운 패러다임을 제시할 잠재력을 지니며, 혁신적이고 지속 가능한 치료 접근법을 위한 길을 열 것으로 기대되고 있다(Karri et al., 2019).
다른 Sambucus 종과 비교할 때, 말오줌나무(Sambucus racemosa subsp. pendula, SRP)는 더 작은 열매와 독특한 꽃차례 형태로 구별된다고 알려져 있다(Lim, 2022). SRP는 한국 고유의 식물로, 울릉도에만 자생하는 것으로 알려져 있다(Lim, 2022). Sambucus 열매는 잼, 주스 등 식품뿐만 아니라 약용으로도 널리 활용되어 왔다(Lim, 2022). 한국 식품의약품안전처는 SRP의 잎과 어린싹만을 식품으로 사용할 수 있도록 허용하고 있으나, SRP 잎의 약리학적 효과에 관한 연구는 현재까지 거의 이루어지지 않았으며, 특히 그 기능적 활성에 대한 과학적 근거가 부족한 실정이다. 최근 보고에 따르면, SRP는 대식세포를 활성화하는 면역 조절 잠재력을 보유하고 있는 것으로 나타났으나(Choi et al., 2024), 그 외 약리학적 활성, 특히 항비만 효과에 대한 연구는 매우 제한적이다. 이에 본 연구에서는 SRP 잎 추출물이 항비만 활성을 보유하고 있는지 구명하고, 이를 통해 SRP의 기능적 가치를 재조명하고자 하였다. 또한 SRP 잎의 항비만 활성을 과학적으로 입증함으로써, 이를 기능성 식품 또는 천연소재 기반의 항비만 치료제 개발을 위한 기초 자료로 활용하는 것이다. 이를 통해 SRP의 활용 가능성을 확대하고, 기존 연구의 한계를 보완하고자 하였다.
재료 및 방법
시약 및 항체
Dexamethasone, 3-isobutyl-1-methylxanthine (IBMX), insulin인슐린, 및 Oil-Red O는 Sigma-Aldrich (St. Louis, MU, USA)에서 구매하였다. Primary antibody인 PPARγ (cat. no. 2435), CEBPα (cat. no. 8178), β-catenin (cat. no. 9562) 및 β-actin (cat. no. 5125)과 secondary antibody인 anti-rabbit (cat. no. 7074)은 및 anti-mouse IgG (cat. no. 7076)에 대한 2차 항체는 Cell Signaling Technology, Inc. (Danvers, MA, USA)에서 구매하였다. Small interfering RNA인 Control siRNA (cat. no. 6568)와 β-catenin siRNA (cat. no. sc-29210)는 각각 Cell Signaling Technology, Inc.와 Santa Cruz Biotechnology, Inc. (Dallas. TX, USA)에서 구매하였다.
시료추출
2023년 5월 울릉도에서 채집된 Sambucus racemosa subsp. pendula(표본 번호: FMRC-230501A1-A3) 잎(SRPL)은 국립산림과학원 산림약용자원연구소에 의해 분류학적으로 동정 되었다. 동결건조된 SRPL은 20배 용량비의 100% 증류수와 에탄올(10%, 30%, 50%, 70%)을 사용하여 상온에서 24시간 동안 추출되었다. 추출이 완료된 후, 각 추출액은 4°C에서 25,200 x g로 10분간 원심분리하였고, 이후 동결건조하였다. 동결건조된 증류수 추출물은 증류수에 재용해하여 실험에 사용하였으며, 에탄올 추출물은 DMSO에 재용해하여 실험에 사용되었다.
세포배양
3T3-L1 지방전구세포는 American Type Culture Collection (ATCC, Manassas, VA, USA)에서 구입하였다. 3T3-L1 세포는 DMEM/F-12 배지(Hyclone Laboratories Inc., UT, USA)에 10% bovine calf serum (BCS, Gibco, NY, USA)과 penicillin/streptomycin (100 U/100 ㎍/mL)을 첨가한 배양액을 사용하여 37°C, 5% CO2 조건에서 배양되었다. 3T3-L1 세포의 분화를 위해서는 10% fetal bovine serum (FBS, Gibco, NY, USA)과 penicillin/streptomycin (100 U/100 ㎍/mL)이 첨가된 DMEM/F-12 배지를 사용되었다.
3T3-L1 세포의 분화
3T3-L1 세포는 6 well plate에서 100% confluence 상태로 2일간 배양하였다. 2일 후(D0), 3T3-L1 세포에 50 μM IBMX, 1 μM dexamethasone, 10 ㎍/mL insulin (DMI)을 처리하여 2일간(D2) 배양하였다. 이후, 3T3-L1 세포에 10 ㎍/mL insulin을 추가로 처리하며 2일간(D4) 배양하였다. 3T3-L1 세포는 추가로 4일간 배양되었으며, 배지는 2일마다(D6 및 D8) 교체하였다. 모든 배양 과정은 37°C, 5% CO2 조건에서 수행되었다.
Oil-Red O 염색
3T3-L1 세포는 상온에서 10% formalin으로 1시간 동안 고정되었다. 이후, 세포를 증류수로 3회 세척하고, 60% isopropanol로 상온에서 5분간 탈수 처리하였다. 건조된 3T3-L1 세포는 60% Oil-Red O 염색 용액으로 상온에서 20분간 염색하여 지질 방울(lipid droplets, LDs)을 시각화하였다. 염색 후, 세포를 증류수로 5회 세척 한 뒤 광학현미경(Olympus Corporation, Tokyo, Japan)을 사용하여 LDs를 관찰하였다. 염색된 LDs를 시각화한 후, 완전히 건조된 3T3-L1 세포에서 100% isopropanol을 이용해 Oil-Red O를 추출하여 축적된 LDs를 정량화하였다. 추출된 Oil-Red O의 흡광도는 microplate reader (SpectraMax M2, Molecular Devices, CA, USA)를 사용해 500 ㎚에서 측정되었다.
Small interference RNA (siRNA)의 형질도입
3T3-L1 지방세포를 6-well plate에 접종한 후, 24시간 동안 부착시켰다. 초기 부착이 완료된 이후, control siRNA와 β-catenin siRNA를 각각 최종 농도 100 nM으로 처리하여 세포에 transfection 시켰다. Transfection 과정은 TransIT-TKO transfection reagent (Mirus, Madison, WI, USA)을 사용하여 48시간 동안 진행되었으며, 제조사의 protocol을 엄격히 준수하여 수행되었다.
SDS-PAGE 및 Western blot analysis
Cell lysate는 RIPA buffer (Boston BioProducts, Milford, MA, USA)를 사용하여 4°C에서 30분간 처리하여 준비하였다. 이후, cell lysate를 4°C에서 15,000 x g로 30분간 원심분리하여 단백질 상층액을 회수하였다. 단백질 농도는 BCA protein assay kit (Thermo Fisher Scientific, Waltham, MA, USA)를 사용하여 측정하였다. 전기영동을 위해 각 well당 30 ㎍의 단백질을 12% acrylamide gel에 로딩한 후, 150 V 및 400 A에서 1시간 동안 단백질 분리 과정을 진행하였다. 분리된 단백질은 100 V 및 300 A에서 2시간 동안 nitrocellulose membrane (Thermo Fisher Scientific, Inc.)으로 전이하였다. Nitrocellulose membrane은 5% non-fat milk로 상온에서 1시간 동안 blocking하였으며, 이후 primary antibody를 1:1,000 희석하여 4°C에서 16시간 동안 반응시켰다. Secondary antibody는 1:1,000 희석하여 상온에서 1시간 동안 반응하였다. Protein band는 ECL Prime Western Blotting Detection Reagents (GE Healthcare, Little Chalfont, Buckinghamshire, UK)를 사용하여 검출하였으며, LI-COR C-DiGit Blot Scanner(LI-COR, Lincoln, Nebraska, USA)를 통해 시각화하였다. 밴드의 정량적 분석은 UN-SCAN-IT gel software version 5.1 (Silk Scientific Inc., Orem, UT, USA)를 사용하여 수행하였다.
통계분석
모든 실험은 최소 3회 반복하여 수행되었다. 통계 분석은 GraphPad Prism 버전 5.0 (GraphPad Software, Inc.)을 사용하여 수행하였으며, 데이터는 평균 ± 표준편차로 표시하였다. 데이터 분석은 일원배치분산분석(one-way ANOVA)을 수행한 후 Bonferroni 사후 검정을 통해 진행하였다. P<0.05는 통계적으로 유의한 차이를 나타내는 기준으로 간주하였다.
결 과
추출조건에 따른 SRPL의 지질축적 억제 활성 비교
SRPL의 항비만 활성을 위한 최적 추출조건을 규명하고자 본 연구에서는 3T3-L1 세포에서 SRPL의 100% 증류수 추출물(AE-SRPL), 10% 에탄올 추출물(10EE-SRPL), 30% 에탄올 추출물(30EE-SRPL), 50% 에탄올 추출물(50EE-SRPL), 70% 에탄올 추출물(70EE-SRPL)의 지질 방울 축적 억제 효과를 비교 분석하였다. Fig. 1A에 나타난 바와 같이 AE-SRPL과 10EE-SRPL은 지질 방울의 축적을 유의적으로 감소시켰으나 30EE-SRPL과 50EE-SRPL은 지질 방울 축적 억제 효과가 없는 것으로 나타났다. 70EE-SRPL이 처리된 세포에서도 지질축적이 나타나지 않았으나 독성으로 인해 세포가 사멸되었다. 그리하여 우리는 SRPL을 다양한 온도 조건으로 100% 증류수로 추출한 후 다시 지질 방울 축적 억제 효과를 비교 분석하였다. Fig. 1B에 나타난 바와 같이, 20°C에서 100% 증류수로 추출된 추출물(AE20-SRPL)에서 가장 높은 지질 방울 축적 억제 효과가 나타났으며, 40°C, 60°C, 그리고 80°C로 추출온도가 높아질수록 지질 방울 축적 억제 효과가 감소하였다. 이에 따라, 20°C에서 100% 증류수로 추출된 말오줌나무 잎 추출물(AE20-SRPL)을 중심으로 추가 연구를 진행하였다.
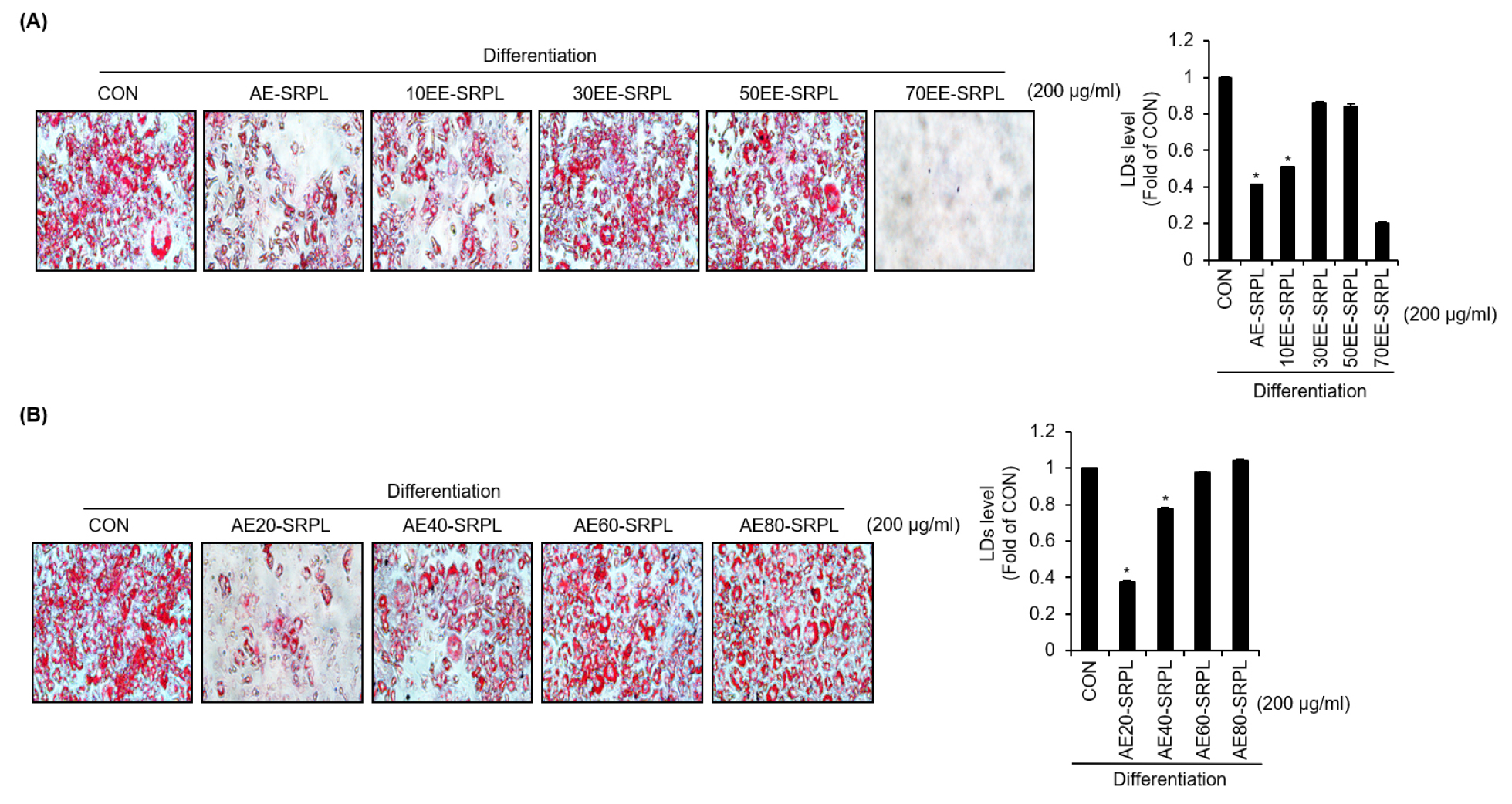
Fig. 1.
Comparison of the lipid accumulation inhibitory activity of SRPL in 3T3-L1 cells under different extraction conditions. (A) During the differentiation process of preadipocyte 3T3-L1 cells into mature adipocytes, AE-SRPL, 10EE-SRPL, 30EE-SRPL, 50EE-SRPL, or 70EE-SRPL were treated from D0 to D8. Lipid droplet accumulation after treatment was analyzed using the Oil-Red O staining assay. (B) During the differentiation process of preadipocyte 3T3-L1 cells into mature adipocytes, AE20-SRPL, AE40-SRPL, AE60-SRPL or AE80-SRPL were treated from D0 to D8. Lipid droplet accumulation after treatment was analyzed using the Oil-Red O staining assay. *P < 0.05 vs CON.
AE20-SRPL의 농도 및 분화단계별 지질방울 축적 억제활성
AE20-SRPL의 농도 의존적 지질축적 억제 활성을 평가한 결과, AE20-SRPL의 농도가 증가함에 따라 지질축적 억제 효과가 농도 의존적으로 강화되는 경향을 확인할 수 있었다(Fig. 2A). 추가로, AE20-SRPL의 처리 시점에 따른 지질 방울 축적 억제 효과를 분석하기 위해 3T3-L1의 분화단계별로 AE20-SRPL의 처리 실험을 진행하였다. 그 결과(Fig. 2B), 분화 초기 단계(D0-D2)에서 AE20-SRPL을 처리한 경우, 지질 방울 축적이 유의미하게 억제되는 결과를 확인할 수 있었다. 반면, 분화 중기(D2-D4) 또는 분화 후기(D4-D8) 단계에서만 AE20-SRPL을 처리한 경우에는 지질 방울 축적 억제 효과가 나타나지 않았다.
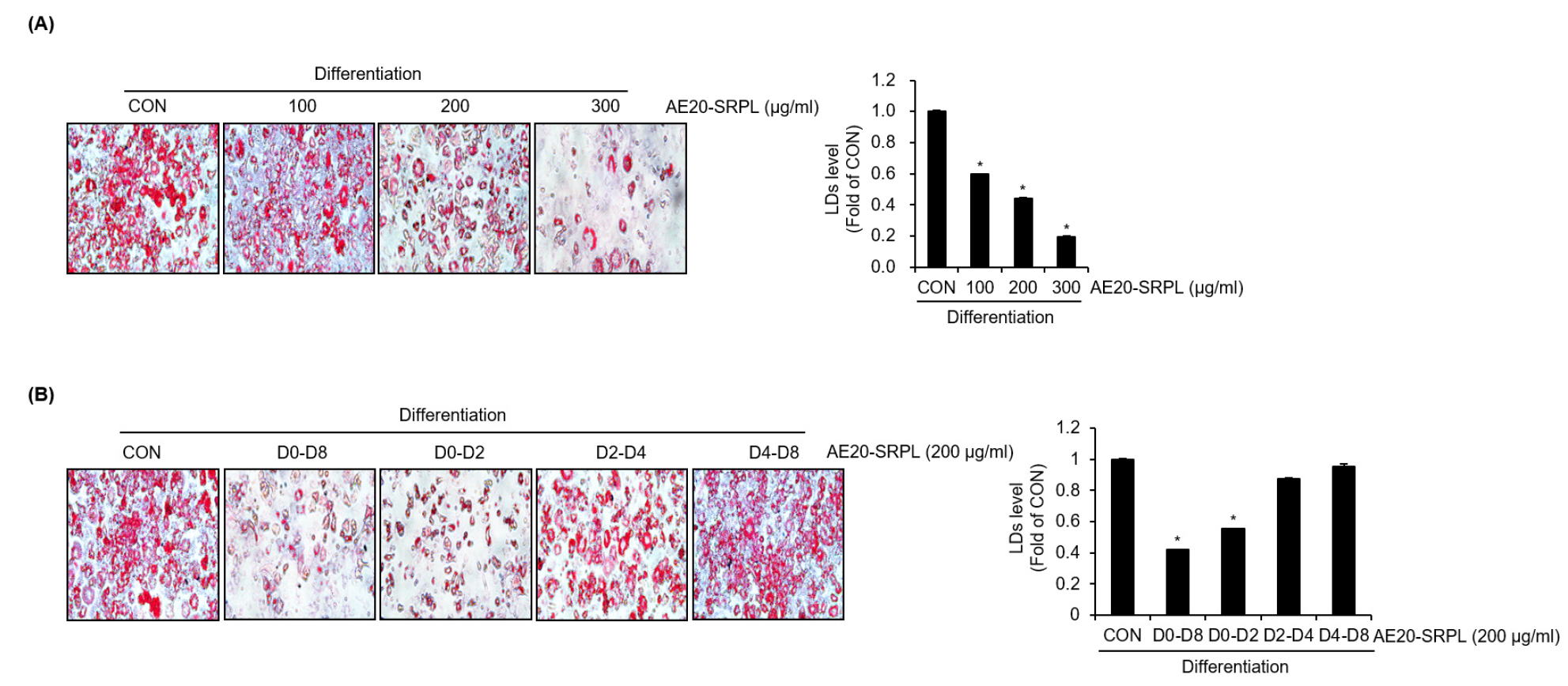
Fig. 2.
Inhibitory activity of AE20-SRPL on lipid droplet accumulation by concentration and differentiation stage in 3T3-L1 cells. (A) During the differentiation process of preadipocyte 3T3-L1 cells into mature adipocytes, AE20-SRPL was treated from D0 to D8. Lipid droplet accumulation after treatment was analyzed using the Oil-Red O staining assay. (B) During the differentiation process of preadipocyte 3T3-L1 cells into mature adipocytes, AE20-SRPL was treated exclusively during the early differentiation stage (D0-D2), mid-differentiation stage (D2-D4), or late differentiation stage (D4-D8). Lipid droplet accumulation after treatment was analyzed using the Oil-Red O staining assay. *P < 0.05 vs CON.
AE20-SRPL이 3T3-L1세포에서 adipogenesis 유도 관련 인자들의 발현에 미치는 영향
AE20-SRPL이 지방세포 내 지질축적 과정에서 초기 단계(D0-D2)에만 처리되었을 때 지질축적 억제 활성을 나타내고, 중기(D2-D4) 또는 후기(D4-D8) 단계에서 처리 시 지질축적 억제 효과가 없는 현상은 지방 전구세포에서 지방세포로의 분화과정인 adipogenesis를 억제할 가능성이 크다고 판단된다. 그리하여 우리는 AE20-SRPL이 adipogenesis를 유도하는 데 있어 중요한 역할을 하는 peroxisome proliferator-activated receptor gamma (PPARγ)와 CCAAT-enhancer binding protein alpha (CEBPα)의 발현을 억제하는지 분석하였다. 그 결과, Fig. 3에 나타난 바와 같이, AE20-SRPL은 농도 의존적으로 PPARγ와 CEBPα의 단백질 수준을 유의적으로 감소시키는 것으로 나타났다.
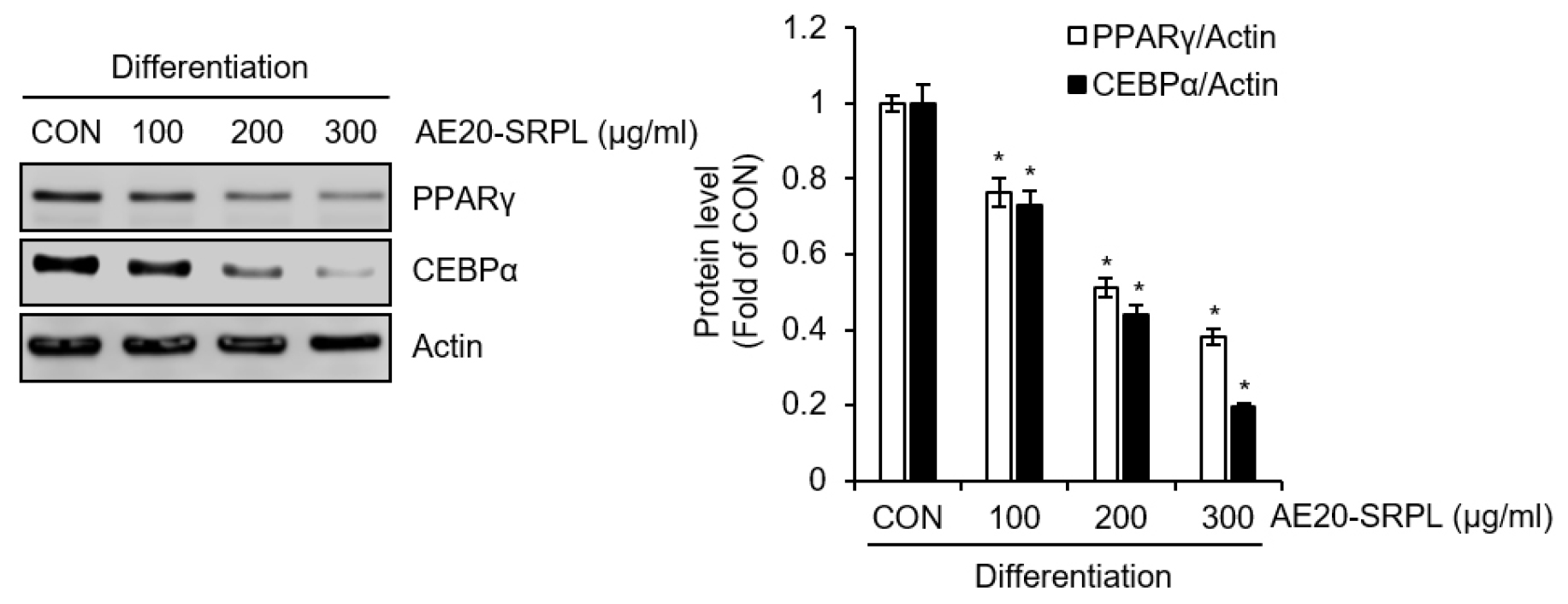
Fig. 3.
Effect of AE20-SRPL on the expression of adipogenesis-related proteins in 3T3-L1 cells. (A) During the differentiation process of preadipocyte 3T3-L1 cells into mature adipocytes, AE20-SRPL was treated from D0 to D8. The protein levels of PPARγ and CEBPα were analyzed using Western blot analysis. *P < 0.05 vs CON.
AE20-SRPL이 3T3-L1세포의 β-catenin 단백질 발현에 미치는 영향
β-catenin은 지방 전구세포의 지방세포로의 분화과정에서 중요한 인자로 인식되며, PPARγ와 CEBPα의 발현을 억제한다고 알려져 있다(Bennett et al., 2002). 그리하여 우리는 AE20-SRPL이 β-catenin의 발현에 미치는 영향과 β-catenin이 AE20-SRPL 매개 PPARγ와 CEBPα의 단백질 수준 감소와 AE20-SRPL 매개 지질축적 억제에 미치는 영향을 분석하였다. Fig. 4A에 나타난 바와 같이, AE20-SRPL은 농도 의존적으로 β-catenin의 단백질 수준을 유의적으로 증가시켰다. 그리고 β-catenin siRNA에 의한 β-catenin의 knockdown은 AE20-SRPL 매개 PPARγ와 CEBPα의 단백질 수준 감소를 억제했고(Fig. 4B), AE20-SRPL 매개 지질축적 억제도 완화하는 것으로 나타났다(Fig. 4C).
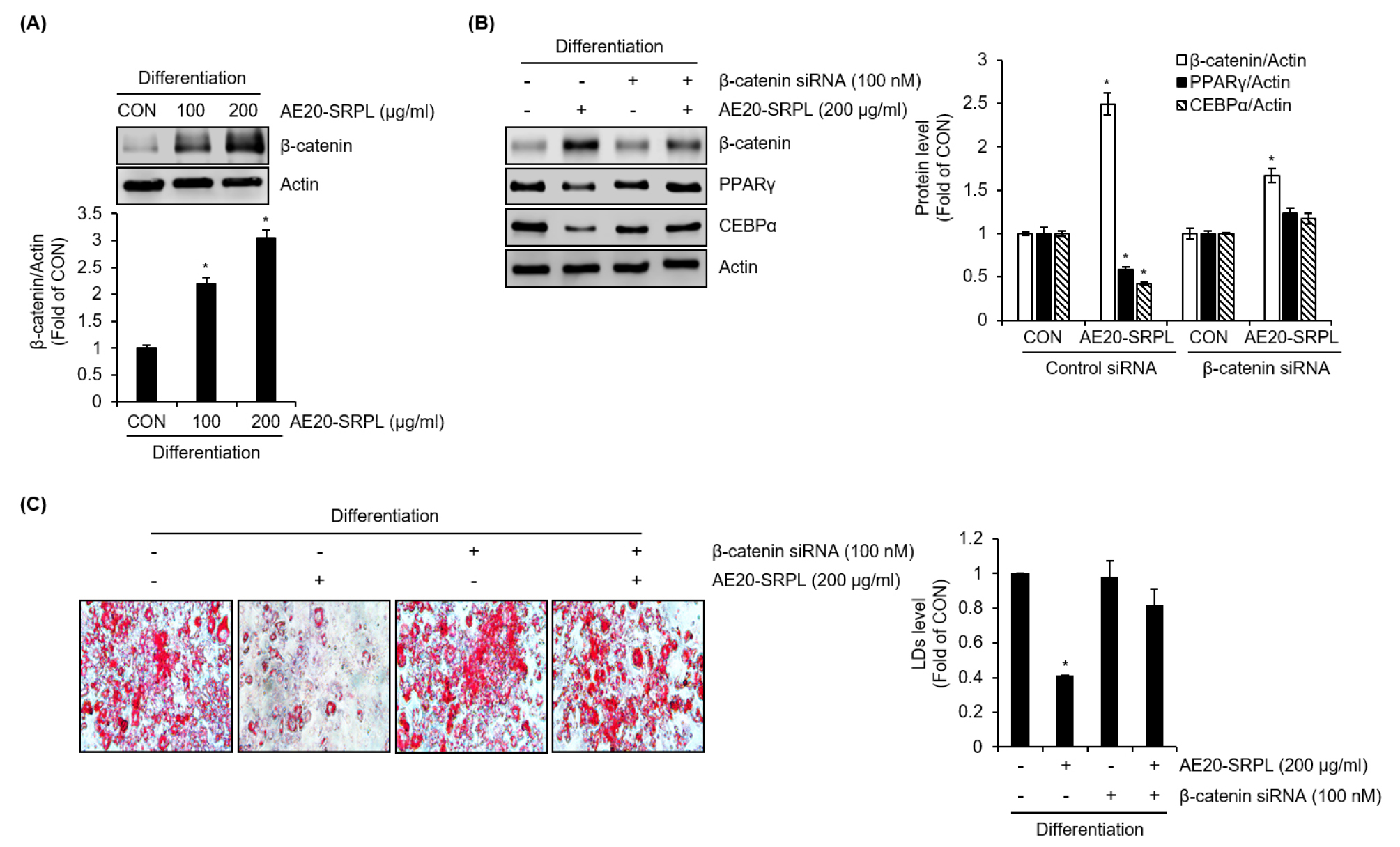
Fig. 4.
Effect of AE20-SRPL on β-catenin protein expression in 3T3-L1 cells. (A) During the differentiation process of preadipocyte 3T3-L1 cells into mature adipocytes, AE20-SRPL was treated from D0 to D8. The β-catenin protein level was analyzed using Western blot analysis. (B) During the differentiation process of preadipocyte 3T3-L1 cells transfected with control siRNA or β-catenin siRNA into mature adipocytes, AE20-SRPL was treated from D0 to D8. The protein levels of β-catenin, PPARγ and CEBPα were analyzed using Western blot analysis. (C) During the differentiation process of preadipocyte 3T3-L1 cells transfected with control siRNA or β-catenin siRNA into mature adipocytes, AE20-SRPL was treated from D0 to D8. Lipid droplet accumulation after treatment was analyzed using the Oil-Red O staining assay. *P < 0.05 vs CON.
고 찰
에너지 섭취가 에너지 소비를 초과할 경우, 초과된 에너지는 체내 지방 조직에 지질 형태로 저장되며, 과도한 지질축적이 비만으로 이어진다는 것은 잘 알려진 사실이다(Hamilton et al., 2007). 따라서 지방 조직 내 지질축적을 감소시키는 능력은 물질의 항비만 활성을 평가하는 중요한 특성 중 하나로 간주될 수 있다. 본 연구에서 SRPL의 다양한 추출조건에 따른 지질축적 억제 활성을 비교한 결과, 추출 용매와 온도가 지질축적 억제 활성에 큰 영향을 미치는 것으로 나타났다. 100% 증류수 추출물이 10%, 30%, 50%, 70% 에탄올 추출물보다 가장 높은 지질축적 억제 활성을 보였으며, 추출 용매의 에탄올 함량이 증가할수록 지질축적 억제 활성이 감소하는 경향이 나타났다. 또한, 100% 증류수를 사용하여 SRPL을 20°C, 40°C, 60°C, 80°C에서 추출했을 때, 20°C에서 추출된 추출물이 가장 높은 지질축적 억제 활성을 보였으며, 추출온도가 상승함에 따라 지질축적 억제 활성은 점진적으로 감소하였다. 이러한 결과는 SRPL의 주요 활성 성분은 친수성 분자일 가능성이 크며, 에탄올 함량이 증가함에 따라 이들 성분의 추출 효율이 감소했을 것으로 판단된다. 100% 증류수 추출에서 20°C에서 추출된 추출물이 가장 높은 활성을 보인 것은 비교적 낮은 온도에서 열에 민감한 성분들이 안정적으로 유지되었기 때문일 가능성이 있다고 판단된다. 반면, 40°C 이상에서는 일부 활성 성분의 화학적 구조가 손상되거나 생리활성이 저하되어 전체 지질 축적 억제 활성에 부정적인 영향을 미쳤을 수 있다. 이러한 결과는 SRPL 추출물의 항비만 활성을 극대화하기 위해 추출 용매로 100% 증류수를 사용하는 것이 적합하며, 추출온도는 20°C로 설정하는 것이 효과적임을 시사한다.
지방 조직은 주로 백색 지방 조직과 갈색 지방 조직이라는 두 가지 유형으로 구분된다. 비만의 발생은 백색 지방 조직 내 지방세포의 크기 증가(hypertrophy) 또는 지방세포의 분화를 통해 새로운 지방세포가 증식하는 과정(hyperplasia)과 연관이 있다는 것은 잘 알려져 있다(Haczeyni et al., 2018). 지방세포의 분화를 통해 새로운 지방세포가 증식하는 과정, 즉 지방세포 형성(adipogenesis)은 지방 전구세포가 성숙 지방세포로 분화하여 성숙 지방세포의 수를 증가시키는 복잡한 과정을 의미한다(Haider and Larose, 2019). 이 과정은 체내에 축적되는 성숙 지방세포의 수와 지질 질량 및 저장 용량을 결정짓는 핵심 요인으로 간주되고 있다(Feng et al., 2016). 따라서, 지방세포 형성을 억제하여 지방세포의 크기와 수를 조절하는 것이 비만 치료 전략으로 활용될 수 있다는 개념은 널리 받아들여지는 정설로 자리 잡고 있다(Jakab et al., 2021). PPARγ와 CEBPα는 지방세포 형성을 촉진하는 데 중요한 역할을 하는 핵심 전사 조절인자로, 이들의 기능이 지방세포 형성 과정을 가속화한다는 사실은 잘 확립되어 있다(Madsen et al., 2014). 이에 따라, PPARγ와 CEBPα는 지방세포 형성을 억제함으로써 항비만제를 개발하기 위한 주요 타겟으로, in vitro 및 in vivo 연구에서 광범위하게 활용되고 있다(Pamplona et al., 2022). 본 연구에서는 AE20-SRPL이 지방전구세포의 성숙한 지방세포로의 분화단계 중 초기 단계에서 지질축적을 억제하는 반면, 중기와 후기 단계에서는 이러한 억제 효과를 나타내지 못한다는 결과를 확인하였다. 이러한 결과는 AE20-SRPL의 지질축적 억제 효과가 지방세포 분화과정의 초기 단계에서 adipogenesis 유도 관련 인자의 발현억제를 통해 나타남을 시사한다. 또한, AE20-SRPL은 adipogenesis 관련 핵심 전사인자인 PPARγ와 CEBPα의 단백질 수준을 유의미하게 감소시켰다. 이러한 결과는 AE20-SRPL이 PPARγ와 CEBPα의 단백질 수준을 감소시킴으로써 초기 단계에서 지방세포 분화를 억제한다는 것을 시사한다. 이는 AE20-SRPL이 지방세포 형성을 조절하여 비만을 예방 및 관리할 수 있는 가능성을 제시한다.
더욱이, 우리는 AE20-SRPL이 β-catenin의 단백질 수준을 증가시키며, β-catenin이 knockdown된 세포에서는 AE20-SRPL에 의해 유도되는 PPARγ와 CEBPα 단백질 수준의 감소가 나타나지 않는다는 것을 확인하였다. 실제로 β-catenin은 지방전구세포에서 PPARγ와 CEBPα의 발현을 억제하여 지방전구세포를 비분화 상태로 유지하는 역할을 한다고 보고된 바 있다. 반대로, β-catenin 수준이 감소하면 PPARγ와 CEBPα의 발현이 증가하여 지방전구세포의 adipogenesis가 유도 된다고 알려져 있다(Rosen and MacDougald, 2006). 이는 β-catenin이 PPARγ와 CEBPα 발현 조절을 통해 지방전구세포의 지방 형성 분화를 조절하는 중심적인 역할을 수행함을 나타낸다. 따라서, β-catenin 수준을 증가시키는 전략은 지방 형성을 억제하기 위한 화합물 개발의 주요 타겟으로 활용될 수 있다. 결론적으로, 본 연구 결과는 AE20-SRPL이 β-catenin 신호를 활성화하여 PPARγ와 CEBPα의 발현을 감소시킴으로써 지방전구세포의 지방 형성 분화를 억제한다는 것을 증명하는 중요한 근거로 사용될 수 있다. 또한, 이러한 결과는 AE20-SRPL를 기반으로 한 항비만 소재 개발에 기여할 수 있는 새로운 과학적 접근을 제시할 수 있다.
적 요
본 연구에서는 3T3-L1세포에서 AE20-SRPL이 β-catenin을 증가시켜 PPARγ와 CEBPα을 감소시켜 지질축적을 억제한다는 것을 구명하였다. 이러한 결과는 AE20-SRPL이 항비만 활성을 지닌다는 것을 보여준다. 그럼에도 불구하고 본 연구에는 몇 가지 한계점이 존재한다. 첫째, 본 연구는 지방전구세포인 3T3-L1 세포를 사용하여 in vitro에서만 진행되었다. 이러한 결과는 잠재적인 항비만 기전을 시사하지만 이러한 효과를 재검증하고 AE20-SRPL이 생체 내에서 어떻게 작용하는지를 이해하기 위해 추가적인 in vivo 연구가 필요하다. 둘째, 본 연구에서는 AE20-SRPL이 항비만 활성을 나타내는데 어떤 특정 성분이 작용하는지 밝혀지지 않았다. 이는 AE20-SRPL의 항비만 관련 연구결과를 완전히 이해하는 데 한계를 줄 뿐 아니라 AE20-SRPL을 활용한 효과적인 항비만 소재를 개발하는 데도 어려움을 줄 수 있다. 이를 해결하려면, AE20-SRPL의 화학적 성분을 분리하고, 그중 활성 성분을 찾아내는 분석이 필요하다.




