서 언
재료 및 방법
실험재료
추출물 제조
세포 배양
Oil red O 염색
SDS-PAGE 및 Western blot 분석
Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR)
통계분석
결과 및 고찰
섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물이 RAW264.7 세포에서 면역증진인자의 생성에 미치는 영향
TLR2/4가 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물에 의한 면역증진인자 생성유도에 미치는 영향
MAPKs가 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물에 의한 면역증진인자 생성유도에 미치는 영향
섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물이 3T3-L1 세포의 지질축적억제에 미치는 영향
섬괴불나무 열매(LIF) 추출물dl 3T3-L1 세포에서 지질분해와 관련된 단백질 발현에 미치는 영향
섬괴불나무 열매(LIF) 추출물이 갈색지방조직으로의 분화유도에 관여하는 단백질 발현에 미치는 영향
적 요
서 언
섬괴불나무(Lonicera Insularis Nakai)는 인동과(Caprifoliaceae) 인동속(Lonicera)에 분류된 식물로 주로 울릉도, 독도 해안가에 분포하는 한국특산식물이다(Jeong et al., 2014). 섬괴불나무의 꽃은 5-6월에 개화하며 잎 모양은 난형, 타원형, 도란형을 띈다(Lee et al., 2020). 인동과(Caprifoliaceae)식물의 경우, iridoids, lignans, flavonoids와 같은 화학성분을 가지고 있으며, 과거 민간요법으로 꽃, 잎, 줄기가 해열, 해독 및 암 치료를 위해 사용된 것으로 알려져 있다(Lee et al., 2020). 섬괴불나무는 phenylpropanoid계열의 salidroside, p-coumaryl alcohol-4-O-glucoside, iridoid계열의 loganic acid, loganin, periclymenoside 그리고, secoiridoid계열에 속하는 sweroside, secologanol, secologanin, threninosecologanin과 같은 화합물을 함유한 것으로 보고되고 있다(Kim, 2017).
면역체계는 박테리아, 바이러스와 같은 다양한 병원성 유기체의 위협으로부터 대처하기 위한 체내 보호 시스템이다(Calder, 2020). 포식작용을 통해 면역의 일부분을 담당하는 대식세포는 활성화되면 면역증진인자를 분비하여 체내 항상성 유지에 관여하는 것으로 보고되어진다(Cavaillon, 1994). 활성화된 대식세포는 nitric oxide (NO), inducible nitric oxide synthase (iNOS), interleukin 1β (IL-1β), tumor necrosis factor-α (TNF-α)와 같은 면역증진인자를 분비하여 체내에 침입한 병원체를 파괴함으로써, 선천면역반응을 이끄는 것으로 알려지고 있다(Hirayama et al., 2018). 이와 같은 면역반응이 일어나기 위해서는 세포 내 신호전달이 요구된다(Marcato et al., 2008). 선행연구를 통해, phosphoInositide-3 kinase (PI3K), protein kinase B (Akt), nuclear factor kappa-light-chain-enhancer of activated B cells (NF-κB), mitogen-activated protein kinases (MAPKs)는 대식세포를 통한 면역증진인자생성에 관여하는 주요 신호전달경로로 보고되고 있다(Yang et al., 2018). 이러한 경로를 통한 대식세포의 활성화는 신체 방어 메커니즘 향상을 위한 중요한 전략으로 여겨지며, 대식세포를 활성화할 수 있는 소재의 관심도 또한 높아지고 있다(Bai et al., 2019; Lee and Hong, 2011). 면역은 비만과도 관련이 있다. 비만은 신체의 면역체계를 약화시키는 주요 원인이다(Bandaru et al., 2013). 적절한 지방세포는 에너지 항상성과 지질대사에 있어서 중요한 임무를 수행하지만, 지방세포의 수와 크기가 증가하게 될 경우, 비만이 발생하게 된다(Wang et al., 2020). 비만은 전 세계적으로 널리 퍼진 비전염성 질병 중 하나로 공중보건의 주요한 관심사이며(De Heredia et al., 2012), 세계보건기구(WHO)에 의해 체내지방조직이 비정상적으로 과다한 상태를 일컫는 질환으로 정의되어있다(Cuthbertson et al., 2020). 오늘날, 고열량 음식 섭취와 적은 신체활동을 특징으로 하는 현대인의 불균형적인 생활양식은 비만뿐만 아니라 당뇨병, 심혈관 같은 만성질환 유발에 큰 영향을 미친다(Gammone and D’Orazio, 2015). 비만과 면역의 연관성에 관한 선행연구에서 비만은 체내의 면역기능을 영양실조와 같은 상태로 만들어 백혈구 수에 영향을 미칠 뿐만 아니라 유사분열 물질에 의한 T세포 및 B세포의 증식을 감소시켜 백신 접종 후, 항체 생성과정에 영향을 미치는 것으로 보고된다(De Heredia et al., 2012). 또한, 비만은 최근 COVID-19와 같은 감염성 바이러스 질환에 취약한 체내 환경을 조성하여 사망위험을 증가시키는 것으로 알려져 있다(Hussain et al., 2020; Yu et al., 2021). 따라서, 지방세포의 분화를 조절하는 것은, 비만 방지를 통해 다양한 질환을 예방하기 위한 중요한 부분으로 간주된다(Wang et al., 2020).
최근, 섬괴불나무 잎을 활용한 항산화 및 항균 활성연구가 보고되었다(Lee et al., 2020). 그러나 그 외, 섬괴불나무의 약리학적 활성연구는 전무한 실정으로 섬괴불나무를 활용한 다양한 약리학적 활성연구가 필요하다고 판단된다. 그리하여 본 연구에서 섬괴불나무의 새로운 기능성을 구명하고자 면역증진 및 항비만 활성을 검증하였다.
재료 및 방법
실험재료
세포배양에 필요한 배지인 DMEM/F-12는 Lonza (Morristown, NJ, USA)에서 구매하였다. 지질축적유도와 지질축적도 확인을 위해 사용된 Dexamethasone, 3-Isobutyl-1-methylxanthine (IBMX), Insulin, Oil Red O staining solution 및 신호전달경로 확인을 위한 C29 (TLR2 inhibitor), TAK-242 (TLR4 inhibitor), PD98059 (ERK1/2 inhibitor), SB203580 (p38 inhibitor) 및 SP600125 (JNK inhibitor)는 Sigma-Aldrich (St. Louis, MO, USA)에서 구매하였다. Western blot을 위한 분석용 일/이차 항체들은 Cell Signaling Technology (Danvers, MA, USA)에서 구매하였다.
추출물 제조
연구에 사용된 시료는 울릉도에 자생하는 섬괴불나무(Lonicera insularis Nakai)를 사용하였으며, 동결건조 후 분쇄한 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS)를 각 1 g을 20 mL 증류수에 침지하여 40℃의 water bath에서 24시간 동안 추출하였다. 추출물은 15,000 rpm에서 20분간 원심분리를 진행하였으며 상등액만을 동결건조하여 최종 섬괴불나무 부위별 추출물 열매(LIF), 잎(LIL), 그리고 줄기(LIS)를 획득했다. 얻어진 추출물은 –80℃의 냉동고에 보관하며 연구를 위한 시료로 사용되었다.
세포 배양
본 연구에 사용된 RAW264.7 마우스 대식세포와 3T3-L1 마우스 지방전구세포는 American Type Culture Collection (Manassas, VA, USA)에서 구매하였다. 섬괴불나무 부위별 추출물 열매(LIF), 잎(LIL) 그리고 줄기(LIS)의 면역 활성 확인을 위한 RAW264.7 세포는 10% Fetal bovine serum, 100 U/mL penicillin과 100 ㎍/mL streptomycin이 함유된 DMEM/F-12 배지를 이용하여 37℃, 5% CO2 하에서 배양되었으며, 섬괴불나무 부위별 추출물 열매(LIF), 잎(LIL) 그리고 줄기(LIS)의 항비만 활성 확인을 위한 3T3-L1 세포는 6 well에 배양된 후, 100% 찬 시기인, D0에 (10% FBS, 1 μM dexamethasone, 0.5 mM 3-isobutyl-1-methylxanthine, 10 ㎍/mL insulin)이 혼합된 DMI배지를 이용하여 48시간 배양하였다. D2와 D4에는 10% FBS와 10 ㎍/mL insulin을 포함하는 DMEM/F-12 배지에 48시간 동안 배양하였으며, D6에는 10% FBS가 포함된 DMEM/F-12 배지로만 교체하여 배양을 진행하였다.
Oil red O 염색
3T3-L1 세포에 처리된 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물의 항비만 활성을 확인하기 위해 Oil Red O staining을 진행하였다. 3T3-L1 처리기간이 D8이 되던 시기에, 1 × phosphate-buffered saline (PBS)로 2회 세척 하였다. 실온에서 10% formalin으로 1시간 동안 고정한 후, 증류수로 2회 세척하여 건조한 뒤, 60% isopropanol를 사용하여 5분간 실온에 두었다. 5분 후, 3T3-L1 세포를 완전히 건조한 다음, 실온에서 60% isopropanol : 40% water 비율로 제조한 Oil Red O 용액을 사용하여 세포를 20분간 염색하였다. 염색 후, 증류수로 5회 세척한 뒤, 3T3-L1 세포에 염색된 지질 방울을 광학현미경(Olympus, Tokyo, Japan)으로 촬영하였다. 촬영 후, 염색된 지질 방울은 100% isopropanol을 사용해 용출시켜 96-well에 100 ㎕씩 분주하여 UV/Visible spectrophotometer (Xma-3000PC, Human Corporation Co., Seoul, Korea)를 이용하여 500 ㎚에서 흡광도를 측정하였다.
SDS-PAGE 및 Western blot 분석
섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물이 처리된 대식세포에서 단백질을 추출하기 위해, 4℃에서 보관한 1 × phosphate-buffered saline (PBS)로 plate를 2회 washing한 뒤, protease inhibitor cocktail (Sigma-Aldrich Co.), phosphatase inhibitor cocktail (Sigma-Aldrich Co.), radioimmunoprecipitation buffer (Boston Bio Products, Ashland, MA, USA)를 혼합해 만든 buffer를 이용하여 단백질을 회수하였으며 4℃에서 30분간 방치하였다. 추출된 단백질은 Bicinchoninic acid protein assay (Pierce Biotechnology Inc., Waltham, MA, USA)기법을 통해 정량분석 하였으며, 계산된 단백질량은 10%, 12% SDS-acrylamide gel에 loading하여 전기영동을 진행하였다. 전기영동이 완료된 gel은 transfer를 통해 2시간 동안 PVDF membrane (Bio-Rad, Hercules, CA, USA)에 이동시켰다. 단백질이 이동된 membrane은 실온에서 5% non-fat dry milk로 1시간 동안 blocking을 진행했다. 1시간 후, 5% bovine serum albumin (GenDEPOT, TX, USA)에 녹인 1차 항체를 4℃에서 20시간 동안 반응시킨 후, membrane을 0.05% tween-20로 만들어진 tris-buffered saline (TBS-T)를 이용하여 10분간 3회 washing 하였다. 그 후, 실온에서 5% non-fat dry milk에 녹인 2차 항체를 membrane에 1시간 반응시켰으며 1시간 후, TBS-T로 10분간 3회 washing한 후, ECL western blotting substrate (Amersham Biosciences Co., Little Chalfont, England)를 이용하여 암실에서 10분간 반응시킨 뒤, C-DiGit® Blot Scanner(LI-CDR, USA)의 standard 조건으로 촬영하였다.
Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR)
섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물이 처리된 대식세포에서 RNA를 추출하기 위해, 4℃에서 보관한 1 × phosphate-buffered saline (PBS)로 2회 세척 후, RNeasy mini kit (QIAGEN GmbH., Hilden, Germany)의 순서에 따라 total RNA를 추출하였다. cDNA는 total RNA 1 ㎍과 Verso cDNA synthesis kit (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 합성되었다. PCR에 사용된 primer의 sequence는 아래 같으며(Table 1), PCR 과정은 PCR Master Mix Kit (Promega Co., Madison, WI, USA)를 이용하여 진행되었다.
Table 1.
Sequence of oligonucleotide primers used for RT-PCR
통계분석
확인된 결과는 3회 반복 측정하였으며, 평균값은 ± 표준편차로 표기하였다. 처리 간 유의성은 Student’s t-test 검증을 통해, p-value 값이 0.05 미만인 경우, 통계적으로 유의성이 있다고 평가하였다(Microsoft Excel 2010, Microsoft, Redmond, WA, USA).
결과 및 고찰
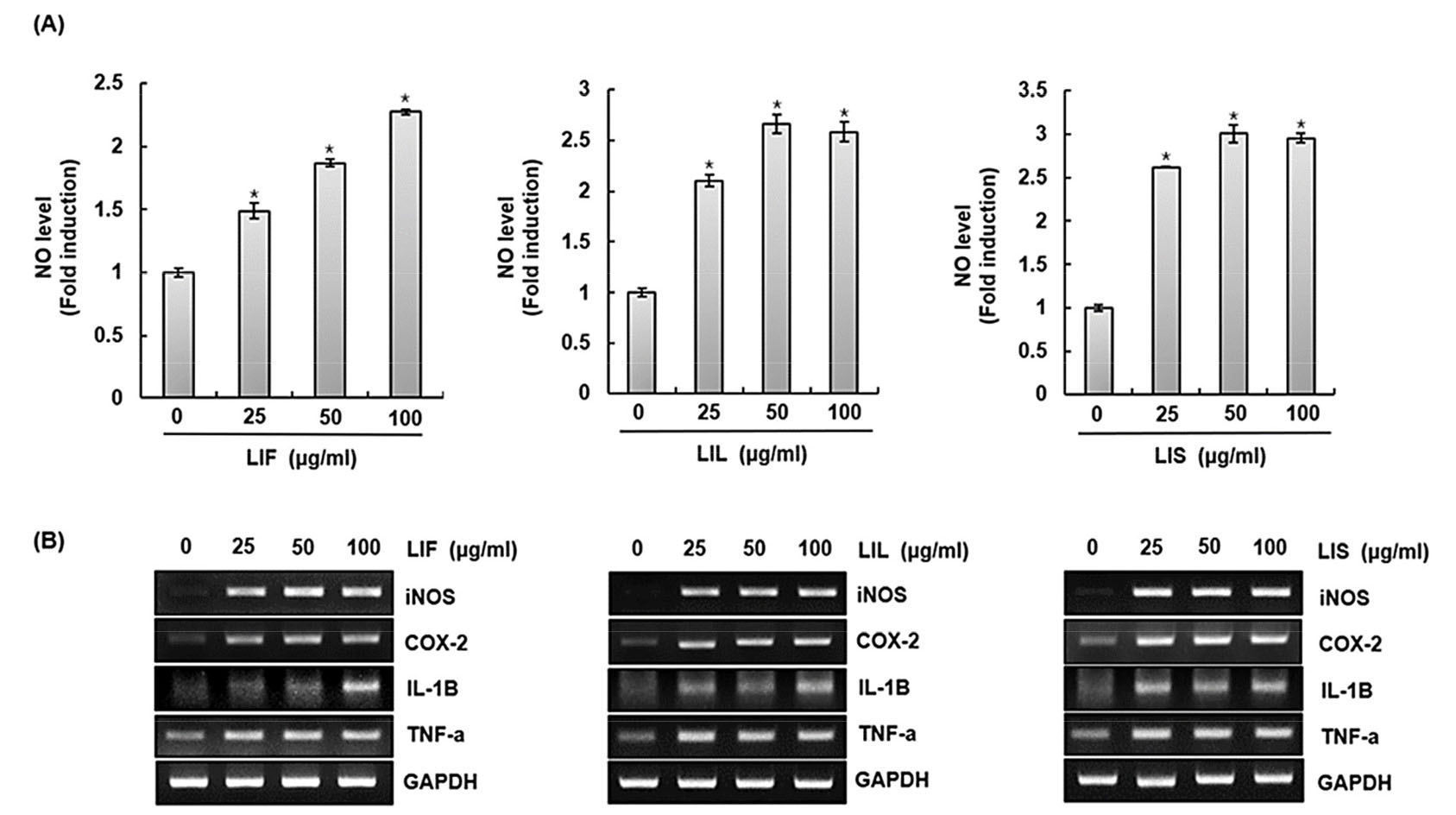
섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물이 RAW264.7 세포에서 면역증진인자의 생성에 미치는 영향
섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물이 면역증진인자 생성에 미치는 영향을 확인하기 위해, RAW264.7 세포에 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물을 다양한 농도(0, 25, 50, 100 ㎍/mL)로 각각 24시간 처리한 후, 대식세포가 활성화될 때 분비되는 면역증진인자(NO, iNOS, COX-2, TNF-α, IL-1β)을 확인하였다. Nitric oxide (NO)는 대식세포가 활성화될 경우 분비되는 면역계 독성인자로 림프구를 통해 면역증진인자 생성에 관여하는 것으로 보고되며(Bogdan et al., 2000), inducible nitric oxide synthase (iNOS)는 염증성 자극에 반응하여 NO생성을 통해 대식세포의 염증반응에 관여하는 중요한 요소로 알려져 있다(McNeill et al., 2015). Cyclooxygenase-2(COX-2)는 면역반응에 관여하는 prostaglandin의 생산과 관련된 유도성 효소이다(Giroux and Descoteaux, 2000). Prostaglandin중 E와 F계열은 B세포의 활성화를 통한 항체 생산과 체액성 면역반응에 관여하는 것으로 보고되어진다(Goodwin and Webb, 1980). Tumor necrosis factor-α (TNF-α)의 경우 대식세포의 활성화 및 항원제시 기능을 강화시켜 면역을 조절한다고 보고된다(Wang and He, 2020). 그리고 interleukin-1β (IL-1β)는 선천, 적응면역계 세포 활성화를 통해 면역에 관여하는 것으로 알려져 있으며(Weber et al., 2010), IL-1β는 IL-1수용체인 IL-1R과 MyD88을 통한 신호전달에서 inducible nitric oxide synthase (iNOS)의 매개를 통해 NO생성을 유도하여 감염에 대한 내성 강화에 도움이 되는 것으로 보고된다(Lima-Junior et al., 2013). 그 결과, NO생성은 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물의 순서로 증가하였으며(Fig. 1A), RT-PCR을 통해 확인한 면역증진인자의 발현변화에서는(Fig. 1B), 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물 모두, iNOS, IL-1β, TNF-α, COX-2의 발현을 증가시켰다. 본 결과로부터 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물은 면역증진인자 발현을 유도하여, 면역시스템을 강화할 수 있는 소재로의 개발이 가능할 것으로 판단된다.
TLR2/4가 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물에 의한 면역증진인자 생성유도에 미치는 영향
Toll-like receptors (TLRs)는 선천면역반응을 활성화하는 필수적인 기능을 하는 것으로 보고되며, TLRs중 TLR2/4는 병원체의 특정패턴인식을 통해 선천 및 적응성 면역반응을 형성하여 체내 균형을 조절하는데, 중요한 부분을 담당하는 것으로 알려진다(Takeda and Akira, 2004; Mukherjee et al., 2016). TLR2는 비 TLR 분자와의 상호작용을 통해 박테리아, 곰팡이, 바이러스에서 파생되어진 다양한 PAMP (Pathogen-associated molecular pattern) 인식에 관여하는 것으로 알려져 있으며(De Oliviera Nascimento et al., 2012), TLR4는 감염성 질환에서 면역계의 약리학적 조절을 위한 치료제로 부상하고 있다(Mukherjee et al., 2016). 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물의 대식세포를 통한 면역증진인자 생성과정과 TLR2/4 사이의 관계성을 확인하기 위해, RAW264.7 세포에 C29 (TLR2 inhibitor), TAK-242 (TLR4 inhibitor)를 2시간 전에 처리하고, 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물을 24시간 병용 처리한 뒤 나타나는 면역증진인자 생성변화를 확인하였다(Fig. 2A). NO의 경우 C29 (TLR2 inhibitor)를 처리한 구에서 생성이 다소 억제되었고, TAK-242 (TLR4 inhibitor)를 처리한 구에서 상당히 억제되는 것이 확인되었다. 면역증진인자의 발현변화를 RT-PCR을 통해 확인한 결과(Fig. 2B), C29를 처리한 구에서 IL-1β의 발현이 억제되었으며, TAK-242를 처리한 구에서는 iNOS, COX-2, IL-1β의 발현이 억제되는 것을 확인할 수 있었으며, 해당 실험으로부터, 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물의 대식세포를 통한 면역증진인자 생성과정은 TLR2/4와 관련성이 있으며, NO생성은 IL-1β의 발현과 연관된 것으로 판단된다.
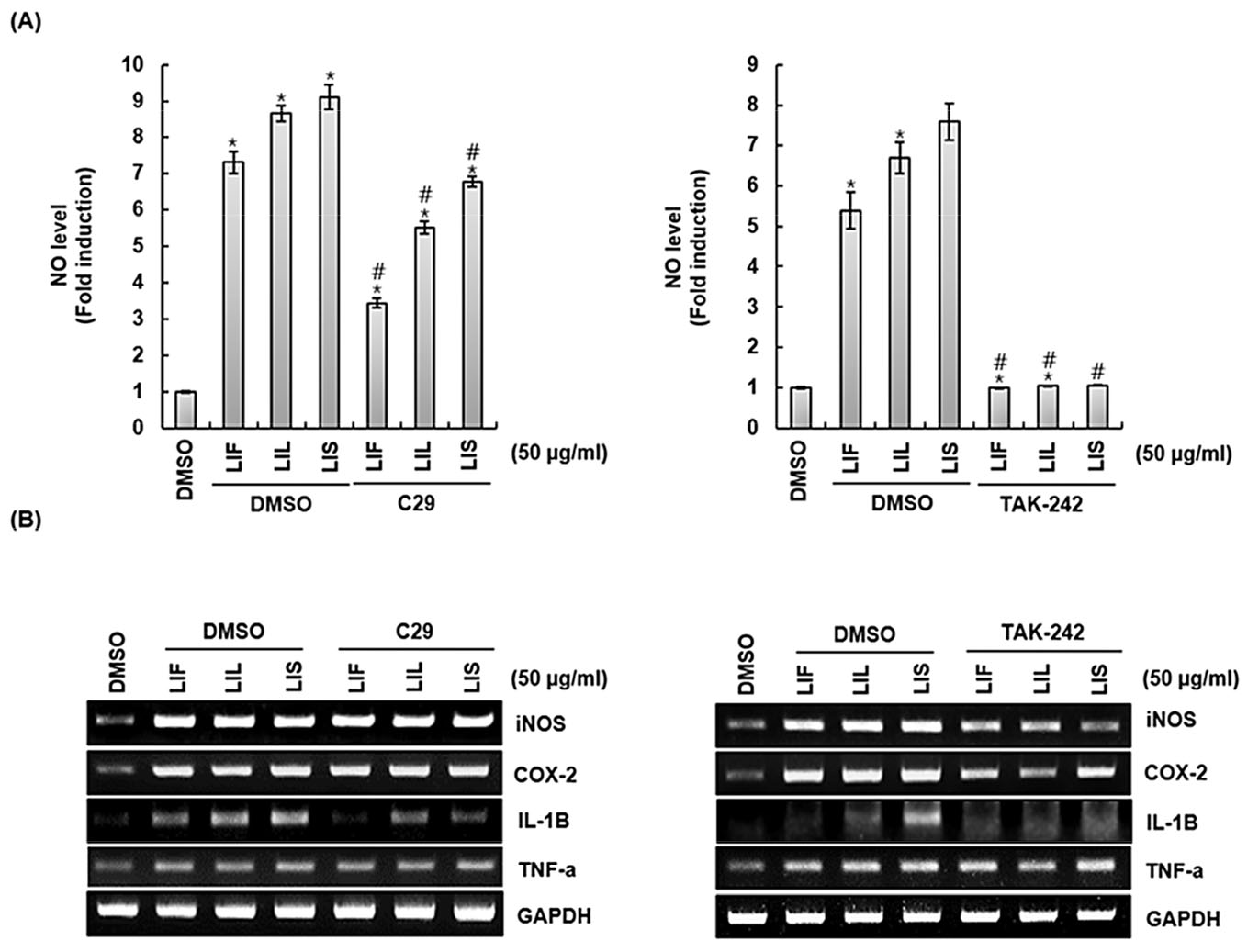
Fig. 2.
Effect of TLR2/4 on the production of immunostimulatory factors in LIF, LIL and LIS treated RAW264.7 cells. RAW264.7 cells were pre-treated with C29 (TLR2 inhibitor, 100 μM) or TAK-242 (TLR4 inhibitor, 5 μM) for 2 h and treated with LIF, LIL and LIS for 24 h. NO level (A) and mRNA level (B) were measured by Griess assay and RT-PCR, respectively. GAPDH was used as internal control for RT-PCR. *P < 0.05 compared to the cells without the treatment. #P < 0.05 compared to the cells treated with LIF, LIL and LIS alone.
MAPKs가 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물에 의한 면역증진인자 생성유도에 미치는 영향
Extracellular signal-regulated kinase 1/2 (ERK1/2), c-Jun N-terminal kinases (JNK), 그리고 p38로 구성된 mitogen-activated protein kinases (MAPKs)는 세포의 증식, 분화, 사멸, 스트레스 반응과 같은 과정에 관여하는 신호전달경로로 다양한 수용체의 신호조합과 변환을 통해 면역세포의 대사, 이동, 생성, 분화에 관여하는 것으로 보고된다(Alam and Gorska, 2011; Guo et al., 2020). JNK는 환경적 스트레스에 의해 생성된 염증성 사이토카인에 의해 활성화되는 것으로 알려져 있으며(Yoshizumi et al., 2000), 세포사멸, 생존, 성장에도 관여하는 것으로 보고된다(Barr and Bogoyevitch, 2001). p38은 다양한 외부신호 해석을 통해 면역과 같은 생물학적 반응을 조절하는 것으로 알려져 있으며(Cuadrado and Nebreda, 2010), ERK1/2는 세포분화, 증식, 형질전환과 같은 기능조절에 관여하는 것으로 보고된다(Lake et al., 2016). 최근, 천연소재 추출물이 TLR을 통해 MAPKs를 활성화하여 면역증강에 도움이 된다고 보고되고 있다(Ren et al., 2017; Yang et al., 2019). Artemisia sphaerocephala Krasch 종자에서 획득한 다당체인 ASKP-1의 경우 TLR4를 통해 PI3K, Akt, NF-κB, MAPKs 경로를 자극하여 RAW264.7 세포 활성화에 관여하였으며(Ren et al., 2017), Physalis alkekengi L. 열매는 TLR2/4 의존성 NF-κB 및 MAPKs 신호전달경로 활성화를 통해 대식세포의 탐식능 및 NO, TNF-α의 생성을 촉진하였다(Yang et al., 2019). MAPKs 신호전달경로와 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물이 처리된 RAW264.7 세포의 면역증진인자 생성과정 간의 관계성을 확인하기 위해, RAW264.7 세포에 2시간 동안 PD98059 (ERK1/2 inhibitor), SB203580 (p38 inhibitor), SP600125 (JNK inhibitor)를 전 처리한 후, 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물을 24시간 병용 처리하였다. 그 후, NO와 면역증진인자의 생성변화를 측정하였다(Fig. 3A). 그 결과, PD98059를 처리한 구에서의 NO생성의 변화는 없었지만, SB203580과 SP600125에서 NO생성이 억제되는 것을 확인할 수 있었다. NO생성이 억제된 SB203580, SP600125가 처리된 구의 면역증진인자의 변화를 확인하기 위해 RT-PCR을 진행하였다(Fig. 3B). SB203580 (p38 inhibitor)를 처리한 구에서는 iNOS, COX-2, IL-1β의 발현이 다소 억제되었으며, SP600125 (JNK inhibitor)를 처리한 구에서 iNOS, COX-2, IL-1β의 발현이 상당히 억제되는 것을 확인할 수 있었다. 본 결과로부터, 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물이 처리된 대식세포의 면역증진인자 생성과정은 p38 그리고 JNK와 관련성이 있는 것으로 판단된다.
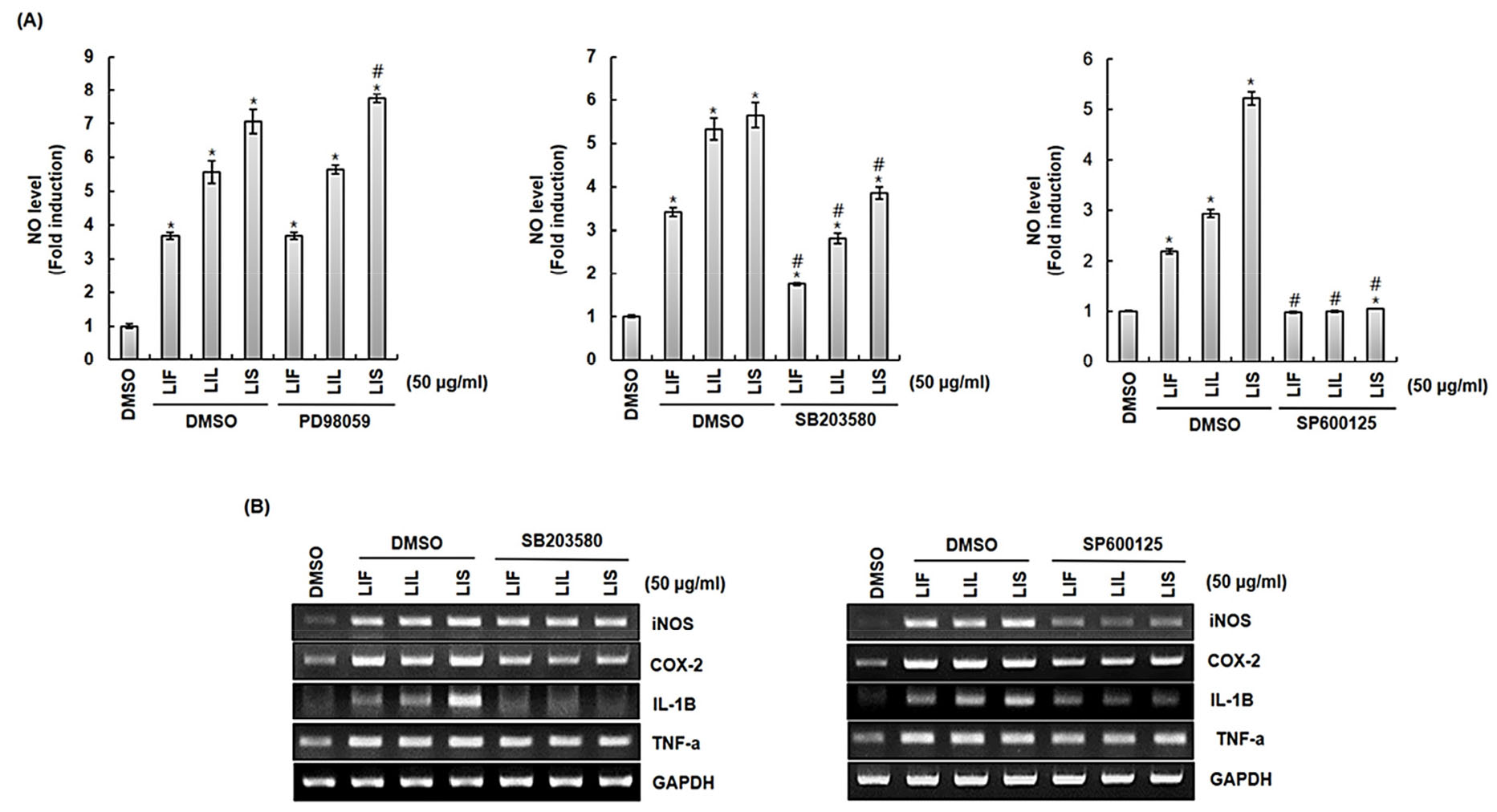
Fig. 3.
Effect of MAPK signaling pathway on the production of immunostimulatory factors in LIF, LIL and LIS treated RAW264.7 cells. RAW264.7 cells were pre-treated with PD98059 (ERK1/2 inhibitor, 40 μM), SB203580 (p38 inhibitor, 40 μM), SP600125 (JNK inhibitor, 40 μM) for 2 h and then treated with LIF, LIL and LIS for 24 h. NO level (A) and mRNA level (B) were measured by Griess assay and RT-PCR. GAPDH and Actin were used as internal control for RT-PCR, Western blot. *P < 0.05 compared to the cells without the treatment. #P < 0.05 compared to the cells with LIF, LIL and LIS alone.
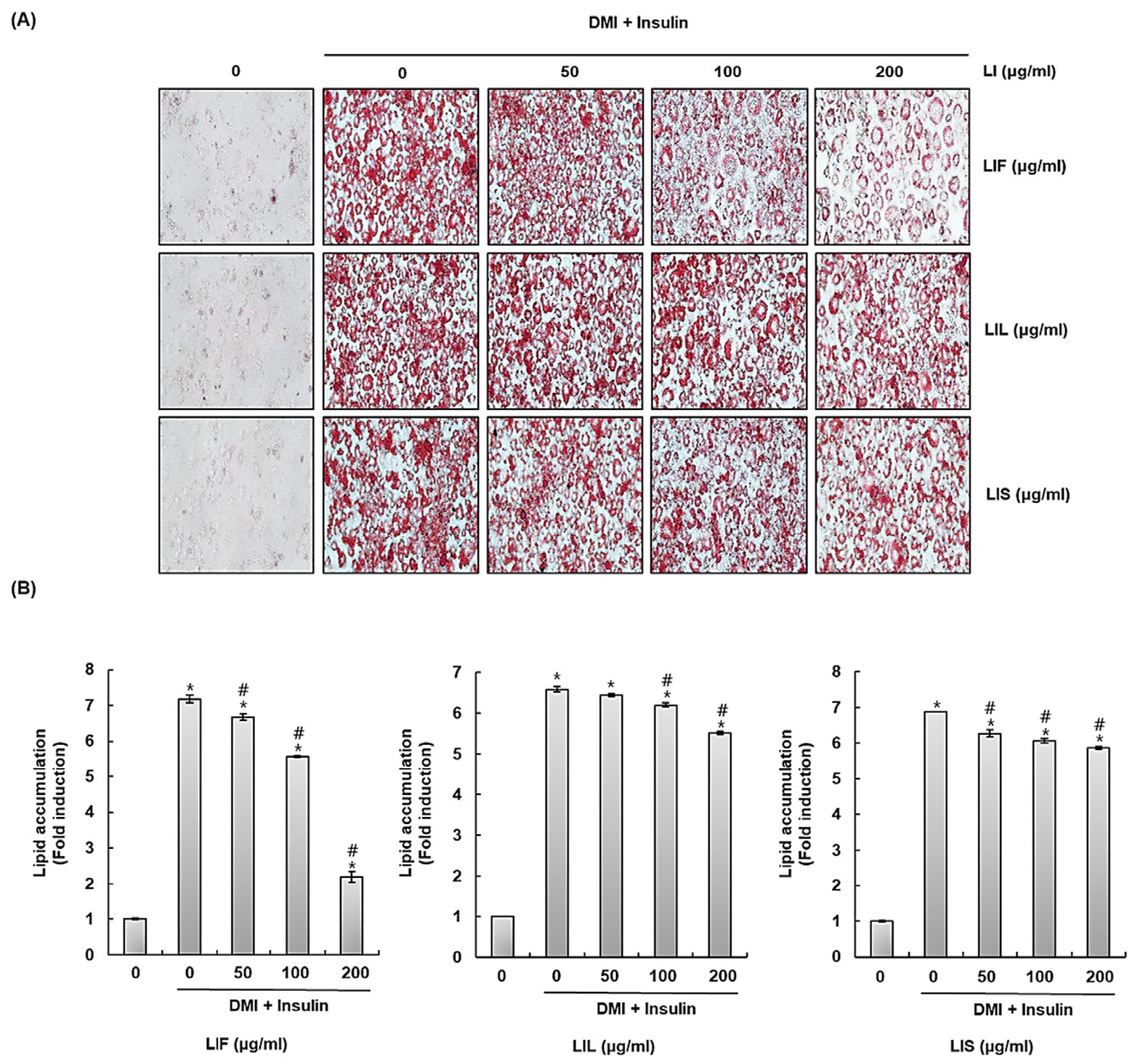
섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물이 3T3-L1 세포의 지질축적억제에 미치는 영향
지난 수십 년 동안 비만 발생률은 꾸준히 증가해왔으며, 매년 전례 없는 수준을 기록해온 것으로 보고된다(Suzanne and Aronee, 2012). 비만이 증가함에 따라, 비만 치료를 위한 소재개발의 관심 또한 증가하고 있다. 이에 따라, 섬괴불나무 열매(LIF), 잎(LIL), 그리고 줄기(LIS) 추출물의 항비만 소재개발 및 활용 가능성을 알아보고자 DMI/insulin처리를 통해 지질축적을 유도한 3T3-L1 세포에 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물을 다양한 농도(0, 50, 100, 200 ㎍/mL)로 8일 동안 처리한 뒤, Oil red O staining을 통해 3T3-L1 세포 내 지질축적의 변화를 확인하였다(Fig. 4A). 섬괴불나무 잎(LIL)과 줄기(LIS) 추출물이 처리된 구는 처리농도가 증가하더라도 농도에 따른 지질축적의 변화를 보이지 않았지만, 섬괴불나무 열매(LIF) 추출물이 처리된 구의 경우, 농도 의존적으로 3T3-L1 세포 내 지질축적이 억제되는 것을 확인할 수 있었다(Fig. 4B). 본 결과로부터, 섬괴불나무 열매(LIF) 추출물은 항비만 소재로의 잠재적 가능성을 보유한 것으로 판단된다.
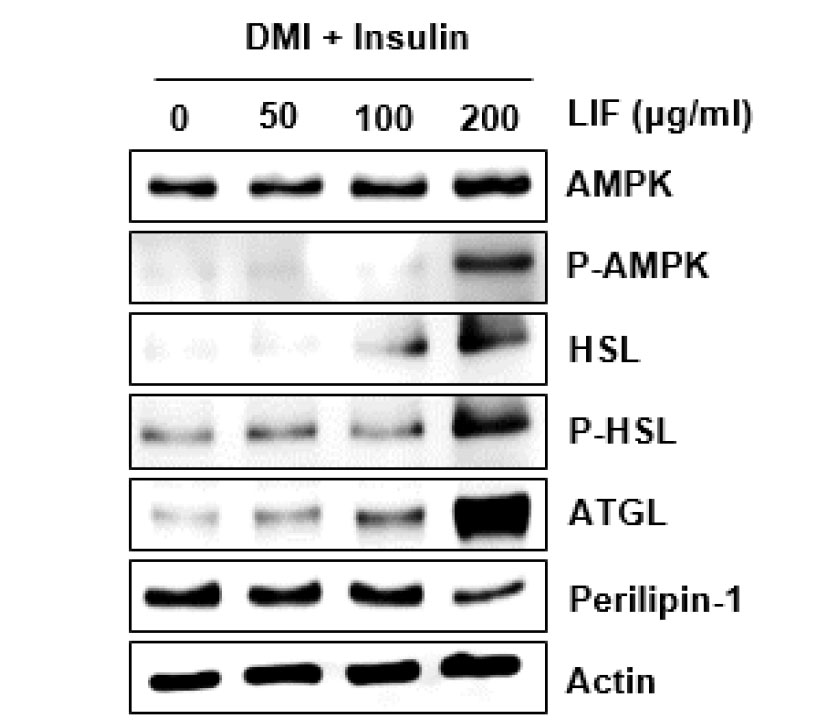
섬괴불나무 열매(LIF) 추출물dl 3T3-L1 세포에서 지질분해와 관련된 단백질 발현에 미치는 영향
지방세포에서 지방분해를 증가시키는 것은 비만 치료에 있어 유용한 표적으로 작용한다(Ahmadian et al., 2010). 따라서, 섬괴불나무 열매(LIF) 추출물이 AMP-activated protein kinase (AMPK), phospho-AMP-activated proein kinase (P-AMPK), hormone sensitive lipase (HSL), phospho-hormone sensitive lipase (P-HSL), adipose triglyceride lipase (ATGL)과 같은 지방분해기능과 관련된 단백질 발현에 영향을 미치는지 알아보기 위해 실험을 진행하였다. 기존 연구결과에 따르면, AMPK는 지방세포에서 포도당과 지질의 항상성을 조절하는 역할을 하며(Hwang et al., 2007), AMPK의 활성화는 비만, 제2형 당뇨병 및 대사증후군과 같은 질환 치료에 있어 매력적인 전략으로 간주된다(Hwang et al., 2007). 또한, AMPK는 지방에서 HSL과 ATGL과 같은 lipase를 직접 인산화시키는 것으로 보고된다(Mihaylova and Shaw, 2011). HSL은 지방분해 과정에 있어서 속도제한단계를 촉매하는 주요 lipase의 역할을 하며 ATGL은 기초지방분해에 관여한다(Johan et al., 2007). Perilipin-1의 경우, 지질세포를 구성하고 있는 일종의 코팅 단백질로 지질대사를 조절하는 역할을 하며(Hansen et al., 2017), 지방세포에서 지질방울의 형성을 촉진하고 지방세포의 지방분해를 차단하는 것으로 알려져 비만치료에 있어 새로운 표적으로 간주되고 있다(Alam et al., 2016). DMI/insulin처리를 통해 지질축적을 유도한 3T3-L1 세포에 섬괴불나무 열매(LIF) 추출물을 다양한 농도(0, 50, 100, 200 ㎍/mL)로 8일 동안 처리한 뒤, Western blot을 통해 지질분해 및 지질형성에 관여하는 단백질인 AMPK, HSL, ATGL, perilipin-1의 발현변화를 측정하였다(Fig. 5). AMPK, HSL, ATGL의 발현은 농도 의존적으로 증가하는 모습을 보였으며, perilipin-1은 농도 의존적으로 감소하는 모습을 확인할 수 있었다. 본 결과를 미뤄볼 때, 섬괴불나무 열매(LIF) 추출물은 지방세포에서의 지질분해 단백질의 발현과 perilipin-1 생성억제를 통해 지질축적억제기능을 수행하는 것으로 판단된다.
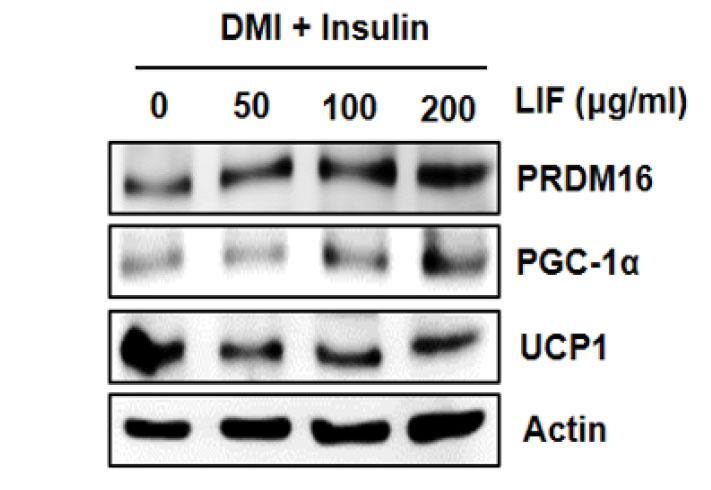
섬괴불나무 열매(LIF) 추출물이 갈색지방조직으로의 분화유도에 관여하는 단백질 발현에 미치는 영향
체내 지방조직은 크게 백색지방조직과 갈색지방조직으로 분류된다. 첫째, 백색지방조직(White adipose tissue, WAT)은 에너지 대사의 규제 및 저장장소 역할을 하며, 혈압조절과 같은 생물학적 작용에 관여한다(Wronska and Kmiec, 2012). 둘째, 갈색지방조직(Brown adipose tissue, BAT)은 열 발생을 통해 체지방을 조절하며, 이 과정에서 미토콘드리아 막 단백질(uncoupling protein-1, UCP-1)이라고 불리는 결합해제 단백질에 영향을 받는 것으로 보고된다(Yoneshiro and Satio, 2015). 최근 연구를 통해 갈색지방조직의 포도당, 지질대사 조절과 같은 기능이 밝혀지면서, 갈색지방조직은 비만과 관련된 대사질환의 치료 표적으로 주목받고 있다(Yoneshiro and Satio, 2015). 선행연구로, 섬괴불나무 열매(LIF) 추출물이 DMI/insulin처리를 통해 지질축적을 유도한 3T3-L1 세포에서 지방분해의 활성을 갖는 것을 확인할 수 있었다. 더 나아가, 섬괴불나무 열매(LIF) 추출물이 지방세포의 갈색지방으로의 분화유도와 열 발생 유전자발현을 통해 체내 에너지 소비를 촉진할 수 있는지 확인하고자 PR domain-containing16 (PRDM16), peroxisome proliferator-activated receptor gamma coactivator 1α (PGC-1α), uncoupling protein-1 (UCP-1)과 같은 단백질의 발현 여부를 확인하였다. PRDM16은 peroxisome proliferator-activated receptor-gamma (PPARγ)에 결합하여 갈색지방으로의 분화를 유도하는 것으로 알려진다(Seale et al., 2008). AMPK 신호전달을 통해 발현이 조절되는 peroxisome proliferator-activated receptor gamma coactivator 1α (PGC-1α)는 포도당 대사, 지방산 산화와 같은 에너지 대사 관련 유전자발현을 조절하며, 항비만, 항당뇨 성분의 화합물은 PGC-1α의 발현을 증가시키는 것으로 알려진다(Yokokawa et al., 2015). 또한, 기존 연구결과에 따르면, PGC-1α는 지방조직의 에너지 소비를 증가시켜, 전신 대사에 유익한 작용을 할뿐만 아니라 UCP-1과 같은 열 생성유도 단백질을 조절하며(Pettersson-Klein et al., 2018), PGC-1α를 활성화하는 약리학적 작용은 비만, 대사질환 치료에 있어 중요한 열쇠로 간주된다고 보고되어진다(Pettersson-Klein et al., 2018). Western blot 결과, 갈색지방세포의 분화와 에너지 대사 및 열 생성 단백질의 발현을 조절하는 PRDM16, PGC-1α의 인자 발현은 농도 의존적으로 증가하는 것이 확인되었지만(Fig. 6) UCP-1의 발현은 차이를 보이지 않았다. 본 결과를 미뤄볼 때, 섬괴불나무 열매(LIF) 추출물은 지방세포에서 갈색지방세포로의 분화유도와 에너지 대사에 관여하는 단백질의 발현을 통해서 과도한 지질축적을 억제하는 것으로 판단된다.
적 요
본 연구에서는 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물의 면역증진 활성과 섬괴불나무 열매(LIF) 추출물의 항비만 활성을 평가하였다. 섬괴불나무 열매(LIF), 잎(LIL) 그리고 줄기(LIS) 추출물은 RAW264.7 세포에서 NO, iNOS, COX-2, IL-1β, TNF-α와 같은 면역증진인자의 생성을 증가시켰으며, IL-1β의 발현은 NO생성과 관련된 것으로 보여진다. 면역증진인자은 TLR2/4를 통해 MAPKs중 p38 그리고 JNK를 자극하여 발현이 유도되는 것으로 판단된다. 항비만 실험에서, 섬괴불나무 열매(LIF) 추출물은 AMPK, HSL, ATGL의 발현 증가와 perilipin-1 발현 억제를 통해 지질분해를 유도하여 세포 내 지질축적을 억제하는 것으로 나타났으며, 갈색지방세포로의 분화유도와 에너지 대사에 관여하는 인자인 PRDM16, PGC-1α의 발현유도를 통해서도 지질축적을 억제하는 것으로 판단된다. 향후 섬괴불나무 추출물은 건강 보조제 및 기능성 식품으로의 활용이 가능할 것으로 판단되지만, 섬괴물나무 추출물의 어떠한 성분이 면역과 항비만 활성에 영향을 미치는지에 대한 성분분석이 필요하다. 또한, 본 연구는 세포를 이용한 실험으로 정확한 분석을 위해서는 동물모델을 이용한 섬괴불나무 추출물의 면역증진 및 항비만 활성에 관한 추가적인 연구가 진행되어야 할 것이다.