서 언
재료 및 방법
공시재료
기기 및 시약
지표성분 설정 및 분석조건
분석법 밸리데이션
추출조건 설정
큰꽃삽주, 삽주 및 창출의 성분함량
결과 및 고찰
분석법 밸리데이션
추출조건 설정
큰꽃삽주, 삽주 및 창출의 성분함량
적 요
서 언
삽주(Atractylodes japonica Koidzumi)와 큰꽃삽주(Atractylodes macrocephala Koidzumi)는 국화과(Compositae) 삽주 속(Atractylodes spp.) 식물로 뿌리줄기를 그대로 또는 주피를 제거하여 말린 약재를 백출(Atractylodis Rhizoma Alba)로 사용하고 있다(Lee et al., 2002). 백출의 ‘백(白)’은 뿌리의 색이 희다는 뜻이고 ‘출(朮)’은 탁(濁) 하다는 뜻으로, 뿌리의 빛이 희고 형상이 혼탁(混濁) 해 보인다는 약재이다. 한의약적으로는 감고온(甘苦溫)한 약성을 가지고 있으며, 보기건비(補氣健脾), 습(濕)을 제하여 이수 작용을 해 주고 땀을 제거하는 효과와 안태 작용이 있으며, 보중익기탕, 오령산, 이중탕, 향사양위탕에 처방되고 특히 위장에 매우 좋다고 알려져 있다(Jerun, 2015; Lee, 1981).
백출의 주요성분으로는 atractylenolide III, atractylenolide I이 알려져 있으며(Dong et al., 2008; Yun et al., 2013), atractyloside A, B와 같은 sesquiterpene glycoside 및 atractan A, B, C 같은 다당체도 보고되어 있다(Kim et al., 2001; Nishikawaet al., 1977; Yosioka et al. 1974).
한약의 원료가 되는 약용작물의 재배과정이 일반 농산물과 거의 동일하기 때문에 농산물이 가지고 있는 생산 및 유통과정에서의 문제점이 유사하게 적용되고 있으며, 한약재의 품질 불균일성과 위품의 혼입에 따른 사회적 불만이 있다. 특히 백출은 관례적으로 창출과 혼용되어 사용하기도 하는데(Lee et al., 2002), 대한약전에서의 백출은 삽주(Atractylodes japonica Koidzumi)와 큰꽃삽주(Atractylodes macrocephala Koidzumi)를 기원으로 하고, 창출은 북창출(Atractylodes chinensis Koidzumi)과 모창출(Atractylodes lancea De Candlle)를 기원으로 규정하고 있다. 삽주와 큰꽃삽주는 잎의 형태나 뿌리줄기로는 정확하게 구별이 힘들고, 각각 백색과 자홍색의 화색으로 구별할 수 있고, 백출과 창출은 엽병의 유무로 구별이 가능하다(Yoon and Ju, 2018). 하지만 한약재 상태에서는 구별이 힘들어 민간에서는 삽주의 햇뿌리를 백출, 묵은 뿌리를 창출로 오용하고 있다. 이에 위품을 구별하기 위한 품질 기준 설정이 필요한 현실이다. 하지만 백출의 품질 관리를 위하여 대한약전에 성상, 확인시험, 순도시험, 회분, 산불용성 회분, 정유함량이 설정되어 있지만 성분에 대한 정량법은 설정되어 있지 않으며, 홍콩중약재표준(HKCMMS)에서는 atractylenolide Ⅲ가 지표성분으로 설정되어(0.019% 이상) 있으나 창출과의 구별을 위한 품질기준은 제시되어 있지 않았다(The Hong Kong Department of Health, 2019). 이에 백출과 창출을 구별할 수 있는 품질 표준 기준을 설정하여 기원이 명확하고 우수한 품질의 백출을 보급할 수 있게 하고자 실험을 진행하였다.
재료 및 방법
공시재료
본 실험에 사용된 시료는 큰꽃삽주와 창출은 GMP 기관인 ㈜그린명품제약에서 제조한 시료(큰꽃삽주 제조번호: GM075-1800101, 창출 제조번호: GM034-1900101)를, 삽주는 한국한의약진흥원 시범재배포(전라남도 장흥군)에서 재배한 시료를 사용하였다. 각 시료는 한국한의약진흥원 약용작물종자보급센터의 안병관박사가 동정하였으며, 표본시료(큰꽃삽주: AMK-2018-1, 삽주: AJK-2018-1, 창출: ALDC-2019-1)는 한국한의약진흥원 한약자원개발본부의 저장고에 보관되어 있다.
기기 및 시약
표준품으로 사용된 Atractylenolide Ⅲ, atracylodin은 각각 Sigma Aldrich (St. Louis, Oklahoma, USA)와 ChemFaces (Wuhan, China)에서 구입하였고, 각각 99%, 98%의 순도를 사용하였다. 정량분석용 이동상에 사용된 용매인 Water, Acetonitrile (ACN)은 HPLC grade의 J.T. Baker (Phillipsburg, New Jersey, USA) 사의 제품을 사용하였다. 성분분석에 사용된 HPLC는 Agilent 1290 (Agilent Technologies, Santa Clara, California, USA) 사의 HPLC 1200을 사용하였다. 시료의 분쇄는 MM200 mixer mill (RETSCH, Dusseldorf, Germany)를 사용하였다.
지표성분 설정 및 분석조건
식품의약품안전평가원에서 발간된 ‘백출(白朮)의 감별 자료집’에 따르면 혼용되어 유통되고 있는 창출에서만 atracylodin이 다량 검출되는 것을 확인할 수 있었다(Yim et al., 1988; National Institute of Food and Drug Safety Evaluation, 2017). 이에 추후 혼용되는 창출에 대한 감별도 가능할 것으로 판단되어 atractylenolide Ⅲ 및 atracylodin을 대상으로 분석법을 설정하였다. 분석에 사용한 column은 Ascentis express C18 column (4.6 × 100 ㎜, 2.7 ㎛ particle size, Sigma Aldrich)을 사용하였으며, column temperature는 40℃, injection volume은 10 μL, flow rate는 1 mL/min을 유지하였다. 이동상으로는 (A) water와, (B) acetonitrile을 초음파를 이용하여 degassing후 사용하였고, gradient system을 이용하여 분석하였다(Table 1). Detector는 UV detector (236 ㎚)를 사용하였다.
Table 1
Composition of the mobile phase employed in the gradient LC system
| Time (min) | Composition of mobile phase (%) | |
| Water | Acetonitrile | |
| 0 | 60 | 40 |
| 10 | 35 | 65 |
| 20 | 0 | 100 |
| 20.1 | 60 | 40 |
| 28 | 60 | 40 |
분석법 밸리데이션
분석법 밸리데이션은 한국식품의약품안전처의 ‘의약품등 시험방법 밸리데이션 가이드라인’, ‘생약(한약)제제의 성분 프로파일 설정 가이드라인’ 및 ‘기능성원료 인정을 위한 제출자료 작성 가이드’에 따라 특이성, 직선성, 범위, 검출한계, 정량한계, 정확성, 정밀성에 대한 평가를 실행하였다(National Institute of Food and Drug Safety Evaluation, 2010; 2015; 2019).
특이성
특이성의 입증은 PDA detacter를 이용하여 표준품의 흡광도 패턴(200 ~ 400 ㎚)을 분석하였으며, 시료의 동일 retention time에서의 흡광도 패턴을 비교하였다.
직선성, 범위, LOD, LOQ
직선성, 범위, 검출한계(Limit of detection, LOD)와 정량한계(Limit of quantification, LOQ)는 5개의 농도(1, 5, 10, 50, 100 ㎍/mL) 별로 3회 반복 시험을 하였다. 이를 이용하여, 피크 면적비를 구하여 표준품 농도(x, ㎍/mL)와 피크 면적비(y)에 대한 검량선(calibration curve, y=ax+b)을 구하였다. 또한, 검량선으로부터 직선성의 결정계수(coefficient of determination, R2)를 구하여 결정계수(R2) 값이 0.995 이상의 직선성을 가지는 구간을 범위로 설정하였다. LOD와 LOQ는 반응의 표준편차와 검량선의 기울기에 근거하여 계산하는 방법을 이용하였으며, 공식은 아래와 같다.
,
σ: y 절편의 표준편차, S: 검량선의 기울기
정밀성(Precision)
정밀성(Precision) 측정은 실험 환경의 변화에 따라 동일한 샘플에 대한 분석 결과의 변화 정도를 확인하기 위하여 상대표준편차(Relative Standard Deviation, RSD, %)를 이용하여 평가하였다. 이는 반복성(Intra-assay precision) 검사는 3가지 농도를 설정을 하여(6.25, 12.5, 25 ㎍/mL) 3반복 측정하였으며, ‘기능성원료 인정을 위한 제출자료 작성 가이드’ 를 참고하여 상대표준편차(RSD, %)가 5% 이상인 경우 측정 날짜, 사람 간, 기기 간 편차를 추가적으로 확인해야 하는 것을 기준으로 설정하여 평가하였다.
정확성(Accuracy)
표준액 3가지 농도(6.25, 12.5, 25 ㎍/mL)를 각 3회 주입하여 얻은 결과를 검량선에 대입하여 얻은 결과와 참값의 오차 정도(회수율, %)로서 정확성을 평가하였다. 그 범위는 90%에서 110% 사이의 범위를 이상적 범위라고 설정하여 평가하였다.
추출조건 설정
설정한 지표성분에 대한 최적의 추출용매 및 추출시간을 확인하고자 성분분석을 진행하였다. 공시재료를 MM200 mixer mill을 이용하여 초당 25회로 1.5분간 작동하여 분쇄하였다. 추출용매는 100%, 80%, 60% MeOH을 이용하였으며(50 ㎎/10 mL), 초음파 추출기를 이용하여 30분, 60분, 90분간 추출하였다. 추출액은 0.2 ㎛ syringe filter를 이용하여 여과 후 검액으로 사용하였다.
큰꽃삽주, 삽주 및 창출의 성분함량
큰꽃삽주, 삽주 및 창출의 성분 차이를 확인하고자 성분분석을 진행하였다. 분석에 사용된 시료는 공시재료를 MM200 mixer mill을 이용하여 초당 25회로 1.5분간 작동하여 분쇄하였다. 추출용매는 80% MeOH을 이용하였으며(50 ㎎/10 mL), 30분간 초음파 추출기를 이용하여 추출하였다. 추출액은 0.2 ㎛ syringe filter를 이용하여 여과 후 검액으로 사용하였다. 지표성분은 5개의 농도(1, 5, 10, 50, 100 ㎍/mL)를 사용하여, 검량선을 구하였으며, 시료의 면적비를 검량선에 대입하여 성분함량을 계산하였다. 분석조건은 앞서 설정한 조건을 이용하여 분석하였다.
결과 및 고찰
분석법 밸리데이션
특이성
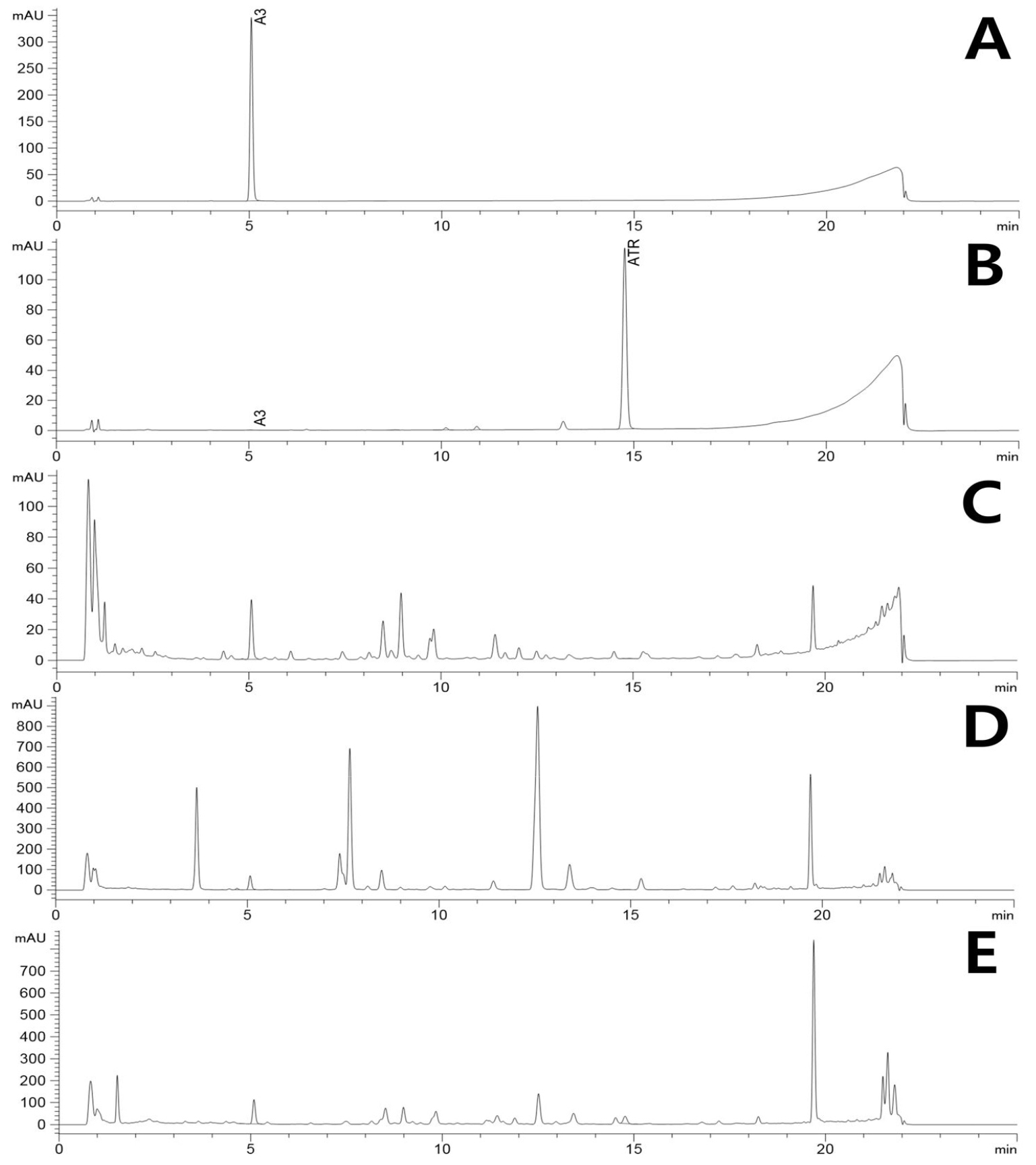
PDA detactor를 이용하여 atractylenolide Ⅲ 표준품의 흡광도(236 ㎚)를 분석한 결과 5.03분에서 peak를 얻었으며, sample을 분석한 결과 이와 동일한 retention time을 갖는 peak를 얻을 수 있었으며, 주변에 다른 peak와의 간섭이 없음을 확인하였다(Fig. 1). PDA detector를 이용하여 atracylodin 표준품의 흡광도(236 ㎚)를 분석한 결과 14.73분에서 peak를 얻었으며, sample을 분석한 결과 이와 동일한 retention time을 가지는 peak를 얻을 수 있었으며, 주변에 다른 peak와의 간섭이 없음을 확인하였다(Fig. 1).
직선성, 범위, LOD, LOQ
Atractylenolide Ⅲ 표준품을 5개의 농도(1, 5, 10, 50, 100 ㎍/mL) 별로 3회 반복 분석하여 검량선 및 직선성의 결정계수(R2)를 계산해본 결과 1 ~ 100 ㎍/mL 범위에서 결정계수가 0.999 이상인 직선성을 확보할 수 있었다(Fig. 2). 그리고 얻어진 y 절편의 표준편차와 검량선의 기울기를 이용하여 LOD와 LOQ를 계산한 결과 각각 0.244 ㎍/mL 와 0.740 ㎍/mL로 확인되었다(Table 2). Atracylodin 표준품을 5개의 농도 5개의 농도(1, 5, 10, 50, 100 ㎍/mL) 별로 3회 반복 분석하여 검량선 및 직선성의 결정계수(R2)를 계산해 본 결과 1 ~ 100 ㎍/mL 범위에서 결정계수가 0.999 이상인 직선성을 확보할 수 있었다(Fig. 2). 그리고 얻어진 y 절편의 표준편차와 검량선의 기울기를 이용하여 LOD와 LOQ를 계산한 결과 각각 0.160 ㎍/mL 와 0.484 ㎍/mL로 확인되었다(Table 2). 두 성분 모두 농도 범위 1 ~ 100 ㎍/mL 사이에서의 직선성은 모두 결정계수가 0.999 이상이었으며, 정량한계는 모두 1 ㎍/mL보다 낮아 정상적인 범위에서 분석이 이루어졌음을 확인할 수 있었다.
Table 2
The linearity, regression equation, coefficient of determination (R2), and LOD and LOQ for measurement of standard components by HPLC
| Components | Regression equationz | R2 (n=3) | LODy (㎍/mL) | LOQx (㎍/mL) |
| atractylenolide Ⅲ | Y=15.05x - 4.79 | 0.999 | 0.244 | 0.740 |
| atractylodin | Y=8.71x - 8.76 | 0.999 | 0.223 | 0.675 |
정밀성(Precision) 및 정확성(Accuracy)
Atractylenolide Ⅲ 표준품을 3개의 농도(6.25, 12.5, 25 ㎚)로 3반복을 진행하여 정밀성과 정확성을 동시에 확인하였으며, 회수율은 각각 95.1, 93.7, 96.1%, 상대표준편차(%)는 농도 별로 0.907, 0.195, 0.888로 측정되었다(Table 3). Atracylodin 표준품을 3개의 농도(6.25, 12.5, 25 ㎚)로 3반복을 진행하여 정밀성과 정확성을 동시에 확인하였으며, 회수율은 94.4, 93.5, 94.8%, 상대표준편차(%)는 농도 별로 각각 0.592, 0.637, 0.494로 측정되었다(Table 3). 두 성분 모두 정밀성의 지표인 상대표준편차는 모두 5% 이하였으며, 정확성의 지표인 회수율은 90%에서 110% 사이의 범위에서 나와 정밀성 및 정확성이 높은 분석방법임을 확인하였다.
Table 3
Analytical results of accuracy test for standard materials by HPLC
추출조건 설정
설정한 지표성분에 대한 최적의 추출용매 및 추출시간을 확인하고자 성분분석을 진행한 결과(Table 4) atractylenolide Ⅲ는 80% MeOH에서 추출이 가장 잘 되었으나 60% MeOH과 큰 차이를 보이지 않았으며 추출시간에는 크게 영향받지 않았다. Atractylodin은 용매와 추출시간에 큰 영향 받지 않았으나 추출시간이 길어질수록 편차가 크게 나타나는 것을 확인하였다. 이에 추출용매는 80% MeOH로 추출시간은 30분으로 추출조건을 설정하였다.
Table 4
Component content according to ultrasonic extraction time and solvent
큰꽃삽주, 삽주 및 창출의 성분함량
큰꽃삽주, 삽주 및 창출의 성분함량 차이를 확인하고자 성분분석을 진행한 결과(Fig. 1, Table 5) 모든 시료에서 atractylenolide Ⅲ이 검출 되었으나 atractylodin는 창출에서만 검출되어 백출과 창출의 구별이 가능한 것으로 확인되었다.